Strukturell och funktionell utveckling av glukostransportör 4 (GLUT4): En titt på GLUT4 i fisk
Reglering av trafiken av fisk GLUT4
I däggdjur är den viktigaste egenskapen som kännetecknar GLUT4 i skelettmuskulatur och fettvävnad och som gör den unik dess förmåga att translokera till PM som svar på insulin . Detta ökar kraftigt cellernas kapacitet att ta upp glukos under det postprandiala tillståndet, vilket är avgörande för att korrekt upprätthålla glukoshomeostasen. Trots detta visar bevis i däggdjursceller tydligt att GLUT4 i basaltillstånd inte är statisk; i stället cirkulerar GLUT4 bland många intracellulära avdelningar, t.ex. trans-Golgi-nätverket (TGN), tidiga och sena endosomer, ett specialiserat insulinrespektive IRC-kompartment (IRC), samt PM . Mängden GLUT4 som finns i PM i basaltillstånd motsvarar endast 5-10 % av det totala GLUT4-proteinet, medan de återstående 90-95 % är instängda intracellulärt i IRC-kompartmentet .
De intracellulära trafikeringsegenskaperna hos de två glukostransportörer som identifierats hos laxfiskar (btGLUT4 och okGLUT4) har studerats i jämförelse med GLUT4 från däggdjur, främst när det uttrycks i heterologa system (adipocytära eller myoblastiska cellinjer från däggdjur), men även som endogent GLUT4 i primärodlade myocyter från öring. I 3T3-L1 adipocyter som transient uttrycker separat btGLUT4 eller okGLUT4 under stabila förhållanden uppvisar btGLUT4 betydligt högre proteinnivåer vid PM (30-40 %), även okGLUT4 men i mindre utsträckning (15-20 %), än rått-GLUT4 (10-15 %) . Detta observerades inte bara i adipocyter, eftersom btGLUT4 också förekom i PM i högre nivåer (20-25 %) än rått-GLUT4 (10-15 %) när det var stabilt exprimerat i L6-muskelceller . Viktigt är att den basala lokaliseringen av endogent GLUT4 vid PM i öringmyocyter i kultur också var relativt hög . Under basala eller ostimulerade förhållanden tycks därför GLUT4 från fiskar hållas mindre effektivt kvar i cytosolen i adipocyter och myocyter än GLUT4 från däggdjur, vilket tyder på att det finns skillnader i de mekanismer som är ansvariga för GLUT4:s intracellulära kvarhållande mellan fiskar och däggdjur (se nedan). Vidare har det, baserat på de observerade skillnaderna i PM-lokalisering mellan fiskars GLUT4 under basala förhållanden, där okGLUT4 liknar sina motsvarigheter från däggdjur mer än btGLUT4, föreslagits att de olika trafikbeteendena hos dessa två GLUT4-proteinvarianter från fiskar kan vara relaterade till skillnader i karakteristiska reglerande egenskaper i GLUT4-proteinsekvensen (i.dvs. N- och C-terminala proteinmotiv) (se avsnitt 3; ).
För övrigt har man också utvärderat förmågan hos fiskens GLUT4 att reagera på insulin. De första studierna där man försökte visa att en fisk GLUT4 translokaliseras till PM vid insulinstimulering utfördes i Xenopusoocytes . Systemet var dock inte lämpligt för att studera GLUT4:s translokalisering, och oocyter som uttryckte okGLUT4 eller en GLUT4 från råtta visade inga skillnader i transportörens lokalisering i cellen som svar på insulin . Istället användes 3T3-L1 adipocytcellsystemet framgångsrikt för att visa att både okGLUT4 och btGLUT4 kunde translokeras signifikant till PM efter insulinbehandling , så som det sker i däggdjur. Dessutom påvisades insulinstimulerad translokering av btGLUT4 till PM i L6-myoblaster och differentierade myotuber som stabilt uttrycker fiskens GLUT4-transportör . Därför visades fiskhomologerna av GLUT4 vara insulinresponsiva som sin motsvarighet från däggdjur, trots deras högre PM-lokalisering vid steady-state.
Som tidigare nämnts distribueras GLUT4 hos däggdjur inne i cellerna i två stora lagringsutrymmen, IRC och det endosomala systemet . Intressant nog visade btGLUT4 endast partiell samlokalisering med GLUT4 från råttor när båda samexpressades antingen i 3T3-L1 adipocyter eller i L6-muskelceller . Denna observation, tillsammans med det faktum att btGLUT4 visade lägre nivåer av retention i intracellulära kompartment under basala förhållanden även om den fortfarande svarade på insulinstimulering i båda celltyperna , föreslog att btGLUT4 är jämnt fördelad mellan den specialiserade IRC och det endosomala kompartmentet, varifrån den cirkulerar kontinuerligt med PM. Dessutom, både i 3T3-L1 adipocyter och L6 muskelceller, visades de högre PM-nivåer som observerades för btGLUT4 bero på en snabbare externaliseringshastighet snarare än på en minskning av endocytoshastigheten .
I däggdjur har flera proteiner beskrivits interagera med GLUT4 för att reglera den intracellulära trafiken och för att bibehålla de proteiner som är sekretessbelagda i IRC. Till exempel har det Golgi-lokaliserade γ-öra-innehållande Arf-bindande proteinet (GGA) beskrivits fungera som en trafikreglerare av nysyntetiserat GLUT4 från TGN till IRC . I detta steg har sortilin också beskrivits ha en nyckelroll, eftersom GLUT4 inte innehåller det specifika målmotivet för att kunna kännas igen av GGA som en lastmolekyl . Nyligen har det insulinreglerade aminopeptidaset (IRAP), som samlokaliseras med GLUT4 i intracellulära vesiklar, visat sig spela en roll i sorteringen av GLUT4 från endosomer till IRC . Dessutom har ett protein vid namn TUG (tether containing a UBX domain for GLUT4) rapporterats interagera med den stora intracellulära GLUT4-slingan mellan TMVI och TMVII och binda GLUT4 till intracellulära vesiklar genom att interagera med cellmembran via sin UBX-domän . De möjliga rollerna för flera GLUT4-interagerande proteiner i regleringen av trafiken av fiskarnas GLUT4-isoformer har undersökts i 3T3-L1 adipocyter som uttrycker motsvarande ortologer från däggdjur. Särskilt anpassarproteinet GGA har rapporterats vara involverat i de tidiga sorteringsstegen för GLUT4 från TGN. Uttryck i 3T3-L1 adipocyter av GLUT4 från råttan tillsammans med GGA av vildtyp eller en dominerande form av GGA (GGA-DN) visade att GGA krävs för att GLUT4 ska nå IRC eftersom den insulinstimulerade translokationen av GLUT4 från råttan till PM var helt avtrubbad i närvaro av GGA-DN . Intressant nog visade den intracellulära trafiken av btGLUT4 och okGLUT4 i 3T3-L1 adipocyter skillnader i fråga om deras känslighet för GGA, eftersom trafiken av btGLUT4 till PM antingen under basala eller insulinstimulerade förhållanden endast delvis undertrycktes av samexpression med GGA-DN, medan okGLUT4 uppvisade ett identiskt svar som rått-GLUT4 . Dessa resultat tyder på att okGLUT4 kan trafikera adipocyter genom samma väg som GLUT4 från däggdjur, men att btGLUT4 delvis kan undgå den reglerade biosyntetiska trafikvägen och förflytta sig till PM genom att följa en GGA-oberoende väg. I överensstämmelse med den olika intracellulära fördelning som observerats mellan btGLUT4 och GLUT4 från råttor kan trafiken av btGLUT4 till PM ske via den konstitutiva väg som används av Glut1 eller transferrinreceptorn (figur 7). Det är känt att GLUT4, när det anländer till IRC, får förmågan att reagera på insulin och translokera till PM. När en plasmid som kodar för GLUT4 från råtta transfekteras till 3T3-L1 adipocyter behöver cellerna 6-9 timmar för att producera det nya proteinet och för att rikta det mot IRC . Däremot genomgår både okGLUT4 och btGLUT4, när de uttrycks i samma cellulära system, insulinstimulerad translokation endast 3 timmar efter transfektion , vilket tyder på att fisk GLUT4 genomgår snabbare syntes, bearbetning eller trafik. Intressant nog visade okGLUT4 ett tidsmässigt svar som låg mellan GLUT4 från råtta och btGLUT4, men närmare det senare, trots att det visade en liknande känslighet för GGA som däggdjurs GLUT4.
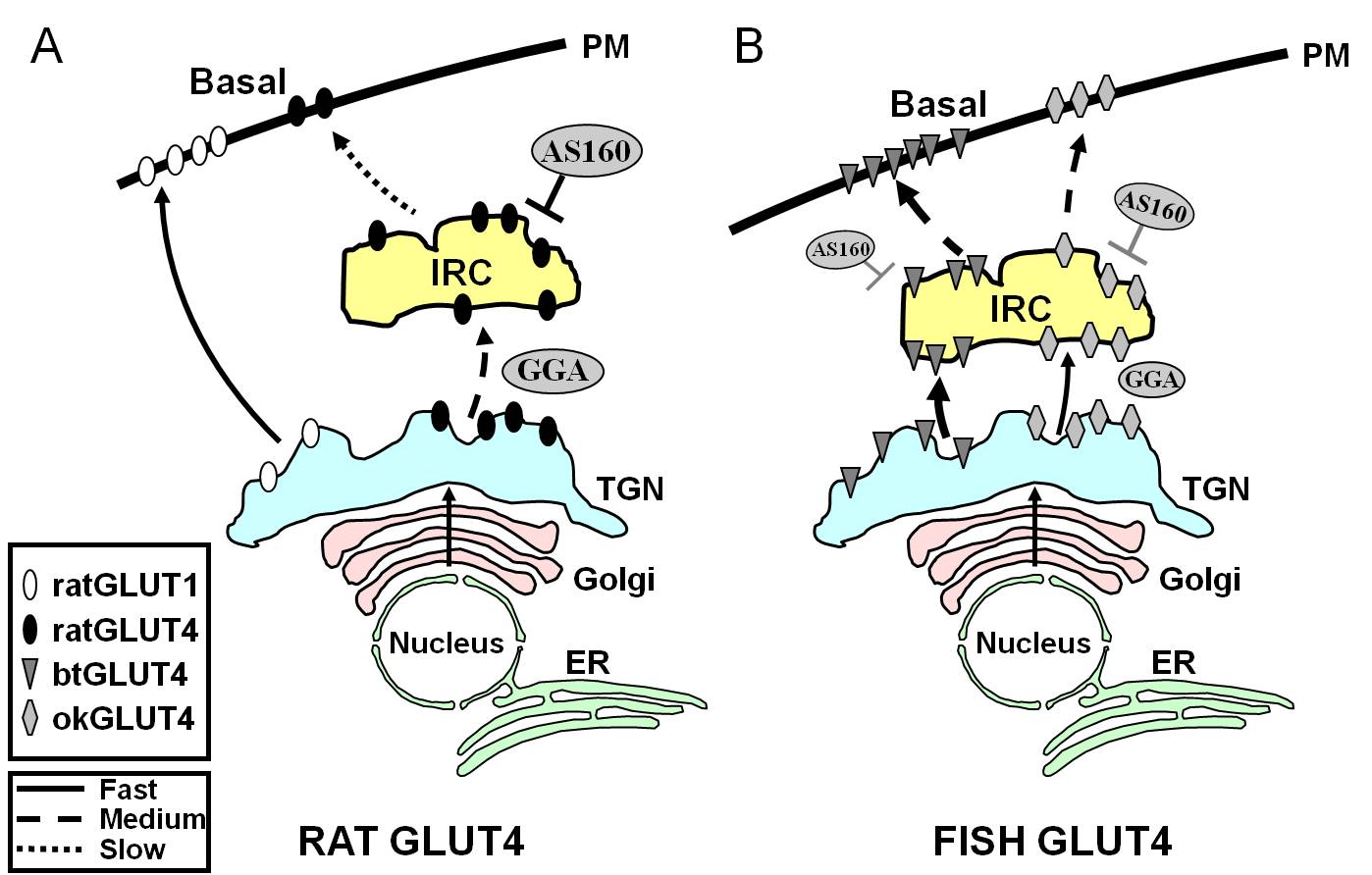
Figur 7.
Skematisk modell som illustrerar skillnaderna i trafiken mellan fisk GLUT4s och GLUT4 och Glut1 från råtta under basaltillstånd i adipocyter. I (A) visas att trafiken av nysyntetiserat GLUT4 från råttor sker genom Golgi och trans-Golgi-nätverket (TGN) och in i det insulinresponsiva kompartmentet (IRC) i en sorteringsprocess som är beroende av adaptorproteinet GGA. I basaltillstånd sekvenseras GLUT4 från råttor huvudsakligen i IRC, en process som regleras av AS160 och som kräver F5QQQI8-motivet för GLUT4:s aminuterminal. Efter biosyntesen åker däremot Glut1 direkt från TGN till plasmamembranet (PM) i en GGA-oberoende process. I (B) visas trafiken av nysyntetiserat GLUT4 från öring (btGLUT4) eller lax (okGLUT4). Vi postulerar att de höga nivåerna av btGLUT4 vid PM verkar bero på en ökad exocytisk hastighet, som ett resultat av att btGLUT4 följer en GGA-oberoende väg från TGN till IRC och genom att visa mindre AS160-reglerad sekretering vid IRC än rått GLUT4. Vi antar att btGLUT4:s olika trafikeringsbeteende kan vara relaterat till den annorlunda sekvensen i dess N-terminala motiv (F5QHL8). Trafikbeteendet hos okGLUT4 (F5QQL8) verkar ligga mellan det hos rått-GLUT4 och btGLUT4. ER: endoplasmatiskt retikulum.
Som tidigare nämnts i avsnitt 3, bland de olika reglerande aminosyramotiv som finns i GLUT4 hos däggdjur, har målmotivet F5QQI8 i N-terminus visat sig vara viktigt för GLUT4-sekvestrering i IRC och insulinstimulerad translokation till PM . Intressant nog, förutom att båda fiskarnas GLUT4-transportörer har en kortare N-terminal domän, uppvisar F5QQQI8-motivet en konserverad aminosyrasubstitution i okGLUT4 (F5QQL8), och det är mindre konserverat i btGLUT4 (F5QHL8), där den dubbla restsubstitutionen orsakar viktiga storleks- och laddningsförändringar (figur 8A). Möjligheten att dessa sekvensskillnader kunde förklara den ökade basala cellytanivå som observerades för btGLUT4 undersöktes (Capilla och Planas, opublicerade data). Figur 8B visar att mutation av btGLUT4-motivet F5QHL8 till F5QQQI8 orsakade en liten minskning av de basala PM-nivåerna; mutation av F5QHL8-motivet till F5QQL8 minskade dock cellytanivåerna av btGLUT4 signifikant till nivåer som är jämförbara med dem av okGLUT4 eller däggdjurs GLUT4. Dessa resultat tyder på att specifika aminosyramotiv samt molekylens veckning verkar vara viktiga för att GLUT4-molekylens intracellulära domäner ska kunna interagera med de olika reglerande proteinerna för korrekt trafik och specifik facklokalisering och/eller retention.
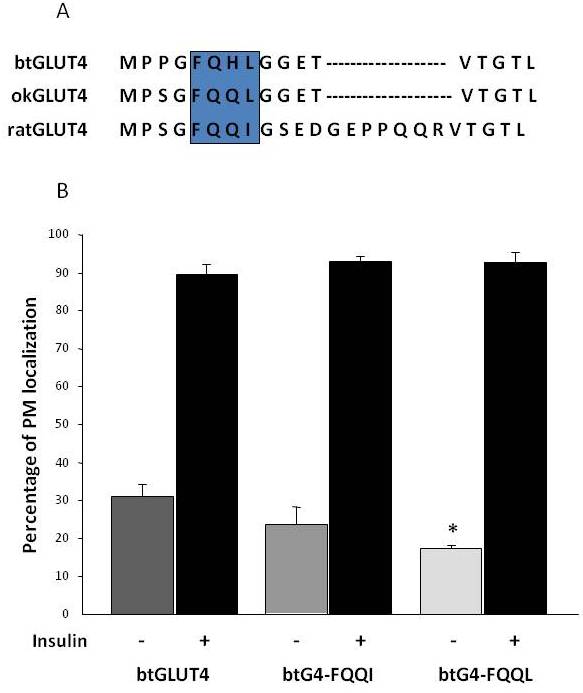
Figur 8.
Den förhöjda basala cellytanivån för btGLUT4 minskas genom att mutera motivet F5QHL8. (A) Aminosyrasekvensanpassning av den N-terminala regionen av GLUT4-molekyler från råtta, brunöring (btGLUT4, AF247395) och coholax (okGLUT4, AF502957). Rutan omsluter det viktiga trafikeringsmotivet F5QQQI8 som delvis är bevarat hos fiskarterna. (B) Differentierade 3T3-L1 adipocyter som uttrycker antingen btGLUT4 eller någon av de två punktmutanterna (btGLUT4-FQQQI eller btGLUT4-FQQL) inkuberades med eller utan insulin (100 nM, 30 min). Data presenteras som procentuell andel (medelvärde ± SEM) av celler som uppvisar en komplett plasmamembran (PM)-kant som erhållits genom att räkna 100 celler per tillstånd i 3 oberoende experiment. Statistisk analys utfördes genom oparat t-test mot vildtypen btGLUT4 vid basala respektive insulinstimulerade förhållanden (* betecknar signifikans vid p < 0,05).
En tidigare studie på däggdjur där man använde chimärer mellan GLUT4 och Glut1 visade att det räcker att ersätta N-terminus och den intracellulära slingan från Glut1 med dem från GLUT4 för att ge det chimära Glut1-proteinet GLUT4:s egenskaper i 3T3-L1 adipocyter . För att identifiera de proteindomäner i GLUT4 i öring som ger den dess särskilda trafikegenskaper (dvs. lägre intracellulär retention, högre PM-nivåer under basala förhållanden) skapades chimära proteiner med N-terminus (btN) eller den intracellulära slingan (btL) från btGLUT4 i en GLUT4-ryggrad från råtta, och de benämndes btN-GLUT4 respektive btL-GLUT4. Dessa konstruktioner uttrycktes sedan stabilt i 3T3-L1-celler och deras förmåga att hållas kvar i cytosolen under basala förhållanden och att reagera på insulin analyserades (Simoes, Planas och Camps, opublicerade resultat). De erhållna resultaten visade att alla konstruktioner kunde translokeras till PM som svar på insulin, men med vissa skillnader mellan dem (figur 9). För det första var den insulinstimulerade translokaliseringen av btGLUT4 lägre än den av rått-GLUT4. För det andra hade btN-GLUT4 det svagaste svaret på insulin, vilket tyder på att N-terminus spelar en roll för GLUT4:s korrekta inriktning på IRC eller för translokationen av GLUT4 till PM. För det tredje orsakade utbytet av den cytoplasmatiska slingan i btL-GLUT4 en minskning av svaret från rått-GLUT4 på insulin som var jämförbar med svaret från btGLUT4. Dessa preliminära resultat stöder idén att N-terminus och den cytoplasmatiska slingan av GLUT4 är ansvariga för några av skillnaderna i trafikering mellan btGLUT4 och rått-GLUT4.
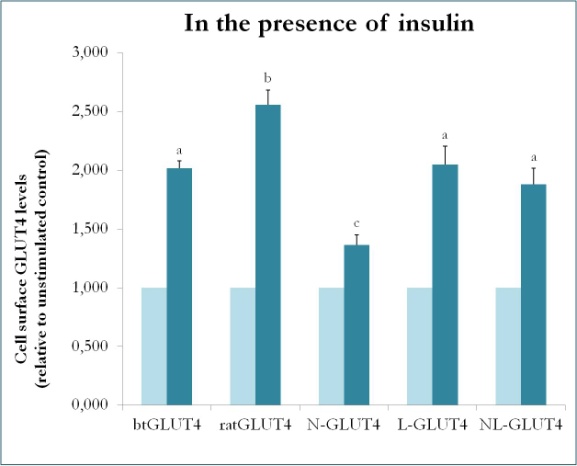
Figur 9.
Cellytanivåer för olika GLUT4-konstruktioner i närvaro av insulin. N-GLUT4 och L-GLUT4 representerar konstruktioner med aminoterminus (N) respektive den intracellulära slingan (L) av btGLUT4 i en GLUT4-bakgrund av råtta. Differentierade 3T3-L1 adipocyter som uttrycker de olika GLUT4-konstruktionerna inkuberades i frånvaro eller närvaro av insulin (100nM) i 30 minuter och bestämning av GLUT4-nivåer på ytan utfördes enligt beskrivningen i . GLUT4 på cellytan uttrycks i förhållande till den ostimulerade kontrollen för varje cellinje. Olika bokstäver anger statistiskt signifikanta skillnader (p < 0,05).
Efter insulinstimulering trafikerar och fusionerar GLUT4 från däggdjur med PM, vilket ökar dess närvaro på cellytan upp till 10-faldigt; därmed stöds den ökning av glukosupptaget som observerats efter utfodring. Insulin ökar antalet transportörer vid PM inte bara genom att öka exocytos utan också genom att minska endocytoshastigheten . Insulin utövar sina effekter genom två olika intracellulära signalvägar . Den första är den välkända vägen för fosfatidylinositol-3-kinas (PI3K)/proteinkinas B (PKB), även känd som Akt, som är nödvändig för att GLUT4-translokation ska inträffa men inte tillräcklig . Den andra vägen är den som inkluderar det Cbl-associerade proteinet (CAP), som binder till insulinreceptorn och aktiverar ett litet GTPas från Rho-familjen som heter TC10, och som beskrevs i adipocyter . TC10-vägen tycks dock inte vara involverad i muskelceller, där en annan Akt-oberoende ingång har visat sig bidra till den cytoskelettomvandling som krävs för fullständig GLUT4-translokation . Nedströms Akt har ett protein som kallas Akt-substrat med 160 KDa (AS160) eller TCB1D4 visat sig vara nyckeln till att kommunicera den fosforyleringskaskad som initieras av insulin med maskineriet för vesikeltrafik . AS160 har 6 rester av treonin/serin som kan fosforyleras för att hämma dess aktivitet och innehåller en GAP-domän (GTPase-activating protein) som i basalt tillstånd inaktiverar en rad Rab-proteiner, små GTPaser från Ras-superfamiljen som ansvarar för membrantrafiken . Fosforylering av AS160 av Akt hämmar dess GAP-aktivitet, vilket gör det möjligt att aktivera Rab-proteinerna, vilket leder till att GLUT4 translokeras till PM . De Rab-medlemmar som identifierats som ansvariga för GLUT4-trafiken hos däggdjur är Rab8a, Rab10 och Rab14 . Förutom att reglera förflyttningen av GLUT4-vesiklar har AS160 visat sig vara nödvändig för att GLUT4 skall kunna hållas kvar i IRC . För att visa att fosforylering av AS160 är avgörande för GLUT4-translokation hos däggdjur skapades en dominant hämmande form av AS160 genom att mutera 4 av dess 6 fosforyleringsställen (AS160-4P) . När den samexpressades i ett cellulärt system tillsammans med GLUT4 från råttor blockerades translokationen av denna molekyl till PM, liksom den ökning av glukosupptaget som observerades efter insulininkubation . När det gäller deras känslighet för AS160-4P observerades tydliga skillnader mellan okGLUT4 och btGLUT4, där den förstnämnda uppvisar liknande egenskaper som däggdjurs GLUT4 och den sistnämnda är opåverkad . Dessa resultat stämmer överens med de skillnader som observerats mellan de två GLUT4-proteinerna från fiskar när det gäller deras intracellulära retention och stödjer hypotesen att AS160 kan sekretessbelägga okGLUT4, men inte btGLUT4, i IRC och att btGLUT4 kan vara mer utspridd i cellen än de andra GLUT4-transportörerna. Eftersom de resultat som erhållits för btGLUT4 mot AS160-känslighet dessutom stämde överens med de resultat som tidigare rapporterats för en GLUT4-F5A-mutant , föreslogs den snabbare exocytiska hastigheten hos btGLUT4 bero på avsaknaden av ett konserverat FQQI-motiv .
Sammanfattningsvis, genom att undersöka trafikeringsegenskaperna hos de två GLUT4-proteinerna från fisk (btGLUT4 och okGLUT4) jämfört med GLUT4 och Glut1 från däggdjur, står det klart att det finns viktiga skillnader mellan dessa transportörer (figur 7). I detta avseende beter sig okGLUT4 i många avseenden på samma sätt som GLUT4 från däggdjur på grund av sin känslighet för GGA och AS160, vilket stöder en roll för dessa molekyler i regleringen av trafiken av okGLUT4 som syntetiseras de novo från TGN till IRC respektive från TGN till PM som svar på insulin. Däremot tycks btGLUT4 vara mindre reglerat och transporteras till IRC oberoende av GGA, samt behålls i IRC och går ut till PM endast delvis under kontroll av AS160. Därför rör sig btGLUT4 mot cellytan möjligen delvis genom en konstitutiv väg som den som används av Glut1.
Leave a Reply