Evolução Estrutural e Funcional do Transportador de Glicose 4 (GLUT4): Um olhar sobre o GLUT4 em peixes
Regulação do tráfego de peixes GLUT4
Em mamíferos, a principal característica que caracteriza o GLUT4 em músculo esquelético e tecido adiposo e o torna único é a sua capacidade de translocação para o PM em resposta à insulina . Isto aumenta muito a capacidade das células de absorver a glicose durante o estado pós-prandial, o que é crucial para manter adequadamente a homeostase da glicose. Não obstante, evidências em células de mamíferos indicam claramente que no estado basal o GLUT4 não é estático; em vez disso, o GLUT4 circula entre numerosos compartimentos intracelulares, como a rede trans-Golgi (TGN), endossomos precoces e tardios, um compartimento especializado em resposta à insulina (IRC), assim como o PM . A quantidade de GLUT4 presente no PM no estado basal corresponde a cerca de apenas 5-10% da proteína GLUT4 total, enquanto o restante 90-95% é sequestrado intracelularmente no compartimento IRC .
As características de tráfico intracelular dos dois transportadores de glicose identificados nos salmonídeos (btGLUT4 e okGLUT4) têm sido estudadas em comparação com o GLUT4 de mamíferos, principalmente quando expresso em sistemas heterólogos (linhas celulares adipocitárias ou miooblásticas de mamíferos), mas também como o GLUT4 endógeno em miócitos primários de trutas cultivadas. Em adipócitos 3T3-L1 que expressam transitoriamente btGLUT4 ou okGLUT4 em condições de estado estacionário, btGLUT4 exibiu níveis de proteína significativamente mais altos na PM (30-40%), também okGLUT4, mas em menor grau (15-20%), do que o GLUT4 de rato (10-15%) . Isso não foi observado apenas nos adipócitos, já que btGLUT4 também estava presente no PM em níveis mais altos (20-25%) do que o GLUT4 de rato (10-15%) quando estavelmente expresso nas células musculares L6 . Importante, a localização basal do GLUT4 endógeno no PM em miócitos de trutas em cultura também foi relativamente alta. Portanto, em condições basais ou não estimuladas, o GLUT4 dos peixes parece estar menos eficientemente retido no citosol nos adipócitos e miócitos do que o GLUT4 dos mamíferos, sugerindo diferenças nos mecanismos responsáveis pela retenção intracelular do GLUT4 entre os peixes e os mamíferos (ver abaixo). Além disso, com base nas diferenças observadas na localização de PM entre os GLUT4 de peixes em condições basais, sendo o okGLUT4 mais semelhante aos seus homólogos de mamíferos do que o btGLUT4, foi sugerido que o comportamento diferente do tráfego destas duas variantes proteicas GLUT4 de peixes pode estar relacionado com diferenças nas características reguladoras da sequência proteica GLUT4 (i.e. Motivos da proteína N e C-terminal) (ver secção 3; ).
Além disso, a capacidade de resposta dos peixes GLUT4 à insulina também tem sido avaliada. Os primeiros estudos que tentaram demonstrar que um peixe GLUT4 transloca para o PM após estimulação insulínica foram realizados em Xenopusoócitos . No entanto, o sistema não foi apropriado para estudar a translocação do GLUT4 e dos oócitos que expressam o okGLUT4 ou um GLUT4 de rato não mostrou diferenças na localização do transportador dentro da célula em resposta à insulina . Ao invés disso, o sistema celular adipocitário 3T3-L1 foi usado com sucesso para demonstrar que tanto o okGLUT4 quanto o btGLUT4 foram capazes de translocar significativamente para a PM após o tratamento com insulina, como ocorre em mamíferos. Além disso, a translocação estimulada por insulina para a PM do btGLUT4 foi demonstrada em miooblastos L6 e em miotrubos diferenciados de forma estável, exprimindo o transportador de GLUT4 de peixes. Assim, os homólogos de peixes do GLUT4 mostraram ser insulino-responsáveis como os seus homólogos de mamíferos, apesar da sua maior localização de PM em estado estacionário.
Como mencionado anteriormente, o GLUT4 em mamíferos é distribuído dentro das células em dois grandes compartimentos de armazenamento, o IRC e o sistema endossómico . Curiosamente, o btGLUT4 mostrou apenas co-localização parcial com GLUT4 de rato quando ambos foram co-expressos em adipócitos 3T3-L1 ou em células musculares L6 . Esta observação, juntamente com o fato de que o btGLUT4 mostrou menores níveis de retenção nos compartimentos intracelulares durante as condições basais, apesar de ainda responder à estimulação insulínica em ambos os tipos celulares, sugeriu que o btGLUT4 está igualmente distribuído entre o IRC especializado e o compartimento endossômico, de onde ele cicla continuamente com o PM. Além disso, tanto nos adipócitos 3T3-L1 quanto nas células musculares L6, os maiores níveis de PM observados para o btGLUT4 demonstraram ser devidos a uma taxa de externalização mais rápida e não a uma diminuição na taxa de endocitose .
Em mamíferos, várias proteínas foram descritas para interagir com o GLUT4 para regular seu tráfego intracelular e manter as proteínas seqüestradas no IRC. Por exemplo, a proteína de ligação Arf (GGA), localizada em Golgi γ, foi descrita para funcionar como um controlador de tráfego do GLUT4 recém-sintetizado do TGN para o IRC. Nesta etapa, a sortilina foi descrita também como tendo um papel fundamental, já que o GLUT4 não contém o motivo específico de direcionamento a ser reconhecido pela GGA como uma molécula de carga . Mais recentemente, a aminopeptidase regulamentada por insulina (IRAP), que co-localiza com o GLUT4 em vesículas intracelulares, demonstrou desempenhar um papel na classificação do GLUT4 desde os endossomos até o IRC. Além disso, uma proteína chamada TUG (tether containing a UBX domain for GLUT4), foi relatada para interagir com o grande laço intracelular GLUT4 presente entre TMVI e TMVII e para amarrar o GLUT4 às vesículas intracelulares através de sua interação, via seu domínio UBX, com membranas celulares . Os possíveis papéis de várias proteínas de interacção GLUT4 na regulação do tráfego das isoformas GLUT4 dos peixes foram explorados em adipócitos 3T3-L1 que expressam os ortologs mamíferos correspondentes. Em particular, a proteína adaptadora GGA tem sido relatada como estando envolvida nas primeiras etapas de triagem do GLUT4 a partir do TGN. A expressão em adipócitos 3T3-L1 do GLUT4 de rato juntamente com GGA do tipo selvagem ou uma forma de interferência dominante de GGA (GGA-DN) demonstrou que a GGA é necessária para que o GLUT4 alcance o IRC porque a translocação estimulada por insulina do GLUT4 de rato para o PM foi completamente embotada na presença de GGA-DN . Curiosamente, o tráfego intracelular de btGLUT4 e okGLUT4 em adipócitos 3T3-L1 mostrou diferenças em relação às suas sensibilidades ao GGA porque o tráfego de btGLUT4 para o PM sob condições basais ou insulino-estimuladas foi apenas parcialmente suprimido pela co-expressão com o GGA-DN enquanto o okGLUT4 mostrou uma resposta idêntica à do GLUT4 de rato. Esses resultados sugerem que o okGLUT4 pode trafegar em adipócitos pela mesma via que o GLUT4 de mamíferos, mas que o btGLUT4 pode estar em parte escapando da via de tráfego biossintético regulado, deslocando-se para o PM seguindo uma via independente da GGA. De acordo com a diferente distribuição intracelular observada entre btGLUT4 e o rato GLUT4 , o tráfego de btGLUT4 para a PM pode estar ocorrendo através da via constitutiva utilizada pelo Glut1 ou pelo receptor de transferrina (Figura 7). Sabe-se que o GLUT4, ao chegar no IRC, adquire a capacidade de responder à insulina e de translocar-se para o PM. Quando um rato codificador de plasmídeo GLUT4 é transfectado em adipócitos 3T3-L1, as células precisam de 6 a 9 horas para produzir a nova proteína e direcioná-la para o IRC. Em contraste, tanto o okGLUT4 como o btGLUT4, quando expressos no mesmo sistema celular, são submetidos a translocação estimulada por insulina apenas 3 horas após a transfecção, sugerindo que o peixe GLUT4 é submetido a uma síntese, processamento ou tráfego mais rápidos. Curiosamente, o okGLUT4 mostrou uma resposta temporal que era intermédia entre o GLUT4 e o btGLUT4 de rato, mas mais próxima deste último, apesar de mostrar uma sensibilidade semelhante à dos mamíferos GLUT4.
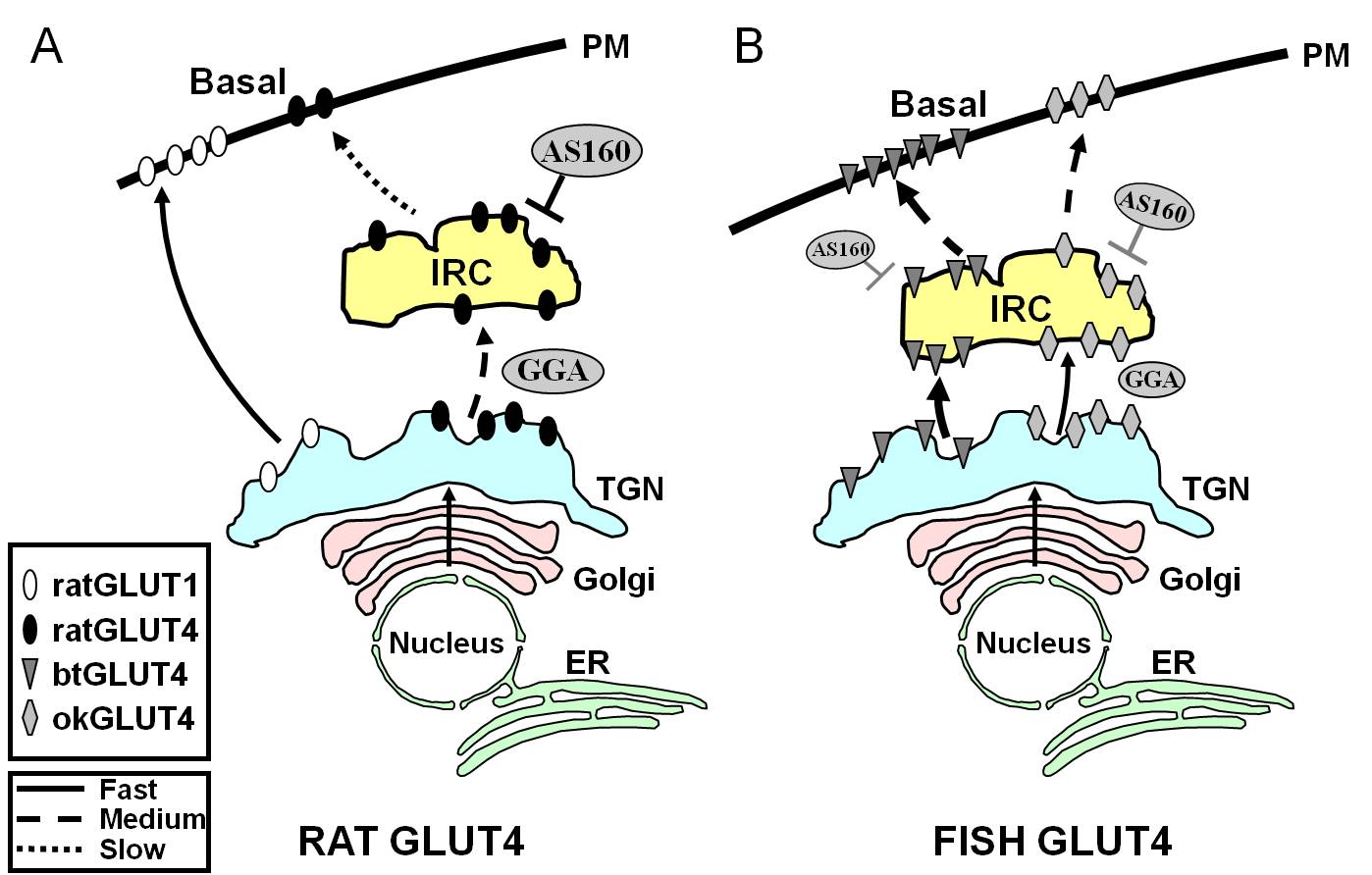
Figure 7.
Modelo esquemático ilustrando diferenças no tráfego entre o GLUT4 de peixe e o GLUT4 de rato e o Glut1 durante o estado basal em adipócitos. Em (A), o tráfego de GLUT4 de rato recém-sintetizado é mostrado para ocorrer através do Golgi e da rede trans-Golgi (TGN) e para o compartimento insulino-responsivo (IRC) em um processo de classificação que depende da proteína GGA do adaptador. No estado basal, o rato GLUT4 é principalmente sequestrado no IRC, um processo que é regulado pela AS160 e que requer o motivo terminal do amino terminal F5QQI8 do GLUT4. Em contraste, após a biossíntese, Glut1 viaja diretamente do TGN para a membrana plasmática (PM) em um processo independente do GGA. Em (B), é mostrado o tráfego de trutas recém-sintetizadas (btGLUT4) ou salmão (okGLUT4) GLUT4. Postulamos que os altos níveis de btGLUT4 no PM parecem ser devidos a um aumento da taxa de exócitos, como resultado de btGLUT4 seguindo uma rota independente de GGA do TGN para o IRC e mostrando menos sequestro AS160-regulado no IRC do que o GLUT4 de rato. Hipótese de que os diferentes comportamentos de tráfico do btGLUT4 podem estar relacionados com a sequência diferente em seu motivo N-terminal (F5QHL8). O comportamento de tráfego do okGLUT4 (F5QQL8) parece ser intermediário entre o do rato GLUT4 e o btGLUT4. ER: retículo endoplasmático.
Como mencionado anteriormente na seção 3, entre os diferentes motivos regulatórios de aminoácidos encontrados no GLUT4 em mamíferos, o motivo F5QQI8 de direcionamento no N-terminal mostrou-se importante para a seqüestração do GLUT4 no IRC e translocação estimulada por insulina para o PM . Curiosamente, para além do facto de ambos os transportadores GLUT4 terem um domínio N-terminal mais curto, o motivo F5QQI8 mostra uma substituição conservada de aminoácidos em okGLUT4 (F5QQL8), e está menos conservado em btGLUT4 (F5QHL8), onde a dupla substituição de resíduos causa importantes alterações de tamanho e carga (Figura 8A). Foi investigada a possibilidade de que essas diferenças de seqüência fossem capazes de contabilizar o aumento dos níveis superficiais de células basais observados para btGLUT4 (Capilla e Planas, dados não publicados). A Figura 8B mostra que a mutação do motivo btGLUT4 F5QHL8 para F5QQI8 causou uma leve diminuição nos níveis basais de PM; entretanto, a mutação do motivo F5QHL8 para F5QQL8 reduziu significativamente os níveis da superfície celular do btGLUT4 para níveis comparáveis aos do okGLUT4 ou do GLUT4 de mamíferos. Estes resultados indicam que motivos específicos de aminoácidos, bem como a dobra da molécula, parecem ser importantes para que os domínios intracelulares da molécula GLUT4 interajam com as diferentes proteínas reguladoras para um tráfego adequado e localização e/ou retenção específica do compartimento.
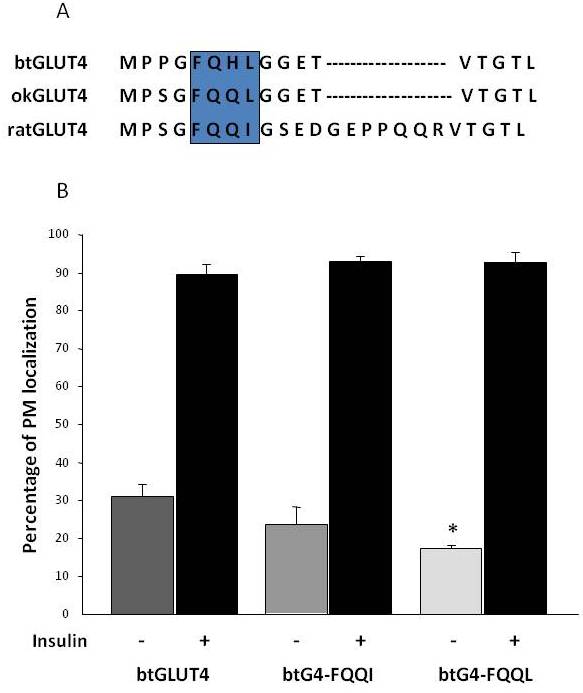
Figure 8.
Os níveis elevados da superfície celular basal do btGLUT4 são reduzidos pela mutação do motivo F5QHL8. (A) Alinhamento da sequência de aminoácidos da região N-terminal do rato, truta castanha (btGLUT4, AF247395) e salmão coho (okGLUT4, AF502957) moléculas GLUT4. A caixa encerra o importante motivo do tráfico F5QQI8 parcialmente conservado nas espécies de peixes. (B) Adipócitos diferenciados 3T3-L1 que expressam btGLUT4 ou qualquer um dos dois pontos mutantes (btGLUT4-FQI ou btGLUT4-FQQL) foram incubados com ou sem insulina (100 nM, 30 min). Os dados são apresentados como percentagem (média ± SEM) de células mostrando uma membrana plasmática (PM) completa, obtida pela contagem de 100 células por condição em 3 experimentos independentes. A análise estatística foi realizada pelo teste t não pareado contra o tipo selvagem btGLUT4 em condições basais ou insulino-estimuladas respectivamente (* denota significância a p < 0,05).
Um estudo anterior em mamíferos usando quimeras entre GLUT4 e Glut1 demonstrou que a substituição do N-terminus e do laço intracelular do Glut1 pelos do GLUT4 é suficiente para conferir à proteína quimérica Glut1 as características do GLUT4 em adipócitos 3T3-L1. Assim, a fim de identificar os domínios proteicos da truta GLUT4 que conferem suas características particulares de tráfego (ou seja, menor retenção intracelular; maiores níveis de PM sob condições basais), foram criadas proteínas quiméricas que possuem o N-terminus (btN) ou a alça intracelular (btL) do btGLUT4 em uma espinha dorsal GLUT4 de rato e foram denominadas btN-GLUT4 ou btL-GLUT4, respectivamente. Essas construções foram então estavelmente expressas em células 3T3-L1 e sua capacidade de retenção no citosol sob condições basais e de resposta à insulina foram analisadas (Simões, Planas e Camps, resultados não publicados). Os resultados obtidos indicaram que todas as construções foram capazes de translocar para a PM em resposta à insulina, mas com certas diferenças entre elas (Figura 9). Primeiro, a translocação estimulada por insulina do btGLUT4 foi menor que a do rato GLUT4. Segundo, o btN-GLUT4 teve a resposta mais fraca à insulina, sugerindo um papel para o N-terminus no direcionamento correto do GLUT4 para o IRC ou na translocação do GLUT4 para o PM. Terceiro, a substituição do laço citoplasmático em btL-GLUT4 causou uma redução na resposta do GLUT4 de rato à insulina comparável à do btGLUT4. Estes resultados preliminares suportam a idéia de que o N-terminus e a alça citoplasmática do GLUT4 são responsáveis por algumas das diferenças de tráfico entre btGLUT4 e o GLUT4 de rato.
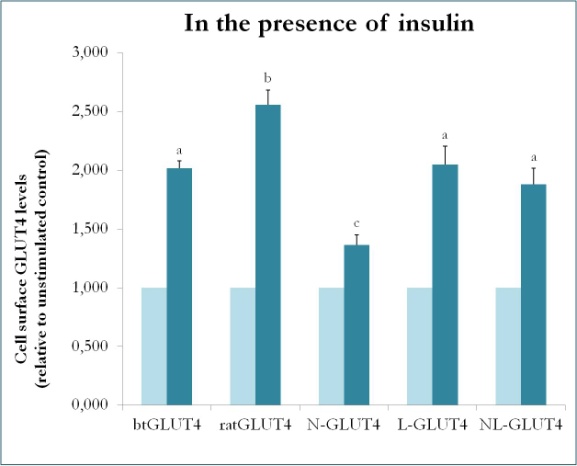
Figure 9.
Níveis de superfície celular de várias construções de GLUT4 na presença de insulina. N-GLUT4 e L-GLUT4 representam construções com o amino terminal (N) ou o laço intracelular (L) do btGLUT4 em uma espinha dorsal GLUT4 de rato, respectivamente. Os adipócitos diferenciados 3T3-L1 que expressam os vários construtos GLUT4 foram incubados na ausência ou presença de insulina (100nM) durante 30 min e a determinação dos níveis de GLUT4 de superfície foi realizada como descrito em . O GLUT4 de superfície celular é expresso em relação ao controle não estimulado para cada linha celular. Diferentes letras indicam diferenças estatisticamente significativas (p < 0,05).
Seguindo a estimulação da insulina, os mamíferos GLUT4 traficam e se fundem com a PM, aumentando sua presença na superfície celular até 10 vezes; assim, suportando o aumento da absorção de glicose observada após a alimentação. A insulina aumenta o número de transportadores na PM não só aumentando a exocitose, mas também diminuindo a taxa de endocitose. A insulina exerce os seus efeitos através de duas vias diferentes de sinalização intracelular . A primeira é a conhecida via do fosfatidilinositol-3-quinase (PI3K)/proteína quinase B (PKB), também conhecida como Akt, que é necessária para que a translocação do GLUT4 ocorra, mas não suficiente. A segunda via é aquela que inclui a proteína Cbl associada (CAP), que liga o receptor de insulina e ativa uma pequena GTPase da família Rho chamada TC10, e que foi descrita em adipócitos . Entretanto, a via TC10 parece não estar envolvida nas células musculares, na qual outra entrada independente de Ak foi mostrada para contribuir para a remodelação do citoesqueleto necessária para a translocação completa do GLUT4 . A jusante do Akt, uma proteína chamada Akt substrato de 160 KDa (AS160) ou TCB1D4, foi encontrada como a chave para comunicar a cascata de fosforilação iniciada pela insulina com as máquinas de tráfico de vesículas . AS160 tem 6 resíduos de trionina/serina que podem ser fosforilados para inibir sua atividade, e contém um domínio de proteína GTPase-ativadora (GAP) que no estado basal inativa uma série de proteínas Rab, pequenos GTPases da superfamília Ras responsáveis pelo tráfico de membranas . A fosforilação do AS160 pela Akt inibe sua atividade GAP, permitindo a ativação das proteínas Rab; assim, provocando a translocação do GLUT4 para o PM . Os membros rabinos identificados como responsáveis pelo tráfico de GLUT4 em mamíferos são Rab8a, Rab10 e Rab14 . Além de regular o movimento das vesículas do GLUT4, foi demonstrado que o AS160 é necessário para a retenção total do GLUT4 no IRC. Para demonstrar que a fosforilação AS160 é crítica para a translocação do GLUT4 em mamíferos, uma forma dominante-inibitória do AS160 foi criada pela mutação de 4 dos seus 6 sítios de fosforilação (AS160-4P) . Quando coexpressa em um sistema celular junto com o GLUT4 de rato, a translocação desta molécula para a PM foi bloqueada, assim como o aumento da absorção de glicose observado após a incubação da insulina . Quanto à sua sensibilidade ao AS160-4P, foram observadas diferenças claras entre o okGLUT4 e o btGLUT4, com o primeiro apresentando propriedades semelhantes às do GLUT4 de mamíferos, e o segundo não sendo afetado. Estes resultados estão de acordo com as diferenças observadas entre as proteínas GLUT4 dos dois peixes em termos de retenção intracelular e apoiam a hipótese de que o AS160 pode sequestrar o okGLUT4, mas não o btGLUT4, no IRC e que o btGLUT4 pode estar mais amplamente distribuído dentro da célula do que os outros transportadores GLUT4. Além disso, como os resultados obtidos para btGLUT4 em direção à sensibilidade AS160 concordam com os relatados anteriormente para um mutante GLUT4-F5A, a taxa exocítica mais rápida do btGLUT4 foi sugerida devido à falta de um motivo FQQI conservado.
Em resumo, ao investigar as características de tráfico das duas proteínas GLUT4 dos peixes (btGLUT4 e okGLUT4) comparadas com as dos mamíferos GLUT4 e Glut1, fica claro que existem diferenças importantes entre estes transportadores (Figura 7). A este respeito, o okGLUT4 comporta-se em muitos aspectos de forma semelhante ao GLUT4 de mamíferos devido à sua sensibilidade à GGA e AS160; assim, suportando um papel para estas moléculas na regulação do tráfego do okGLUT4 sintetizado de novoformado do TGN para o IRC, e do TGN para o PM em resposta à insulina, respectivamente. Em contraste, o btGLUT4 parece ser menos regulado, traficando para o IRC independentemente do GGA, bem como sendo retido no IRC e saindo para o PM apenas em parte sob o controle do AS160; portanto, movendo-se para a superfície celular possivelmente, em parte, através de uma via constitutiva como a utilizada pelo Glut1.
Leave a Reply