Evoluția structurală și funcțională a transportorului de glucoză 4 (GLUT4): O privire asupra GLUT4 la pești
Reglementarea traficului de GLUT4 la pești
La mamifere, principala trăsătură care caracterizează GLUT4 în mușchiul scheletic și în țesutul adipos și care îl face unic este capacitatea sa de a se transloca în PM ca răspuns la insulină. Acest lucru crește foarte mult capacitatea celulelor de a absorbi glucoza în timpul stării postprandiale, ceea ce este crucial pentru a menține în mod corespunzător homeostazia glucozei. Cu toate acestea, dovezile din celulele mamiferelor indică în mod clar faptul că, în starea bazală, GLUT4 nu este static; în schimb, GLUT4 circulă între numeroase compartimente intracelulare, cum ar fi rețeaua trans-Golgi (TGN), endosomii timpurii și tardivi, un compartiment specializat care răspunde la insulină (IRC), precum și PM . Cantitatea de GLUT4 prezentă în PM în starea bazală corespunde doar la aproximativ 5-10% din totalul proteinei GLUT4, în timp ce restul de 90-95% este sechestrat intracelular în compartimentul IRC .
Caracteristicile de trafic intracelular ale celor doi transportatori de glucoză identificați la salmonide (btGLUT4 și okGLUT4) au fost studiate în comparație cu GLUT4 de mamifere, în principal atunci când este exprimat în sisteme heterologe (linii celulare adipocitare sau mioblastice de mamifere), dar și ca GLUT4 endogen în miocitele primare de păstrăv cultivate. În adipocitele 3T3-L1 care exprimă în mod tranzitoriu separat btGLUT4 sau okGLUT4 în condiții de echilibru, btGLUT4 a prezentat niveluri de proteine semnificativ mai mari la nivelul PM (30-40%), de asemenea okGLUT4, dar într-o măsură mai mică (15-20%), decât GLUT4 de șobolan (10-15%) . Acest lucru nu a fost observat doar în adipocite, deoarece btGLUT4 a fost prezent, de asemenea, în PM la niveluri mai ridicate (20-25%) decât GLUT4 de șobolan (10-15%) atunci când a fost exprimat în mod stabil în celulele musculare L6 . Este important de remarcat faptul că localizarea bazală a GLUT4 endogen la PM în miocitele de păstrăv în cultură a fost, de asemenea, relativ ridicată . Prin urmare, în condiții bazale sau nestimulate, GLUT4 de pește pare să fie reținut mai puțin eficient în citosol în adipocite și miocite decât GLUT4 de mamifere, sugerând diferențe în mecanismele responsabile de retenția intracelulară a GLUT4 între pești și mamifere (a se vedea mai jos). Mai mult decât atât, pe baza diferențelor observate în localizarea PM între GLUT4 de pește în condiții bazale, okGLUT4 fiind mai asemănător cu omologii săi de mamifere decât btGLUT4, s-a sugerat că comportamentul diferit de trafic al acestor două variante ale proteinei GLUT4 de pește poate fi legat de diferențe în trăsăturile caracteristice de reglementare din secvența proteică GLUT4 (i.adică motivele proteice N și C-terminale) (a se vedea secțiunea 3; ).
Mai mult, a fost evaluată, de asemenea, capacitatea peștilor GLUT4 de a răspunde la insulină. Primele studii care au încercat să demonstreze că un GLUT4 de pește se translocă în PM în urma stimulării cu insulină au fost efectuate în xenopocitele Xenopuso . Cu toate acestea, sistemul nu a fost adecvat pentru a studia translocarea GLUT4, iar ovocitele care exprimă okGLUT4 sau un GLUT4 de șobolan nu au prezentat diferențe în localizarea transportatorului în interiorul celulei ca răspuns la insulină. În schimb, sistemul de celule adipocitare 3T3-L1 a fost utilizat cu succes pentru a demonstra că atât okGLUT4, cât și btGLUT4 au fost capabili să se transloce în mod semnificativ în PM după tratamentul cu insulină , așa cum se întâmplă la mamifere. Mai mult, translocarea stimulată de insulină în PM a btGLUT4 a fost demonstrată în mioblaste L6 și miotuburi diferențiate care exprimă în mod stabil transportatorul GLUT4 de pește. Prin urmare, s-a demonstrat că omologii de pește ai GLUT4 răspund la insulină ca și omologii lor de la mamifere, în ciuda localizării lor mai mari în PM la starea de echilibru.
După cum s-a menționat anterior, GLUT4 la mamifere este distribuit în interiorul celulelor în două compartimente majore de stocare, IRC și sistemul endosomal . În mod interesant, btGLUT4 a prezentat doar o co-localizare parțială cu GLUT4 de șobolan atunci când ambele au fost co-exprimate fie în adipocite 3T3-L1, fie în celule musculare L6 . Această observație, împreună cu faptul că btGLUT4 a prezentat niveluri mai scăzute de retenție în compartimentele intracelulare în condiții bazale, deși a răspuns în continuare la stimularea cu insulină în ambele tipuri de celule , a sugerat că btGLUT4 este distribuit în mod egal între IRC specializat și compartimentul endosomal, de unde ciclează continuu cu PM. Mai mult decât atât, atât în adipocitele 3T3-L1, cât și în celulele musculare L6, s-a demonstrat că nivelurile PM mai ridicate observate pentru btGLUT4 se datorează mai degrabă unei rate de externalizare mai rapidă decât unei scăderi a ratei de endocitoză .
La mamifere, s-a descris că mai multe proteine interacționează cu GLUT4 pentru a regla traficul său intracelular și pentru a menține proteinele sechestrate în IRC. De exemplu, s-a descris că proteina de legare Arf (GGA), localizată în Golgi, care conține γ-ear, funcționează ca un regulator de trafic al GLUT4 nou sintetizat din TGN către IRC . În această etapă, sortilina a fost descrisă ca având, de asemenea, un rol cheie, deoarece GLUT4 nu conține motivul de direcționare specific pentru a fi recunoscut de GGA ca moleculă de sarcină . Mai recent, s-a demonstrat că aminopeptidaza reglată de insulină (IRAP), care se colocalizează împreună cu GLUT4 în veziculele intracelulare, joacă un rol în sortarea GLUT4 din endosomi în IRC . Mai mult, s-a raportat că o proteină numită TUG (tether containing a UBX domain for GLUT4), interacționează cu bucla mare intracelulară a GLUT4 prezentă între TMVI și TMVII și leagă GLUT4 de veziculele intracelulare prin interacțiunea sa, prin intermediul domeniului său UBX, cu membranele celulare . Rolurile posibile ale mai multor proteine care interacționează cu GLUT4 în reglarea traficului izoformelor GLUT4 de pește au fost explorate în adipocitele 3T3-L1 care exprimă ortologii corespunzători de mamifere. În special, s-a raportat că proteina adaptoare GGA este implicată în primele etape de sortare a GLUT4 din TGN. Exprimarea în adipocite 3T3-L1 a GLUT4 de șobolan împreună cu GGA de tip sălbatic sau cu o formă de interferență dominantă a GGA (GGA-DN) a demonstrat că GGA este necesară pentru ca GLUT4 să ajungă la IRC, deoarece translocarea stimulată de insulină a GLUT4 de șobolan în PM a fost complet atenuată în prezența GGA-DN. În mod interesant, traficul intracelular al btGLUT4 și okGLUT4 în adipocitele 3T3-L1 a prezentat diferențe în ceea ce privește sensibilitatea lor la GGA, deoarece traficul btGLUT4 către PM, fie în condiții bazale, fie în condiții de stimulare cu insulină, a fost doar parțial suprimat prin coexprimarea cu GGA-DN, în timp ce okGLUT4 a prezentat un răspuns identic cu cel al GLUT4 de șobolan. Aceste rezultate au sugerat că okGLUT4 poate circula în adipocite prin aceeași cale ca și GLUT4 de mamifere, dar că btGLUT4 poate scăpa parțial de ruta de trafic biosintetic reglementată, deplasându-se către PM pe o cale independentă de GGA. În concordanță cu distribuția intracelulară diferită observată între btGLUT4 și GLUT4 de șobolan, traficul lui btGLUT4 către PM poate avea loc prin intermediul căii constitutive utilizate de Glut1 sau de receptorul de transferrină (figura 7). Se știe că GLUT4, după ce ajunge în IRC, dobândește capacitatea de a răspunde la insulină și de a se transloca în PM. Atunci când o plasmidă care codifică GLUT4 de șobolan este transfectată în adipocite 3T3-L1, celulele au nevoie de 6 până la 9 ore pentru a produce noua proteină și pentru a o direcționa către IRC . În schimb, atât okGLUT4, cât și btGLUT4, atunci când sunt exprimate în același sistem celular, suferă o translocare stimulată de insulină la numai 3 ore după transfecție, ceea ce sugerează că GLUT4 de pește suferă o sinteză, o procesare sau un trafic mai rapid. În mod interesant, okGLUT4 a prezentat un răspuns temporal care a fost intermediar între GLUT4 de șobolan și btGLUT4, dar mai apropiat de acesta din urmă, în ciuda faptului că prezintă o sensibilitate similară față de GGA ca și GLUT4 de mamifere.
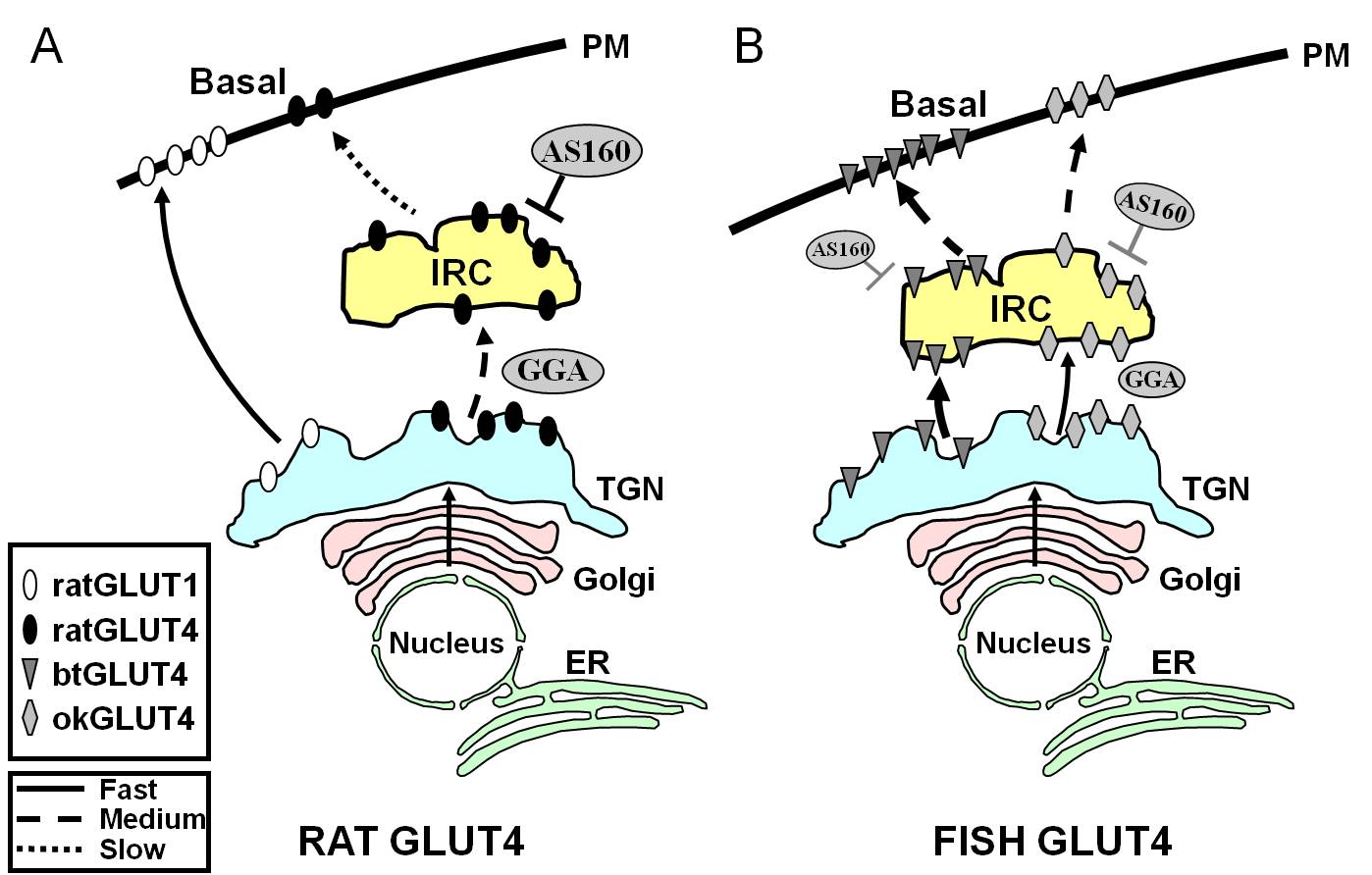
Figura 7.
Model schematic care ilustrează diferențele de trafic între GLUT4 de pește și GLUT4 de șobolan și Glut1 în timpul stării bazale în adipocite. În (A), se arată că traficul de GLUT4 de șobolan nou sintetizat are loc prin Golgi și rețeaua trans-Golgi (TGN) și în compartimentul sensibil la insulină (IRC) într-un proces de sortare care depinde de proteina adaptoare GGA. În starea bazală, GLUT4 de șobolan este sechestrat în principal în IRC, un proces care este reglementat de AS160 și care necesită motivul amino terminal F5QQI8 al GLUT4. În schimb, după biosinteză, Glut1 se deplasează direct de la TGN la membrana plasmatică (PM) într-un proces independent de GGA. În (B), este prezentat traficul de GLUT4 recent sintetizat de păstrăv (btGLUT4) sau somon (okGLUT4). Postulăm că nivelurile ridicate de btGLUT4 în PM par să se datoreze unei viteze exocitice crescute, ca urmare a faptului că btGLUT4 urmează un traseu independent de GGA de la TGN la IRC și prezintă o sechestrare mai puțin reglată de AS160 la IRC decât GLUT4 de șobolan. Am emis ipoteza că acest comportament diferit de trafic al btGLUT4 poate fi legat de secvența diferită din motivul său N-terminal (F5QHL8). Comportamentul de trafic al okGLUT4 (F5QQL8) pare să fie intermediar între cel al GLUT4 de șobolan și cel al btGLUT4. ER: reticulul endoplasmatic.
După cum s-a menționat anterior în secțiunea 3, printre diferitele motive de reglementare cu aminoacizi găsite în GLUT4 la mamifere, s-a demonstrat că motivul de direcționare F5QQI8 din N-terminal este important pentru sechestrarea GLUT4 în IRC și pentru translocarea stimulată de insulină în PM . Este interesant faptul că, pe lângă faptul că ambii transportatori GLUT4 din pește au un domeniu N-terminal mai scurt, motivul F5QQI8 prezintă o substituție de aminoacizi conservată în okGLUT4 (F5QQL8) și este mai puțin conservat în btGLUT4 (F5QHL8), unde substituția cu reziduu dublu determină modificări importante de mărime și sarcină (figura 8A). A fost investigată posibilitatea ca aceste diferențe de secvență să fie capabile să explice nivelurile bazale crescute la suprafața celulară observate pentru btGLUT4 (Capilla și Planas, date nepublicate). Figura 8B arată că mutația motivului btGLUT4 F5QHL8 în F5QQI8 a provocat o ușoară scădere a nivelurilor PM bazale; cu toate acestea, mutația motivului F5QHL8 în F5QQL8 a redus semnificativ nivelurile de suprafață celulară ale btGLUT4 la niveluri comparabile cu cele ale okGLUT4 sau ale GLUT4 de mamifere. Aceste rezultate indică faptul că motivele specifice de aminoacizi, precum și plierea moleculei par a fi importante pentru ca domeniile intracelulare ale moleculei GLUT4 să interacționeze cu diferitele proteine de reglare pentru un trafic adecvat și pentru localizarea și/sau retenția în compartimente specifice.
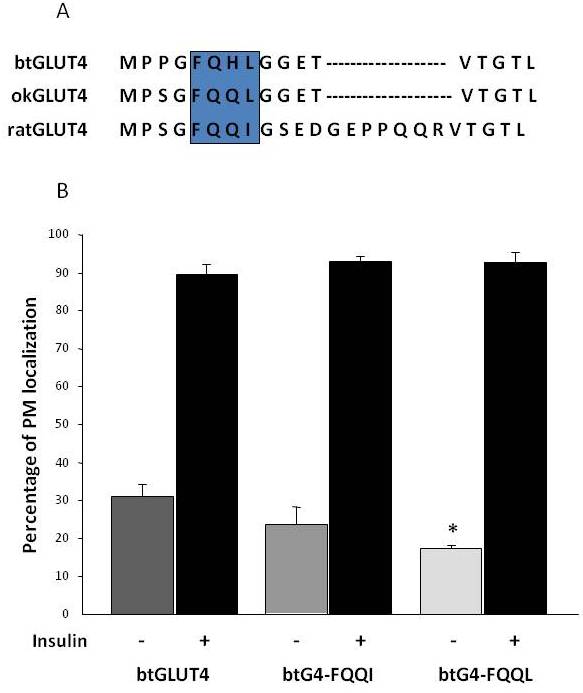
Figura 8.
Nivelurile bazale ridicate de suprafață celulară ale btGLUT4 sunt reduse prin mutarea motivului F5QHL8. (A) Alinierea secvenței de aminoacizi a regiunii N-terminale a moleculelor GLUT4 de șobolan, păstrăv brun (btGLUT4, AF247395) și somon coho (okGLUT4, AF502957). Caseta cuprinde motivul important de trafic F5QQI8, parțial conservat la speciile de pești. (B) Adipocitele 3T3-L1 diferențiate care exprimă fie btGLUT4, fie oricare dintre cei doi mutanți punctuali (btGLUT4-FQQI sau btGLUT4-FQQL) au fost incubate cu sau fără insulină (100 nM, 30 min). Datele sunt prezentate ca procentaj (medie ± SEM) de celule care prezintă un contur complet al membranei plasmatice (PM), obținut prin numărarea a 100 de celule pe condiție în 3 experimente independente. Analiza statistică a fost efectuată prin testul t nepereche față de btGLUT4 de tip sălbatic în condiții bazale sau, respectiv, stimulate cu insulină (* denotă semnificație la p < 0,05).
Un studiu anterior la mamifere folosind chimeri între GLUT4 și Glut1 a demonstrat că înlocuirea terminației N-terminale și a buclei intracelulare a Glut1 cu cele ale GLUT4 este suficientă pentru a conferi proteinei Glut1 chimerice caracteristicile GLUT4 în adipocitele 3T3-L1 . Astfel, pentru a identifica domeniile proteice din GLUT4 de păstrăv care îi conferă caracteristicile sale specifice de trafic (adică retenție intracelulară mai mică; niveluri mai ridicate de PM în condiții bazale), au fost create proteine chimerice care au extremitatea N-terminală (btN) sau bucla intracelulară (btL) a btGLUT4 într-o coloană vertebrală GLUT4 de șobolan și au fost denumite btN-GLUT4 sau, respectiv, btL-GLUT4. Aceste construcții au fost apoi exprimate în mod stabil în celulele 3T3-L1 și a fost analizată capacitatea lor de a fi reținute în citosol în condiții bazale și de a răspunde la insulină (Simoes, Planas și Camps, rezultate nepublicate). Rezultatele obținute au indicat că toate construcțiile au fost capabile să se transloce în PM ca răspuns la insulină, dar cu anumite diferențe între ele (figura 9). În primul rând, translocarea stimulată de insulină a btGLUT4 a fost mai mică decât cea a GLUT4 de șobolan. În al doilea rând, btN-GLUT4 a avut cel mai slab răspuns la insulină, sugerând un rol al extremității N-terminale în direcționarea corectă a GLUT4 către IRC sau în translocarea GLUT4 către PM. În al treilea rând, înlocuirea buclei citoplasmatice în btL-GLUT4 a determinat o reducere a răspunsului GLUT4 de șobolan la insulină comparabilă cu cea a btGLUT4. Aceste rezultate preliminare susțin ideea că extremitatea N-terminală și bucla citoplasmatică a GLUT4 sunt responsabile pentru unele dintre diferențele de trafic dintre btGLUT4 și GLUT4 de șobolan.
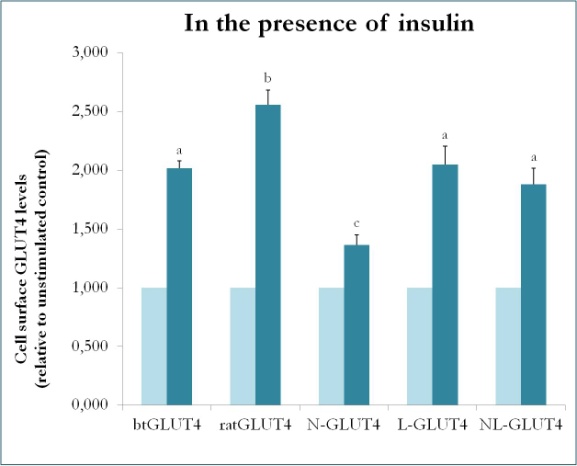
Figura 9.
Nivelurile de suprafață celulară ale diferitelor construcții GLUT4 în prezența insulinei. N-GLUT4 și L-GLUT4 reprezintă construcții cu terminația amino terminală (N) sau bucla intracelulară (L) a btGLUT4 într-o coloană vertebrală GLUT4 de șobolan, respectiv. Adipocitele 3T3-L1 diferențiate care exprimă diferitele construcții GLUT4 au fost incubate în absența sau în prezența insulinei (100nM) timp de 30 de minute, iar determinarea nivelurilor de GLUT4 de suprafață a fost efectuată conform descrierii din . GLUT4 de suprafață celulară este exprimat în raport cu controlul nestimulat pentru fiecare linie celulară. Literele diferite indică diferențe semnificative din punct de vedere statistic (p < 0,05).
În urma stimulării cu insulină, GLUT4 de mamifere circulă și fuzionează cu PM, mărindu-și prezența la suprafața celulară de până la 10 ori; astfel, susținând creșterea absorbției de glucoză observată după hrănire. Insulina crește numărul de transportatori la PM nu numai prin creșterea exocitozei, ci și prin scăderea ratei de endocitoză . Insulina își exercită efectele prin două căi diferite de semnalizare intracelulară . Prima este binecunoscuta cale a fosfatidilinositol-3-kinazei (PI3K)/proteina-kinazei B (PKB), cunoscută și sub numele de Akt, care este necesară pentru ca translocarea GLUT4 să aibă loc, dar nu este suficientă . A doua cale este cea care include proteina asociată Cbl (CAP), care se leagă de receptorul de insulină și activează o mică GTPază din familia Rho numită TC10, și care a fost descrisă în adipocite . Cu toate acestea, calea TC10 pare să nu fie implicată în celulele musculare, în care s-a demonstrat că o altă intrare independentă de Akt contribuie la remodelarea citoscheletului necesară pentru translocarea completă a GLUT4 . În aval de Akt, o proteină numită substrat Akt de 160 KDa (AS160) sau TCB1D4, s-a dovedit a fi cheia comunicării cascadei de fosforilare inițiată de insulină cu mașinăria de trafic de vezicule . AS160 are 6 resturi de treonină/serină care pot fi fosforilate pentru a-i inhiba activitatea și conține un domeniu GTPase-activating protein (GAP) care, în stare bazală, inactivează o serie de proteine Rab, mici GTPaze din superfamilia Ras responsabile de traficul membranar . Fosforilarea lui AS160 de către Akt inhibă activitatea GAP a acestuia, permițând activarea proteinelor Rab; astfel, determinând translocarea GLUT4 în PM . Membrii Rab identificați ca fiind responsabili de traficul GLUT4 la mamifere sunt Rab8a, Rab10 și Rab14 . În plus față de reglarea mișcării veziculelor GLUT4, s-a demonstrat că AS160 este necesar pentru reținerea completă a GLUT4 în IRC . Pentru a demonstra că fosforilarea AS160 este esențială pentru translocarea GLUT4 la mamifere, a fost creată o formă inhibitorie dominantă a AS160 prin mutarea a 4 din cele 6 situsuri de fosforilare ale sale (AS160-4P) . Atunci când a fost co-exprimat într-un sistem celular împreună cu GLUT4 de șobolan, translocarea acestei molecule în PM a fost blocată, precum și creșterea absorbției de glucoză observată după incubarea cu insulină . În ceea ce privește sensibilitatea lor față de AS160-4P, s-au observat diferențe clare între okGLUT4 și btGLUT4, primul prezentând proprietăți similare cu cele ale GLUT4 de mamifere, iar cel de-al doilea nefiind afectat . Aceste rezultate au fost în concordanță cu diferențele observate între cele două proteine GLUT4 de pește în ceea ce privește retenția lor intracelulară și susțin ipoteza că AS160 poate sechestra okGLUT4, dar nu și btGLUT4, în IRC și că btGLUT4 poate fi mai larg distribuit în interiorul celulei decât ceilalți transportatori GLUT4. Mai mult decât atât, deoarece rezultatele obținute pentru btGLUT4 față de sensibilitatea AS160 au fost în concordanță cu cele raportate anterior pentru un mutant GLUT4-F5A , s-a sugerat că rata exocitară mai rapidă a btGLUT4 se datorează lipsei unui motiv conservat FQQI .
În rezumat, prin investigarea caracteristicilor de trafic ale celor două proteine GLUT4 de pește (btGLUT4 și okGLUT4) în comparație cu GLUT4 și Glut1 de mamifere, este clar că există diferențe importante între acești transportatori (figura 7). În această privință, okGLUT4 se comportă în multe aspecte în mod similar cu GLUT4 de mamifere datorită sensibilității sale față de GGA și AS160; astfel, susținând un rol pentru aceste molecule în reglarea traficului de okGLUT4 sintetizat de novodin TGN în IRC și, respectiv, din TGN în PM ca răspuns la insulină. În schimb, btGLUT4 pare a fi mai puțin reglementat, traficând către IRC independent de GGA, precum și fiind reținut în IRC și ieșind către PM doar parțial sub controlul AS160; prin urmare, se deplasează către suprafața celulară posibil, în parte, printr-o cale constitutivă precum cea utilizată de Glut1.
.
Leave a Reply