グルコーストランスポーター4(GLUT4)の構造的・機能的進化を明らかにした。 魚類のGLUT4について
Regulation of traffic of fish GLUT4
哺乳類の骨格筋や脂肪組織におけるGLUT4の特徴として、インスリンに応答して細胞外に移行する能力があることがあげられる 。 このことは、食後の細胞のグルコース取り込み能力を大きく向上させ、グルコースのホメオスタシスを適切に維持するために重要である。 しかし、哺乳類細胞では、GLUT4は基礎状態では固定されておらず、トランスゴルジネットワーク(TGN)、初期および後期エンドソーム、インスリン応答区画(IRC)、さらにPMなど、多くの細胞内区画を循環していることが明らかにされている 。 基底状態のPMに存在するGLUT4の量は、全GLUT4タンパク質の約5-10%に過ぎず、残りの90-95%は細胞内のIRCコンパートメントに隔離されている。
サケ科魚類で同定された2つのグルコーストランスポーター(btGLUT4とokGLUT4)の細胞内輸送特性は、主に異種系(哺乳類の脂肪細胞や筋芽細胞株)で発現させた場合と、初代培養トラウト筋細胞で内在性のGLUT4として、哺乳類のGLUT4との比較研究が行われてきた。 3T3-L1脂肪細胞において、定常状態でbtGLUT4またはokGLUT4を別々に一過性に発現させると、btGLUT4はラットGLUT4(10-15%)より有意に高いタンパク質レベル(30-40%)、okGLUT4もより低い程度(15-20%)でPMにおけるタンパク質のレベルを示した。 これは脂肪細胞だけでなく、L6筋細胞で安定発現させたbtGLUT4も、ラットGLUT4(10-15%)より高いレベル(20-25%)でPMに存在した。 重要なことは、培養中のマス筋細胞における内因性GLUT4のPMへの局在も比較的高いということであった。 したがって、基礎状態あるいは非刺激状態において、魚類のGLUT4は哺乳類のGLUT4よりも脂肪細胞や筋細胞の細胞質への保持効率が低いようであり、魚類と哺乳類の間でGLUT4の細胞内保持のメカニズムに違いがあることを示唆している(以下を参照のこと)。 さらに、基礎条件下で観察された魚類GLUT4間の細胞内局在の違い(okGLUT4はbtGLUT4よりも哺乳類に近い)に基づき、これら2種類の魚類GLUT4タンパク質変異体の異なる交通挙動は、GLUT4タンパク質配列における特徴的制御機能の違い(すなわち。さらに、魚類のGLUT4がインスリンに反応する能力も評価されている。 魚類のGLUT4がインスリン刺激により細胞質内へ移動することを証明しようとした最初の研究は、Xenopusoocytesで行われた 。 しかしながら、このシステムはGLUT4の転座を研究するには適切ではなく、okGLUT4またはラットGLUT4を発現する卵母細胞は、インスリンに応答して細胞内のトランスポーター局在に違いを示さなかった 。 その代わりに、3T3-L1脂肪細胞系を用い、okGLUT4とbtGLUT4の両方が、哺乳類で起こるように、インスリン処理後にPMに著しく移動できることを実証することに成功した。 さらに、魚類のGLUT4トランスポーターを安定に発現しているL6筋芽細胞や分化した筋管においても、インスリン刺激によりbtGLUT4がPMに移行することが確認された。 また、魚類のGLUT4のホモログは、定常状態では細胞内局在が高いにもかかわらず、哺乳類のGLUT4と同様にインスリンに反応することが示されました。
前述のように、哺乳類のGLUT4は細胞内にIRCとエンドソームシステムという二つの主要貯蔵区画に分布しています . 興味深いことに、btGLUT4は3T3-L1脂肪細胞やL6筋肉細胞で共発現させると、ラットGLUT4と部分的にしか共局在化しなかった。 このことは、btGLUT4がインスリン刺激に応答するにもかかわらず、基礎状態では細胞内コンパートメントへの保持レベルが低いことと合わせて、btGLUT4が特殊なIRCとエンドソームの間に均等に分布し、そこからPMと連続的に循環していることを示唆している。 さらに、3T3-L1脂肪細胞とL6筋肉細胞において、btGLUT4で観察された高い細胞内レベルは、エンドサイトーシス速度の低下というよりも、より速い外部化速度によるものであることが示された。 例えば、ゴルジ体に局在するγ-ear-containing Arf-binding protein (GGA) は、新たに合成されたGLUT4をTGNからIRCへ輸送するトラフィックコントローラーとして機能することが報告されている。 このステップでは、GLUT4がGGAによってカーゴ分子として認識されるための特異的な標的モチーフを持たないため、ソルティリンも重要な役割を果たすと報告されている。 さらに最近、細胞内小胞でGLUT4と共局在しているインスリン制御アミノペプチダーゼ(IRAP)が、エンドソームからIRCへのGLUT4のソーティングに関与していることが明らかにされた . さらに、TUG (tether containing a UBX domain for GLUT4) というタンパク質が、TMVI と TMVII の間に存在する大きな細胞内 GLUT4 ループと相互作用し、UBX ドメインを介して細胞膜と相互作用して GLUT4 を細胞内小胞に繋留することが報告されています。 魚類のGLUT4アイソフォームの輸送の制御におけるいくつかのGLUT4相互作用タンパク質の役割の可能性が、対応する哺乳類のオルソログを発現する3T3-L1脂肪細胞で探索された。 特に、アダプタータンパク質であるGGAは、TGNからのGLUT4の選別の初期段階に関与していることが報告されている。 ラットGLUT4と野生型GGAまたはドミナントインターフェリング型GGA(GGA-DN)を3T3-L1脂肪細胞に発現させると、インスリン刺激によるラットGLUT4のPMへの移動がGGA-DN存在下で完全に停止したことから、GGAがGLUT4のIRC到達に必要であることが明らかになった 。 興味深いことに、3T3-L1脂肪細胞におけるbtGLUT4とokGLUT4の細胞内輸送は、GGA-DNとの共発現により、基礎状態でもインスリン刺激状態でも、部分的にしかPMへの輸送が抑制されないのに対し、okGLUT4はラットGLUT4と同じ応答を示したことから、GGAに対する感受性に関して違いが見られた。 これらの結果から、okGLUT4は哺乳類のGLUT4と同じ経路で脂肪細胞内を移動するが、btGLUT4は生合成による輸送の制御を逃れ、GGAに依存しない経路で脂肪細胞内に移動している可能性があることが示唆された。 btGLUT4とラットGLUT4の細胞内分布が異なることから、btGLUT4の細胞内輸送は、Glut1またはトランスフェリン受容体が用いる構成的経路を経由して行われている可能性が考えられる(図7)。 GLUT4はIRCに到達すると、インスリンに応答する能力を獲得し、PMにトランスロケーションすることが知られている。 ラットGLUT4をコードするプラスミドを3T3-L1脂肪細胞にトランスフェクトすると、細胞は新しいタンパク質を産生し、それをIRCに輸送するのに6〜9時間必要とする。 一方、okGLUT4とbtGLUT4は、同じ細胞系で発現させた場合、トランスフェクションからわずか3時間後にインスリン刺激によるトランスロケーションを受ける。これは、魚類のGLUT4がより速く合成、プロセシング、輸送を受けることを示唆している。 興味深いことに、okGLUT4は、哺乳類のGLUT4と同様のGGAに対する感受性を示すにもかかわらず、ラットGLUT4とbtGLUT4の中間の、より後者に近い時間応答を示していた。 (A)では、新たに合成されたラットGLUT4の輸送が、アダプタータンパク質GGAに依存した選別プロセスで、ゴルジ体およびトランスゴルジネットワーク(TGN)を通ってインスリン応答性コンパートメント(IRC)に行われることが示されている。 このプロセスはAS160によって制御され、GLUT4のF5QQI8アミノ末端モチーフが必要である。 一方、Glut1は生合成後、GGAに依存しないプロセスでTGNから細胞膜(PM)へ直接移動する。 B)では、新たに合成されたトラウト(btGLUT4)またはサケ(okGLUT4)のGLUT4のトラフィックを示している。 PMでのbtGLUT4の高いレベルは、btGLUT4がTGNからIRCへのGGA非依存的な経路をたどり、ラットGLUT4よりもIRCでのAS160制御による隔離が少ないことにより、外分泌速度が増加したためと思われると推測された。 我々は、btGLUT4の異なる輸送挙動は、そのN末端モチーフの異なる配列(F5QHL8)に関連しているのではないかと考えている。 okGLUT4 (F5QQL8)の輸送挙動は、ラットGLUT4とbtGLUT4の中間であるように思われる。 ER: endoplasmic reticulum.
3節で述べたように、哺乳類のGLUT4に見られる異なる制御アミノ酸モチーフのうち、N-末端のF5QQI8ターゲティングモチーフはGLUT4のIRCへの隔離とインスリン刺激によるPMへのトランスロケーションに重要であると示されている 。 興味深いことに、両魚類のGLUT4トランスポーターはN末端ドメインが短いことに加え、F5QQI8モチーフはokGLUT4 (F5QQL8) では1つの保存アミノ酸置換を示し、btGLUT4 (F5QHL8) では保存度が低く、2残基置換によりサイズと電荷に重要な変化が生じる (図8A)。 これらの配列の違いが、btGLUT4について観察された基底細胞表面レベルの増加を説明できる可能性を調査した(CapillaおよびPlanas、未発表データ)。 図8Bは、btGLUT4モチーフF5QHL8からF5QQI8への変異が、基底PMレベルのわずかな減少を引き起こしたことを示す;しかしながら、F5QHL8モチーフのF5QQL8への変異は、btGLUT4の細胞表面レベルをokGLUT4または哺乳動物GLUT4と同等のレベルまで有意に減少させることを示す。 これらの結果は、GLUT4分子の細胞内ドメインが、適切な交通および特定の区画の局在化および/または保持のために異なる制御タンパク質と相互作用するためには、分子の折りたたみと同様に特定のアミノ酸モチーフが重要であると思われることを示す。 (A)ラット、ブラウントラウト(btGLUT4、AF247395)およびギンザケ(okGLUT4、AF502957)GLUT4分子のN-末端領域のアミノ酸配列アライメント。 魚類で部分的に保存されている重要な輸送モチーフF5QQI8をボックスで囲んでいる。 (B)btGLUT4または2つの点変異体(btGLUT4-FQQIまたはbtGLUT4-FQQL)のいずれかを発現する分化3T3-L1脂肪細胞をインスリン(100 nM、30分)と共にまたはインスリンなしでインキュベートした。 データは、3つの独立した実験において、条件ごとに100個の細胞を数えることによって得られた完全な細胞膜(PM)縁を示す細胞の割合(平均±SEM)として提示される。 統計解析は、基礎条件またはインスリン刺激条件それぞれにおける野生型btGLUT4に対する対応のないt-検定によって行った(*はp < 0.05で有意であることを示す)。
GLUT4とGlut1のキメラを用いた哺乳類での以前の研究では、Glut1のN末端と細胞内ループをGLUT4のものに置き換えることで、3T3-L1脂肪細胞においてキメラGlut1タンパク質にGLUT4の特性を付与することが実証された。 そこで、トラウトGLUT4の特異的な輸送特性(すなわち、低い細胞内滞留性;基礎条件下で高いPMレベル)を付与するタンパク質ドメインを特定するために、ラットGLUT4骨格にbtGLUT4のN末端(btN)または細胞内ループ(btL)を有するキメラタンパク質を作り、それぞれbtN-GLUT4またはbtL-GLUT4と命名した。 これらのコンストラクトを3T3-L1細胞で安定的に発現させ、基礎条件下で細胞質に保持される能力とインスリンに応答する能力を分析した(Simoes, Planas and Camps, 未発表の結果)。 得られた結果から、すべてのコンストラクトはインスリンに応答してPMに移動することができたが、それらの間に一定の違いがあることが示された(図9)。 まず、btGLUT4のインスリン刺激による転座は、ラットGLUT4の転座よりも低いものであった。 第二に、btN-GLUT4はインスリンに対する反応が最も弱く、これはGLUT4のIRCへの正しいターゲティングやPMへのトランスロケーションにおいてN末端の役割があることを示唆している。 第三に、btL-GLUT4の細胞質ループを置換すると、ラットGLUT4のインスリンに対する応答はbtGLUT4と同程度に低下した。 これらの予備的な結果は、GLUT4のN末端と細胞質ループが、btGLUT4とラットGLUT4の間の輸送の違いのいくつかに関与しているという考えを支持する。
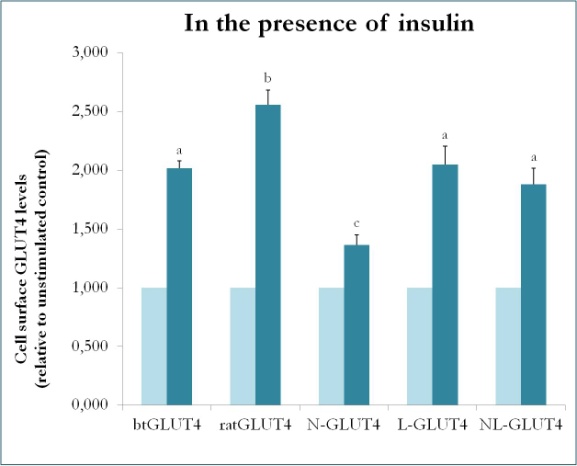
図9.9151>
インスリン存在下における様々なGLUT4構築物の細胞表面レベル。 N-GLUT4およびL-GLUT4は、それぞれ、ラットGLUT4バックボーンにbtGLUT4のアミノ末端(N)または細胞内ループ(L)を有する構築物を表す。 様々なGLUT4コンストラクトを発現する分化3T3-L1脂肪細胞を、インスリン(100nM)の非存在下または存在下で30分間インキュベートし、表面GLUT4レベルの決定を、に記載したように実施した。 細胞表面GLUT4は、各細胞株について、刺激していないコントロールとの相対値で表した。 3195>
インスリン刺激後、哺乳類のGLUT4はPMに輸送および融合し、細胞表面におけるその存在感を最大10倍まで増加させ、したがって、摂食後に観察されるグルコース摂取の増加を支援する。 インスリンは、エキソサイトーシスを促進するだけでなく、エンドサイトーシスの速度を減少させることによっても、細胞質におけるトランスポーターの数を増加させる。 インスリンは2つの異なる細胞内シグナル伝達経路を介してその効果を発揮する。 1つ目は、ホスファチジルイノシトール-3-キナーゼ(PI3K)/プロテインキナーゼB(PKB)(別名Akt)のよく知られた経路で、GLUT4トランスロケーションの発生に必要だが十分ではない. 第二の経路は、Cbl associated protein (CAP)を含む経路で、インスリン受容体に結合し、TC10というRhoファミリーの小さなGTPaseを活性化し、脂肪細胞で報告されたものである . しかし、筋肉細胞ではTC10経路は関与していないようで、別のAkt非依存的な入力がGLUT4の完全な移動に必要な細胞骨格のリモデリングに寄与していることが示された … Aktの下流には、Akt substrate of 160 KDa(AS160)あるいはTCB1D4と呼ばれるタンパク質があり、インスリンによって開始されたリン酸化カスケードを小胞輸送機構に伝える鍵となることが分かってきた。 AS160は、6つのスレオニン/セリン残基を持ち、その活性を抑制することができる。また、GTPase-activating protein (GAP) ドメインを持ち、基底状態において、膜輸送を担うRasスーパーファミリーの小GTPaseである一連のRabタンパク質が不活性化されている。 AktによるAS160のリン酸化は、そのGAP活性を阻害し、Rabタンパク質の活性化を可能にし、その結果、GLUT4が細胞膜に移動する。 哺乳類においてGLUT4の輸送に関与するRabタンパク質は、Rab8a、Rab10およびRab14であることが確認されている。 GLUT4小胞の移動を制御することに加えて、AS160はGLUT4をIRCに完全に保持するために必要であることが証明された。 AS160のリン酸化がGLUT4の移動に重要であることを証明するために、AS160の6つのリン酸化部位のうち4つを変異させたドミナント阻害型(AS160-4P)が作られた。 細胞系でラットGLUT4と共発現させると、この分子の細胞質への移動が阻害され、インスリン培養後に観察されるグルコース取り込みの増加も阻害された。 AS160-4Pに対する感受性については、okGLUT4とbtGLUT4の間で明確な違いが見られ、前者は哺乳類のGLUT4と同様の特性を示し、後者は影響を受けなかった。 これらの結果は、2つの魚類のGLUT4タンパク質の細胞内保持能の違いと一致し、AS160はbtGLUT4ではなくokGLUT4をIRCに封じ込め、btGLUT4は他のGLUT4トランスポーターよりも細胞内に広く分布している可能性があるとの仮説を支持するものであった。 さらに、AS160感受性に対するbtGLUT4の結果は、以前に報告されたGLUT4-F5A変異体の結果と一致したことから、btGLUT4の速い細胞外への放出速度は、保存されたFQQIモチーフがないためであることが示唆された.
以上のように、魚類のGLUT4タンパク質(btGLUT4とokGLUT4)の輸送特性を哺乳類のGLUT4とGlut1と比較して調べたところ、これらのトランスポーターの間に重要な違いが存在することが明らかになった(図7)。 この点、okGLUT4は、GGAおよびAS160に対する感受性により、多くの点で哺乳類GLUT4と同様に振る舞う。したがって、インスリンに応答して、新たに合成されたokGLUT4がTGNからIRCへ、およびTGNからPMへの輸送をそれぞれ制御する上でこれらの分子の役割を支持するものである。 一方、btGLUT4はあまり制御されていないようで、GGAとは無関係にIRCに移動し、AS160の制御下で部分的にしかIRCに保持されず、細胞外に出る。したがって、おそらくGlut1が用いる経路のように構成的に細胞表面に向かって移動している。
Leave a Reply