Strukturní a funkční vývoj glukózového transportéru 4 (GLUT4): Pohled na GLUT4 u ryb
Regulace provozu rybího GLUT4
U savců je hlavním rysem, který charakterizuje GLUT4 v kosterním svalu a tukové tkáni a činí jej jedinečným, jeho schopnost translokace do PM v reakci na inzulin . To výrazně zvyšuje schopnost buněk vychytávat glukózu během postprandiálního stavu, což je zásadní pro správné udržení homeostázy glukózy. Přesto důkazy u savčích buněk jasně ukazují, že v bazálním stavu není GLUT4 statický; místo toho GLUT4 cirkuluje mezi mnoha intracelulárními kompartmenty, jako je trans-Golgiho síť (TGN), časné a pozdní endozomy, specializovaný kompartment reagující na inzulin (IRC) a také PM . Množství GLUT4 přítomné v PM v základním stavu odpovídá asi jen 5-10 % celkového proteinu GLUT4, zatímco zbývajících 90-95 % je sekvestrováno intracelulárně v kompartmentu IRC .
Vlastnosti intracelulárního transportu dvou glukózových transportérů identifikovaných u lososovitých (btGLUT4 a okGLUT4) byly studovány ve srovnání se savčím GLUT4 především při expresi v heterologních systémech (savčí adipocytární nebo myoblastické buněčné linie), ale také jako endogenní GLUT4 v primárně kultivovaných myocytech pstruha. V adipocytech 3T3-L1 exprimujících přechodně odděleně btGLUT4 nebo okGLUT4 za ustálených podmínek vykazoval btGLUT4 výrazně vyšší hladiny proteinu v PM (30-40 %), rovněž okGLUT4, ale v menší míře (15-20 %), než krysí GLUT4 (10-15 %) . To nebylo pozorováno pouze u adipocytů, protože btGLUT4 byl při stabilní expresi ve svalových buňkách L6 přítomen rovněž v PM ve vyšších hladinách (20-25 %) než potkaní GLUT4 (10-15 %) . Důležité je, že bazální lokalizace endogenního GLUT4 v PM u pstruhových myocytů v kultuře byla také poměrně vysoká . Zdá se tedy, že za bazálních nebo nestimulovaných podmínek je rybí GLUT4 v adipocytech a myocytech méně účinně zadržován v cytosolu než savčí GLUT4, což naznačuje rozdíly v mechanismech odpovědných za intracelulární zadržování GLUT4 mezi rybami a savci (viz níže). Kromě toho se na základě pozorovaných rozdílů v lokalizaci v PM mezi rybími GLUT4 za bazálních podmínek, kdy okGLUT4 je podobnější svým savčím protějškům než btGLUT4, předpokládá, že rozdílné dopravní chování těchto dvou variant rybího proteinu GLUT4 může souviset s rozdíly v charakteristických regulačních rysech v sekvenci proteinu GLUT4 (mj.tj. N- a C-koncové proteinové motivy) (viz oddíl 3; ).
Mimo to byla hodnocena také schopnost rybích GLUT4 reagovat na inzulin. První studie, které se snažily prokázat, že rybí GLUT4 se po stimulaci inzulinem přemisťuje do PM, byly provedeny na Xenopusoocytech . Nicméně tento systém nebyl vhodný pro studium translokace GLUT4 a oocyty exprimující okGLUT4 nebo krysí GLUT4 nevykazovaly rozdíly v lokalizaci transportéru v buňce v reakci na inzulin . Místo toho byl úspěšně použit systém 3T3-L1 adipocytárních buněk, který prokázal, že jak okGLUT4, tak btGLUT4 jsou schopny se po léčbě inzulinem významně přemístit do PM , jak k tomu dochází u savců. Navíc byla prokázána inzulinem stimulovaná translokace btGLUT4 do PM u myoblastů L6 a diferencovaných myotub stabilně exprimujících rybí transportér GLUT4 . Bylo tedy prokázáno, že rybí homology GLUT4 reagují na inzulín stejně jako jejich savčí protějšky, a to i přes jejich vyšší lokalizaci v PM v ustáleném stavu.
Jak již bylo uvedeno, GLUT4 je u savců distribuován uvnitř buněk ve dvou hlavních zásobních oddílech, IRC a endozomálním systému . Je zajímavé, že btGLUT4 vykazoval pouze částečnou kolokaci s GLUT4 potkana, když byly oba koexprimovány buď v adipocytech 3T3-L1, nebo ve svalových buňkách L6 . Toto pozorování spolu se skutečností, že btGLUT4 vykazoval nižší úroveň retence v intracelulárních kompartmentech během bazálních podmínek, ačkoli stále reagoval na stimulaci inzulinem v obou typech buněk , naznačuje, že btGLUT4 je rovnoměrně distribuován mezi specializovaným IRC a endosomálním kompartmentem, odkud kontinuálně cyklicky přechází do PM. Navíc jak u adipocytů 3T3-L1, tak u svalových buněk L6 se ukázalo, že vyšší hladiny PM pozorované u btGLUT4 jsou způsobeny spíše rychlejší externalizací než snížením rychlosti endocytózy .
U savců bylo popsáno několik proteinů, které interagují s GLUT4, aby regulovaly jeho intracelulární provoz a udržovaly proteiny sekvestrované v IRC. Například byl popsán protein vázající Arf (GGA), který je lokalizován v Golgi a obsahuje γ uši, a který funguje jako regulátor provozu nově syntetizovaného GLUT4 z TGN do IRC . V tomto kroku byla popsána také klíčová role sortilinu, protože GLUT4 neobsahuje specifický cílový motiv, aby byl rozpoznán GGA jako nákladní molekula . Nedávno bylo prokázáno, že při třídění GLUT4 z endosomů do IRC hraje roli aminopeptidáza regulovaná inzulinem (IRAP), která se společně s GLUT4 lokalizuje v intracelulárních vezikulech . Kromě toho bylo zjištěno, že protein s názvem TUG (tether obsahující doménu UBX pro GLUT4) interaguje s velkou intracelulární smyčkou GLUT4 přítomnou mezi TMVI a TMVII a poutá GLUT4 k intracelulárním vezikulům prostřednictvím interakce s buněčnými membránami prostřednictvím své domény UBX . Možná role několika proteinů interagujících s GLUT4 v regulaci pohybu rybích izoforem GLUT4 byla zkoumána v adipocytech 3T3-L1 exprimujících příslušné savčí ortology. Zejména bylo zjištěno, že adaptorový protein GGA se podílí na časných krocích třídění GLUT4 z TGN. Exprese krysího GLUT4 v adipocytech 3T3-L1 spolu s divokým typem GGA nebo dominantní interferující formou GGA (GGA-DN) ukázala, že GGA je nutný k tomu, aby GLUT4 dosáhl IRC, protože inzulinem stimulovaná translokace krysího GLUT4 do PM byla v přítomnosti GGA-DN zcela otupena. Zajímavé je, že intracelulární přenos btGLUT4 a okGLUT4 v adipocytech 3T3-L1 vykazoval rozdíly, pokud jde o jejich citlivost na GGA, protože přenos btGLUT4 do PM buď za bazálních, nebo inzulinem stimulovaných podmínek byl pouze částečně potlačen koexpresí s GGA-DN, zatímco okGLUT4 vykazoval stejnou odezvu jako GLUT4 potkana. Tyto výsledky naznačují, že okGLUT4 se může v adipocytech pohybovat stejnou cestou jako savčí GLUT4, ale že btGLUT4 může částečně unikat regulované biosyntetické cestě a pohybovat se do PM cestou nezávislou na GGA. V souladu s rozdílnou intracelulární distribucí pozorovanou mezi btGLUT4 a GLUT4 potkanů se pohyb btGLUT4 do PM může odehrávat konstitutivní cestou využívanou Glut1 nebo transferinovým receptorem (obrázek 7). Je známo, že GLUT4 po příchodu do IRC získá schopnost reagovat na inzulin a přemístit se do PM. Když je plazmid kódující krysí GLUT4 transfekován do adipocytů 3T3-L1, buňky potřebují 6 až 9 hodin k produkci nového proteinu a k jeho zacílení do IRC . Naproti tomu okGLUT4 i btGLUT4, pokud jsou exprimovány ve stejném buněčném systému, podléhají inzulinem stimulované translokaci pouze 3 hodiny po transfekci , což naznačuje, že rybí GLUT4 podléhá rychlejší syntéze, zpracování nebo transportu. Zajímavé je, že okGLUT4 vykazoval časovou odezvu, která byla prostřední mezi GLUT4 potkana a btGLUT4, ale blíže k posledně jmenovanému, přestože vykazoval podobnou citlivost vůči GGA jako GLUT4 savců.
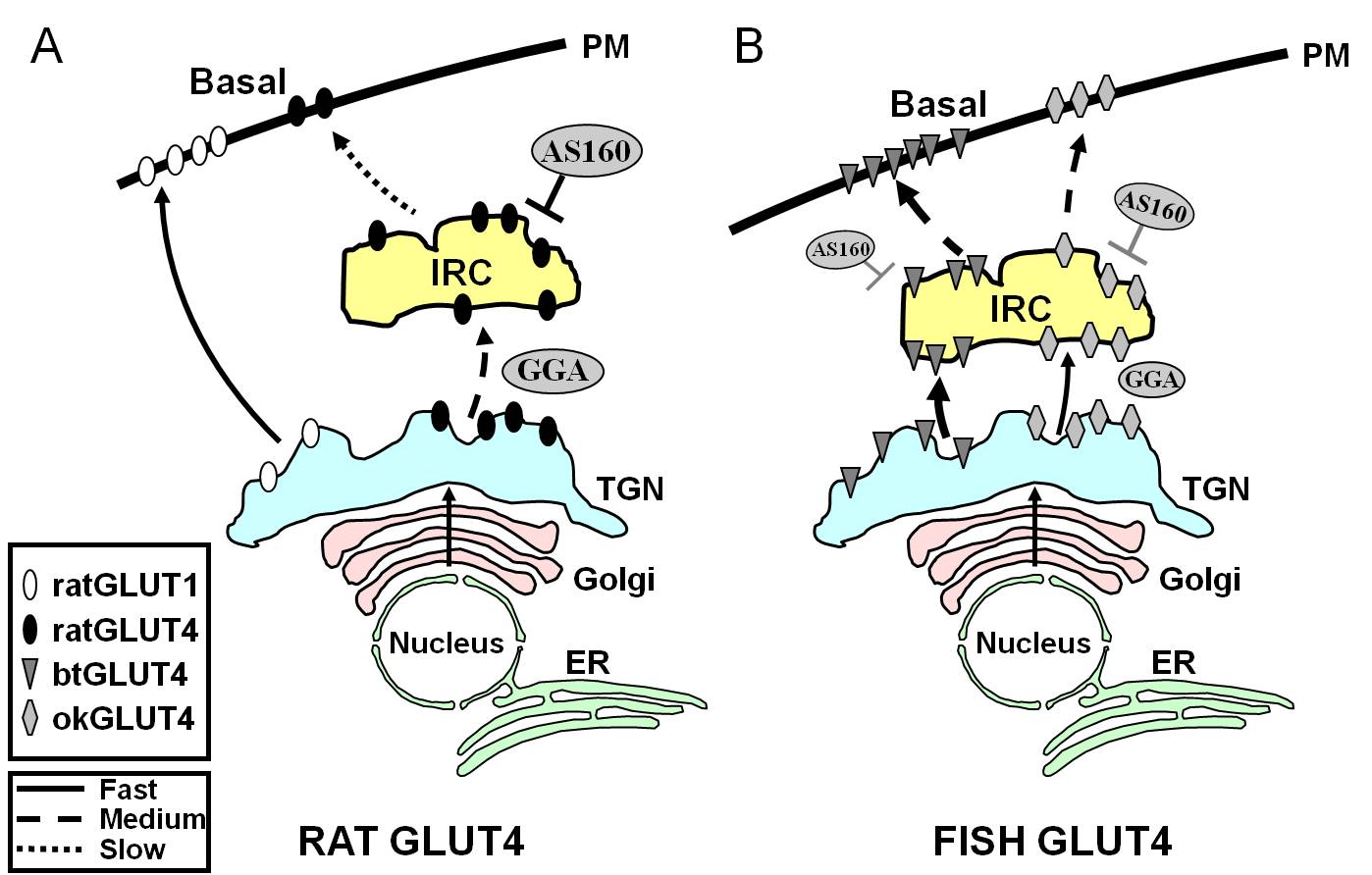
Obrázek 7.
Schematický model ilustrující rozdíly v provozu mezi rybími GLUT4s a GLUT4 a Glut1 potkana během bazálního stavu v adipocytech. V (A) je znázorněn provoz nově syntetizovaných krysích GLUT4, který probíhá přes Golgiho a trans-Golgiho síť (TGN) a do kompartmentu reagujícího na inzulín (IRC) v procesu třídění, který je závislý na adaptorovém proteinu GGA. V základním stavu je GLUT4 potkanů převážně sekvestrován do IRC, přičemž tento proces je regulován AS160 a vyžaduje aminoterminální motiv F5QQI8 GLUT4. Naproti tomu Glut1 po biosyntéze putuje přímo z TGN do plazmatické membrány (PM) v procesu nezávislém na GGA. Na obrázku (B) je znázorněn pohyb nově syntetizovaného GLUT4 pstruha (btGLUT4) nebo lososa (okGLUT4). Předpokládáme, že vysoké hladiny btGLUT4 v PM jsou zřejmě způsobeny zvýšenou rychlostí exocytózy v důsledku toho, že btGLUT4 jde z TGN do IRC cestou nezávislou na GGA a vykazuje menší sekvestraci regulovanou AS160 v IRC než GLUT4 potkana. Předpokládáme, že odlišné chování btGLUT4 může souviset s odlišnou sekvencí v jeho N-koncovém motivu (F5QHL8). Zdá se, že dopravní chování okGLUT4 (F5QQL8) je prostřední mezi chováním krysího GLUT4 a btGLUT4. ER: endoplazmatické retikulum
Jak již bylo uvedeno v části 3, mezi různými regulačními aminokyselinovými motivy, které se vyskytují v GLUT4 u savců, se ukázalo, že cílový motiv F5QQI8 na N-konci je důležitý pro sekvestraci GLUT4 do IRC a inzulinem stimulovanou translokaci do PM . Je zajímavé, že kromě toho, že oba rybí transportéry GLUT4 mají kratší N-koncovou doménu, vykazuje motiv F5QQI8 jednu konzervovanou aminokyselinovou záměnu u okGLUT4 (F5QQL8) a méně konzervovaný je u btGLUT4 (F5QHL8), kde záměna dvojitého zbytku způsobuje důležité změny velikosti a náboje (obr. 8A). Byla zkoumána možnost, že tyto sekvenční rozdíly jsou schopny vysvětlit zvýšené bazální hladiny na povrchu buněk pozorované u btGLUT4 (Capilla a Planas, nepublikované údaje). Obrázek 8B ukazuje, že mutace motivu btGLUT4 F5QHL8 na F5QQI8 způsobila mírné snížení bazálních hladin PM; mutace motivu F5QHL8 na F5QQL8 však výrazně snížila povrchové hladiny btGLUT4 na hladiny srovnatelné s hladinami okGLUT4 nebo savčího GLUT4. Tyto výsledky naznačují, že specifické aminokyselinové motivy i skládání molekuly jsou zřejmě důležité pro interakci intracelulárních domén molekuly GLUT4 s různými regulačními proteiny pro správný provoz a lokalizaci a/nebo retenci ve specifických kompartmentech.
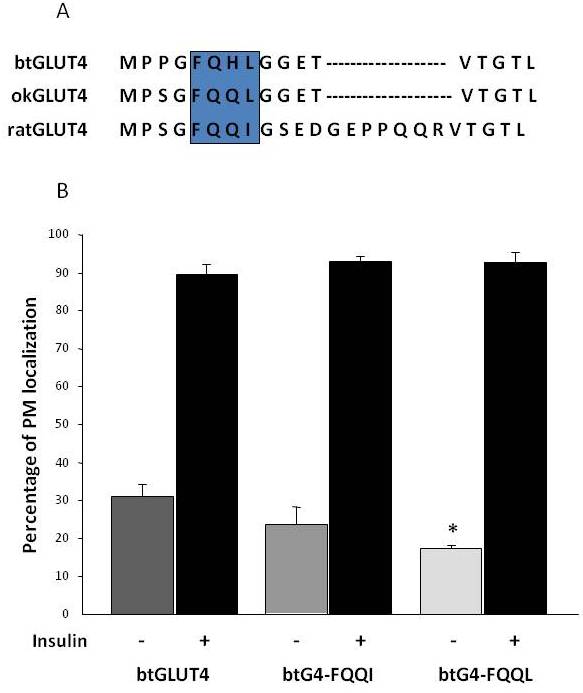
Obrázek 8.
Zvýšené bazální hladiny btGLUT4 na buněčném povrchu jsou sníženy mutací motivu F5QHL8. (A) Zarovnání aminokyselinové sekvence N-koncové oblasti molekul GLUT4 potkana, pstruha potočního (btGLUT4, AF247395) a lososa obecného (okGLUT4, AF502957). Rámeček uzavírá důležitý motiv F5QQI8, který je u ryb částečně konzervován. (B) Diferencované adipocyty 3T3-L1 exprimující buď btGLUT4, nebo některý ze dvou bodových mutantů (btGLUT4-FQQI nebo btGLUT4-FQQL) byly inkubovány s inzulinem nebo bez něj (100 nM, 30 min). Údaje jsou prezentovány jako procento (průměr ± SEM) buněk vykazujících kompletní lem plazmatické membrány (PM) získané počítáním 100 buněk na podmínku ve 3 nezávislých experimentech. Statistická analýza byla provedena nepárovým t-testem proti divokému typu btGLUT4 za bazálních, resp. inzulinem stimulovaných podmínek (* značí významnost při p < 0,05).
Dřívější studie na savcích s použitím chimér mezi GLUT4 a Glut1 ukázala, že záměna N-konce a intracelulární smyčky Glut1 za ty z GLUT4 je dostatečná k tomu, aby chimérický protein Glut1 získal vlastnosti GLUT4 v adipocytech 3T3-L1 . Proto byly za účelem identifikace proteinových domén v pstruhovém GLUT4, které mu propůjčují specifické dopravní vlastnosti (tj. nižší intracelulární retence; vyšší hladiny PM za bazálních podmínek), vytvořeny chimérické proteiny, které mají N-konec (btN) nebo intracelulární smyčku (btL) btGLUT4 v krysím GLUT4 páteři a byly pojmenovány btN-GLUT4, resp. btL-GLUT4. Tyto konstrukty byly poté stabilně exprimovány v buňkách 3T3-L1 a byla analyzována jejich schopnost udržet se v cytosolu za bazálních podmínek a reagovat na inzulin (Simoes, Planas a Camps, nepublikované výsledky). Získané výsledky ukázaly, že všechny konstrukty byly schopny translokace do PM v reakci na inzulin, ale s určitými rozdíly mezi nimi (obr. 9). Za prvé, inzulinem stimulovaná translokace btGLUT4 byla nižší než translokace krysího GLUT4. Za druhé, btN-GLUT4 měl nejslabší odpověď na inzulin, což naznačuje roli N-konce při správném zacílení GLUT4 do IRC nebo při translokaci GLUT4 do PM. Zatřetí, záměna cytoplazmatické smyčky v btL-GLUT4 způsobila snížení odpovědi krysího GLUT4 na inzulin srovnatelné s odpovědí btGLUT4. Tyto předběžné výsledky podporují myšlenku, že N-konec a cytoplazmatická smyčka GLUT4 jsou zodpovědné za některé rozdíly v transportu mezi btGLUT4 a krysím GLUT4.
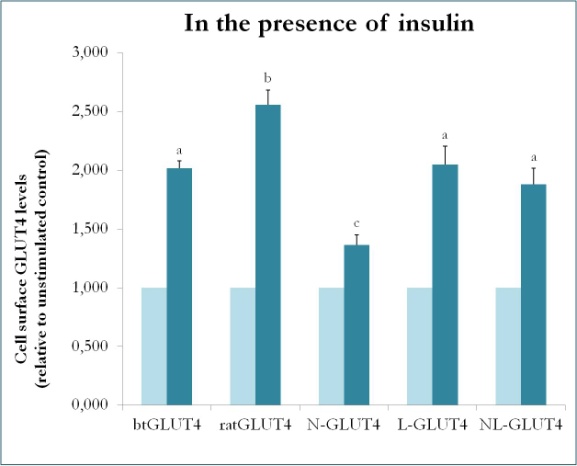
Obrázek 9.
Hladiny různých konstruktů GLUT4 na povrchu buněk v přítomnosti inzulínu. N-GLUT4 a L-GLUT4 představují konstrukty s aminoterminálem (N), resp. intracelulární smyčkou (L) btGLUT4 v páteři GLUT4 potkana. Diferencované adipocyty 3T3-L1 exprimující různé konstrukty GLUT4 byly inkubovány v nepřítomnosti nebo přítomnosti inzulinu (100 nM) po dobu 30 min a stanovení povrchových hladin GLUT4 bylo provedeno podle popisu v . Povrchový GLUT4 buněk je vyjádřen ve vztahu k nestimulované kontrole pro každou buněčnou linii. Rozdílná písmena označují statisticky významné rozdíly (p < 0,05).
Po stimulaci inzulinem se savčí GLUT4 pohybuje a fúzuje s PM, čímž se jeho přítomnost na povrchu buněk zvýší až 10krát; podporuje tak zvýšení příjmu glukózy pozorované po krmení. Inzulin zvyšuje počet transportérů na PM nejen zvýšením exocytózy, ale také snížením rychlosti endocytózy . Inzulin uplatňuje své účinky prostřednictvím dvou různých intracelulárních signálních drah . První z nich je dobře známá dráha fosfatidylinositol-3-kinázy (PI3K)/proteinkinázy B (PKB), známé také jako Akt, která je nezbytná pro to, aby došlo k translokaci GLUT4, ale nestačí . Druhou cestou je cesta zahrnující protein asociovaný s Cbl (CAP), který váže inzulinový receptor a aktivuje malou GTPázu z rodiny Rho s názvem TC10, a která byla popsána v adipocytech . Zdá se však, že dráha TC10 není zapojena ve svalových buňkách, v nichž bylo prokázáno, že k remodelaci cytoskeletu potřebné pro úplnou translokaci GLUT4 přispívá jiný vstup nezávislý na Akt . Bylo zjištěno, že za Aktem se nachází protein nazvaný Akt substrát 160 KDa (AS160) nebo TCB1D4, který je klíčem ke komunikaci fosforylační kaskády iniciované inzulínem s mechanismem obchodování s vezikuly. AS160 má 6 zbytků threoninu/serinu, které mohou být fosforylovány, aby se inhibovala jeho aktivita, a obsahuje GTPase-activating protein (GAP) doménu, která v bazálním stavu inaktivuje řadu proteinů Rab, malých GTPas z nadrodiny Ras zodpovědných za membránové obchodování . Fosforylace AS160 Aktem inhibuje jeho aktivitu GAP a umožňuje aktivaci proteinů Rab; tím způsobuje translokaci GLUT4 do PM . Za přenos GLUT4 jsou u savců zodpovědné tyto členy Rab: Rab8a, Rab10 a Rab14 . Kromě regulace pohybu vezikul GLUT4 bylo prokázáno, že AS160 je nutný pro úplné zadržení GLUT4 v IRC . Aby se prokázalo, že fosforylace AS160 je rozhodující pro translokaci GLUT4 u savců, byla vytvořena dominantní inhibiční forma AS160 mutací 4 z jeho 6 fosforylačních míst (AS160-4P) . Při společné expresi v buněčném systému spolu s krysím GLUT4 byla blokována translokace této molekuly do PM, stejně jako zvýšení příjmu glukózy pozorované po inkubaci s inzulinem . Pokud jde o citlivost vůči AS160-4P, byly pozorovány jasné rozdíly mezi okGLUT4 a btGLUT4, přičemž první z nich vykazoval podobné vlastnosti jako savčí GLUT4 a druhý nebyl ovlivněn . Tyto výsledky byly v souladu s rozdíly pozorovanými mezi oběma rybími proteiny GLUT4, pokud jde o jejich intracelulární retenci, a podporují hypotézu, že AS160 může v IRC sekvestrovat okGLUT4, ale ne btGLUT4, a že btGLUT4 může být v buňce rozšířenější než ostatní transportéry GLUT4. Navíc vzhledem k tomu, že výsledky získané pro btGLUT4 vůči citlivosti AS160 se shodují s výsledky dříve uvedenými pro mutanta GLUT4-F5A , bylo navrženo, že rychlejší exocytická rychlost btGLUT4 je způsobena nedostatkem konzervovaného motivu FQQI .
Shrnem lze říci, že při zkoumání vlastností transportu obou rybích proteinů GLUT4 (btGLUT4 a okGLUT4) ve srovnání se savčími GLUT4 a Glut1 je zřejmé, že mezi těmito transportéry existují významné rozdíly (obr. 7). V tomto ohledu se okGLUT4 chová v mnoha ohledech podobně jako savčí GLUT4 díky své citlivosti vůči GGA a AS160; to podporuje roli těchto molekul v regulaci přenosu okGLUT4 syntetizovaného de novofrom z TGN do IRC, respektive z TGN do PM v reakci na inzulin. Naproti tomu se zdá, že btGLUT4 je méně regulován, pohybuje se do IRC nezávisle na GGA a také je zadržován v IRC a opouští PM pouze částečně pod kontrolou AS160; pohybuje se tedy směrem k povrchu buňky pravděpodobně částečně konstitutivní cestou, jakou používá Glut1.
.
Leave a Reply