Evolución estructural y funcional del transportador de glucosa 4 (GLUT4): Una mirada a GLUT4 en los peces
Regulación del tráfico de GLUT4 de los peces
En los mamíferos, el principal rasgo que caracteriza a GLUT4 en el músculo esquelético y en el tejido adiposo y que lo hace único es su capacidad de translocarse a la MP en respuesta a la insulina . Esto aumenta en gran medida la capacidad de las células para captar glucosa durante el estado postprandial, lo cual es crucial para mantener adecuadamente la homeostasis de la glucosa. No obstante, las pruebas obtenidas en las células de mamíferos indican claramente que, en el estado basal, GLUT4 no es estático, sino que circula entre numerosos compartimentos intracelulares, como la red trans-Golgi (TGN), los endosomas tempranos y tardíos, un compartimento especializado que responde a la insulina (IRC), así como el PM . La cantidad de GLUT4 presente en el PM en el estado basal corresponde a sólo un 5-10% del total de la proteína GLUT4, mientras que el 90-95% restante está secuestrado intracelularmente en el compartimento IRC .
Las características del tráfico intracelular de los dos transportadores de glucosa identificados en salmónidos (btGLUT4 y okGLUT4) se han estudiado en comparación con el GLUT4 de mamíferos, principalmente cuando se expresa en sistemas heterólogos (líneas celulares adipocíticas o mioblásticas de mamíferos), pero también como el GLUT4 endógeno en miocitos primarios de trucha cultivados. En los adipocitos 3T3-L1 que expresan transitoriamente por separado btGLUT4 o okGLUT4 en condiciones estables, btGLUT4 mostró niveles de proteína significativamente más altos en la MP (30-40%), también okGLUT4 pero en menor medida (15-20%), que GLUT4 de rata (10-15%) . Esto no sólo se observó en los adipocitos, ya que btGLUT4 también estaba presente en el PM en niveles más altos (20-25%) que GLUT4 de rata (10-15%) cuando se expresaba de forma estable en células musculares L6 . Es importante destacar que la localización basal de GLUT4 endógena en el PM en los miocitos de trucha en cultivo fue también relativamente alta. Por lo tanto, en condiciones basales o no estimuladas, la GLUT4 de los peces parece estar retenida de forma menos eficiente en el citosol de los adipocitos y los miocitos que la GLUT4 de los mamíferos, lo que sugiere diferencias en los mecanismos responsables de la retención intracelular de la GLUT4 entre los peces y los mamíferos (véase más adelante). Además, basándose en las diferencias observadas en la localización en la MP entre las GLUT4 de peces en condiciones basales, siendo la okGLUT4 más similar a sus homólogas de mamíferos que la btGLUT4, se ha sugerido que el diferente comportamiento de tráfico de estas dos variantes de la proteína GLUT4 de peces puede estar relacionado con las diferencias en los rasgos reguladores característicos de la secuencia de la proteína GLUT4 (es decire. motivos proteicos N y C-terminales) (ver sección 3; ).
Además, también se ha evaluado la capacidad de las GLUT4 de peces para responder a la insulina. Los primeros estudios que intentaron demostrar que una GLUT4 de pez se transloca a la PM al ser estimulada por la insulina se realizaron en Xenopusocitos . Sin embargo, el sistema no era apropiado para estudiar la translocación de GLUT4 y los ovocitos que expresaban okGLUT4 o un GLUT4 de rata no mostraron diferencias en la localización del transportador dentro de la célula en respuesta a la insulina . En su lugar, se utilizó con éxito el sistema celular de adipocitos 3T3-L1 para demostrar que tanto okGLUT4 como btGLUT4 eran capaces de translocarse significativamente a la MP tras el tratamiento con insulina , como ocurre en los mamíferos. Además, se demostró la translocación de btGLUT4 al PM estimulada por la insulina en mioblastos L6 y miotubos diferenciados que expresan de forma estable el transportador GLUT4 de peces. Por lo tanto, se demostró que los homólogos de GLUT4 de los peces responden a la insulina como sus homólogos de los mamíferos, a pesar de su mayor localización en la PM en estado estacionario.
Como se mencionó anteriormente, GLUT4 en los mamíferos se distribuye dentro de las células en dos compartimentos principales de almacenamiento, el IRC y el sistema endosomal . Curiosamente, btGLUT4 mostró sólo una co-localización parcial con GLUT4 de rata cuando ambos fueron co-expresados en adipocitos 3T3-L1 o en células musculares L6 . Esta observación, junto con el hecho de que btGLUT4 mostró menores niveles de retención en los compartimentos intracelulares durante las condiciones basales, aunque seguía respondiendo a la estimulación de la insulina en ambos tipos celulares , sugirió que btGLUT4 se distribuye por igual entre el IRC especializado y el compartimento endosomal, desde donde cicla continuamente con el MP. Además, tanto en los adipocitos 3T3-L1 como en las células musculares L6, se demostró que los mayores niveles de PM observados para btGLUT4 se debían a una tasa de externalización más rápida que a una disminución de la tasa de endocitosis .
En los mamíferos, se han descrito varias proteínas que interactúan con GLUT4 para regular su tráfico intracelular y mantener las proteínas secuestradas en el IRC. Por ejemplo, se ha descrito que la proteína de unión a Arf (GGA) localizada en el Golgi y que contiene una oreja γ funciona como controlador del tráfico de GLUT4 recién sintetizado desde el TGN al IRC . En este paso, se ha descrito que la sortilina también tiene un papel clave, ya que GLUT4 no contiene el motivo de orientación específico para ser reconocida por GGA como molécula de carga . Más recientemente, se ha demostrado que la aminopeptidasa regulada por la insulina (IRAP), que se co-localiza con GLUT4 en las vesículas intracelulares, desempeña un papel en la clasificación de GLUT4 desde los endosomas hacia el IRC . Además, se ha informado de que una proteína denominada TUG (tether containing a UBX domain for GLUT4), interactúa con el gran bucle intracelular de GLUT4 presente entre TMVI y TMVII y ata a GLUT4 a las vesículas intracelulares mediante su interacción, a través de su dominio UBX, con las membranas celulares . Las posibles funciones de varias proteínas que interactúan con GLUT4 en la regulación del tráfico de las isoformas GLUT4 de peces se han explorado en adipocitos 3T3-L1 que expresan los correspondientes ortólogos de mamíferos. En particular, se ha informado de que la proteína adaptadora GGA participa en los primeros pasos de clasificación de GLUT4 desde el TGN. La expresión en adipocitos 3T3-L1 de GLUT4 de rata junto con GGA de tipo salvaje o una forma de interferencia dominante de GGA (GGA-DN) demostró que GGA es necesaria para que GLUT4 alcance el IRC, ya que la translocación de GLUT4 de rata al PM, estimulada por la insulina, se redujo completamente en presencia de GGA-DN. Curiosamente, el tráfico intracelular de btGLUT4 y okGLUT4 en los adipocitos 3T3-L1 mostró diferencias en cuanto a su sensibilidad a la GGA, ya que el tráfico de btGLUT4 hacia el PM, ya sea en condiciones basales o estimuladas por la insulina, sólo se suprimió parcialmente mediante la coexpresión con GGA-DN, mientras que okGLUT4 mostró una respuesta idéntica a la de GLUT4 de rata. Estos resultados sugieren que okGLUT4 puede traficar en los adipocitos a través de la misma vía que GLUT4 de mamífero, pero que btGLUT4 puede estar escapando en parte de la ruta de tráfico biosintético regulado, moviéndose a la PM siguiendo una vía independiente de GGA. De acuerdo con la diferente distribución intracelular observada entre btGLUT4 y GLUT4 de rata, el tráfico de btGLUT4 a la MP puede estar ocurriendo a través de la vía constitutiva utilizada por Glut1 o el receptor de transferrina (Figura 7). Se sabe que GLUT4, al llegar al IRC, adquiere la capacidad de responder a la insulina y translocarse a la PM. Cuando se transfecta un plásmido que codifica GLUT4 de rata en adipocitos 3T3-L1, las células necesitan de 6 a 9 horas para producir la nueva proteína y dirigirla al IRC . Por el contrario, tanto okGLUT4 como btGLUT4, cuando se expresan en el mismo sistema celular, experimentan una translocación estimulada por la insulina sólo 3 horas después de la transfección , lo que sugiere que la GLUT4 de pez experimenta una síntesis, un procesamiento o un tráfico más rápidos. Curiosamente, okGLUT4 mostró una respuesta temporal intermedia entre GLUT4 de rata y btGLUT4, pero más cercana a esta última, a pesar de mostrar una sensibilidad a la GGA similar a la de GLUT4 de mamífero.
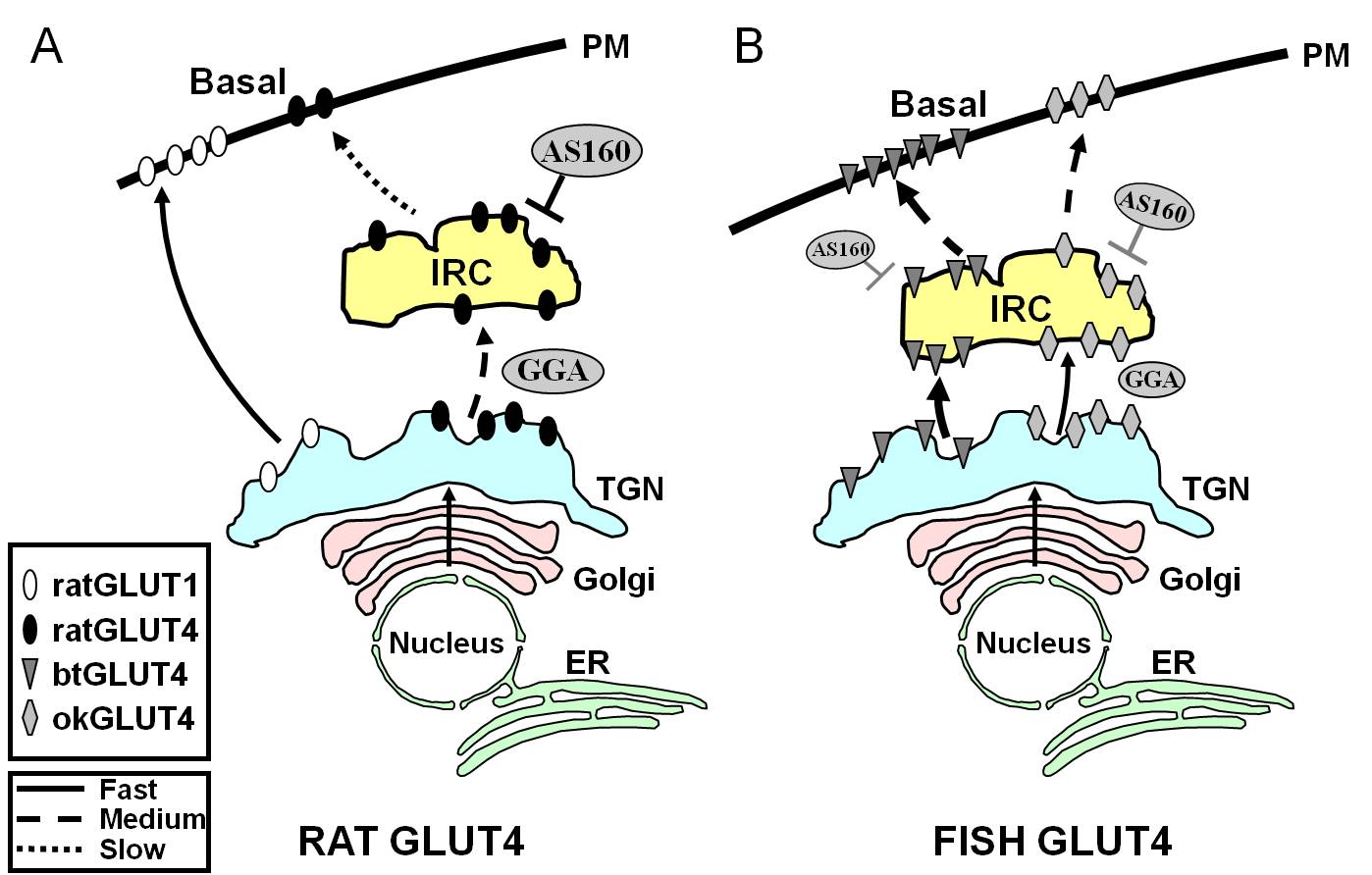
Figura 7.
Modelo esquemático que ilustra las diferencias en el tráfico entre GLUT4 de pez y GLUT4 y Glut1 de rata durante el estado basal en adipocitos. En (A), se muestra que el tráfico de GLUT4 de rata recién sintetizado tiene lugar a través del Golgi y de la red trans-Golgi (TGN) y hacia el compartimento que responde a la insulina (IRC) en un proceso de clasificación que depende de la proteína adaptadora GGA. En el estado basal, la GLUT4 de rata es secuestrada principalmente en el IRC, un proceso regulado por AS160 y que requiere el motivo amino terminal F5QQI8 de la GLUT4. En cambio, tras la biosíntesis, Glut1 viaja directamente desde el TGN a la membrana plasmática (PM) en un proceso independiente de GGA. En (B), se muestra el tráfico de GLUT4 de trucha recién sintetizada (btGLUT4) o de salmón (okGLUT4). Postulamos que los altos niveles de btGLUT4 en el PM parecen deberse a una mayor tasa exocítica, como resultado de que btGLUT4 sigue una ruta independiente de la GGA desde el TGN hasta el IRC y mostrando menos secuestro regulado por AS160 en el IRC que GLUT4 de rata. Nuestra hipótesis es que el diferente comportamiento de tráfico de btGLUT4 puede estar relacionado con la diferente secuencia en su motivo N-terminal (F5QHL8). El comportamiento de tráfico de okGLUT4 (F5QQL8) parece ser intermedio entre el de GLUT4 de rata y btGLUT4. ER: retículo endoplásmico.
Como se mencionó anteriormente en la sección 3, entre los diferentes motivos de aminoácidos reguladores que se encuentran en GLUT4 en los mamíferos, se ha demostrado que el motivo de orientación F5QQI8 en el N-terminal es importante para el secuestro de GLUT4 en el IRC y la translocación estimulada por la insulina al PM . Curiosamente, además del hecho de que ambos transportadores GLUT4 de peces tienen un dominio N-terminal más corto, el motivo F5QQI8 muestra una sustitución de aminoácidos conservada en okGLUT4 (F5QQL8), y está menos conservado en btGLUT4 (F5QHL8), donde la sustitución de doble residuo provoca importantes cambios de tamaño y carga (Figura 8A). Se investigó la posibilidad de que estas diferencias de secuencia pudieran explicar el aumento de los niveles basales de la superficie celular observados para btGLUT4 (Capilla y Planas, datos no publicados). La Figura 8B muestra que la mutación del motivo F5QHL8 de btGLUT4 a F5QQI8 causó una ligera disminución de los niveles basales de PM; sin embargo, la mutación del motivo F5QHL8 a F5QQL8 redujo significativamente los niveles de superficie celular de btGLUT4 a niveles comparables a los de okGLUT4 o el GLUT4 de mamíferos. Estos resultados indican que los motivos de aminoácidos específicos, así como el plegado de la molécula, parecen ser importantes para que los dominios intracelulares de la molécula GLUT4 interactúen con las diferentes proteínas reguladoras para un tráfico adecuado y una localización y/o retención en compartimentos específicos.
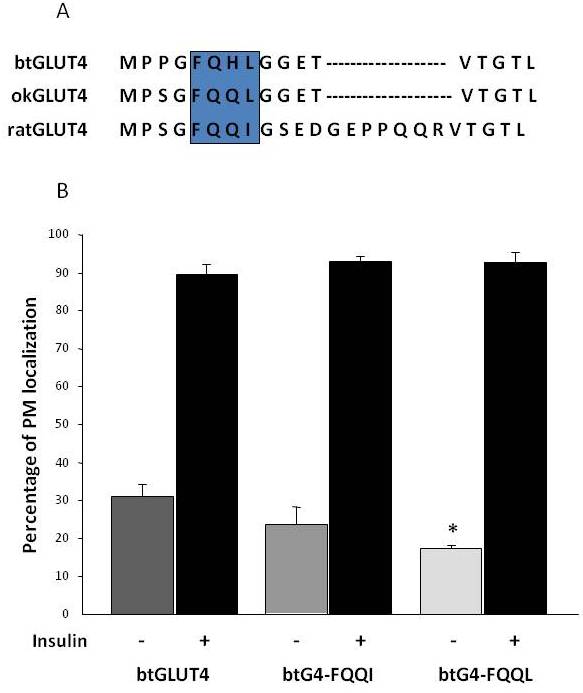
Figura 8.
Los elevados niveles basales de superficie celular de btGLUT4 se reducen al mutar el motivo F5QHL8. (A) Alineación de la secuencia de aminoácidos de la región N-terminal de las moléculas GLUT4 de rata, trucha marrón (btGLUT4, AF247395) y salmón coho (okGLUT4, AF502957). El recuadro encierra el importante motivo de tráfico F5QQI8 parcialmente conservado en las especies de peces. (B) Los adipocitos 3T3-L1 diferenciados que expresan btGLUT4 o cualquiera de los dos mutantes puntuales (btGLUT4-FQQI o btGLUT4-FQQL) se incubaron con o sin insulina (100 nM, 30 min). Los datos se presentan como porcentaje (media ± SEM) de células que muestran un borde completo de la membrana plasmática (PM) obtenido contando 100 células por condición en 3 experimentos independientes. El análisis estadístico se llevó a cabo mediante una prueba t no emparejada frente al tipo salvaje de btGLUT4 en condiciones basales o estimuladas por la insulina, respectivamente (* denota significación a p < 0,05).
Un estudio anterior en mamíferos utilizando quimeras entre GLUT4 y Glut1 demostró que la sustitución del N-terminal y del bucle intracelular de Glut1 por los de GLUT4 es suficiente para conferir a la proteína Glut1 quimérica las características de GLUT4 en adipocitos 3T3-L1 . Así pues, para identificar los dominios proteicos de GLUT4 de trucha que le confieren sus características particulares de tráfico (es decir, menor retención intracelular; mayores niveles de MP en condiciones basales), se crearon proteínas quiméricas que tienen el N-terminal (btN) o el bucle intracelular (btL) de btGLUT4 en un esqueleto de GLUT4 de rata y se denominaron btN-GLUT4 o btL-GLUT4, respectivamente. A continuación, estas construcciones se expresaron de forma estable en células 3T3-L1 y se analizó su capacidad de retención en el citosol en condiciones basales y de respuesta a la insulina (Simoes, Planas y Camps, resultados no publicados). Los resultados obtenidos indicaron que todas las construcciones eran capaces de translocarse al MP en respuesta a la insulina, pero con ciertas diferencias entre ellas (Figura 9). En primer lugar, la translocación estimulada por la insulina de btGLUT4 fue menor que la de GLUT4 de rata. En segundo lugar, btN-GLUT4 tuvo la respuesta más débil a la insulina, lo que sugiere un papel del N-terminal en la correcta orientación de GLUT4 al IRC o en la translocación de GLUT4 al PM. En tercer lugar, la sustitución del bucle citoplasmático en btL-GLUT4 provocó una reducción de la respuesta de GLUT4 de rata a la insulina comparable a la de btGLUT4. Estos resultados preliminares apoyan la idea de que el N-terminal y el bucle citoplasmático de GLUT4 son responsables de algunas de las diferencias de tráfico entre btGLUT4 y GLUT4 de rata.
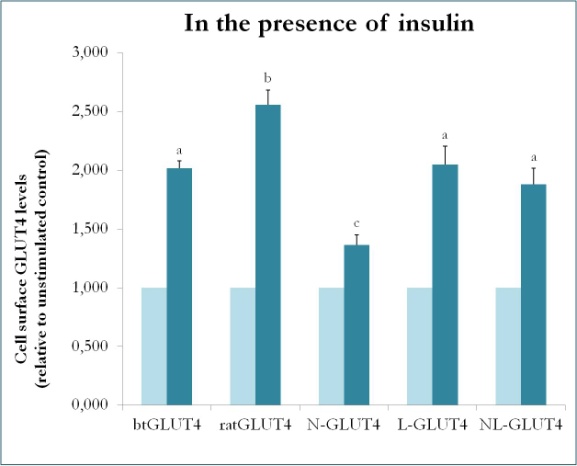
Figura 9.
Niveles en la superficie celular de varias construcciones de GLUT4 en presencia de insulina. N-GLUT4 y L-GLUT4 representan construcciones con el extremo amino (N) o el bucle intracelular (L) de btGLUT4 en un esqueleto de GLUT4 de rata, respectivamente. Los adipocitos 3T3-L1 diferenciados que expresaban los distintos constructos de GLUT4 se incubaron en ausencia o presencia de insulina (100nM) durante 30 minutos y la determinación de los niveles de GLUT4 de superficie se realizó como se describe en . La superficie de la célula GLUT4 se expresa en relación con el control no estimulado para cada línea celular. Letras diferentes indican diferencias estadísticamente significativas (p < 0,05).
Después de la estimulación de la insulina, el GLUT4 de mamíferos trafica y se fusiona con la MP, aumentando su presencia en la superficie celular hasta 10 veces; apoyando así el aumento de la captación de glucosa observado después de la alimentación. La insulina aumenta el número de transportadores en el PM no sólo aumentando la exocitosis sino también disminuyendo la tasa de endocitosis. La insulina ejerce sus efectos a través de dos vías de señalización intracelular diferentes . La primera es la conocida vía de la fosfatidilinositol-3-quinasa (PI3K)/proteína quinasa B (PKB), también conocida como Akt, que es necesaria para que se produzca la translocación de GLUT4 pero no suficiente . La segunda vía es la que incluye la proteína asociada a Cbl (CAP), que se une al receptor de insulina y activa una pequeña GTPasa de la familia Rho denominada TC10, y que fue descrita en los adipocitos . Sin embargo, la vía TC10 no parece estar implicada en las células musculares, en las que se demostró que otra entrada independiente de Akt contribuye a la remodelación del citoesqueleto necesaria para la completa translocación de GLUT4 . Aguas abajo de Akt, se ha descubierto que una proteína denominada sustrato de Akt de 160 KDa (AS160) o TCB1D4, es la clave para comunicar la cascada de fosforilación iniciada por la insulina con la maquinaria de tráfico de vesículas . AS160 tiene 6 residuos de treonina/serina que pueden ser fosforilados para inhibir su actividad, y contiene un dominio de proteína activadora de GTPasas (GAP) que en el estado basal inactiva una serie de proteínas Rab, pequeñas GTPasas de la superfamilia Ras responsables del tráfico de membranas . La fosforilación de AS160 por Akt inhibe su actividad GAP, permitiendo la activación de las proteínas Rab; provocando así la translocación de GLUT4 a la MP . Los miembros de Rab identificados como responsables del tráfico de GLUT4 en los mamíferos son Rab8a, Rab10 y Rab14. Además de regular el movimiento de las vesículas de GLUT4, se ha demostrado que AS160 es necesario para retener completamente GLUT4 en el IRC . Para demostrar que la fosforilación de AS160 es crítica para la translocación de GLUT4 en mamíferos, se creó una forma dominante-inhibitoria de AS160 mutando 4 de sus 6 sitios de fosforilación (AS160-4P) . Cuando se coexpresó en un sistema celular junto con GLUT4 de rata, se bloqueó la translocación de esta molécula a la MP, así como el aumento de la captación de glucosa observado tras la incubación con insulina . En cuanto a su sensibilidad al AS160-4P, se observaron claras diferencias entre okGLUT4 y btGLUT4, mostrando el primero propiedades similares a las del GLUT4 de mamífero, y no viéndose afectado el segundo . Estos resultados concuerdan con las diferencias observadas entre las dos proteínas GLUT4 de los peces en cuanto a su retención intracelular y apoyan la hipótesis de que AS160 puede secuestrar a okGLUT4, pero no a btGLUT4, en el IRC y que btGLUT4 puede estar más ampliamente distribuido dentro de la célula que los otros transportadores GLUT4. Además, dado que los resultados obtenidos para btGLUT4 hacia la sensibilidad al AS160 coincidían con los comunicados anteriormente para un mutante GLUT4-F5A , se sugirió que la tasa exocítica más rápida de btGLUT4 se debía a la falta de un motivo FQQI conservado .
En resumen, al investigar las características de tráfico de las dos proteínas GLUT4 de peces (btGLUT4 y okGLUT4) en comparación con GLUT4 y Glut1 de mamíferos, está claro que existen importantes diferencias entre estos transportadores (Figura 7). En este sentido, okGLUT4 se comporta en muchos aspectos de forma similar a GLUT4 de mamíferos debido a su sensibilidad hacia GGA y AS160; apoyando así un papel de estas moléculas en la regulación del tráfico de okGLUT4 sintetizado de novo desde el TGN hacia el IRC, y desde el TGN hacia el PM en respuesta a la insulina, respectivamente. Por el contrario, btGLUT4 parece estar menos regulado, traficando al IRC independientemente de GGA, así como siendo retenido en el IRC y saliendo al PM sólo en parte bajo el control de AS160; por lo tanto, moviéndose hacia la superficie celular posiblemente, en parte, a través de una vía constitutiva como la utilizada por Glut1.
Leave a Reply