Strukturelle und funktionelle Evolution des Glukosetransporters 4 (GLUT4): Ein Blick auf GLUT4 in Fischen
Regulierung des Verkehrs von GLUT4 in Fischen
Bei Säugetieren ist das Hauptmerkmal, das GLUT4 im Skelettmuskel und im Fettgewebe charakterisiert und einzigartig macht, seine Fähigkeit, als Reaktion auf Insulin in den PM zu verlagern. Dadurch wird die Fähigkeit der Zellen zur Aufnahme von Glukose während des postprandialen Zustands erheblich gesteigert, was für die Aufrechterhaltung der Glukosehomöostase entscheidend ist. Dennoch gibt es in Säugetierzellen eindeutige Hinweise darauf, dass GLUT4 im Grundzustand nicht statisch ist; stattdessen zirkuliert GLUT4 zwischen zahlreichen intrazellulären Kompartimenten, wie dem trans-Golgi-Netzwerk (TGN), frühen und späten Endosomen, einem spezialisierten insulinempfindlichen Kompartiment (IRC) sowie dem PM . Die Menge an GLUT4, die im Grundzustand am PM vorhanden ist, entspricht nur etwa 5-10 % des gesamten GLUT4-Proteins, während die restlichen 90-95 % intrazellulär im IRC-Kompartiment sequestriert sind.
Die intrazellulären Transporteigenschaften der beiden bei Salmoniden identifizierten Glukosetransporter (btGLUT4 und okGLUT4) wurden im Vergleich zu GLUT4 aus Säugetieren untersucht, vor allem wenn sie in heterologen Systemen (adipozytäre oder myoblastische Zelllinien von Säugetieren) exprimiert wurden, aber auch als endogenes GLUT4 in primär kultivierten Forellenmyozyten. In 3T3-L1-Adipozyten, die vorübergehend getrennt btGLUT4 oder okGLUT4 unter stationären Bedingungen exprimieren, wies btGLUT4 signifikant höhere Proteinkonzentrationen an der PM auf (30-40%), okGLUT4 ebenfalls, jedoch in geringerem Maße (15-20%), als GLUT4 der Ratte (10-15%). Dies wurde nicht nur in Adipozyten beobachtet, da btGLUT4 auch in der PM in höheren Konzentrationen (20-25%) vorhanden war als Ratten-GLUT4 (10-15%), wenn es in L6-Muskelzellen stabil exprimiert wurde. Wichtig ist, dass die basale Lokalisierung von endogenem GLUT4 an der PM in Forellenmyozyten in Kultur ebenfalls relativ hoch war. Daher scheint GLUT4 von Fischen unter basalen oder nicht stimulierten Bedingungen weniger effizient im Zytosol von Adipozyten und Myozyten gehalten zu werden als GLUT4 von Säugetieren, was auf Unterschiede in den Mechanismen hindeutet, die für die intrazelluläre Retention von GLUT4 zwischen Fischen und Säugetieren verantwortlich sind (siehe unten). Darüber hinaus wurde aufgrund der beobachteten Unterschiede in der PM-Lokalisierung zwischen Fisch-GLUT4 unter basalen Bedingungen, wobei okGLUT4 seinen Säugetier-Gegenstücken ähnlicher ist als btGLUT4, vermutet, dass das unterschiedliche Verkehrsverhalten dieser beiden Fisch-GLUT4-Proteinvarianten mit Unterschieden in charakteristischen regulatorischen Merkmalen in der GLUT4-Proteinsequenz zusammenhängen könnte (d. h. N- und C-terminales Protein).d. h. N- und C-terminale Proteinmotive) zusammenhängen könnten (siehe Abschnitt 3).
Darüber hinaus wurde auch die Fähigkeit von Fisch-GLUT4, auf Insulin zu reagieren, untersucht. Die ersten Studien, die nachzuweisen versuchten, dass ein Fisch-GLUT4 bei Insulinstimulation in die PM transloziert, wurden in Xenopusozyten durchgeführt. Dieses System war jedoch nicht geeignet, um die Translokation von GLUT4 zu untersuchen, und Oozyten, die okGLUT4 oder ein Ratten-GLUT4 exprimieren, zeigten keine Unterschiede in der Transporterlokalisierung innerhalb der Zelle als Reaktion auf Insulin. Stattdessen wurde das 3T3-L1-Adipozyten-Zellsystem erfolgreich verwendet, um zu zeigen, dass sowohl okGLUT4 als auch btGLUT4 in der Lage waren, nach einer Insulinbehandlung signifikant in die PM zu verlagern, wie es bei Säugetieren der Fall ist. Darüber hinaus wurde die insulinstimulierte Translokation von btGLUT4 in L6-Myoblasten und differenzierten Myotubes, die den GLUT4-Transporter der Fische stabil exprimieren, in die PM nachgewiesen. Somit wurde gezeigt, dass die Fisch-Homologe von GLUT4 wie ihr Säugetier-Gegenstück auf Insulin reagieren, trotz ihrer höheren PM-Lokalisierung im Steady-State.
Wie bereits erwähnt, ist GLUT4 in Säugetieren innerhalb der Zellen in zwei großen Speicherkompartimenten verteilt, dem IRC und dem endosomalen System. Interessanterweise zeigte btGLUT4 nur eine teilweise Ko-Lokalisierung mit GLUT4 der Ratte, wenn beide entweder in 3T3-L1-Adipozyten oder in L6-Muskelzellen koexprimiert wurden. Diese Beobachtung und die Tatsache, dass btGLUT4 unter basalen Bedingungen weniger in intrazellulären Kompartimenten zurückgehalten wurde, obwohl es in beiden Zelltypen auf Insulinstimulation reagierte, deutet darauf hin, dass btGLUT4 gleichmäßig zwischen dem spezialisierten IRC und dem endosomalen Kompartiment verteilt ist, von wo aus es kontinuierlich mit dem PM zirkuliert. Darüber hinaus wurde sowohl in 3T3-L1-Adipozyten als auch in L6-Muskelzellen gezeigt, dass die höheren PM-Konzentrationen, die für btGLUT4 beobachtet wurden, eher auf eine schnellere Externalisierungsrate als auf eine Verringerung der Endozytoserate zurückzuführen sind.
In Säugetieren wurden mehrere Proteine beschrieben, die mit GLUT4 interagieren, um seinen intrazellulären Verkehr zu regulieren und die im IRC sequestrierten Proteine zu erhalten. So wurde beispielsweise beschrieben, dass das im Golgi lokalisierte γ-Ohr-enthaltende Arf-bindende Protein (GGA) als Verkehrsregler für neu synthetisiertes GLUT4 vom TGN zum IRC fungiert. Bei diesem Schritt wurde Sortilin ebenfalls eine Schlüsselrolle zugeschrieben, da GLUT4 nicht das spezifische Targeting-Motiv enthält, um von GGA als Frachtmolekül erkannt zu werden. In jüngerer Zeit wurde gezeigt, dass die Insulin-regulierte Aminopeptidase (IRAP), die mit GLUT4 in intrazellulären Vesikeln kolokalisiert ist, eine Rolle bei der Sortierung von GLUT4 aus Endosomen in das IRC spielt. Darüber hinaus wurde berichtet, dass ein Protein namens TUG (tether containing a UBX domain for GLUT4) mit der großen intrazellulären GLUT4-Schleife zwischen TMVI und TMVII interagiert und GLUT4 durch seine Interaktion über seine UBX-Domäne mit Zellmembranen an intrazelluläre Vesikel bindet. Die mögliche Rolle mehrerer GLUT4-interagierender Proteine bei der Regulierung des Verkehrs der Fisch-GLUT4-Isoformen wurde in 3T3-L1-Adipozyten untersucht, die die entsprechenden Säugetierorthologe exprimieren. Insbesondere wurde berichtet, dass das Adaptorprotein GGA an den frühen Sortierschritten von GLUT4 aus dem TGN beteiligt ist. Die Expression von Ratten-GLUT4 zusammen mit Wildtyp-GGA oder einer dominant interferierenden Form von GGA (GGA-DN) in 3T3-L1-Adipozyten zeigte, dass GGA erforderlich ist, damit GLUT4 das IRC erreicht, da die insulinstimulierte Translokation von Ratten-GLUT4 in das PM in Gegenwart von GGA-DN vollständig abgeschwächt war. Interessanterweise zeigte der intrazelluläre Verkehr von btGLUT4 und okGLUT4 in 3T3-L1-Adipozyten Unterschiede in Bezug auf ihre Empfindlichkeit gegenüber GGA, da der Verkehr von btGLUT4 zum PM sowohl unter basalen als auch unter insulinstimulierten Bedingungen durch die Koexpression mit GGA-DN nur teilweise unterdrückt wurde, während okGLUT4 eine identische Reaktion wie die von Ratten-GLUT4 zeigte. Diese Ergebnisse deuten darauf hin, dass okGLUT4 in Adipozyten über denselben Weg wie GLUT4 von Säugetieren transportiert wird, dass aber btGLUT4 teilweise dem regulierten biosynthetischen Transportweg entgeht und über einen GGA-unabhängigen Weg zum PM gelangt. In Übereinstimmung mit der unterschiedlichen intrazellulären Verteilung von btGLUT4 und Ratten-GLUT4 könnte der Verkehr von btGLUT4 zum PM über den konstitutiven Weg erfolgen, der von Glut1 oder dem Transferrin-Rezeptor genutzt wird (Abbildung 7). Es ist bekannt, dass GLUT4 nach seiner Ankunft im IRC die Fähigkeit erwirbt, auf Insulin zu reagieren und sich in die PM zu verlagern. Wenn ein Plasmid, das für GLUT4 der Ratte kodiert, in 3T3-L1-Adipozyten transfiziert wird, benötigen die Zellen 6 bis 9 Stunden, um das neue Protein zu produzieren und es in den IRC zu bringen. Im Gegensatz dazu werden sowohl okGLUT4 als auch btGLUT4, wenn sie im gleichen Zellsystem exprimiert werden, nur 3 Stunden nach der Transfektion durch Insulin stimuliert, was darauf hindeutet, dass Fisch-GLUT4 schneller synthetisiert, verarbeitet oder transportiert wird. Interessanterweise zeigte okGLUT4 eine zeitliche Reaktion, die zwischen Ratten-GLUT4 und btGLUT4 lag, aber näher an letzterem, obwohl es eine ähnliche Empfindlichkeit gegenüber GGA wie das Säugetier-GLUT4 zeigte.
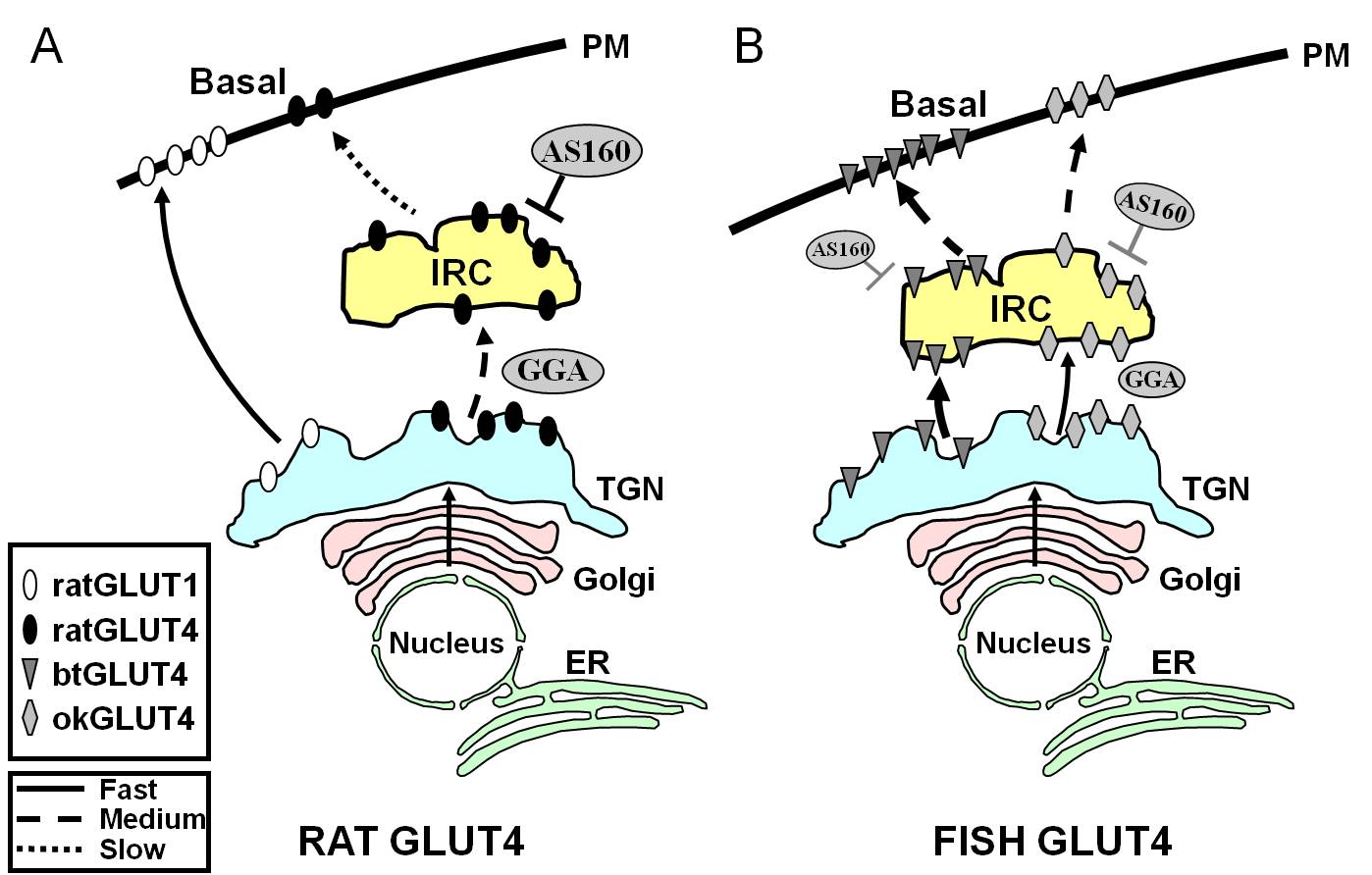
Abbildung 7.
Schematisches Modell, das die Unterschiede im Verkehr zwischen Fisch-GLUT4 und Ratten-GLUT4 und Glut1 während des Grundzustandes in Adipozyten veranschaulicht. In (A) wird gezeigt, dass der Verkehr von neu synthetisiertem Ratten-GLUT4 durch den Golgi und das trans-Golgi-Netzwerk (TGN) und in das auf Insulin reagierende Kompartiment (IRC) in einem Sortierprozess stattfindet, der von dem Adaptorprotein GGA abhängig ist. Im Grundzustand wird GLUT4 der Ratte hauptsächlich in das IRC sequestriert, ein Prozess, der durch AS160 reguliert wird und das F5QQI8 Aminoterminalmotiv von GLUT4 erfordert. Im Gegensatz dazu wandert Glut1 nach der Biosynthese direkt vom TGN zur Plasmamembran (PM) in einem GGA-unabhängigen Prozess. In (B) ist der Verkehr von neu synthetisiertem GLUT4 der Forelle (btGLUT4) oder des Lachses (okGLUT4) dargestellt. Wir vermuten, dass die hohen Konzentrationen von btGLUT4 am PM auf eine erhöhte Exozytierungsrate zurückzuführen sind, da btGLUT4 einen GGA-unabhängigen Weg vom TGN zum IRC nimmt und weniger AS160-regulierte Sequestrierung im IRC aufweist als GLUT4 der Ratte. Wir stellen die Hypothese auf, dass das unterschiedliche Transportverhalten von btGLUT4 mit der unterschiedlichen Sequenz in seinem N-terminalen Motiv (F5QHL8) zusammenhängen könnte. Das Verkehrsverhalten von okGLUT4 (F5QQL8) scheint zwischen dem von Ratten-GLUT4 und btGLUT4 zu liegen. ER: Endoplasmatisches Retikulum.
Wie bereits in Abschnitt 3 erwähnt, hat sich unter den verschiedenen regulatorischen Aminosäuremotiven, die in GLUT4 bei Säugetieren zu finden sind, das F5QQI8-Targeting-Motiv im N-Terminus als wichtig für die Sequestrierung von GLUT4 in das IRC und die Insulin-stimulierte Translokation in das PM erwiesen. Interessanterweise weist das F5QQI8-Motiv zusätzlich zu der Tatsache, dass beide Fisch-GLUT4-Transporter eine kürzere N-terminale Domäne haben, eine konservierte Aminosäuresubstitution in okGLUT4 (F5QQL8) auf, während es in btGLUT4 (F5QHL8) weniger konserviert ist, wo die Substitution von zwei Resten wichtige Größen- und Ladungsveränderungen verursacht (Abbildung 8A). Es wurde die Möglichkeit untersucht, dass diese Sequenzunterschiede für die für btGLUT4 beobachteten erhöhten Basalwerte an der Zelloberfläche verantwortlich sind (Capilla und Planas, unveröffentlichte Daten). Abbildung 8B zeigt, dass die Mutation des btGLUT4-Motivs F5QHL8 zu F5QQI8 einen leichten Rückgang der basalen PM-Konzentrationen verursachte; die Mutation des F5QHL8-Motivs zu F5QQL8 reduzierte jedoch die Zelloberflächenkonzentrationen von btGLUT4 signifikant auf Werte, die mit denen von okGLUT4 oder GLUT4 von Säugetieren vergleichbar sind. Diese Ergebnisse deuten darauf hin, dass spezifische Aminosäuremotive sowie die Faltung des Moleküls für die intrazellulären Domänen des GLUT4-Moleküls wichtig zu sein scheinen, um mit den verschiedenen regulatorischen Proteinen für den ordnungsgemäßen Verkehr und die spezifische Kompartimentlokalisierung und/oder -retention zu interagieren.
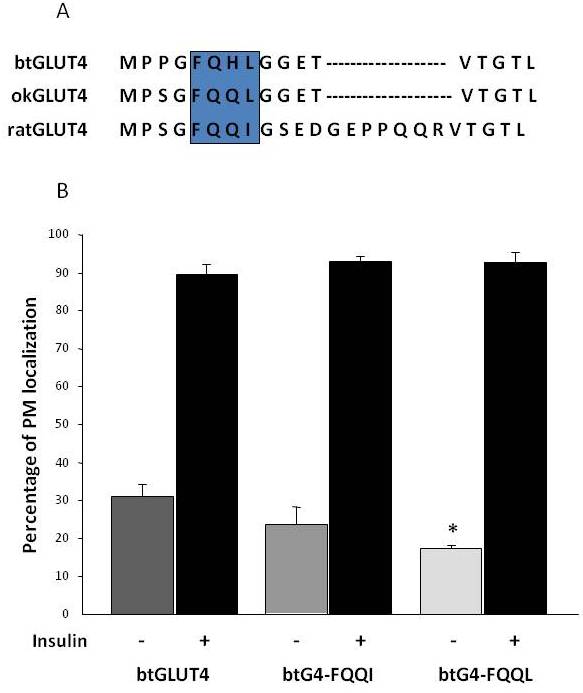
Abbildung 8.
Die erhöhten basalen Zelloberflächenspiegel von btGLUT4 werden durch Mutation des F5QHL8-Motivs reduziert. (A) Aminosäuresequenz-Alignment der N-terminalen Region von GLUT4-Molekülen der Ratte, der Bachforelle (btGLUT4, AF247395) und des Coho-Lachses (okGLUT4, AF502957). Der Kasten umschließt das wichtige Trafficking-Motiv F5QQI8, das bei den Fischarten teilweise konserviert ist. (B) Differenzierte 3T3-L1-Adipozyten, die entweder btGLUT4 oder eine der beiden Punktmutanten (btGLUT4-FQQI oder btGLUT4-FQQL) exprimieren, wurden mit oder ohne Insulin (100 nM, 30 min) inkubiert. Die Daten werden als Prozentsatz (Mittelwert ± SEM) der Zellen dargestellt, die einen vollständigen Plasmamembran-Rand (PM) aufweisen, der durch Zählen von 100 Zellen pro Bedingung in drei unabhängigen Experimenten ermittelt wurde. Die statistische Analyse wurde mittels eines ungepaarten t-Tests gegen den Wildtyp btGLUT4 unter basalen bzw. insulinstimulierten Bedingungen durchgeführt (* bedeutet Signifikanz bei p < 0,05).
Eine frühere Studie an Säugetieren, in der Chimären zwischen GLUT4 und Glut1 verwendet wurden, hat gezeigt, dass der Austausch des N-Terminus und der intrazellulären Schleife von Glut1 gegen die von GLUT4 ausreicht, um dem chimären Glut1-Protein die Eigenschaften von GLUT4 in 3T3-L1-Adipozyten zu verleihen. Um die Proteindomänen in Forellen-GLUT4 zu identifizieren, die seine besonderen Verkehrseigenschaften (d. h. geringere intrazelluläre Retention; höhere PM-Werte unter Basalbedingungen) verleihen, wurden chimäre Proteine mit dem N-Terminus (btN) oder der intrazellulären Schleife (btL) von btGLUT4 in einem Ratten-GLUT4-Rückgrat geschaffen und als btN-GLUT4 bzw. btL-GLUT4 bezeichnet. Diese Konstrukte wurden dann stabil in 3T3-L1-Zellen exprimiert und ihre Fähigkeit, unter Basalbedingungen im Zytosol zu verbleiben und auf Insulin zu reagieren, wurde analysiert (Simoes, Planas und Camps, unveröffentlichte Ergebnisse). Die Ergebnisse zeigten, dass alle Konstrukte in der Lage waren, als Reaktion auf Insulin in die PM zu verlagern, allerdings mit gewissen Unterschieden zwischen ihnen (Abbildung 9). Erstens war die insulinstimulierte Translokation von btGLUT4 geringer als die von GLUT4 der Ratte. Zweitens reagierte btN-GLUT4 am schwächsten auf Insulin, was auf eine Rolle des N-Terminus bei der korrekten Ausrichtung von GLUT4 auf das IRC oder bei der Translokation von GLUT4 in das PM hindeutet. Drittens führte die Substitution der zytoplasmatischen Schleife in btL-GLUT4 zu einer Verringerung der Reaktion von GLUT4 der Ratte auf Insulin, die mit der von btGLUT4 vergleichbar war. Diese vorläufigen Ergebnisse unterstützen die Idee, dass der N-Terminus und die zytoplasmatische Schleife von GLUT4 für einige der Unterschiede im Transport zwischen btGLUT4 und Ratten-GLUT4 verantwortlich sind.
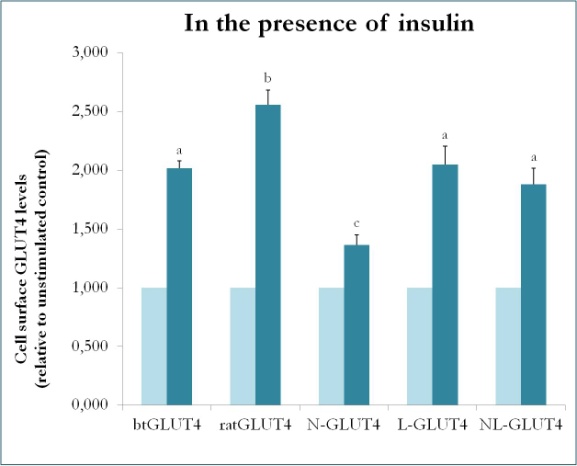
Abbildung 9.
Zelloberflächenwerte verschiedener GLUT4-Konstrukte in Gegenwart von Insulin. N-GLUT4 und L-GLUT4 stellen Konstrukte mit dem Aminoterminus (N) bzw. der intrazellulären Schleife (L) von btGLUT4 in einem Ratten-GLUT4-Grundgerüst dar. Differenzierte 3T3-L1-Adipozyten, die die verschiedenen GLUT4-Konstrukte exprimieren, wurden 30 Minuten lang in Abwesenheit oder Anwesenheit von Insulin (100nM) inkubiert, und die Bestimmung der Oberflächen-GLUT4-Konzentrationen wurde wie in beschrieben durchgeführt. Der GLUT4-Gehalt an der Zelloberfläche wird für jede Zelllinie im Verhältnis zur unstimulierten Kontrolle angegeben. Unterschiedliche Buchstaben weisen auf statistisch signifikante Unterschiede hin (p < 0,05).
Nach Insulinstimulation wandert GLUT4 von Säugetieren und fusioniert mit dem PM, wodurch seine Präsenz an der Zelloberfläche um das bis zu 10-fache erhöht wird; dies unterstützt die nach der Fütterung beobachtete Zunahme der Glukoseaufnahme. Insulin erhöht die Anzahl der Transporter an der PM nicht nur durch die Verstärkung der Exozytose, sondern auch durch die Verringerung der Endozytosegeschwindigkeit. Insulin übt seine Wirkung über zwei verschiedene intrazelluläre Signalwege aus. Der erste ist der bekannte Weg der Phosphatidylinositol-3-Kinase (PI3K)/Proteinkinase B (PKB), auch bekannt als Akt, der für die Translokation von GLUT4 notwendig, aber nicht ausreichend ist. Der zweite Weg ist der des Cbl-assoziierten Proteins (CAP), das an den Insulinrezeptor bindet und eine kleine GTPase aus der Rho-Familie namens TC10 aktiviert, die in Adipozyten beschrieben wurde. Der TC10-Weg scheint jedoch nicht in Muskelzellen involviert zu sein, in denen ein anderer Akt-unabhängiger Input zum Umbau des Zytoskeletts beiträgt, der für die vollständige Translokation von GLUT4 erforderlich ist. Stromabwärts von Akt wurde ein Protein mit der Bezeichnung Akt-Substrat von 160 KDa (AS160) oder TCB1D4 als Schlüssel zur Kommunikation der durch Insulin ausgelösten Phosphorylierungskaskade mit der Vesikeltransportmaschinerie entdeckt. AS160 hat 6 Threonin/Serin-Reste, die phosphoryliert werden können, um seine Aktivität zu hemmen, und enthält eine GTPase-aktivierende Proteindomäne (GAP), die im Grundzustand eine Reihe von Rab-Proteinen inaktiviert, kleine GTPasen der Ras-Superfamilie, die für den Membranverkehr verantwortlich sind. Die Phosphorylierung von AS160 durch Akt hemmt seine GAP-Aktivität und ermöglicht so die Aktivierung der Rab-Proteine, was wiederum die Translokation von GLUT4 in die PM bewirkt. Die Rab-Proteine, die bei Säugetieren für den GLUT4-Transport verantwortlich sind, sind Rab8a, Rab10 und Rab14. AS160 reguliert nicht nur die Bewegung von GLUT4-Vesikeln, sondern ist nachweislich auch für den vollständigen Verbleib von GLUT4 im IRC erforderlich. Um zu zeigen, dass die Phosphorylierung von AS160 für die Translokation von GLUT4 in Säugetieren entscheidend ist, wurde durch Mutation von 4 der 6 Phosphorylierungsstellen (AS160-4P) eine dominant-hemmende Form von AS160 erzeugt. Wenn sie in einem zellulären System zusammen mit GLUT4 der Ratte exprimiert wurde, wurde die Translokation dieses Moleküls in die PM blockiert, ebenso wie der Anstieg der Glukoseaufnahme, der nach der Inkubation mit Insulin beobachtet wurde. Hinsichtlich ihrer Empfindlichkeit gegenüber AS160-4P wurden deutliche Unterschiede zwischen okGLUT4 und btGLUT4 festgestellt, wobei das erstere ähnliche Eigenschaften wie das GLUT4 von Säugetieren aufwies und das letztere unbeeinflusst blieb. Diese Ergebnisse stimmen mit den Unterschieden überein, die zwischen den beiden Fisch-GLUT4-Proteinen hinsichtlich ihrer intrazellulären Retention beobachtet wurden, und stützen die Hypothese, dass AS160 okGLUT4, aber nicht btGLUT4, im IRC sequestrieren kann und dass btGLUT4 innerhalb der Zelle weiter verteilt sein könnte als die anderen GLUT4-Transporter. Da die für btGLUT4 erzielten Ergebnisse in Bezug auf die AS160-Empfindlichkeit mit denen übereinstimmten, die zuvor für eine GLUT4-F5A-Mutante berichtet wurden, wurde außerdem angenommen, dass die schnellere Exozytierungsrate von btGLUT4 auf das Fehlen eines konservierten FQQI-Motivs zurückzuführen ist.
Zusammenfassend lässt sich sagen, dass die Untersuchung der Trafficking-Eigenschaften der beiden Fisch-GLUT4-Proteine (btGLUT4 und okGLUT4) im Vergleich zu GLUT4 und Glut1 aus Säugetieren zeigt, dass es wichtige Unterschiede zwischen diesen Transportern gibt (Abbildung 7). In dieser Hinsicht verhält sich okGLUT4 aufgrund seiner Empfindlichkeit gegenüber GGA und AS160 in vielen Aspekten ähnlich wie GLUT4 von Säugetieren; dies spricht für eine Rolle dieser Moleküle bei der Regulierung des Verkehrs von okGLUT4, das de novo aus dem TGN in das IRC bzw. als Reaktion auf Insulin aus dem TGN in die PM synthetisiert wird. Im Gegensatz dazu scheint btGLUT4 weniger reguliert zu sein, da es unabhängig von GGA in den IRC transportiert wird, im IRC verbleibt und nur teilweise unter der Kontrolle von AS160 in die PM austritt; daher bewegt es sich möglicherweise teilweise über einen konstitutiven Weg zur Zelloberfläche, wie er von Glut1 genutzt wird.
Leave a Reply