Evoluzione strutturale e funzionale del trasportatore di glucosio 4 (GLUT4): A Look at GLUT4 in Fish
Regolazione del traffico di GLUT4 nei pesci
Nei mammiferi, la caratteristica principale che caratterizza GLUT4 nel muscolo scheletrico e nel tessuto adiposo e lo rende unico è la sua capacità di traslocare al PM in risposta all’insulina . Questo aumenta notevolmente la capacità delle cellule di assorbire il glucosio durante lo stato postprandiale, che è fondamentale per mantenere correttamente l’omeostasi del glucosio. Ciononostante, l’evidenza nelle cellule dei mammiferi indica chiaramente che nello stato basale GLUT4 non è statico; invece, GLUT4 circola tra numerosi compartimenti intracellulari, come la rete trans-Golgi (TGN), endosomi precoci e tardivi, un compartimento specializzato insulino-responsivo (IRC), così come il PM. La quantità di GLUT4 presente nel PM allo stato basale corrisponde a circa solo il 5-10% della proteina GLUT4 totale, mentre il restante 90-95% è sequestrato intracellularmente nel compartimento IRC.
Le caratteristiche di traffico intracellulare dei due trasportatori di glucosio identificati nei salmonidi (btGLUT4 e okGLUT4) sono state studiate in confronto con il GLUT4 dei mammiferi principalmente quando espresso in sistemi eterologhi (linee cellulari adipocitiche o mioblastiche dei mammiferi), ma anche come il GLUT4 endogeno in miociti di trota in coltura primaria. Negli adipociti 3T3-L1 che esprimono transitoriamente separatamente btGLUT4 o okGLUT4 in condizioni stazionarie, btGLUT4 ha esibito livelli proteici significativamente più elevati al PM (30-40%), anche okGLUT4 ma in misura minore (15-20%), rispetto a GLUT4 di ratto (10-15%). Questo non è stato osservato solo negli adipociti, dal momento che btGLUT4 era presente anche al PM a livelli più elevati (20-25%) rispetto al GLUT4 di ratto (10-15%) quando stably-espresso in cellule muscolari L6. È importante notare che la localizzazione basale di GLUT4 endogena al PM nei miociti di trota in cultura era anche relativamente alta. Pertanto, in condizioni basali o non stimolati pesce GLUT4 sembra essere meno efficacemente trattenuto nel citosol in adipociti e miociti di mammiferi GLUT4, suggerendo differenze nei meccanismi responsabili della ritenzione intracellulare di GLUT4 tra pesci e mammiferi (vedi sotto). Inoltre, sulla base delle differenze osservate nella localizzazione PM tra GLUT4s pesce in condizioni basali, con okGLUT4 essere più simile alle sue controparti mammiferi rispetto btGLUT4, è stato suggerito che il comportamento diverso traffico di questi due pesce GLUT4 varianti proteiche può essere correlato a differenze nelle caratteristiche di regolamentazione nella sequenza della proteina GLUT4 (cioè N-e C-terminale).cioè i motivi proteici N e C-terminali) (vedi sezione 3; ).
Inoltre, è stata valutata anche la capacità delle GLUT4 di pesce di rispondere all’insulina. I primi studi che hanno cercato di dimostrare che una GLUT4 di pesce trasloca al PM su stimolazione di insulina sono stati eseguiti in Xenopusoociti. Tuttavia, il sistema non era appropriato per studiare la traslocazione di GLUT4 e gli ovociti che esprimono okGLUT4 o un GLUT4 di ratto non hanno mostrato differenze nella localizzazione del trasportatore all’interno della cellula in risposta all’insulina. Invece, il sistema cellulare di adipociti 3T3-L1 è stato utilizzato con successo per dimostrare che sia okGLUT4 che btGLUT4 erano in grado di traslocare significativamente nel PM dopo il trattamento con insulina, come avviene nei mammiferi. Inoltre, la traslocazione stimolata dall’insulina al PM di btGLUT4 è stata dimostrata nei mioblasti L6 e nei miotubi differenziati che esprimono stabilmente il trasportatore GLUT4 dei pesci. Pertanto, gli omologhi di pesce di GLUT4 hanno dimostrato di essere insulino-reattiva come la loro controparte nei mammiferi, nonostante la loro localizzazione PM superiore allo stato stazionario.
Come accennato in precedenza, GLUT4 nei mammiferi è distribuito all’interno delle cellule in due compartimenti di stoccaggio principali, il IRC e il sistema endosomiale. È interessante notare che btGLUT4 ha mostrato solo parziale co-localizzazione con GLUT4 ratto quando entrambi sono stati co-espressi sia in 3T3-L1 adipociti o in cellule muscolari L6. Questa osservazione, insieme al fatto che btGLUT4 ha mostrato livelli più bassi di ritenzione nei compartimenti intracellulari durante le condizioni basali, anche se ha ancora risposto alla stimolazione dell’insulina in entrambi i tipi di cellule, ha suggerito che btGLUT4 è equamente distribuito tra il IRC specializzato e il compartimento endosomiale, da cui circola continuamente con il PM. Inoltre, sia negli adipociti 3T3-L1 che nelle cellule muscolari L6, i livelli PM più alti osservati per btGLUT4 hanno dimostrato di essere dovuti a un tasso di esternalizzazione più veloce piuttosto che a una diminuzione del tasso di endocitosi. Nei mammiferi, sono state descritte diverse proteine che interagiscono con GLUT4 per regolare il suo traffico intracellulare e per mantenere le proteine sequestrate nell’IRC. Per esempio, la proteina legante Arf contenente γ-ear localizzata nel Golgi (GGA) è stata descritta per funzionare come un controllore del traffico di GLUT4 appena sintetizzato dal TGN all’IRC. In questo passaggio, sortilina è stato descritto anche per avere un ruolo chiave, come GLUT4 non contiene il motivo di targeting specifico per essere riconosciuto da GGA come molecola di carico. Più recentemente, l’aminopeptidasi regolata dall’insulina (IRAP), che co-localizza con GLUT4 nelle vescicole intracellulari, ha dimostrato di svolgere un ruolo nello smistamento di GLUT4 dagli endosomi nell’IRC. Inoltre, una proteina chiamata TUG (tether contenente un dominio UBX per GLUT4), è stata segnalata per interagire con il grande loop intracellulare GLUT4 presente tra TMVI e TMVII e per legare GLUT4 alle vescicole intracellulari attraverso la sua interazione, attraverso il suo dominio UBX, con le membrane cellulari. I possibili ruoli di diverse proteine GLUT4-interacting nella regolazione del traffico delle isoforme GLUT4 dei pesci sono stati esplorati in adipociti 3T3-L1 che esprimono i corrispondenti ortologhi dei mammiferi. In particolare, la proteina adattatrice GGA è stata riportata per essere coinvolta nelle prime fasi di smistamento di GLUT4 dal TGN. L’espressione in adipociti 3T3-L1 di GLUT4 di ratto insieme a GGA wild-type o una forma dominante-interferente di GGA (GGA-DN) ha dimostrato che GGA è necessaria per GLUT4 per raggiungere l’IRC perché la traslocazione stimolata dall’insulina di GLUT4 di ratto al PM è stata completamente smussata in presenza di GGA-DN. È interessante notare che il traffico intracellulare di btGLUT4 e okGLUT4 negli adipociti 3T3-L1 ha mostrato differenze per quanto riguarda la loro sensibilità a GGA perché il traffico di btGLUT4 al PM sia in condizioni basali o insulino-stimolato è stato solo parzialmente soppresso dalla coespressione con GGA-DN mentre okGLUT4 ha mostrato una risposta identica a quella di GLUT4 di ratto. Questi risultati hanno suggerito che okGLUT4 può traffico negli adipociti attraverso lo stesso percorso come GLUT4 dei mammiferi, ma che btGLUT4 può essere in parte sfuggendo il percorso regolamentato traffico biosintetico, spostando al PM seguendo un percorso GGA-indipendente. In accordo con la diversa distribuzione intracellulare osservata tra btGLUT4 e ratto GLUT4, il traffico di btGLUT4 al PM può avvenire attraverso il percorso costitutivo utilizzato da Glut1 o il recettore della transferrina (Figura 7). È noto che GLUT4, all’arrivo nell’IRC, acquisisce la capacità di rispondere all’insulina e di traslocare nel PM. Quando un plasmide che codifica GLUT4 di ratto viene trasfettato negli adipociti 3T3-L1, le cellule richiedono da 6 a 9 ore per produrre la nuova proteina e per indirizzarla all’IRC. Al contrario, sia okGLUT4 che btGLUT4, quando espressi nello stesso sistema cellulare, subiscono una traslocazione stimolata dall’insulina solo 3 ore dopo la trasfezione, suggerendo che il pesce GLUT4 subisce una sintesi, un’elaborazione o un traffico più veloce. È interessante notare che okGLUT4 ha mostrato una risposta temporale che era intermedio tra ratto GLUT4 e btGLUT4, ma più vicino a quest’ultimo, pur mostrando una sensibilità simile verso GGA come il mammifero GLUT4.
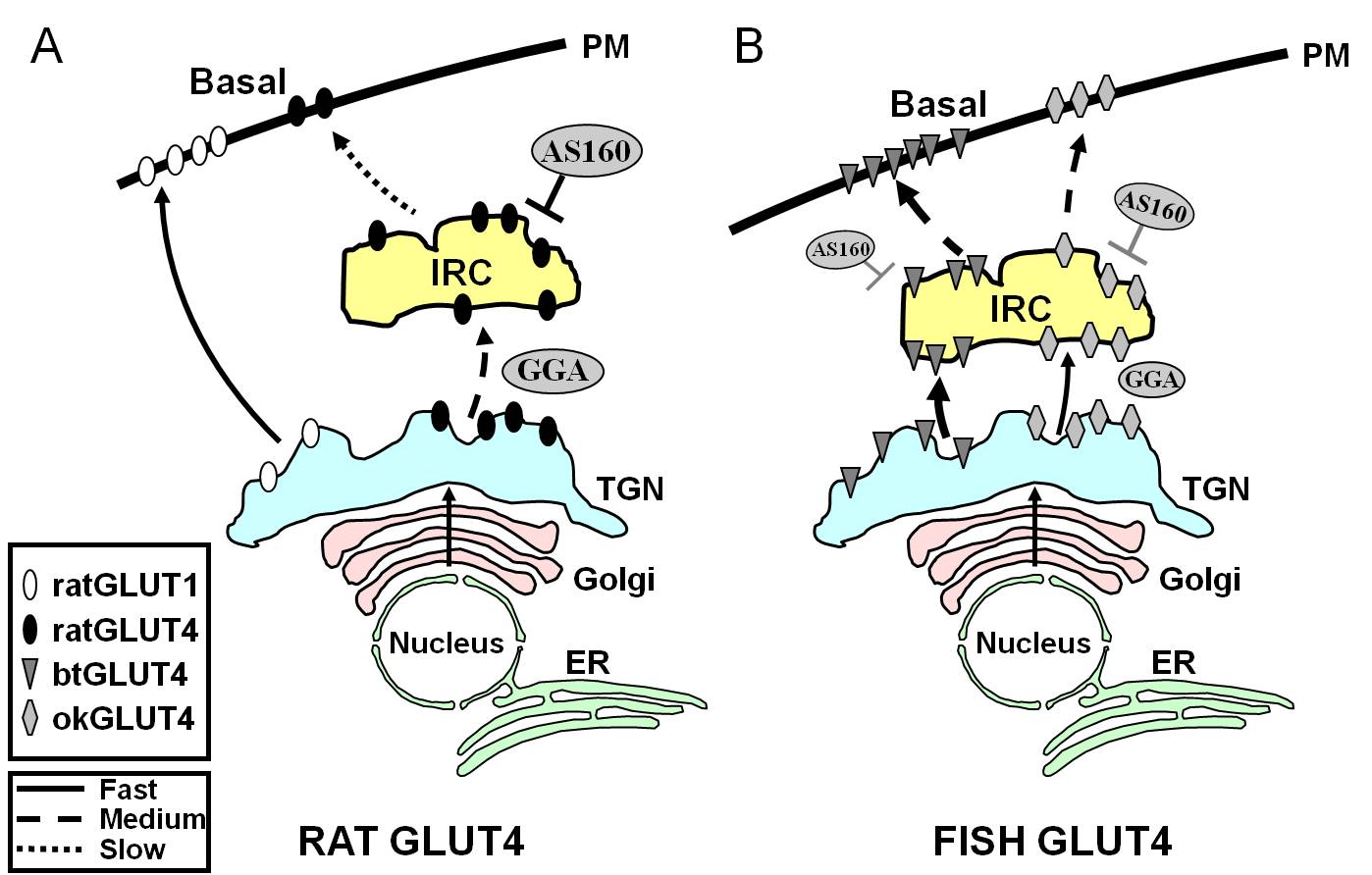
Figura 7.
Modello schematico che illustra le differenze nel traffico tra pesce GLUT4s e ratto GLUT4 e Glut1 durante lo stato basale in adipociti. In (A), il traffico di GLUT4 di ratto appena sintetizzato è mostrato avvenire attraverso il Golgi e la rete trans-Golgi (TGN) e nel compartimento insulino-responsivo (IRC) in un processo di ordinamento che dipende dalla proteina adattatrice GGA. Nello stato basale, GLUT4 del ratto è principalmente sequestrato nel IRC, un processo che è regolato da AS160 e che richiede il motivo amino terminale F5QQI8 di GLUT4. Al contrario, dopo la biosintesi, Glut1 viaggia direttamente dal TGN alla membrana plasmatica (PM) in un processo indipendente da GGA. In (B), il traffico di trota appena sintetizzata (btGLUT4) o salmone (okGLUT4) GLUT4 è mostrato. Noi postuliamo che gli alti livelli di btGLUT4 al PM sembrano essere dovuti ad un aumentato tasso esocitico, come risultato di btGLUT4 seguendo un percorso GGA-indipendente dal TGN al IRC e mostrando meno AS160-regolato sequestro al IRC di ratto GLUT4. Noi ipotizziamo che il diverso comportamento di traffico di btGLUT4 possa essere legato alla diversa sequenza nel suo motivo N-terminale (F5QHL8). Il comportamento di traffico di okGLUT4 (F5QQL8) sembra essere intermedio tra quello di GLUT4 di ratto e btGLUT4. ER: reticolo endoplasmatico.
Come precedentemente menzionato nella sezione 3, tra i diversi motivi aminoacidici regolatori trovati in GLUT4 nei mammiferi, il motivo di targeting F5QQI8 nel N-terminale ha dimostrato di essere importante per il sequestro di GLUT4 nell’IRC e la traslocazione stimolata dall’insulina nel PM . È interessante notare che, oltre al fatto che entrambi i trasportatori GLUT4 pesce hanno un dominio N-terminale più breve, il motivo F5QQI8 mostra una sostituzione conservata aminoacido in okGLUT4 (F5QQL8), ed è meno conservato in btGLUT4 (F5QHL8), dove la sostituzione doppio residuo provoca cambiamenti importanti dimensioni e carica (Figura 8A). La possibilità che queste differenze di sequenza fossero in grado di spiegare l’aumento dei livelli basali della superficie cellulare osservati per btGLUT4 è stata studiata (Capilla e Planas, dati non pubblicati). Figura 8B mostra che la mutazione del motivo btGLUT4 F5QHL8 a F5QQI8 causato una leggera diminuzione dei livelli basali PM, tuttavia, la mutazione del motivo F5QHL8 a F5QQL8 ridotto significativamente i livelli di superficie cellulare di btGLUT4 a livelli comparabili a quelli di okGLUT4 o il GLUT4 mammifero. Questi risultati indicano che specifici motivi aminoacidici così come il ripiegamento della molecola sembrano essere importanti per i domini intracellulari della molecola GLUT4 per interagire con le diverse proteine di regolazione per il traffico adeguato e la localizzazione e/o la ritenzione del compartimento specifico.
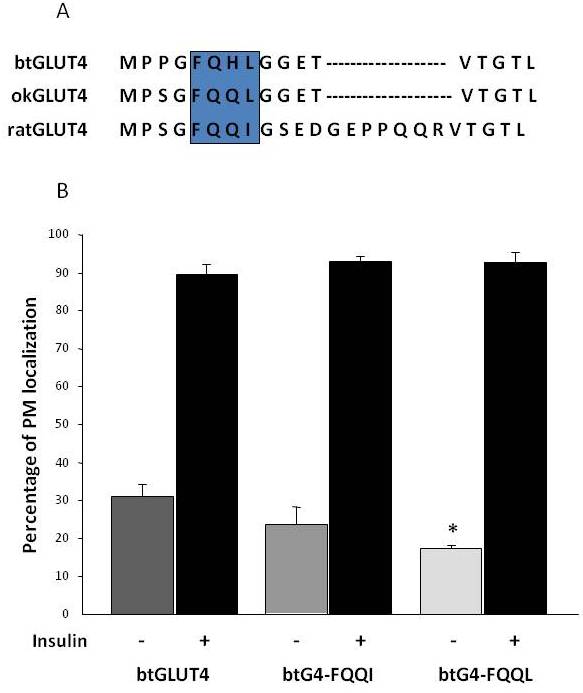
Figura 8.
I livelli di superficie cellulare basali elevati di btGLUT4 sono ridotti mutando il motivo F5QHL8. (A) Allineamento di sequenza degli amminoacidi della regione N-terminale delle molecole GLUT4 di ratto, trota marrone (btGLUT4, AF247395) e salmone coho (okGLUT4, AF502957). La casella racchiude l’importante motivo di traffico F5QQI8 parzialmente conservato nelle specie di pesci. (B) Differenziati 3T3-L1 adipociti che esprimono sia btGLUT4 o uno dei due mutanti punto (btGLUT4-FQQI o btGLUT4-FQQL) sono stati incubati con o senza insulina (100 nM, 30 min). I dati sono presentati come percentuale (media ± SEM) di cellule che mostrano una membrana plasmatica completa (PM) bordo ottenuto contando 100 cellule per condizione in 3 esperimenti indipendenti. L’analisi statistica è stata eseguita da unpaired t-test contro il wild type btGLUT4 in condizioni basali o insulino-stimolato rispettivamente (* denota la significatività a p < 0,05).
Uno studio precedente nei mammiferi utilizzando chimere tra GLUT4 e Glut1 ha dimostrato che la sostituzione del N-terminale e del loop intracellulare di Glut1 con quelli di GLUT4 è sufficiente a conferire alla proteina chimerica Glut1 le caratteristiche di GLUT4 negli adipociti 3T3-L1. Così, al fine di identificare i domini proteici in trota GLUT4 che conferiscono le sue particolari caratteristiche di traffico (cioè minore ritenzione intracellulare; più alti livelli PM in condizioni basali), proteine chimeriche sono stati creati che hanno il N-terminale (btN) o il ciclo intracellulare (btL) di btGLUT4 in un backbone GLUT4 ratto e sono stati chiamati btN-GLUT4 o btL-GLUT4, rispettivamente. Questi costrutti sono stati poi espressi stabilmente in cellule 3T3-L1 e la loro capacità di essere trattenuti nel citosol in condizioni basali e di rispondere all’insulina sono stati analizzati (Simoes, Planas e Camps, risultati non pubblicati). I risultati ottenuti hanno indicato che tutti i costrutti erano in grado di traslocare nel PM in risposta all’insulina, ma con alcune differenze tra loro (Figura 9). In primo luogo, l’insulina-stimolato traslocazione di btGLUT4 era inferiore a quello di GLUT4 ratto. In secondo luogo, btN-GLUT4 aveva la risposta più debole all’insulina, suggerendo un ruolo per il N-terminale nel corretto targeting di GLUT4 al IRC o nella traslocazione di GLUT4 al PM. In terzo luogo, la sostituzione del ciclo citoplasmatico in btL-GLUT4 ha causato una riduzione della risposta di GLUT4 del ratto all’insulina paragonabile a quella di btGLUT4. Questi risultati preliminari supportano l’idea che l’N-terminale e il ciclo citoplasmatico di GLUT4 siano responsabili di alcune delle differenze di traffico tra btGLUT4 e GLUT4 di ratto.
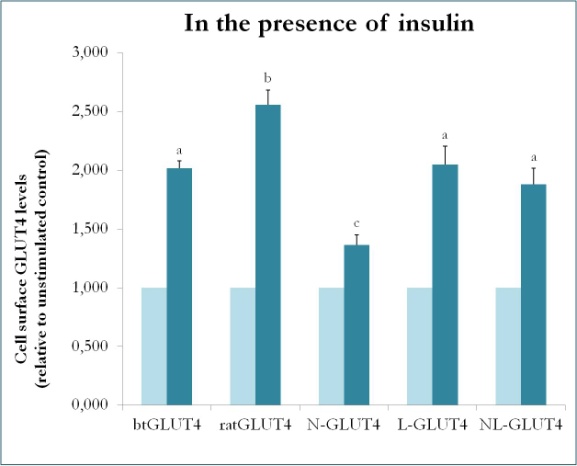
Figura 9.
Livelli di superficie cellulare di vari costrutti GLUT4 in presenza di insulina. N-GLUT4 e L-GLUT4 rappresentano costrutti con la terminazione amminica (N) o il loop intracellulare (L) di btGLUT4 in un backbone GLUT4 di ratto, rispettivamente. Differenziati 3T3-L1 adipociti che esprimono i vari costrutti GLUT4 sono stati incubati in assenza o in presenza di insulina (100nM) per 30 min e la determinazione dei livelli di superficie GLUT4 è stata eseguita come descritto in . La superficie cellulare GLUT4 è espressa rispetto al controllo non stimolato per ogni linea cellulare. Lettere diverse indicano differenze statisticamente significative (p < 0.05).
Dopo la stimolazione dell’insulina, GLUT4 dei mammiferi traffica e si fonde con il PM, aumentando la sua presenza nella superficie cellulare fino a 10 volte; quindi, sostenere l’aumento dell’assorbimento del glucosio osservato dopo l’alimentazione. L’insulina aumenta il numero di trasportatori nel PM non solo aumentando l’esocitosi ma anche diminuendo il tasso di endocitosi. L’insulina esercita i suoi effetti attraverso due diverse vie di segnalazione intracellulare. La prima è la ben nota via della fosfatidilinositolo-3-chinasi (PI3K)/proteina chinasi B (PKB), nota anche come Akt, che è necessaria per la traslocazione di GLUT4 ma non sufficiente. La seconda via è quella che include la proteina associata Cbl (CAP), che lega il recettore dell’insulina e attiva una piccola GTPasi della famiglia Rho chiamata TC10, e che è stata descritta negli adipociti. Tuttavia, la via TC10 non sembra essere coinvolta nelle cellule muscolari, in cui un altro input indipendente da Akt ha dimostrato di contribuire al rimodellamento del citoscheletro necessario per la completa traslocazione di GLUT4. A valle di Akt, una proteina chiamata Akt substrato di 160 KDa (AS160) o TCB1D4, è stata trovata per essere la chiave per comunicare la cascata di fosforilazione iniziata dall’insulina con il meccanismo di traffico delle vescicole. AS160 ha 6 residui di treonina/serina che possono essere fosforilati per inibire la sua attività, e contiene un dominio GTPase-activating protein (GAP) che allo stato basale inattiva una serie di proteine Rab, piccole GTPasi della superfamiglia Ras responsabili del traffico di membrana. La fosforilazione di AS160 da parte di Akt inibisce la sua attività GAP, permettendo l’attivazione delle proteine Rab; quindi, causando la traslocazione di GLUT4 al PM. I membri di Rab identificati come responsabili del traffico di GLUT4 nei mammiferi sono Rab8a, Rab10 e Rab14. Oltre a regolare il movimento delle vescicole GLUT4, AS160 ha dimostrato di essere richiesto per trattenere completamente GLUT4 nel IRC. Per dimostrare che la fosforilazione di AS160 è critica per la traslocazione di GLUT4 nei mammiferi, una forma dominante-inibitoria di AS160 è stata creata mutando 4 dei suoi 6 siti di fosforilazione (AS160-4P). Quando co-espresso in un sistema cellulare insieme a GLUT4 di ratto, la traslocazione di questa molecola al PM è stato bloccato, così come l’aumento dell’assorbimento del glucosio osservato dopo l’incubazione di insulina. Per quanto riguarda la loro sensibilità verso AS160-4P, sono state osservate chiare differenze tra okGLUT4 e btGLUT4, con il primo che mostra proprietà simili a quelle del GLUT4 dei mammiferi, e il secondo che non è influenzato. Questi risultati sono in accordo con le differenze osservate tra le due proteine GLUT4 dei pesci in termini di ritenzione intracellulare e supportano l’ipotesi che AS160 possa sequestrare okGLUT4, ma non btGLUT4, nell’IRC e che btGLUT4 possa essere più ampiamente distribuito all’interno della cellula rispetto agli altri trasportatori GLUT4. Inoltre, poiché i risultati ottenuti per btGLUT4 verso la sensibilità AS160 concordavano con quelli riportati in precedenza per un mutante GLUT4-F5A , il tasso esocitico più veloce di btGLUT4 è stato suggerito di essere dovuto alla mancanza di un motivo conservato FQQI .
In sintesi, studiando le caratteristiche di traffico delle due proteine GLUT4 di pesce (btGLUT4 e okGLUT4) rispetto al GLUT4 dei mammiferi e Glut1, è chiaro che esistono importanti differenze tra questi trasportatori (Figura 7). A questo proposito, okGLUT4 si comporta in molti aspetti in modo simile al mammifero GLUT4 a causa della sua sensibilità verso GGA e AS160; così, sostenendo un ruolo per queste molecole nella regolazione del traffico di okGLUT4 sintetizzato de novofrom il TGN in IRC, e dal TGN in PM in risposta all’insulina, rispettivamente. Al contrario, btGLUT4 sembra essere meno regolato, traffico verso l’IRC indipendentemente da GGA, così come essere trattenuto in IRC e uscire al PM solo in parte sotto il controllo di AS160; quindi, muovendosi verso la superficie cellulare forse, in parte, attraverso un percorso costitutivo come quello utilizzato da Glut1.
Leave a Reply