Ewolucja strukturalna i funkcjonalna transportera glukozy 4 (GLUT4): A Look at GLUT4 in Fish
Regulacja ruchu ryb GLUT4
W ssakach, główną cechą, która charakteryzuje GLUT4 w mięśniach szkieletowych i tkance tłuszczowej i czyni go wyjątkowym, jest jego zdolność do translokacji do PM w odpowiedzi na insulinę . To znacznie zwiększa zdolność komórek do wychwytu glukozy w stanie poposiłkowym, co jest kluczowe dla prawidłowego utrzymania homeostazy glukozy. Niezależnie od tego, dowody w komórkach ssaków wyraźnie wskazują, że w stanie podstawowym GLUT4 nie jest statyczny; zamiast tego GLUT4 krąży między wieloma przedziałami wewnątrzkomórkowymi, takimi jak sieć trans-Golgiego (TGN), wczesne i późne endosomy, wyspecjalizowany przedział reagujący na insulinę (IRC), jak również PM . Ilość GLUT4 obecna w PM w stanie podstawowym odpowiada tylko około 5-10% całkowitej ilości białka GLUT4, podczas gdy pozostałe 90-95% jest sekwestrowane wewnątrzkomórkowo w przedziale IRC.
Właściwości wewnątrzkomórkowego transportu dwóch transporterów glukozy zidentyfikowanych u łososiowatych (btGLUT4 i okGLUT4) zostały zbadane w porównaniu z GLUT4 ssaków, głównie w przypadku ekspresji w systemach heterologicznych (linie komórkowe adipocytarne lub mioblastyczne ssaków), ale także jako endogenny GLUT4 w pierwotnie hodowanych miocytach pstrąga. W adipocytach 3T3-L1 ulegających przejściowej ekspresji oddzielnie btGLUT4 lub okGLUT4 w warunkach stanu ustalonego, btGLUT4 wykazywał znacząco wyższy poziom białka w PM (30-40%), również okGLUT4, ale w mniejszym stopniu (15-20%), niż szczurzy GLUT4 (10-15%). Nie było to obserwowane tylko w adipocytach, ponieważ btGLUT4 był obecny w PM na wyższym poziomie (20-25%) niż szczurzy GLUT4 (10-15%), gdy był trwale eksprymowany w komórkach mięśniowych L6. Co ważne, podstawowa lokalizacja endogennego GLUT4 w PM w hodowlanych miocytach pstrąga była również stosunkowo wysoka. Dlatego w warunkach podstawowych lub niestymulowanych rybi GLUT4 wydaje się być mniej wydajnie zatrzymywany w cytozolu w adipocytach i miocytach niż ssaki GLUT4, co sugeruje różnice w mechanizmach odpowiedzialnych za wewnątrzkomórkową retencję GLUT4 między rybami i ssakami (patrz poniżej). Ponadto, na podstawie obserwowanych różnic w lokalizacji PM pomiędzy rybimi GLUT4 w warunkach podstawowych, przy czym okGLUT4 jest bardziej podobny do swoich ssaczych odpowiedników niż btGLUT4, zasugerowano, że różne zachowanie ruchu tych dwóch rybich wariantów białka GLUT4 może być związane z różnicami w charakterystycznych cechach regulacyjnych w sekwencji białka GLUT4 (tj.N- i C-terminalnych motywów białkowych) (patrz punkt 3; ).
Ponadto oceniano również zdolność rybich GLUT4 do odpowiedzi na insulinę. Pierwsze badania, w których próbowano wykazać, że rybi GLUT4 ulega translokacji do PM po stymulacji insuliną, przeprowadzono w Xenopusoocytach . Niemniej jednak system ten nie był odpowiedni do badania translokacji GLUT4 i oocyty wyrażające okGLUT4 lub szczurzą GLUT4 nie wykazywały różnic w lokalizacji transportera w obrębie komórki w odpowiedzi na insulinę. Zamiast tego z powodzeniem zastosowano system komórek adipocytów 3T3-L1, aby wykazać, że zarówno okGLUT4, jak i btGLUT4 były zdolne do znaczącej translokacji do PM po leczeniu insuliną, tak jak to się dzieje u ssaków. Co więcej, stymulowana insuliną translokacja btGLUT4 do PM została wykazana w mioblastach L6 i zróżnicowanych miotubach trwale eksprymujących rybi transporter GLUT4. Dlatego też wykazano, że rybie homologi GLUT4 reagują na insulinę podobnie jak ich odpowiedniki u ssaków, pomimo ich wyższej lokalizacji w PM w stanie ustalonym.
Jak wcześniej wspomniano, GLUT4 u ssaków jest rozmieszczony wewnątrz komórek w dwóch głównych przedziałach magazynowych, IRC i systemie endosomalnym. Co ciekawe, btGLUT4 wykazał tylko częściową kolokalizację ze szczurzym GLUT4, gdy oba były współekspresjonowane albo w adipocytach 3T3-L1, albo w komórkach mięśniowych L6 . Ta obserwacja, wraz z faktem, że btGLUT4 wykazywał niższy poziom retencji w przedziałach wewnątrzkomórkowych w warunkach podstawowych, chociaż nadal reagował na stymulację insuliną w obu typach komórek, sugeruje, że btGLUT4 jest równomiernie rozmieszczony pomiędzy wyspecjalizowanym IRC i przedziałem endosomalnym, skąd podlega ciągłej cyrkulacji z PM. Ponadto, zarówno w adipocytach 3T3-L1, jak i komórkach mięśniowych L6, wykazano, że wyższe poziomy PM obserwowane dla btGLUT4 wynikają raczej z szybszej szybkości eksternalizacji niż ze zmniejszenia szybkości endocytozy .
W ssakach opisano kilka białek, które wchodzą w interakcje z GLUT4, aby regulować jego ruch wewnątrzkomórkowy i utrzymywać białka sekwestrowane w IRC. Na przykład, zlokalizowane w Golgii białko wiążące Arf (GGA), zawierające γ ucho, zostało opisane jako regulator ruchu nowo syntetyzowanego GLUT4 z TGN do IRC. Opisano, że w tym etapie kluczową rolę odgrywa również sortilina, ponieważ GLUT4 nie zawiera specyficznego motywu docelowego, który byłby rozpoznawany przez GGA jako cząsteczka ładunku. Ostatnio wykazano, że aminopeptydaza regulowana insuliną (IRAP), która współlokuje się z GLUT4 w pęcherzykach wewnątrzkomórkowych, odgrywa rolę w sortowaniu GLUT4 z endosomów do IRC. Ponadto, białko o nazwie TUG (tether containing a UBX domain for GLUT4), zostało zgłoszone do interakcji z dużą wewnątrzkomórkową pętlą GLUT4 obecną pomiędzy TMVI i TMVII i do wiązania GLUT4 do pęcherzyków wewnątrzkomórkowych poprzez jego interakcję, poprzez jego domenę UBX, z błonami komórkowymi. Możliwa rola kilku białek oddziałujących z GLUT4 w regulacji ruchu rybich izoform GLUT4 została zbadana w adipocytach 3T3-L1 wyrażających odpowiadające im ortologi ssaków. W szczególności, białko adaptorowe GGA zostało zgłoszone jako zaangażowane we wczesne etapy sortowania GLUT4 z TGN. Ekspresja w adipocytach 3T3-L1 szczurzego GLUT4 wraz z GGA typu dzikiego lub formą dominującą GGA (GGA-DN) wykazała, że GGA jest wymagane, aby GLUT4 dotarł do IRC, ponieważ stymulowana insuliną translokacja szczurzego GLUT4 do PM była całkowicie stłumiona w obecności GGA-DN. Co ciekawe, wewnątrzkomórkowy ruch btGLUT4 i okGLUT4 w adipocytach 3T3-L1 wykazywał różnice w odniesieniu do ich wrażliwości na GGA, ponieważ ruch btGLUT4 do PM w warunkach podstawowych lub stymulowanych insuliną był tylko częściowo tłumiony przez koekspresję z GGA-DN, podczas gdy okGLUT4 wykazywał identyczną odpowiedź jak szczurzy GLUT4. Wyniki te sugerują, że okGLUT4 może przemieszczać się w adipocytach tą samą drogą co GLUT4 ssaków, ale btGLUT4 może częściowo wymykać się regulowanej drodze biosyntezy, przemieszczając się do PM ścieżką niezależną od GGA. W porozumieniu z inną wewnątrzkomórkową dystrybucją obserwowaną między btGLUT4 i szczurzym GLUT4, ruch btGLUT4 do PM może odbywać się poprzez konstytutywną ścieżkę używaną przez Glut1 lub receptor transferyny (Figura 7). Wiadomo, że GLUT4, po przybyciu do IRC, nabywa zdolność do odpowiedzi na insulinę i translokacji do PM. Kiedy plazmid kodujący szczurzy GLUT4 jest transfekowany do adipocytów 3T3-L1, komórki potrzebują od 6 do 9 godzin do wytworzenia nowego białka i skierowania go do IRC . W przeciwieństwie do tego, zarówno okGLUT4, jak i btGLUT4, gdy są wyrażane w tym samym systemie komórkowym, ulegają translokacji stymulowanej insuliną tylko 3 godziny po transfekcji, co sugeruje, że rybi GLUT4 ulega szybszej syntezie, przetwarzaniu lub ruchowi. Co ciekawe, okGLUT4 wykazywał odpowiedź czasową, która była pośrednia między szczurzym GLUT4 i btGLUT4, ale bliższa temu ostatniemu, pomimo wykazywania podobnej wrażliwości na GGA jak ssaki GLUT4.
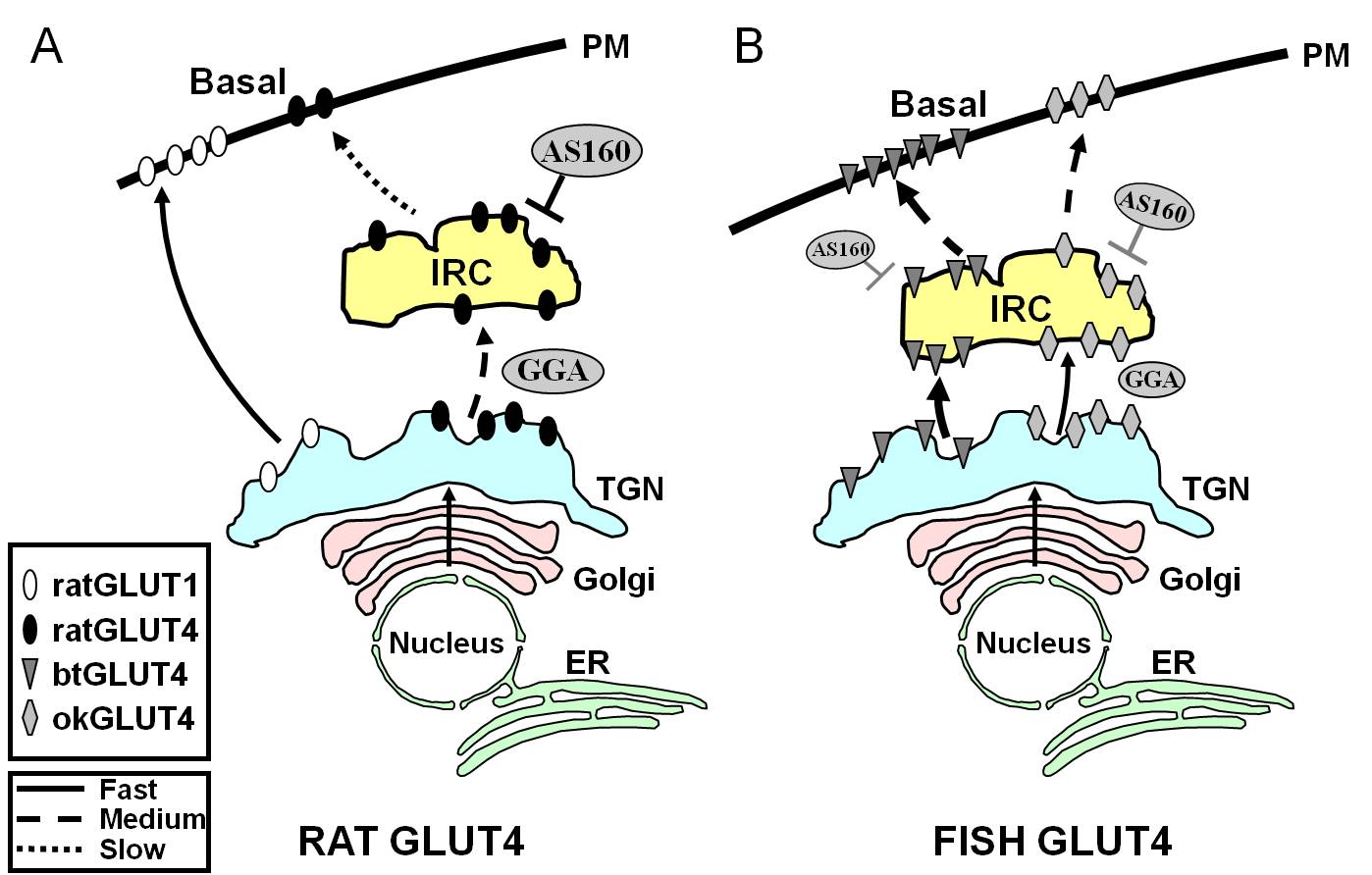
Ryc. 7.
Schematyczny model ilustrujący różnice w ruchu między rybim GLUT4s a szczurzym GLUT4 i Glut1 podczas stanu podstawowego w adipocytach. W (A), ruch nowo syntetyzowanych szczurzych GLUT4 odbywa się przez Golgiego i sieć trans-Golgiego (TGN) do przedziału reagującego na insulinę (IRC) w procesie sortowania, który jest zależny od białka adaptorowego GGA. W stanie podstawowym, szczurzy GLUT4 jest głównie sekwestrowany do IRC, proces ten jest regulowany przez AS160 i wymaga aminokońcowego motywu F5QQI8 GLUT4. W przeciwieństwie do tego, po biosyntezie Glut1 bezpośrednio przemieszcza się z TGN do błony plazmatycznej (PM) w procesie niezależnym od GGA. W (B) pokazano ruch nowo zsyntetyzowanego GLUT4 pstrąga (btGLUT4) lub łososia (okGLUT4). Postulujemy, że wysoki poziom btGLUT4 w PM wydaje się być spowodowany zwiększoną szybkością egzocytarną, w wyniku tego, że btGLUT4 podąża szlakiem niezależnym od GGA z TGN do IRC i wykazuje mniejszą sekwestrację regulowaną przez AS160 w IRC niż szczurzy GLUT4. Wysunęliśmy hipotezę, że odmienne zachowanie traffickingowe btGLUT4 może być związane z inną sekwencją w jego N-końcowym motywie (F5QHL8). Zachowanie ruchowe okGLUT4 (F5QQL8) wydaje się być pośrednie pomiędzy zachowaniem szczurzego GLUT4 i btGLUT4. ER: retikulum endoplazmatyczne.
Jak już wspomniano w sekcji 3, wśród różnych regulacyjnych motywów aminokwasowych występujących w GLUT4 u ssaków, wykazano, że motyw docelowy F5QQI8 na N-końcu jest ważny dla sekwestracji GLUT4 w IRC i stymulowanej insuliną translokacji do PM . Co ciekawe, oprócz faktu, że oba transportery GLUT4 ryb mają krótszą domenę N-końcową, motyw F5QQI8 wykazuje jedną konserwowaną substytucję aminokwasową w okGLUT4 (F5QQL8), a jest mniej konserwowany w btGLUT4 (F5QHL8), gdzie podwójna substytucja reszt powoduje istotne zmiany wielkości i ładunku (Figura 8A). Zbadano możliwość, że te różnice sekwencji mogły odpowiadać za zwiększone podstawowe poziomy powierzchni komórek obserwowane dla btGLUT4 (Capilla i Planas, dane niepublikowane). Figura 8B pokazuje, że mutacja motywu btGLUT4 F5QHL8 do F5QQI8 spowodowała niewielki spadek podstawowych poziomów PM; jednak mutacja motywu F5QHL8 do F5QQL8 znacznie zmniejszyła poziomy powierzchni komórek btGLUT4 do poziomów porównywalnych z okGLUT4 lub ssaczym GLUT4. Wyniki te wskazują, że specyficzne motywy aminokwasowe, jak również fałdowanie cząsteczki wydają się być ważne dla wewnątrzkomórkowych domen cząsteczki GLUT4, aby oddziaływać z różnymi białkami regulatorowymi dla prawidłowego ruchu i specyficznej lokalizacji przedziałów i/lub retencji.
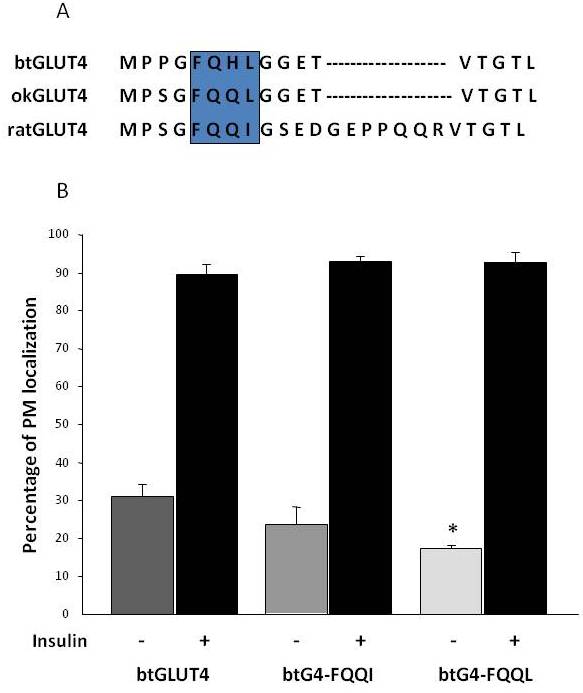
Ryc. 8.
Podwyższone podstawowe poziomy powierzchni komórki btGLUT4 są zmniejszone przez mutację motywu F5QHL8. (A) Wyrównanie sekwencji aminokwasów N-końcowego regionu cząsteczek GLUT4 szczura, pstrąga brunatnego (btGLUT4, AF247395) i łososia Coho (okGLUT4, AF502957). W ramce zaznaczono ważny motyw transportowy F5QQI8, częściowo konserwowany u tych gatunków ryb. (B) Zróżnicowane adipocyty 3T3-L1 wykazujące ekspresję btGLUT4 lub którejkolwiek z dwóch mutacji punktowych (btGLUT4-FQQI lub btGLUT4-FQQL) inkubowano z insuliną (100 nM, 30 min) lub bez niej. Dane przedstawiono jako odsetek (średnia ± SEM) komórek wykazujących kompletne obrzeże błony plazmatycznej (PM), uzyskany przez policzenie 100 komórek w każdym warunku w 3 niezależnych eksperymentach. Analizę statystyczną przeprowadzono za pomocą niesparowanego testu t względem dzikiego typu btGLUT4 odpowiednio w warunkach podstawowych lub stymulowanych insuliną (* oznacza istotność przy p < 0,05).
Wcześniejsze badania na ssakach z użyciem chimer pomiędzy GLUT4 i Glut1 wykazały, że zastąpienie N-końca i pętli wewnątrzkomórkowej Glut1 tymi z GLUT4 jest wystarczające do nadania chimerycznemu białku Glut1 cech GLUT4 w adipocytach 3T3-L1 . Tak więc, w celu zidentyfikowania domen białkowych w pstrągowym GLUT4, które nadają mu szczególne cechy ruchu (tj. niższą retencję wewnątrzkomórkową; wyższy poziom PM w warunkach podstawowych), utworzono białka chimeryczne, które mają N-końcówkę (btN) lub pętlę wewnątrzkomórkową (btL) btGLUT4 w szkielecie szczurzego GLUT4 i nazwano je odpowiednio btN-GLUT4 lub btL-GLUT4. Konstrukty te uległy następnie stabilnej ekspresji w komórkach 3T3-L1 i analizowano ich zdolność do zatrzymania w cytozolu w warunkach podstawowych oraz do odpowiedzi na insulinę (Simoes, Planas i Camps, wyniki niepublikowane). Uzyskane wyniki wskazują, że wszystkie konstrukty były zdolne do translokacji do PM w odpowiedzi na insulinę, ale z pewnymi różnicami między nimi (Figura 9). Po pierwsze, stymulowana insuliną translokacja btGLUT4 była niższa niż translokacja szczurzego GLUT4. Po drugie, btN-GLUT4 miał najsłabszą odpowiedź na insulinę, co sugeruje rolę N-końca w prawidłowym kierowaniu GLUT4 do IRC lub w translokacji GLUT4 do PM. Po trzecie, substytucja pętli cytoplazmatycznej w btL-GLUT4 spowodowała zmniejszenie odpowiedzi szczurzego GLUT4 na insulinę porównywalne do odpowiedzi btGLUT4. Te wstępne wyniki wspierają ideę, że N-terminus i pętla cytoplazmatyczna GLUT4 są odpowiedzialne za niektóre z różnic w handlu między btGLUT4 i szczurzym GLUT4.
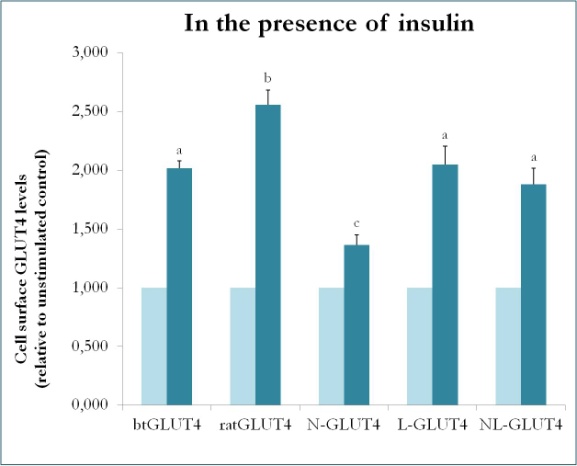
Rycina 9.
Poziomy powierzchni komórek różnych konstruktów GLUT4 w obecności insuliny. N-GLUT4 i L-GLUT4 reprezentują konstrukty z odpowiednio aminowym końcem (N) lub wewnątrzkomórkową pętlą (L) btGLUT4 w szkielecie szczurzego GLUT4. Zróżnicowane adipocyty 3T3-L1 wykazujące ekspresję różnych konstruktów GLUT4 inkubowano w nieobecności lub obecności insuliny (100nM) przez 30 min, a oznaczenie poziomu powierzchniowego GLUT4 przeprowadzono zgodnie z opisem w . Powierzchnia komórek GLUT4 jest wyrażona w stosunku do niestymulowanej kontroli dla każdej linii komórkowej. Różne litery oznaczają statystycznie istotne różnice (p < 0,05).
Po stymulacji insuliną, ssaki GLUT4 przemieszczają się i łączą z PM, zwiększając swoją obecność na powierzchni komórki do 10-krotnie; w ten sposób wspierając wzrost wychwytu glukozy obserwowany po karmieniu. Insulina zwiększa liczbę transporterów w PM nie tylko poprzez nasilenie egzocytozy, ale także poprzez zmniejszenie tempa endocytozy. Insulina wywiera swoje działanie poprzez dwa różne wewnątrzkomórkowe szlaki sygnalizacyjne. Pierwszym z nich jest dobrze znany szlak fosfatydyloinozytol-3-kinazy (PI3K)/kinazy białkowej B (PKB), znanej również jako Akt, która jest niezbędna do translokacji GLUT4, ale niewystarczająca. Drugą ścieżką jest ta, która obejmuje białko związane z Cbl (CAP), które wiąże receptor insuliny i aktywuje małą GTPazę z rodziny Rho o nazwie TC10, i która została opisana w adipocytach. Jednak wydaje się, że szlak TC10 nie jest zaangażowany w komórkach mięśniowych, w których wykazano, że inne wejście niezależne od Akt przyczynia się do przebudowy cytoszkieletu wymaganej do pełnej translokacji GLUT4. Stwierdzono, że białko zwane substratem Akt o masie 160 KDa (AS160) lub TCB1D4 jest kluczem do komunikacji kaskady fosforylacji inicjowanej przez insulinę z mechanizmem handlu cząsteczkami. AS160 posiada 6 reszt treoninowych/serynowych, które mogą być fosforylowane w celu zahamowania jego aktywności, oraz zawiera domenę GAP (GTPase-activating protein), która w stanie podstawowym inaktywuje szereg białek Rab, małych GTPaz z nadrodziny Ras odpowiedzialnych za trafficking błonowy. Fosforylacja AS160 przez Akt hamuje jego aktywność GAP, umożliwiając aktywację białek Rab, co powoduje translokację GLUT4 do PM. Białka Rab zidentyfikowane jako odpowiedzialne za przemieszczanie GLUT4 u ssaków to Rab8a, Rab10 i Rab14. Oprócz regulacji ruchu pęcherzyków GLUT4, wykazano, że AS160 jest wymagany do pełnego zatrzymania GLUT4 w IRC. Aby wykazać, że fosforylacja AS160 jest krytyczna dla translokacji GLUT4 u ssaków, stworzono dominującą formę hamującą AS160 poprzez mutację 4 z 6 miejsc fosforylacji (AS160-4P). W przypadku koekspresji w systemie komórkowym wraz ze szczurzym GLUT4, translokacja tej cząsteczki do PM była zablokowana, podobnie jak wzrost wychwytu glukozy obserwowany po inkubacji z insuliną. Jeśli chodzi o wrażliwość na AS160-4P, zaobserwowano wyraźne różnice pomiędzy okGLUT4 i btGLUT4, przy czym pierwsze z nich wykazywały podobne właściwości jak GLUT4 ssaków, a drugie pozostawały bez zmian. Wyniki te były zgodne z różnicami obserwowanymi pomiędzy dwoma rybimi białkami GLUT4 w zakresie ich retencji wewnątrzkomórkowej i wspierają hipotezę, że AS160 może sekwestrować okGLUT4, ale nie btGLUT4, w IRC oraz że btGLUT4 może być szerzej dystrybuowany wewnątrz komórki niż inne transportery GLUT4. Co więcej, ponieważ wyniki uzyskane dla btGLUT4 wobec wrażliwości na AS160 zgadzały się z tymi zgłoszonymi wcześniej dla mutanta GLUT4-F5A, sugerowano, że szybsze tempo egzocytarne btGLUT4 wynika z braku konserwowanego motywu FQQI .
Podsumowując, badając charakterystykę handlu dwóch rybich białek GLUT4 (btGLUT4 i okGLUT4) w porównaniu z ssaczym GLUT4 i Glut1, jasne jest, że istnieją istotne różnice między tymi transporterami (Figura 7). W tym względzie okGLUT4 zachowuje się w wielu aspektach podobnie do GLUT4 ssaków ze względu na wrażliwość na GGA i AS160, co przemawia za rolą tych cząsteczek w regulacji ruchu okGLUT4 syntetyzowanego de novof z TGN do IRC oraz z TGN do PM w odpowiedzi na insulinę. W przeciwieństwie do tego, btGLUT4 wydaje się być mniej regulowany, przemieszczając się do IRC niezależnie od GGA, jak również będąc zatrzymanym w IRC i wychodząc do PM tylko częściowo pod kontrolą AS160; zatem, przemieszczając się w kierunku powierzchni komórki prawdopodobnie, częściowo, poprzez konstytutywną ścieżkę, jak ta używana przez Glut1.
.
Leave a Reply