Structurele en functionele evolutie van Glucose Transporter 4 (GLUT4): A Look at GLUT4 in Fish
Regulation of the traffic of fish GLUT4
In zoogdieren is het belangrijkste kenmerk dat GLUT4 in skeletspieren en vetweefsel kenmerkt en het uniek maakt, zijn vermogen om naar de PM te transloceren in reactie op insuline . Dit verhoogt aanzienlijk de capaciteit van de cellen om glucose op te nemen tijdens de postprandiale toestand, hetgeen cruciaal is om de glucose homeostase goed te handhaven. Desondanks blijkt uit gegevens in zoogdiercellen duidelijk dat GLUT4 in de basale toestand niet statisch is; in plaats daarvan circuleert GLUT4 tussen tal van intracellulaire compartimenten, zoals het trans-Golgi netwerk (TGN), vroege en late endosomen, een gespecialiseerd insuline responsief compartiment (IRC), evenals de PM . De hoeveelheid GLUT4 aanwezig op de PM in de basale toestand komt overeen met ongeveer slechts 5-10% van het totale GLUT4 eiwit, terwijl de resterende 90-95% intracellulair is opgesloten in het IRC compartiment .
De intracellulaire transportkarakteristieken van de twee bij zalmachtigen geïdentificeerde glucose transporters (btGLUT4 en okGLUT4) zijn bestudeerd in vergelijking met zoogdier GLUT4, voornamelijk wanneer uitgedrukt in heterologe systemen (zoogdier adipocytische of myoblastische cellijnen), maar ook als het endogene GLUT4 in primaire gekweekte forel myocyten. In 3T3-L1 adipocyten die afzonderlijk btGLUT4 of okGLUT4 tot expressie brachten onder steady-state condities, vertoonde btGLUT4 significant hogere eiwitniveaus in de PM (30-40%), ook okGLUT4 maar in mindere mate (15-20%), dan rat GLUT4 (10-15%). Dit werd niet alleen waargenomen in adipocyten, aangezien btGLUT4 ook aanwezig was in de PM op hogere niveaus (20-25%) dan rat GLUT4 (10-15%) wanneer het stabiel werd geëxpresseerd in L6 spiercellen. Belangrijk is dat de basale lokalisatie van endogeen GLUT4 bij de PM in forel myocyten in cultuur ook relatief hoog was . Onder basale of niet gestimuleerde condities lijkt vis GLUT4 dus minder efficiënt in het cytosol in adipocyten en myocyten vastgehouden te worden dan zoogdier GLUT4, wat duidt op verschillen in de mechanismen die verantwoordelijk zijn voor de intracellulaire retentie van GLUT4 tussen vissen en zoogdieren (zie verder). Bovendien, gebaseerd op de waargenomen verschillen in PM lokalisatie tussen vis GLUT4s onder basale condities, waarbij okGLUT4 meer lijkt op zijn zoogdier tegenhangers dan btGLUT4, is gesuggereerd dat het verschillende verkeersgedrag van deze twee vis GLUT4 eiwit varianten gerelateerd kan zijn aan verschillen in karakteristieke regulerende kenmerken in de GLUT4 eiwitsequentie (i.d. N- en C-terminale eiwit motieven) (zie sectie 3; ).
Daarnaast is ook het vermogen van vis GLUT4s om te reageren op insuline geëvalueerd. De eerste studies die probeerden aan te tonen dat een vis GLUT4 transloceert naar de PM bij insuline stimulatie werden uitgevoerd in Xenopusoocytes . Het systeem was echter niet geschikt om de translocatie van GLUT4 te bestuderen en oocyten die okGLUT4 of een rat GLUT4 tot expressie brachten toonden geen verschillen in translokatie van de transporter binnen de cel in reactie op insuline . In plaats daarvan werd het 3T3-L1 adipocyte celsysteem met succes gebruikt om aan te tonen dat zowel okGLUT4 als btGLUT4 in staat waren om aanzienlijk te transloceren naar de PM na insuline behandeling , zoals het gebeurt bij zoogdieren. Bovendien werd een door insuline gestimuleerde translocatie van btGLUT4 naar de PM aangetoond in L6 myoblasten en gedifferentieerde myotubes die stabiel de vis GLUT4 transporter tot expressie brengen. Daarom werd aangetoond dat de vis homologs van GLUT4 insuline responsief zijn zoals hun zoogdieren tegenhanger, ondanks hun hogere PM lokalisatie bij steady-state.
Zoals eerder vermeld, wordt GLUT4 bij zoogdieren gedistribueerd binnen de cellen in twee belangrijke opslagcompartimenten, het IRC en het endosomale systeem . Interessant is dat btGLUT4 slechts gedeeltelijke co-lokalisatie vertoonde met rat GLUT4 wanneer beide werden gecoëxpresseerd in 3T3-L1 adipocyten of in L6 spiercellen . Deze observatie, samen met het feit dat btGLUT4 lagere retentieniveaus vertoonde in intracellulaire compartimenten tijdens basale condities, hoewel het nog steeds reageerde op insuline stimulatie in beide celtypes , suggereerde dat btGLUT4 gelijk verdeeld is tussen het gespecialiseerde IRC en het endosomale compartiment, van waaruit het continu met de PM cycliseert. Bovendien werd zowel in 3T3-L1 adipocyten als in L6 spiercellen aangetoond dat de hogere PM niveaus die werden waargenomen voor btGLUT4 te wijten waren aan een snellere externalisatiesnelheid in plaats van aan een afname van de snelheid van endocytose.
In zoogdieren is van verschillende eiwitten beschreven dat ze interageren met GLUT4 om het intracellulaire verkeer ervan te reguleren en om de eiwitten in het IRC opgesloten te houden. Bijvoorbeeld, het Golgi-gelokaliseerde γ-oor-bevattende Arf-bindende proteïne (GGA) is beschreven om te functioneren als een verkeersregelaar van nieuw gesynthetiseerd GLUT4 van de TGN naar het IRC . In deze stap heeft sortiline ook een sleutelrol, aangezien GLUT4 niet het specifieke targeting motief bevat om door GGA als ladingmolecuul herkend te worden. Meer recent is aangetoond dat het insuline-gereguleerde aminopeptidase (IRAP), dat samen met GLUT4 in intracellulaire vesikels gelokaliseerd is, een rol speelt bij het sorteren van GLUT4 van endosomen naar het IRC . Bovendien is een eiwit genaamd TUG (tether containing a UBX domain for GLUT4), gerapporteerd te interageren met de grote intracellulaire GLUT4 lus die aanwezig is tussen TMVI en TMVII en GLUT4 te binden aan intracellulaire vesicles door zijn interactie, via zijn UBX domein, met cellulaire membranen. De mogelijke rol van verschillende GLUT4-interagerende eiwitten in de regulatie van het verkeer van de vis GLUT4 isovormen is onderzocht in 3T3-L1 adipocyten die de corresponderende zoogdier-orthologs tot expressie brengen. In het bijzonder is gemeld dat het adaptor proteïne GGA betrokken is bij de vroege sorteerstappen van GLUT4 uit het TGN. Expressie in 3T3-L1 adipocyten van rat GLUT4 samen met wild-type GGA of een dominante interfererende vorm van GGA (GGA-DN) toonde aan dat GGA nodig is voor GLUT4 om de IRC te bereiken, omdat de insuline-gestimuleerde translocatie van rat GLUT4 naar de PM volledig werd onderdrukt in de aanwezigheid van GGA-DN. Interessant is dat het intracellulaire verkeer van btGLUT4 en okGLUT4 in 3T3-L1 adipocyten verschillen vertoonde met betrekking tot hun gevoeligheid voor GGA omdat het verkeer van btGLUT4 naar de PM onder basale of insuline gestimuleerde condities slechts gedeeltelijk werd onderdrukt door co-expressie met GGA-DN terwijl okGLUT4 een identieke respons vertoonde als die van rat GLUT4 . Deze resultaten suggereren dat okGLUT4 zich in adipocyten via dezelfde route verplaatst als GLUT4 van zoogdieren, maar dat btGLUT4 deels ontsnapt aan de gereguleerde biosynthetische route en zich naar de PM verplaatst via een GGA-onafhankelijke route. In overeenstemming met de verschillende intracellulaire distributie waargenomen tussen btGLUT4 en rat GLUT4, kan het verkeer van btGLUT4 naar de PM plaatsvinden via de constitutieve route gebruikt door Glut1 of de transferrine receptor (figuur 7). Het is bekend dat GLUT4, na aankomst in het IRC, de mogelijkheid verwerft om te reageren op insuline en te transloceren naar de PM. Wanneer een plasmide coderend voor rat GLUT4 wordt getransfecteerd in 3T3-L1 adipocyten, hebben de cellen 6 tot 9 uur nodig om het nieuwe eiwit te produceren en het te richten op het IRC . In tegenstelling, zowel okGLUT4 als btGLUT4, wanneer uitgedrukt in hetzelfde cellulaire systeem, ondergaan insuline gestimuleerde translocatie slechts 3 uur na transfectie , wat suggereert dat vis GLUT4 een snellere synthese, verwerking of verkeer ondergaat. Interessant is dat okGLUT4 een temporele respons vertoonde die intermediair was tussen rat GLUT4 en btGLUT4, maar dichter bij de laatste, ondanks het vertonen van een vergelijkbare gevoeligheid voor GGA als de zoogdier GLUT4.
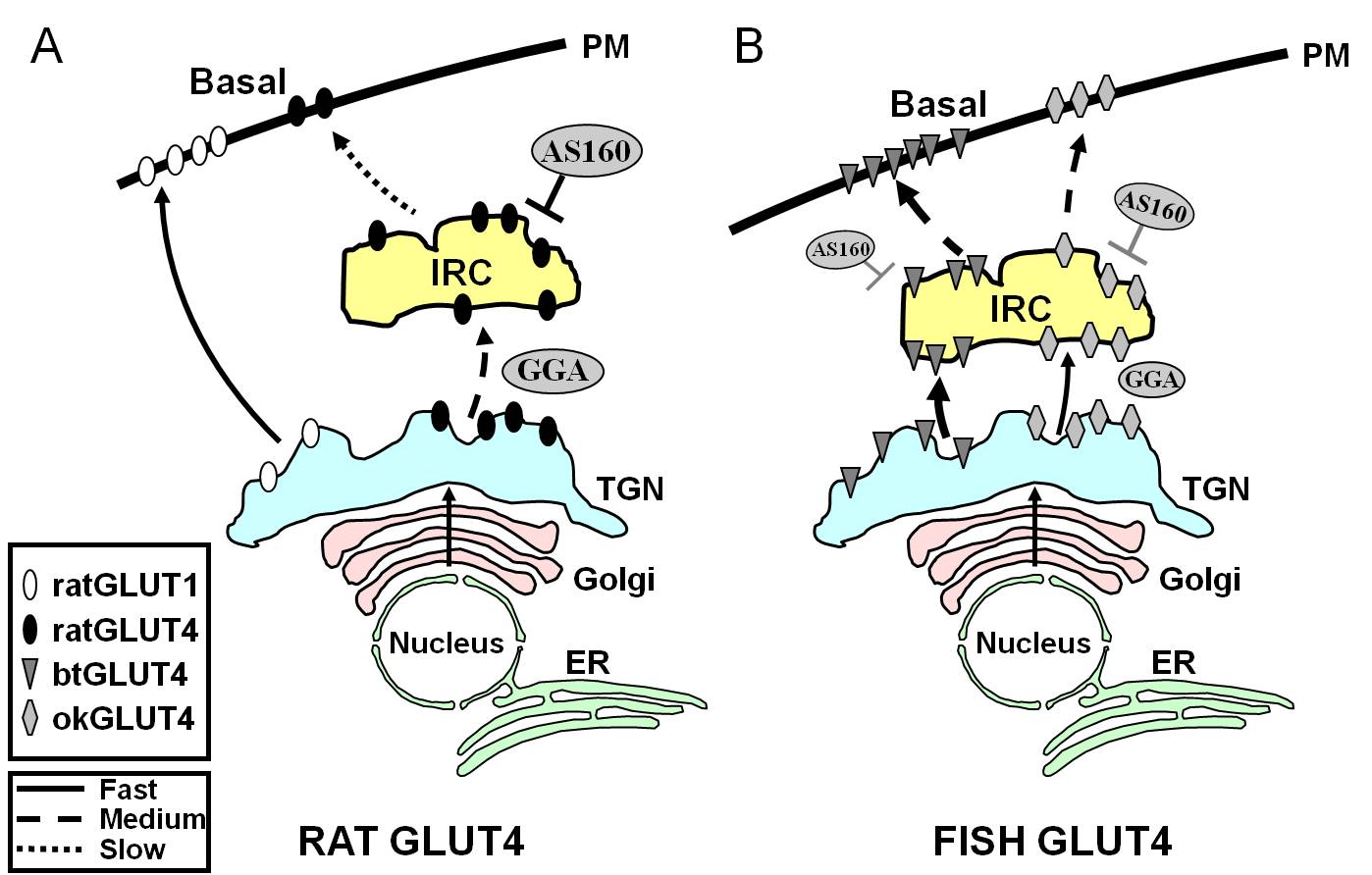
Figuur 7.
Schematisch model ter illustratie van verschillen in verkeer tussen vis GLUT4s en rat GLUT4 en Glut1 tijdens de basale toestand in adipocyten. In (A), is te zien hoe het verkeer van nieuw gesynthetiseerde rat GLUT4 plaatsvindt door de Golgi en het trans-Golgi netwerk (TGN) en in het insuline-responsieve compartiment (IRC) in een sorteerproces dat afhankelijk is van het adaptor-eiwit GGA. In de basale toestand, wordt rat GLUT4 voornamelijk gesekwestreerd in het IRC, een proces dat wordt gereguleerd door AS160 en dat het F5QQI8 amino terminal motief van GLUT4 vereist. In tegenstelling, na biosynthese, reist Glut1 direct van de TGN naar de plasma membraan (PM) in een GGA-onafhankelijk proces. In (B), is het verkeer van nieuw gesynthetiseerde forel (btGLUT4) of zalm (okGLUT4) GLUT4 te zien. Wij stellen dat de hoge niveaus van btGLUT4 bij de PM het gevolg lijken te zijn van een verhoogde exocytische snelheid, als gevolg van het feit dat btGLUT4 een GGA-onafhankelijke route volgt van de TGN naar het IRC en door minder AS160-gestuurde sequestratie te vertonen bij het IRC dan rat GLUT4. Wij stellen de hypothese voorop dat het verschillende transportgedrag van btGLUT4 gerelateerd kan zijn aan de verschillende sequentie in zijn N-terminale motief (F5QHL8). Het transportgedrag van okGLUT4 (F5QQL8) lijkt het midden te houden tussen dat van rat GLUT4 en btGLUT4. ER: endoplasmatisch reticulum.
Zoals eerder vermeld in sectie 3, is van de verschillende regulerende aminozuurmotieven die in GLUT4 bij zoogdieren zijn gevonden, aangetoond dat het F5QQI8 targeting motief in de N-terminus belangrijk is voor GLUT4 sequestratie in het IRC en insuline-gestimuleerde translocatie naar de PM . Interessant is dat, naast het feit dat beide vis GLUT4 transporters een korter N-terminaal domein hebben, het F5QQI8 motief één geconserveerde aminozuur substitutie vertoont in okGLUT4 (F5QQL8), en het is minder geconserveerd in btGLUT4 (F5QHL8), waar de dubbele residu substitutie belangrijke grootte en lading veranderingen veroorzaakt (Figuur 8A). De mogelijkheid dat deze sequentieverschillen verantwoordelijk zijn voor de verhoogde basale celoppervlaktespiegels die voor btGLUT4 zijn waargenomen, werd onderzocht (Capilla en Planas, ongepubliceerde gegevens). Figuur 8B laat zien dat mutatie van het btGLUT4 motief F5QHL8 naar F5QQI8 een lichte afname van de basale PM niveaus veroorzaakte; mutatie van het F5QHL8 motief naar F5QQL8 verminderde echter de celoppervlak niveaus van btGLUT4 aanzienlijk tot niveaus die vergelijkbaar zijn met die van okGLUT4 of het zoogdier GLUT4. Deze resultaten geven aan dat specifieke aminozuurmotieven en de vouwing van het molecuul belangrijk lijken te zijn voor de intracellulaire domeinen van het GLUT4 molecuul om te interageren met de verschillende regulerende eiwitten voor het juiste verkeer en de specifieke compartiment lokalisatie en/of retentie.
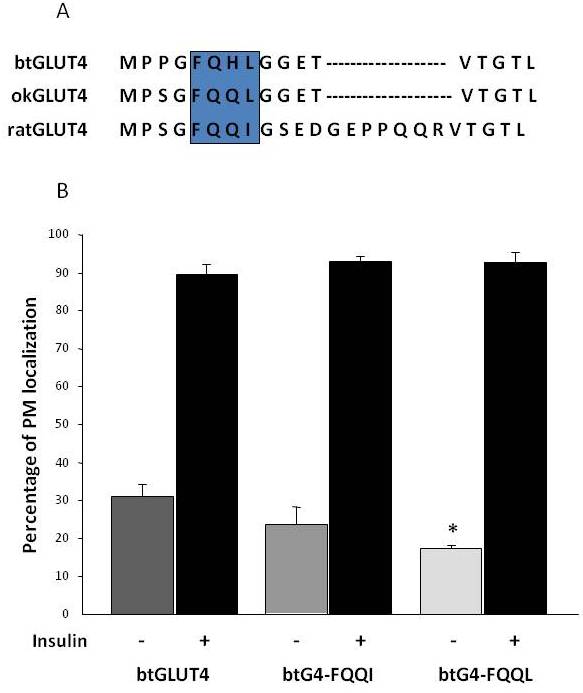
Figuur 8.
De verhoogde basale celoppervlak niveaus van btGLUT4 worden verlaagd door mutatie van het F5QHL8 motief. (A) Aminozuur sequentie alignment van de N-terminale regio van rat, bruine forel (btGLUT4, AF247395) en coho zalm (okGLUT4, AF502957) GLUT4 moleculen. Het kader omsluit het belangrijke transportmotief F5QQI8 dat gedeeltelijk geconserveerd is in de vissoorten. (B) Gedifferentieerde 3T3-L1 adipocyten die ofwel btGLUT4 of een van de twee puntmutanten (btGLUT4-FQQI of btGLUT4-FQQL) tot expressie brengen, werden geïncubeerd met of zonder insuline (100 nM, 30 min). Gegevens worden gepresenteerd als percentage (gemiddelde ± SEM) van de cellen met een volledige plasmamembraan (PM) rand verkregen door het tellen van 100 cellen per conditie in 3 onafhankelijke experimenten. Statistische analyse werd uitgevoerd door ongepaarde t-test tegen het wildtype btGLUT4 bij basale of insuline gestimuleerde omstandigheden respectievelijk (* betekent significantie bij p < 0,05).
Een eerdere studie bij zoogdieren met chimaeren tussen GLUT4 en Glut1 toonde aan dat vervanging van de N-terminus en de intracellulaire lus van Glut1 door die van GLUT4 voldoende is om het chimere Glut1 eiwit de eigenschappen van GLUT4 te geven in 3T3-L1 adipocyten. Dus, om de eiwitdomeinen in forel GLUT4 te identificeren die zijn specifieke verkeerskenmerken verlenen (d.w.z. lagere intracellulaire retentie; hogere PM niveaus onder basale condities), werden chimere eiwitten gecreëerd die de N-terminus (btN) of de intracellulaire lus (btL) van btGLUT4 in een rat GLUT4 backbone hebben en werden btN-GLUT4 of btL-GLUT4 genoemd, respectievelijk. Deze constructen werden vervolgens stabiel tot expressie gebracht in 3T3-L1 cellen en hun vermogen om in het cytosol vastgehouden te worden onder basale condities en om te reageren op insuline werd geanalyseerd (Simoes, Planas en Camps, ongepubliceerde resultaten). Uit de verkregen resultaten bleek dat alle constructen in staat waren naar de PM te transloceren in reactie op insuline, maar met bepaalde onderlinge verschillen (figuur 9). Ten eerste, de insuline-gestimuleerde translocatie van btGLUT4 was lager dan die van rat GLUT4. Ten tweede, btN-GLUT4 had de zwakste respons op insuline, wat suggereert dat de N-terminus een rol speelt in de juiste targeting van GLUT4 naar het IRC of in de translocatie van GLUT4 naar de PM. Ten derde, de vervanging van de cytoplasmatische lus in btL-GLUT4 veroorzaakte een vermindering in de respons van rat GLUT4 op insuline vergelijkbaar met die van btGLUT4. Deze voorlopige resultaten ondersteunen het idee dat de N-terminus en de cytoplasmatische lus van GLUT4 verantwoordelijk zijn voor een deel van de verschillen in transport tussen btGLUT4 en rat GLUT4.
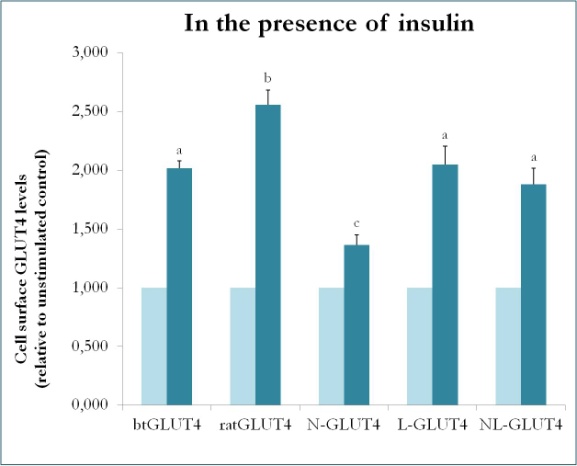
Figuur 9.
Celoppervlak niveaus van verschillende GLUT4 constructen in aanwezigheid van insuline. N-GLUT4 en L-GLUT4 zijn constructen met de amino terminus (N) of de intracellulaire lus (L) van btGLUT4 in een rat GLUT4 backbone, respectievelijk. Gedifferentieerde 3T3-L1 adipocyten expressie van de verschillende GLUT4 constructen werden geïncubeerd in de afwezigheid of aanwezigheid van insuline (100nM) gedurende 30 min en de bepaling van het oppervlak GLUT4 niveaus werd uitgevoerd zoals beschreven in . Celoppervlak GLUT4 wordt uitgedrukt ten opzichte van de niet-gestimuleerde controle voor elke cellijn. Verschillende letters wijzen op statistisch significante verschillen (p < 0,05).
Na insuline stimulatie, zoogdieren GLUT4 traficeert en fuseert met de PM, waardoor de aanwezigheid in het celoppervlak tot 10-voudige; dus ter ondersteuning van de toename van de glucose-opname waargenomen na de voeding. Insuline verhoogt het aantal transporters op de PM niet alleen door exocytose te bevorderen, maar ook door de snelheid van endocytose te verlagen. Insuline oefent zijn effecten uit via twee verschillende intracellulaire signaalwegen. De eerste is de bekende route van fosfatidylinositol-3-kinase (PI3K)/protein kinase B (PKB), ook bekend als Akt, die noodzakelijk is voor de translocatie van GLUT4, maar niet voldoende is. De tweede route is die met het Cbl associated protein (CAP), dat de insuline receptor bindt en een klein GTPase van de Rho familie, TC10 genaamd, activeert, en dat beschreven is in adipocyten. De TC10-route lijkt echter niet betrokken te zijn bij spiercellen, waarin een andere Akt-onafhankelijke input bleek bij te dragen aan de cytoskelet-remodellering die nodig is voor volledige GLUT4 translocatie. Stroomafwaarts van Akt is een eiwit met de naam Akt substraat van 160 KDa (AS160) of TCB1D4 de sleutel gebleken tot de communicatie tussen de door insuline geïnitieerde fosforyleringscascade en de vesicle trafficking machinerie. AS160 heeft 6 threonine/serine residuen die gefosforyleerd kunnen worden om zijn activiteit te remmen, en bevat een GTPase-activating protein (GAP) domein dat in basale toestand een reeks Rab proteïnen inactiveert, kleine GTPasen uit de Ras superfamilie die verantwoordelijk zijn voor membraantransport. Fosforylering van AS160 door Akt inhibeert zijn GAP activiteit, waardoor activering van de Rab proteïnen mogelijk wordt; hierdoor wordt translocatie van GLUT4 naar de PM veroorzaakt. De Rab-leden die verantwoordelijk zijn voor het transport van GLUT4 bij zoogdieren zijn Rab8a, Rab10 en Rab14. Naast het reguleren van de beweging van GLUT4 vesicles, is aangetoond dat AS160 nodig is voor het volledig vasthouden van GLUT4 in het IRC . Om aan te tonen dat AS160 fosforylatie kritisch is voor GLUT4 translocatie bij zoogdieren, werd een dominant-remmende vorm van AS160 gecreëerd door 4 van de 6 fosforylatie plaatsen te muteren (AS160-4P) . Samengeëxpresseerd in een cellulair systeem met rat GLUT4, werd de translocatie van deze molecule naar de PM geblokkeerd, evenals de toename in glucose opname waargenomen na insuline incubatie. Met betrekking tot hun gevoeligheid voor AS160-4P, werden duidelijke verschillen waargenomen tussen okGLUT4 en btGLUT4, waarbij de eerste vergelijkbare eigenschappen vertoonde als die van zoogdier GLUT4, en de laatste niet werd beïnvloed. Deze resultaten waren in overeenstemming met de verschillen die werden waargenomen tussen de twee vis GLUT4 eiwitten in termen van hun intracellulaire retentie en ondersteunen de hypothese dat AS160 okGLUT4, maar niet btGLUT4, kan sekwestreren in het IRC en dat btGLUT4 meer verspreid kan zijn in de cel dan de andere GLUT4 transporters. Bovendien, omdat de resultaten verkregen voor btGLUT4 ten opzichte van AS160 gevoeligheid overeenkwamen met die eerder gerapporteerd voor een GLUT4-F5A mutant , werd gesuggereerd dat de snellere exocytische snelheid van btGLUT4 te wijten is aan het ontbreken van een geconserveerd FQQI motief .
Samenvattend, door het onderzoeken van de trafficking karakteristieken van de twee vis GLUT4 eiwitten (btGLUT4 en okGLUT4) in vergelijking met zoogdier GLUT4 en Glut1, is het duidelijk dat er belangrijke verschillen bestaan tussen deze transporters (figuur 7). In dit opzicht gedraagt okGLUT4 zich in veel aspecten vergelijkbaar met zoogdieren GLUT4 door zijn gevoeligheid voor GGA en AS160; dus, ondersteunt een rol voor deze moleculen in de regulatie van het verkeer van okGLUT4 gesynthetiseerd de novof van de TGN naar de IRC, en van de TGN naar de PM in reactie op insuline, respectievelijk. Daarentegen lijkt btGLUT4 minder gereguleerd te zijn en onafhankelijk van GGA naar het IRC te worden getransporteerd, in het IRC te worden vastgehouden en slechts gedeeltelijk onder controle van AS160 naar de PM te worden geëxporteerd; daarom beweegt het zich mogelijk, gedeeltelijk, naar het celoppervlak via een constitutieve route zoals die wordt gebruikt door Glut1.
Leave a Reply