Glukoosin kuljettaja 4:n (GLUT4) rakenteellinen ja toiminnallinen kehitys: A Look at GLUT4 in Fish
Regulation of the traffic of fish GLUT4
Nisäkkäillä GLUT4:lle luurankolihaksessa ja rasvakudoksessa ominainen ja siitä ainutlaatuisen tekevä pääpiirre on sen kyky translokoitua PM:ään insuliinin vaikutuksesta . Tämä lisää huomattavasti solujen kykyä ottaa glukoosia postprandiaalisen tilan aikana, mikä on ratkaisevan tärkeää glukoosihomeostaasin asianmukaisen ylläpitämisen kannalta. Nisäkässoluista saadut todisteet osoittavat kuitenkin selvästi, että perustilassa GLUT4 ei ole staattinen, vaan GLUT4 kiertää lukuisissa solunsisäisissä lokeroissa, kuten trans-Golgi-verkossa (TGN), varhaisissa ja myöhäisissä endosomeissa, erikoistuneessa insuliiniin reagoivassa lokerossa (IRC) sekä PM:ssä . Perustilassa PM:ssä olevan GLUT4:n määrä vastaa vain noin 5-10 prosenttia GLUT4-proteiinin kokonaismäärästä, kun taas loput 90-95 prosenttia on sidottu solunsisäisesti IRC-osastoon .
Lohikaloissa tunnistettujen kahden glukoosinsiirtäjän (btGLUT4 ja okGLUT4) solunsisäisiä kulkeutumisominaisuuksia on tutkittu verrattuna nisäkkäiden GLUT4:ään lähinnä silloin, kun niitä on ekspressoitu heterologisissa järjestelmissä (nisäkkäiden adiposyytti- tai sydänlihassolulinjoissa), mutta myös silloin, kun niitä on ekspressoitu primaarisesti viljellyissä taimenlihassoluissa olevana endogeenisena GLUT4:nä. 3T3-L1-rasvasoluissa, jotka ekspressoivat ohimenevästi erikseen btGLUT4:ää tai okGLUT4:ää vakaassa tilassa, btGLUT4:n proteiinipitoisuudet PM:ssä olivat huomattavasti korkeammat (30-40 %), samoin okGLUT4:n, mutta vähäisemmässä määrin (15-20 %), kuin rotan GLUT4:n (10-15 %) . Tätä ei havaittu ainoastaan rasvasoluissa, sillä btGLUT4:ää esiintyi myös PM:ssä korkeampina pitoisuuksina (20-25 %) kuin rotan GLUT4:ää (10-15 %), kun sitä ekspressoitiin stabiilisti L6-lihassoluissa . Tärkeää on, että endogeenisen GLUT4:n peruslokalisaatio PM:ssä taimenlihassoluissa viljelyssä oli myös suhteellisen korkea . Näin ollen kalojen GLUT4 näyttäisi perusolosuhteissa tai stimuloimattomissa olosuhteissa säilyvän vähemmän tehokkaasti sytosolissa rasvasoluissa ja lihassoluissa kuin nisäkkäiden GLUT4, mikä viittaa eroihin GLUT4:n solunsisäisestä säilymisestä vastaavissa mekanismeissa kalojen ja nisäkkäiden välillä (ks. jäljempänä). Lisäksi kalojen GLUT4:n PM-lokalisaatiossa havaittujen erojen perusteella kalojen GLUT4:n ollessa perusolosuhteissa okGLUT4:n ollessa nisäkkäiden vastaaviensa kaltaisempi kuin btGLUT4:n, on ehdotettu, että näiden kahden kalojen GLUT4-proteiinivariantin erilainen liikennekäyttäytyminen voi liittyä eroihin GLUT4-proteiinisekvenssin tyypillisissä säätelyominaisuuksissa (i.eli N- ja C-terminaalisiin proteiinimotiiveihin) (ks. kohta 3; ).
Myös kalojen GLUT4:n kykyä reagoida insuliiniin on arvioitu. Ensimmäiset tutkimukset, joissa pyrittiin osoittamaan, että kalan GLUT4 translokoituu PM:ään insuliinistimulaation yhteydessä, suoritettiin Xenopusoocyteilla . Järjestelmä ei kuitenkaan soveltunut GLUT4:n translokaation tutkimiseen, ja okGLUT4:ää tai rotan GLUT4:ää ilmentävät munasolut eivät osoittaneet eroja kuljettajan lokalisaatiossa solun sisällä vasteena insuliinille . Sen sijaan 3T3-L1-rasvasolusysteemiä käytettiin menestyksekkäästi osoittamaan, että sekä okGLUT4 että btGLUT4 pystyivät translokoitumaan merkittävästi PM:ään insuliinikäsittelyn jälkeen , kuten nisäkkäillä tapahtuu. Lisäksi btGLUT4:n insuliinin stimuloima translokaatio PM:ään osoitettiin L6-myoblasteissa ja erilaistuneissa myotubeissa, jotka ilmentävät vakaasti kalan GLUT4-transportteria . Näin ollen kalojen GLUT4:n homologien osoitettiin olevan insuliiniin reagoivia nisäkkäiden vastineensa tavoin huolimatta niiden korkeammasta PM-lokalisaatiosta vakaassa tilassa.
Kuten aiemmin mainittiin, nisäkkäiden GLUT4 jakautuu solujen sisällä kahteen tärkeimpään varastointikompartimenttiin, IRC:hen ja endosomaaliseen järjestelmään . Mielenkiintoista oli, että btGLUT4 osoitti vain osittaista yhteislokalisaatiota rotan GLUT4:n kanssa, kun molempia ekspressoitiin yhdessä joko 3T3-L1-rasvasoluissa tai L6-lihassoluissa . Tämä havainto yhdessä sen tosiasian kanssa, että btGLUT4 osoitti alhaisempaa retentioastetta solunsisäisissä osastoissa perusolosuhteissa, vaikka se reagoi edelleen insuliinistimulaatioon molemmissa solutyypeissä , viittasi siihen, että btGLUT4 jakautuu tasaisesti erikoistuneen IRC:n ja endosomaalisen osaston välillä, josta se kiertää jatkuvasti PM:n kanssa. Lisäksi sekä 3T3-L1-adiposyyteissä että L6-lihassoluissa btGLUT4:lle havaittujen korkeampien PM-tasojen osoitettiin johtuvan pikemminkin nopeammasta ulkoistumisnopeudesta kuin endosytoosin nopeuden vähenemisestä .
Nisäkkäillä on kuvattu useita proteiineja, jotka ovat vuorovaikutuksessa GLUT4:n kanssa säätelemässä sen solunsisäistä liikennettä ja ylläpitämässä IRC:ssä eristettyjä proteiineja. Esimerkiksi Golgi-lokalisoituneen γ-korvan sisältävän Arf-sitovan proteiinin (GGA) on kuvattu toimivan hiljattain syntetisoidun GLUT4:n liikenteen ohjaajana TGN:stä IRC:hen . Tässä vaiheessa myös sortiliinilla on kuvattu olevan keskeinen rooli, sillä GLUT4 ei sisällä spesifistä kohdistusmotiivia, jotta GGA tunnistaisi sen rahtimolekyylinä . Viime aikoina on osoitettu, että insuliinin säätelemällä aminopeptidaasilla (IRAP), joka lokalisoituu yhdessä GLUT4:n kanssa solunsisäisiin vesikkeleihin, on merkitystä GLUT4:n lajittelussa endosomeista IRC:hen . Lisäksi TUG (tether containing a UBX domain for GLUT4) -nimisen proteiinin on raportoitu olevan vuorovaikutuksessa suuren solunsisäisen GLUT4-silmukan kanssa, joka sijaitsee TMVI:n ja TMVII:n välissä, ja sitovan GLUT4:n solunsisäisiin vesikkeleihin vuorovaikutuksen kautta UBX-domeeninsa kautta solukalvojen kanssa . Useiden GLUT4:n kanssa vuorovaikutuksessa olevien proteiinien mahdollista roolia kalojen GLUT4-isoformien liikenteen säätelyssä on tutkittu 3T3-L1-rasvasoluissa, jotka ilmentävät nisäkkäiden vastaavia ortologeja. Erityisesti adaptoriproteiini GGA:n on raportoitu osallistuvan GLUT4:n varhaisiin lajitteluvaiheisiin TGN:stä. Rotan GLUT4:n ilmentäminen 3T3-L1-rasvasoluissa yhdessä villityyppisen GGA:n tai GGA:n dominoivan häiritsevän muodon (GGA-DN) kanssa osoitti, että GGA:ta tarvitaan GLUT4:n pääsemiseksi IRC:hen, koska rotan GLUT4:n insuliinin stimuloima translokaatio PM:ään tyrehtyi täysin GGA-DN:n läsnä ollessa. Mielenkiintoista oli, että btGLUT4:n ja okGLUT4:n solunsisäinen liikenne 3T3-L1-rasvasoluissa osoitti eroja niiden herkkyydessä GGA:lle, koska btGLUT4:n liikenne PM:ään joko perus- tai insuliinistimuloitujen olosuhteiden vallitessa tukahdutettiin vain osittain samanaikaisella ilmentämisellä GGA-DN:n kanssa, kun taas okGLUT4:llä ilmeni samanlainen vaste kuin rotan GLUT4:llä . Nämä tulokset viittasivat siihen, että okGLUT4 saattaa liikkua rasvasoluissa samaa reittiä kuin nisäkkäiden GLUT4, mutta että btGLUT4 saattaa osittain välttää säännellyn biosynteettisen liikennereitin ja siirtyä PM:ään GGA:sta riippumatonta reittiä pitkin. Koska btGLUT4:n ja rotan GLUT4:n solunsisäinen jakautuminen on erilainen, btGLUT4:n liikenne PM:ään voi tapahtua Glut1:n tai transferriinireseptorin käyttämää konstitutiivista reittiä pitkin (kuva 7). Tiedetään, että GLUT4 saa IRC:hen saavuttuaan kyvyn reagoida insuliiniin ja siirtyä PM:ään. Kun rotan GLUT4:ää koodaava plasmidi transfektoidaan 3T3-L1-rasvasoluihin, solut tarvitsevat 6-9 tuntia tuottaakseen uuden proteiinin ja kohdistaakseen sen IRC:hen. Sitä vastoin sekä okGLUT4 että btGLUT4, kun ne ilmentyvät samassa solujärjestelmässä, kokevat insuliinin stimuloiman translokaation vain 3 tuntia transfektion jälkeen, mikä viittaa siihen, että kalojen GLUT4:n synteesi, prosessointi tai liikenne on nopeampaa. Mielenkiintoista on, että okGLUT4 osoitti ajallista vastetta, joka oli rotan GLUT4:n ja btGLUT4:n välimaastossa, mutta lähempänä jälkimmäistä, huolimatta siitä, että se osoitti samanlaista herkkyyttä GGA:lle kuin nisäkkäiden GLUT4.
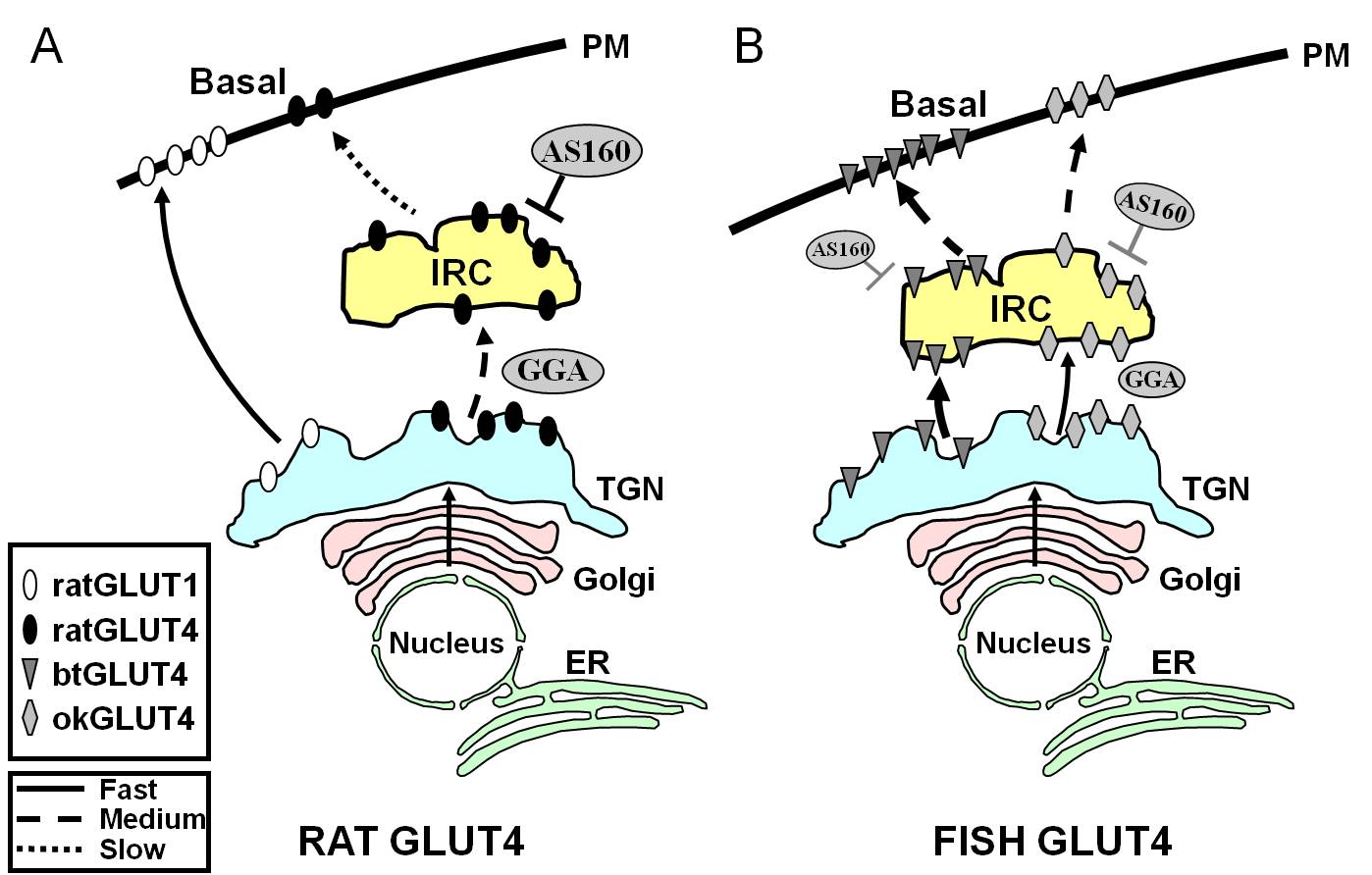
Kuvio 7.
Kaavamainen malli, joka havainnollistaa eroja kalojen GLUT4:ien ja rotan GLUT4:n ja Glut1:n välisessä liikenteessä pohjatilan aikana rasvasoluissa. Kuviossa (A) on esitetty rotan vastasyntetisoidun GLUT4:n liikenne Golgin ja trans-Golgi-verkoston (TGN) kautta insuliiniin reagoivaan lokeroon (IRC) lajitteluprosessissa, joka on riippuvainen adaptoriproteiini GGA:sta. Perustilassa rotan GLUT4 sekvestroituu pääasiassa IRC:hen, ja tätä prosessia säätelee AS160 ja se edellyttää GLUT4:n F5QQQI8-aminoterminaalista motiivia. Sitä vastoin biosynteesin jälkeen Glut1 kulkee suoraan TGN:stä plasmakalvoon (PM) GGA:sta riippumattomassa prosessissa. Kuviossa (B) on esitetty vastasyntetisoidun taimenen (btGLUT4) tai lohen (okGLUT4) GLUT4:n liikenne. Oletamme, että btGLUT4:n korkeat tasot PM:ssä näyttävät johtuvan lisääntyneestä eksosytoosinopeudesta, joka johtuu siitä, että btGLUT4 kulkee GGA:sta riippumatonta reittiä TGN:stä IRC:hen, ja siitä, että se osoittaa vähemmän AS160:n säätelemää sekvestoitumista IRC:ssä kuin rotan GLUT4. Oletamme, että btGLUT4:n erilainen kulkeutumiskäyttäytyminen voi liittyä sen N-terminaalisen motiivin (F5QHL8) erilaiseen sekvenssiin. okGLUT4:n (F5QQL8) liikennekäyttäytyminen näyttää olevan rotan GLUT4:n ja btGLUT4:n liikennekäyttäytymisen välimuoto. ER: endoplasminen retikulum.
Kuten aiemmin kohdassa 3 mainittiin, nisäkkäiden GLUT4:ssä esiintyvistä erilaisista säätelyaminohappomotiiveista N-terminaalissa oleva F5QQI8-kohdistusmotiivi on osoittautunut tärkeäksi GLUT4:n sekventoitumiselle IRC:hen ja insuliinin stimuloimalle translokaatiolle PM:ään . Sen lisäksi, että molemmilla kalojen GLUT4-transportaattoreilla on lyhyempi N-terminaalinen domeeni, on mielenkiintoista, että F5QQI8-motiivissa on yksi konservoitunut aminohapposubstituutio okGLUT4:ssä (F5QQL8) ja vähemmän konservoitunut btGLUT4:ssä (F5QHL8), jossa kahden jäännöksen substituutio aiheuttaa merkittäviä koko- ja varaustason muutoksia (kuva 8A). Tutkittiin mahdollisuutta, että nämä sekvensserierot voisivat selittää btGLUT4:n osalta havaitut lisääntyneet solunpinnan basaalitasot (Capilla ja Planas, julkaisemattomat tiedot). Kuvasta 8B nähdään, että btGLUT4:n motiivin F5QHL8 mutaatio F5QQQI8:ksi aiheutti vähäisen laskun PM:n perustasoissa; motiivin F5QHL8 mutaatio F5QQL8:ksi vähensi kuitenkin merkittävästi btGLUT4:n solunpinnan tasoja tasoille, jotka olivat vertailukelpoisia okGLUT4:n tai nisäkkäiden GLUT4:n tasoihin. Nämä tulokset osoittavat, että tietyt aminohappomotiivit sekä molekyylin taittuminen näyttävät olevan tärkeitä sille, että GLUT4-molekyylin solunsisäiset domeenit ovat vuorovaikutuksessa eri säätelyproteiinien kanssa asianmukaista liikennettä ja spesifistä lokalisaatiota ja/tai säilymistä varten.
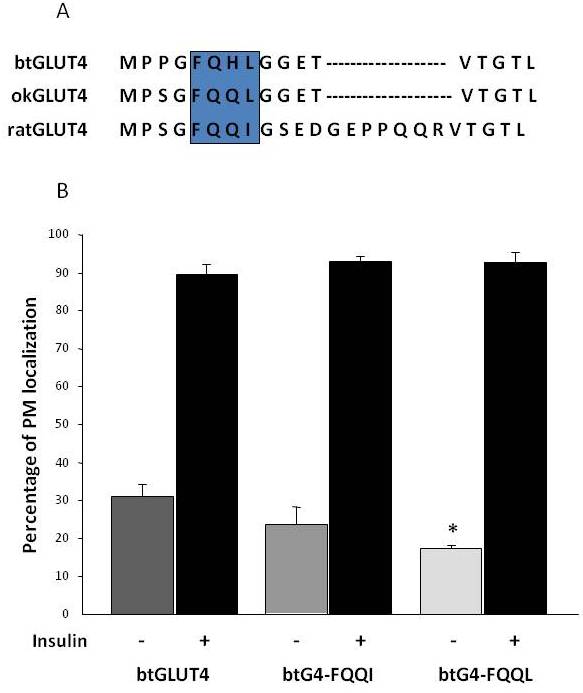
Kuvio 8.
BtGLUT4:n kohonneita solunpintatasoja vähennetään mutantoimalla motiivi F5QHL8. (A) Rotan, kirjolohen (btGLUT4, AF247395) ja koholohen (okGLUT4, AF502957) GLUT4-molekyylien N-terminaalisen alueen aminohapposekvenssikohdistus. Laatikko sulkee sisäänsä tärkeän kuljetusmotiivin F5QQI8, joka on osittain konservoitunut kalalajeissa. (B) Differentioituneita 3T3-L1-rasvasoluja, jotka ilmentävät joko btGLUT4:ää tai jotakin kahdesta pistemutaatiosta (btGLUT4-FQQI tai btGLUT4-FQQL), inkuboitiin insuliinin kanssa tai ilman insuliinia (100 nM, 30 min). Tiedot esitetään niiden solujen prosenttiosuutena (keskiarvo ± SEM), joissa on täydellinen plasmakalvon (PM) reunus, joka on saatu laskemalla 100 solua olosuhdetta kohti 3 riippumattomassa kokeessa. Tilastollinen analyysi suoritettiin parittomalla t-testillä verrattuna villityypin btGLUT4:ään vastaavasti perusolosuhteissa tai insuliinin stimuloimissa olosuhteissa (* tarkoittaa merkitsevyyttä p < 0,05).
Nisäkkäillä tehty aiempi tutkimus, jossa käytettiin GLUT4:n ja Glut1:n välisiä kimeerejä, osoitti, että Glut1:n N-terminaalin ja solunsisäisen silmukan korvaaminen GLUT4:n N-terminaalilla ja solunsisäisellä silmukalla riittää antamaan kimeeriselle Glut1-proteiinille GLUT4:n ominaispiirteet 3T3-L1-rasvasoluissa . Näin ollen niiden proteiinidomeenien tunnistamiseksi taimen GLUT4:ssä, jotka antavat sille erityiset liikenneominaisuudet (eli alhaisempi solunsisäinen retentio; korkeammat PM-pitoisuudet perusolosuhteissa), luotiin kimeerisiä proteiineja, joilla on btGLUT4:n N-terminaali (btN) tai solunsisäinen silmukka (btL) rotan GLUT4-selkärangassa, ja ne nimettiin btN-GLUT4:ksi tai btL-GLUT4:ksi. Nämä konstruktiot ekspressoitiin sitten stabiilisti 3T3-L1-soluissa ja analysoitiin niiden kykyä pysyä sytosolissa perusolosuhteissa ja reagoida insuliiniin (Simoes, Planas ja Camps, julkaisemattomat tulokset). Saadut tulokset osoittivat, että kaikki konstruktiot pystyivät siirtymään PM:ään insuliinin vaikutuksesta, mutta niissä oli tiettyjä eroja (kuva 9). Ensinnäkin btGLUT4:n insuliinin stimuloima translokaatio oli pienempi kuin rotan GLUT4:n. Toiseksi btN-GLUT4:llä oli heikoin vaste insuliinille, mikä viittaa siihen, että N-terminaalilla on merkitystä GLUT4:n oikeassa kohdentumisessa IRC:hen tai GLUT4:n translokaatiossa PM:ään. Kolmanneksi sytoplasmisilmukan korvaaminen btL-GLUT4:ssä vähensi rotan GLUT4:n vastetta insuliinille vastaavalla tavalla kuin btGLUT4:n. Nämä alustavat tulokset tukevat ajatusta, että GLUT4:n N-terminaali ja sytoplasminen silmukka ovat vastuussa osasta btGLUT4:n ja rotan GLUT4:n välisiä kulkeutumiseroja.
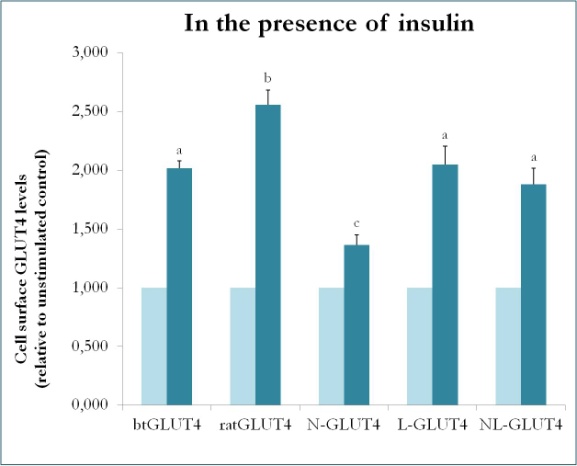
Kuva 9.
Eri GLUT4-konstruktioiden solunpinnan tasot eri GLUT4-konstruktioissa insuliinin läsnä ollessa. N-GLUT4 ja L-GLUT4 edustavat konstruktioita, joissa on btGLUT4:n aminoterminaali (N) tai solunsisäinen silmukka (L) rotan GLUT4-selkärangassa. Eri GLUT4-konstruktioita ilmentäviä erilaistuneita 3T3-L1-adiposyyttejä inkuboitiin insuliinin (100nM) puuttuessa tai läsnä ollessa 30 minuutin ajan, ja pinnan GLUT4-tasojen määrittäminen suoritettiin kohdassa kuvatulla tavalla. Solun pinnan GLUT4 on ilmaistu suhteessa kunkin solulinjan stimuloimattomaan kontrolliin. Eri kirjaimet merkitsevät tilastollisesti merkitseviä eroja (p < 0,05).
Insuliinistimulaation jälkeen nisäkkäiden GLUT4 kulkee ja fuusioituu PM:n kanssa lisäten sen läsnäoloa solun pinnalla jopa 10-kertaiseksi; näin se tukee ruokinnan jälkeen havaittua glukoosinoton lisääntymistä. Insuliini lisää kuljettajien määrää PM:ssä paitsi tehostamalla eksosytoosia myös vähentämällä endosytoosin nopeutta . Insuliini vaikuttaa kahden erilaisen solunsisäisen signaalireitin kautta . Ensimmäinen on tunnettu fosfatidyyliinositoli-3-kinaasi (PI3K)/proteiinikinaasi B (PKB) -reitti, joka tunnetaan myös nimellä Akt ja joka on välttämätön GLUT4:n translokaation tapahtumiselle, mutta ei riittävä . Toinen reitti on reitti, johon kuuluu Cbl-assosioitunut proteiini (CAP), joka sitoutuu insuliinireseptoriin ja aktivoi pienen GTPaasin, joka kuuluu Rho-perheeseen ja jonka nimi on TC10, ja joka on kuvattu adiposyyteissä . TC10-reitti ei kuitenkaan näytä olevan osallisena lihassoluissa, joissa toisen Akt-riippumattoman tulon osoitettiin edistävän sytoskeletin uudelleenmuokkausta, jota tarvitaan täydelliseen GLUT4-translokaatioon . Aktin alapuolella olevan proteiinin, jonka nimi on 160 KDa:n Akt-substraatti (AS160) tai TCB1D4, on todettu olevan avain insuliinin käynnistämän fosforylaatiokaskadin välittämiseen vesikkelien kuljetuskoneiston kanssa. AS160:ssä on 6 treoniini-/seriinijäämää, jotka voidaan fosforyloida sen aktiivisuuden estämiseksi, ja se sisältää GTPaasia aktivoivan proteiinin (GAP) domeenin, joka perustilassa inaktivoi useita Rab-proteiineja, jotka ovat Ras-superperheeseen kuuluvia pieniä GTPaaseja, jotka ovat vastuussa kalvojen kuljettamisesta . Aktin suorittama AS160:n fosforylaatio estää sen GAP-aktiivisuuden, mikä mahdollistaa Rab-proteiinien aktivoitumisen ja aiheuttaa siten GLUT4:n translokaation PM:ään . Nisäkkäillä GLUT4:n kulkeutumisesta vastuussa oleviksi Rab-proteiinien jäseniksi on tunnistettu Rab8a, Rab10 ja Rab14 . Sen lisäksi, että AS160 säätelee GLUT4-vesikkelien liikkumista, sen on osoitettu olevan välttämätön, jotta GLUT4 pysyy täysin IRC:ssä . Sen osoittamiseksi, että AS160:n fosforylaatio on kriittinen GLUT4:n translokaatiolle nisäkkäissä, luotiin AS160:n dominoiva inhiboiva muoto muuntamalla neljä sen kuudesta fosforylaatiokohdasta (AS160-4P) . Kun sitä ekspressoitiin solujärjestelmässä yhdessä rotan GLUT4:n kanssa, tämän molekyylin translokaatio PM:ään estyi, samoin kuin insuliini-inkubaation jälkeen havaittu glukoosinoton lisääntyminen . Niiden herkkyydessä AS160-4P:lle havaittiin selviä eroja okGLUT4:n ja btGLUT4:n välillä, sillä ensin mainitulla oli samanlaiset ominaisuudet kuin nisäkkäiden GLUT4:llä ja jälkimmäisellä ei ollut vaikutusta . Nämä tulokset olivat sopusoinnussa kalojen GLUT4-proteiinien välillä havaittujen erojen kanssa niiden solunsisäisen pidättymisen suhteen, ja ne tukevat hypoteesia, jonka mukaan AS160 voi sitoa okGLUT4:n, mutta ei btGLUT4:ää, IRC:ssä ja että btGLUT4 voi olla laajemmin jakautunut solun sisällä kuin muut GLUT4:n kuljettajat. Lisäksi, koska btGLUT4:stä saadut tulokset AS160-herkkyyttä kohtaan olivat yhtäpitäviä aiemmin GLUT4-F5A-mutantille raportoitujen tulosten kanssa, btGLUT4:n nopeamman eksosytointinopeuden ehdotettiin johtuvan konservoidun FQQI-motiivin puuttumisesta.
Yhteenvetona voidaan todeta, että tutkimalla kahden kalan GLUT4-proteiinin (btGLUT4 ja okGLUT4) kulkeutumisominaisuuksia verrattuna nisäkkäiden GLUT4:ään ja Glut1:een on selvää, että näiden kuljettajien välillä on merkittäviä eroja (kuva 7). Tässä suhteessa okGLUT4 käyttäytyy monilta osin samoin kuin nisäkkäiden GLUT4, koska se on herkkä GGA:lle ja AS160:lle, mikä tukee näiden molekyylien roolia de novo syntetisoidun okGLUT4:n liikenteen säätelyssä TGN:stä IRC:hen ja TGN:stä PM:ään insuliinin vaikutuksesta. Sitä vastoin btGLUT4 näyttää olevan vähemmän säännelty, sillä se kulkeutuu IRC:hen GGA:sta riippumatta, pysyy IRC:ssä ja poistuu PM:ään vain osittain AS160:n ohjaamana; näin ollen se liikkuu kohti solun pintaa mahdollisesti osittain konstitutiivista reittiä, kuten Glut1:n käyttämä reitti.
Leave a Reply