Strukturel og funktionel udvikling af glukosetransporter 4 (GLUT4): Et kig på GLUT4 i fisk
Regulering af trafikken af fisk GLUT4
I pattedyr er det vigtigste træk, der karakteriserer GLUT4 i skeletmuskulatur og fedtvæv og gør det unikt, dets evne til at translokere til PM som reaktion på insulin . Dette øger i høj grad cellernes kapacitet til at optage glukose under den postprandiale tilstand, hvilket er afgørende for korrekt opretholdelse af glukosehomeostase. Ikke desto mindre tyder beviser i pattedyrceller klart på, at GLUT4 i basaltilstand ikke er statisk; i stedet cirkulerer GLUT4 mellem talrige intracellulære rum, såsom trans-Golgi-netværket (TGN), tidlige og sene endosomer, et specialiseret insulinresponsivt rum (IRC) samt PM . Mængden af GLUT4, der er til stede i PM i basal tilstand, svarer kun til ca. 5-10 % af det samlede GLUT4-protein, mens de resterende 90-95 % er bundet intracellulært i IRC-kompartmentet .
Den intracellulære trafikeringskarakteristik af de to glukosetransportører, der er identificeret hos laksefisk (btGLUT4 og okGLUT4), er blevet undersøgt i sammenligning med GLUT4 fra pattedyr, hovedsagelig når det udtrykkes i heterologe systemer (adipocytære eller myoblastiske cellelinjer fra pattedyr), men også som det endogene GLUT4 i primære dyrkede ørredmyocytter. I 3T3-L1 adipocytter, der transient udtrykker separat btGLUT4 eller okGLUT4 under steady-state forhold, udviste btGLUT4 signifikant højere proteinniveauer ved PM (30-40%), også okGLUT4, men i mindre grad (15-20%), end rotte GLUT4 (10-15%) . Dette blev ikke kun observeret i adipocytter, da btGLUT4 også var til stede i PM i højere grad (20-25 %) end rotte-GLUT4 (10-15 %), når det blev stabilt udtrykt i L6-muskelceller . Det er vigtigt, at den basale lokalisering af endogent GLUT4 ved PM i ørredmyocytter i kultur også var relativt høj . Derfor synes fisk GLUT4 under basale eller ustimulerede forhold at blive mindre effektivt tilbageholdt i cytosolen i adipocytter og myocytter end GLUT4 fra pattedyr, hvilket tyder på forskelle i de mekanismer, der er ansvarlige for den intracellulære tilbageholdelse af GLUT4 mellem fisk og pattedyr (se nedenfor). Endvidere er det på baggrund af de observerede forskelle i PM-lokalisering mellem fisk GLUT4s under basale forhold, hvor okGLUT4 ligner sine pattedyrmodstykker mere end btGLUT4, blevet foreslået, at den forskellige trafikadfærd for disse to fisk GLUT4-proteinvarianter kan være relateret til forskelle i karakteristiske regulatoriske træk i GLUT4-proteinsekvensen (i.dvs. N- og C-terminale proteinmotiver) (se afsnit 3; ).
Der er desuden også blevet undersøgt, om fisk GLUT4’s evne til at reagere på insulin er blevet evalueret. De første undersøgelser, der forsøgte at påvise, at en fisk GLUT4 translokaliserer til PM ved insulinstimulering, blev udført i Xenopusoocytter . Ikke desto mindre var systemet ikke egnet til at undersøge translokationen af GLUT4, og oocytter, der udtrykker okGLUT4 eller en rotte-GLUT4, viste ikke forskelle i transportørlokaliseringen i cellen som reaktion på insulin . I stedet blev 3T3-L1 adipocytcellesystemet anvendt med succes til at påvise, at både okGLUT4 og btGLUT4 var i stand til at translokalisere signifikant til PM efter insulinbehandling , som det sker i pattedyr. Desuden blev insulinstimuleret translokation til PM af btGLUT4 påvist i L6-myoblaster og differentierede myotuber, der stabilt udtrykker fisk GLUT4-transporteren . Derfor blev fiskens homologer af GLUT4 vist at være insulinresponsive ligesom deres pattedyrs modstykke, på trods af deres højere PM-lokalisering ved steady-state.
Som tidligere nævnt er GLUT4 hos pattedyr distribueret inde i cellerne i to store opbevaringsrum, IRC og det endosomale system . Interessant nok viste btGLUT4 kun delvis samlokalisering med rotte GLUT4, når begge blev sameksprimeret enten i 3T3-L1 adipocytter eller i L6 muskelceller . Denne observation, sammen med det faktum, at btGLUT4 viste lavere niveauer af retention i intracellulære kompartmenter under basale forhold, selv om det stadig reagerede på insulinstimulering i begge celletyper , antydede, at btGLUT4 er ligeligt fordelt mellem det specialiserede IRC og det endosomale kompartment, hvorfra det cirkulerer kontinuerligt med PM . Desuden blev det både i 3T3-L1 adipocytter og L6 muskelceller vist, at de højere PM-niveauer, der blev observeret for btGLUT4, skyldes en hurtigere eksternaliseringshastighed snarere end et fald i endocytosehastigheden .
I pattedyr er flere proteiner blevet beskrevet for at interagere med GLUT4 for at regulere dens intracellulære trafik og for at opretholde de proteiner, der er sequesteret i IRC’en. For eksempel er det Golgi-lokaliserede γ-øre-holdige Arf-bindende protein (GGA) blevet beskrevet til at fungere som en trafikregulator af nysyntetiseret GLUT4 fra TGN til IRC . I dette trin er sortilin også blevet beskrevet som havende en nøglerolle, da GLUT4 ikke indeholder det specifikke målmotiv til at blive genkendt af GGA som et fragtmolekyle . For nylig er den insulinregulerede aminopeptidase (IRAP), som samlokaliseres med GLUT4 i intracellulære vesikler, blevet vist at spille en rolle i sorteringen af GLUT4 fra endosomer til IRC . Desuden er der rapporteret om et protein ved navn TUG (tether containing a UBX domain for GLUT4), som interagerer med den store intracellulære GLUT4-loop, der findes mellem TMVI og TMVII, og som binder GLUT4 til intracellulære vesikler gennem sin interaktion via sit UBX-domæne med cellemembraner . De mulige roller, som flere GLUT4-interagerende proteiner spiller i reguleringen af trafikken af fiskens GLUT4-isoformer, er blevet undersøgt i 3T3-L1 adipocytter, der udtrykker de tilsvarende ortologer fra pattedyr. Især adaptorproteinet GGA er blevet rapporteret som værende involveret i de tidlige sorteringstrin af GLUT4 fra TGN. Ekspression i 3T3-L1 adipocytter af rotte-GLUT4 sammen med wild-type GGA eller en dominerende interfererende form af GGA (GGA-DN) viste, at GGA er påkrævet for at GLUT4 kan nå IRC, fordi den insulinstimulerede translokation af rotte-GLUT4 til PM blev fuldstændig afstumpet i tilstedeværelse af GGA-DN . Interessant nok viste den intracellulære trafik af btGLUT4 og okGLUT4 i 3T3-L1 adipocytter forskelle med hensyn til deres følsomhed over for GGA, fordi trafikken af btGLUT4 til PM enten under basale eller insulinstimulerede forhold kun blev delvist undertrykt ved samekspression med GGA-DN, mens okGLUT4 viste et identisk respons som rotte-GLUT4 . Disse resultater tyder på, at okGLUT4 kan bevæge sig i adipocytter ad den samme vej som GLUT4 fra pattedyr, men at btGLUT4 til dels kan undslippe den regulerede biosyntetiske trafikrute og bevæge sig til PM ad en GGA-uafhængig vej. I overensstemmelse med den forskellige intracellulære fordeling, der er observeret mellem btGLUT4 og rotte-GLUT4 , kan trafikken af btGLUT4 til PM foregå via den konstitutive vej, der anvendes af Glut1 eller transferrinreceptoren (figur 7). Det er kendt, at GLUT4, når det ankommer til IRC, får evnen til at reagere på insulin og translokalisere til PM. Når et plasmid, der koder for GLUT4 fra rotte, transficeres til 3T3-L1 adipocytter, har cellerne brug for 6-9 timer til at producere det nye protein og til at målrette det til IRC . I modsætning hertil gennemgår både okGLUT4 og btGLUT4, når de udtrykkes i det samme cellesystem, insulinstimuleret translokation kun 3 timer efter transfektion , hvilket tyder på, at fisk GLUT4 gennemgår en hurtigere syntese, forarbejdning eller trafik. Interessant nok viste okGLUT4 et tidsmæssigt respons, der lå mellem rotte GLUT4 og btGLUT4, men tættere på sidstnævnte, til trods for at det viste en lignende følsomhed over for GGA som pattedyr GLUT4.
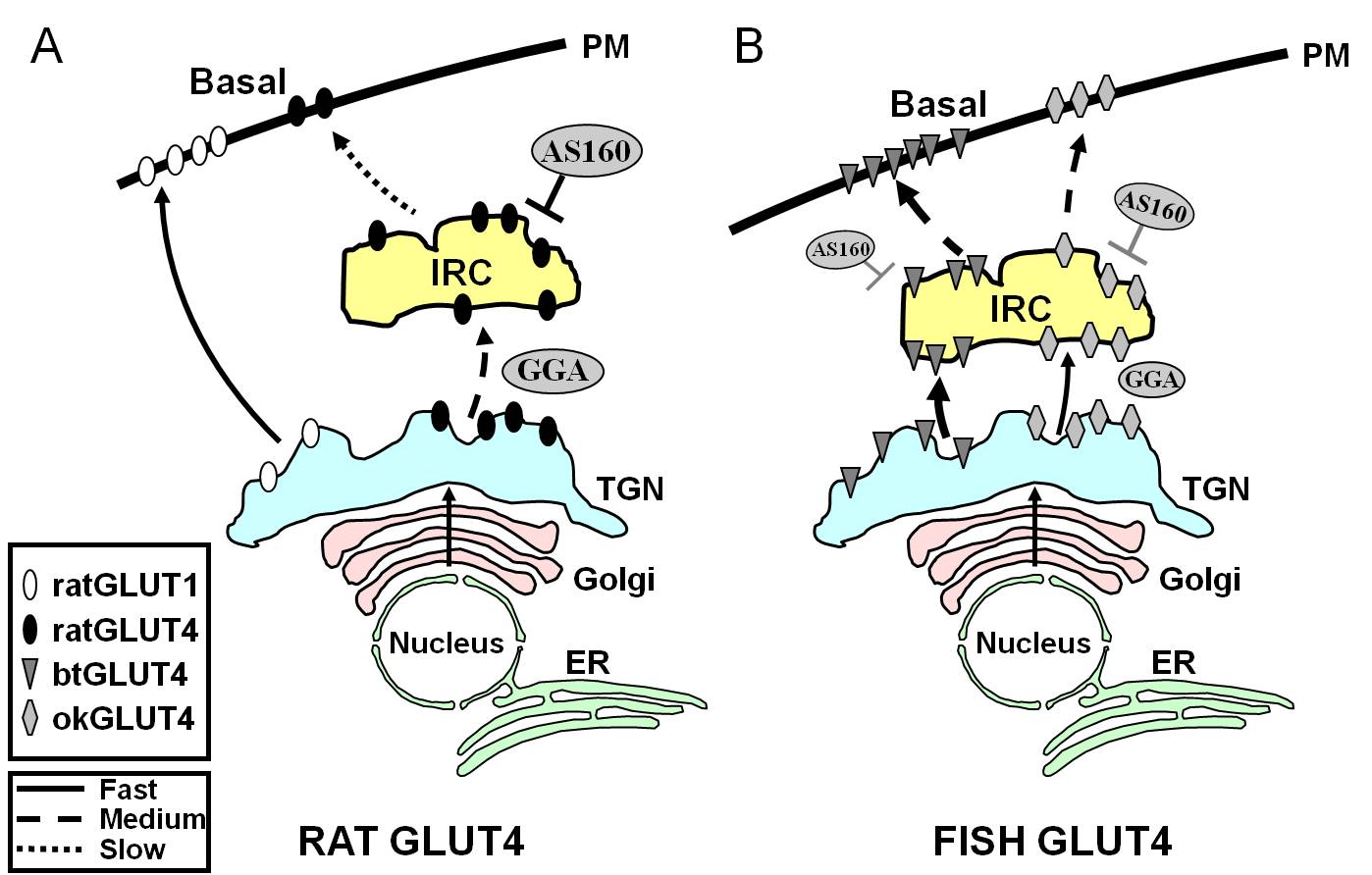
Figur 7.
Skematisk model, der illustrerer forskelle i trafikken mellem fisk GLUT4s og rotte GLUT4 og Glut1 under basaltilstand i adipocytter. I (A) vises trafikken af nyligt syntetiseret rotte-GLUT4, der foregår gennem Golgi og det trans-Golgi-netværk (TGN) og ind i det insulinresponsive kompartment (IRC) i en sorteringsproces, der er afhængig af adaptorproteinet GGA. I basaltilstand er GLUT4 fra rotter hovedsageligt sequesteret i IRC, en proces, der reguleres af AS160, og som kræver GLUT4’s F5QQQI8-aminoterminale motiv. Efter biosyntesen bevæger Glut1 sig derimod direkte fra TGN til plasmamembranen (PM) i en GGA-uafhængig proces efter biosyntesen. I (B) er trafikken af nysyntetiseret GLUT4 fra ørred (btGLUT4) eller laks (okGLUT4) vist. Vi postulerer, at de høje niveauer af btGLUT4 ved PM synes at skyldes en øget exocytisk hastighed som følge af, at btGLUT4 følger en GGA-uafhængig rute fra TGN til IRC og ved at udvise mindre AS160-reguleret sekventering ved IRC end GLUT4 fra rotter. Vi stiller den hypotese, at btGLUT4’s forskellige trafikadfærd kan være relateret til den forskellige sekvens i dens N-terminale motiv (F5QHL8). Trafikadfærden for okGLUT4 (F5QQL8) synes at være mellem okGLUT4’s og btGLUT4’s trafikadfærd mellem rotte-GLUT4 og btGLUT4. ER: endoplasmatisk retikulum.
Som tidligere nævnt i afsnit 3 er det blandt de forskellige regulerende aminosyremotiver, der findes i GLUT4 hos pattedyr, blevet vist, at F5QQQI8-målmotivet i N-terminus er vigtigt for GLUT4-sekestrering i IRC og insulinstimuleret translokation til PM . Interessant er det, at ud over det faktum, at begge fisk GLUT4-transportører har et kortere N-terminalt domæne, viser F5QQQI8-motivet en konserveret aminosyresubstitution i okGLUT4 (F5QQL8), og det er mindre konserveret i btGLUT4 (F5QHL8), hvor den dobbelte restsubstitution forårsager vigtige størrelses- og ladningsændringer (Figur 8A). Muligheden for, at disse sekvensforskelle kunne forklare de øgede basale celleoverfladeniveauer, der blev observeret for btGLUT4, blev undersøgt (Capilla og Planas, upublicerede data). Figur 8B viser, at mutation af btGLUT4-motivet F5QHL8 til F5QQQI8 forårsagede et lille fald i basale PM-niveauer; mutation af F5QHL8-motivet til F5QQL8 reducerede imidlertid markant celleoverfladeniveauerne af btGLUT4 til niveauer, der kan sammenlignes med okGLUT4 eller pattedyrs GLUT4. Disse resultater tyder på, at specifikke aminosyremotiver samt molekylets foldning synes at være vigtige for, at GLUT4-molekylets intracellulære domæner interagerer med de forskellige regulerende proteiner med henblik på korrekt trafik og specifik kompartmentlokalisering og/eller tilbageholdelse.
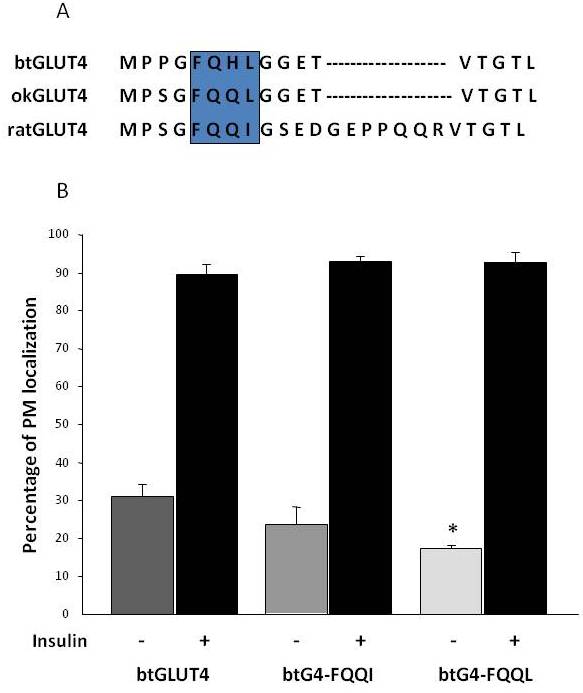
Figur 8.
De forhøjede basale celleoverfladeniveauer af btGLUT4 reduceres ved at mutere F5QHL8-motivet. (A) Aminosyresekvensudligning af den N-terminale region af GLUT4-molekyler fra rotte, brun ørred (btGLUT4, AF247395) og coho laks (okGLUT4, AF502957). Boksen omslutter det vigtige trafikmønster F5QQQI8, der er delvist bevaret i fiskearterne. (B) Differentierede 3T3-L1 adipocytter, der udtrykker enten btGLUT4 eller en af de to punktmutanter (btGLUT4-FQQQI eller btGLUT4-FQQL), blev inkuberet med eller uden insulin (100 nM, 30 min). Dataene præsenteres som procentdel (gennemsnit ± SEM) af celler, der viser en komplet plasmamembran (PM)-rand, opnået ved at tælle 100 celler pr. tilstand i 3 uafhængige eksperimenter. Statistisk analyse blev udført ved uparret t-test i forhold til den vilde type btGLUT4 ved henholdsvis basale eller insulinstimulerede forhold (* angiver signifikans ved p < 0,05).
En tidligere undersøgelse hos pattedyr ved hjælp af kimærer mellem GLUT4 og Glut1 viste, at det er tilstrækkeligt at erstatte N-terminus og den intracellulære loop af Glut1 med dem af GLUT4 for at give det kimære Glut1-protein egenskaberne af GLUT4 i 3T3-L1 adipocytter . For at identificere de proteindomæner i GLUT4 i ørred, der giver den særlige trafikkarakteristika (dvs. lavere intracellulær retention; højere PM-niveauer under basale forhold), blev der således skabt kimære proteiner med N-terminus (btN) eller den intracellulære løkke (btL) af btGLUT4 i en GLUT4-ryggekasse af rotte, og de blev kaldt henholdsvis btN-GLUT4 eller btL-GLUT4. Disse konstruktioner blev derefter stabilt udtrykt i 3T3-L1-celler, og deres evne til at blive tilbageholdt i cytosolen under basale forhold og til at reagere på insulin blev analyseret (Simoes, Planas og Camps, upublicerede resultater). De opnåede resultater viste, at alle konstruktioner var i stand til at translokere til PM som reaktion på insulin, men med visse forskelle mellem dem (figur 9). For det første var den insulinstimulerede translokation af btGLUT4 lavere end translokationen af GLUT4 fra rotte. For det andet havde btN-GLUT4 det svageste respons på insulin, hvilket tyder på en rolle for N-terminus i den korrekte målretning af GLUT4 til IRC eller i translokationen af GLUT4 til PM. For det tredje forårsagede substitutionen af den cytoplasmatiske loop i btL-GLUT4 en reduktion i responsen af rotte-GLUT4 på insulin, der var sammenlignelig med btGLUT4’s respons. Disse foreløbige resultater understøtter ideen om, at N-terminus og den cytoplasmatiske loop af GLUT4 er ansvarlig for nogle af trafikeringsforskellene mellem btGLUT4 og rotte-GLUT4.
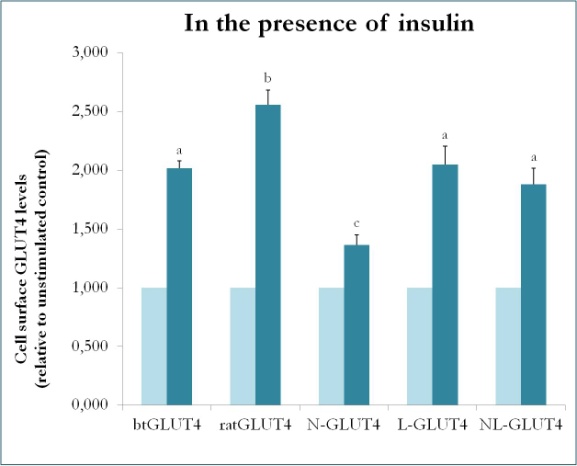
Figur 9.
Celleoverfladeniveauer af forskellige GLUT4-konstruktioner i nærvær af insulin. N-GLUT4 og L-GLUT4 repræsenterer konstruktioner med henholdsvis aminoterminus (N) eller den intracellulære loop (L) af btGLUT4 i en GLUT4-baggrundsstruktur fra rotter. Differentierede 3T3-L1 adipocytter, der udtrykker de forskellige GLUT4-konstruktioner, blev inkuberet i fravær eller tilstedeværelse af insulin (100nM) i 30 min, og bestemmelse af GLUT4-niveauer på overfladen blev udført som beskrevet i . Celleoverflade-GLUT4 er udtrykt i forhold til den ustimulerede kontrol for hver cellelinje. Forskellige bogstaver angiver statistisk signifikante forskelle (p < 0,05).
Følgende på insulinstimulering trafikerer og fusionerer pattedyrs GLUT4 med PM, hvilket øger dets tilstedeværelse i celleoverfladen op til 10 gange; hvilket understøtter den stigning i glukoseoptagelse, der er observeret efter fodring. Insulin øger antallet af transportører ved PM ikke kun ved at øge exocytose, men også ved at nedsætte endocytosehastigheden . Insulin udøver sine virkninger gennem to forskellige intracellulære signalveje . Den første er den velkendte vej for fosfatidylinositol-3-kinase (PI3K)/proteinkinase B (PKB), også kendt som Akt, som er nødvendig for at GLUT4-translokation kan finde sted, men ikke tilstrækkelig . Den anden vej er den, der omfatter det Cbl-associerede protein (CAP), som binder insulinreceptoren og aktiverer en lille GTPase fra Rho-familien ved navn TC10, og som blev beskrevet i adipocytter . TC10-vejen synes imidlertid ikke at være involveret i muskelceller, hvor et andet Akt-uafhængigt input blev vist at bidrage til den cytoskeletomdannelse, der er nødvendig for fuldstændig GLUT4-translokation . Nedstrøms Akt er et protein kaldet Akt substrat af 160 KDa (AS160) eller TCB1D4, blevet fundet for at være nøglen til at kommunikere fosforyleringskaskaden initieret af insulin med vesikel-trafikeringsmaskineriet . AS160 har 6 rester af threonin/serin, der kan fosforyleres for at hæmme dets aktivitet, og indeholder et GTPase-aktiverende proteindomæne (GAP), der i basal tilstand inaktiverer en række Rab-proteiner, små GTPaser fra Ras-superfamilien, der er ansvarlige for membrantrafikken . Phosphorylering af AS160 af Akt hæmmer dets GAP-aktivitet, hvilket giver mulighed for aktivering af Rab-proteinerne og dermed forårsager translokation af GLUT4 til PM . De Rab-medlemmer, der er identificeret som ansvarlige for GLUT4-trafikken hos pattedyr, er Rab8a, Rab10 og Rab14 . Ud over at regulere bevægelsen af GLUT4-vesikler er det blevet påvist, at AS160 er nødvendig for at fastholde GLUT4 fuldt ud i IRC . For at påvise, at AS160-fosforylering er afgørende for GLUT4-translokation hos pattedyr, blev der skabt en dominerende inhiberende form af AS160 ved at mutere 4 af de 6 fosforyleringssteder (AS160-4P) . Ved samekspression i et cellulært system sammen med GLUT4 fra rotter blev translokationen af dette molekyle til PM blokeret, ligesom den stigning i glukoseoptagelsen, der blev observeret efter insulininkubation, blev blokeret . Med hensyn til deres følsomhed over for AS160-4P blev der observeret klare forskelle mellem okGLUT4 og btGLUT4, idet førstnævnte viste lignende egenskaber som pattedyrs GLUT4, og sidstnævnte var upåvirket . Disse resultater er i overensstemmelse med de forskelle, der er observeret mellem de to GLUT4-proteiner fra fisk med hensyn til deres intracellulære retention, og de understøtter hypotesen om, at AS160 kan seponere okGLUT4, men ikke btGLUT4, i IRC, og at btGLUT4 kan være mere udbredt i cellen end de andre GLUT4-transportører. Da de opnåede resultater for btGLUT4 over for AS160-følsomhed desuden stemte overens med dem, der tidligere er rapporteret for en GLUT4-F5A-mutant , blev det foreslået, at den hurtigere exocytiske hastighed for btGLUT4 skyldtes manglen på et bevaret FQQI-motiv .
Sammenfattende er det ved at undersøge trafikken af de to fisk GLUT4-proteiner (btGLUT4 og okGLUT4) sammenlignet med pattedyrs GLUT4 og Glut1 klart, at der er vigtige forskelle mellem disse transportører (figur 7). I denne henseende opfører okGLUT4 sig i mange henseender på samme måde som pattedyrs GLUT4 på grund af dets følsomhed over for GGA og AS160; dette understøtter således en rolle for disse molekyler i reguleringen af trafikken af okGLUT4 syntetiseret de novo fra TGN til IRC og fra TGN til PM som reaktion på insulin. I modsætning hertil synes btGLUT4 at være mindre reguleret, idet det transporteres til IRC uafhængigt af GGA, ligesom det fastholdes i IRC og kun delvist udgår til PM under kontrol af AS160; derfor bevæger det sig mod celleoverfladen muligvis delvist gennem en konstitutiv vej som den, der anvendes af Glut1.
Leave a Reply