Perkutan kolecystostomi som behandling av akut kolecystit: Vad har hänt under de senaste fem åren? En litteraturöversikt | Revista de Gastroenterología de México
Introduktion
Gallblåspatologi är en av de vanligaste sjukdomarna som allmänläkaren ställs inför. För närvarande anses laparoskopisk kolecystektomi (LC) vara den gyllene standarden som behandling av akut kolecystit (AC). Man har försökt minska morbiditeten och mortaliteten i samband med ingreppet hos kirurgiska högriskpatienter genom mindre invasiva ingrepp, t.ex. perkutan kolecystostomi (PC).
AC är en inflammatorisk sjukdom i gallblåsan vars patofysiologi består av obstruktion av gallblåsans dräneringsvägar eller dysmotilitet i dess väggar, vilket villkorar en ökning av det intraluminala trycket, väggödem, förändrad vaskularitet med ischemi eller nekros, bakterieproliferation eller perforering av gallblåsan. Syftet med PC vid AC är att möjliggöra dränering av gallgången för att lösa de akuta symtomen och förhindra utvecklingen av lokala och systemiska komplikationer. PC är i allmänhet reserverad för patienter med AC som är kirurgiska högriskpatienter eller som uppvisar organsvikt. PC erbjuder användbara fördelar i det sammanhanget: allmän anestesi krävs inte, det kan utföras vid patientens säng, det är ett snabbt förfarande, dess framgångsfrekvens är över 95 %, det har en låg komplikationsfrekvens och det kan användas som överbryggande behandling före elektiv kirurgi.
Gallblåsedränering är ett behandlingsalternativ som ingår i de viktigaste internationella riktlinjerna för AC-behandling, men det finns fortfarande en viss kontrovers om dess resultat hos kritiskt sjuka patienter, dess exakta indikationer och dess överlägsenhet jämfört med definitiv kirurgisk behandling.
Det finns lite evidens om övervakning och vård av patienter som genomgår PC. Majoriteten av studierna fokuserar på urvalet av patienter som kommer att gynnas av ingreppet, men få beskriver den efterföljande patienthanteringen. Vi analyserar här bevisen för nyttan av PC vid AC och föreslår en algoritm för hantering av PC-kateter.
Kriterier för klassificering av svårighetsgraden av akut kolecystit
I 2018 års Tokyoriktlinjer (TG18) för AC klassificeras sjukdomens svårighetsgrad som lindrig (grad I), måttlig (grad II) och svår (grad III).1 Said klassificering tar hänsyn till patientens komorbiditeter, symtomlängd, fysiska fynd vid sjukhusintag, tecken på systemiskt inflammatoriskt svar, förekomst av markerad lokal inflammation i bildundersökningar och utveckling av organdysfunktion. TG-klassificeringen är användbar eftersom sjukdomspresentationens svårighetsgrad korrelerar med mortalitet, morbiditet, sjukhusvistelsens längd och graden av konvertering från laparoskopisk kirurgi till öppen kirurgi (tabellerna 1 och 2).
Klassificering av svårighetsgrad av akut kolecystit enligt Tokyoriktlinjerna från 2018.1
| Grad I (mild) | Grad II (måttlig) | Grad III (allvarlig) |
|---|---|---|
|
Ett av följande tillstånd:
|
Någon av följande organdysfunktioner:
|
Karakteristika för de olika svårighetsgraderna.
| Dödlighet vid 30 dagar2 | Morbiditet78 | Sjukhusvistelse78,a | Konverteringsgrad78,a | |
|---|---|---|---|---|
| Grad I | 1.1% | 2,9% | 3 (1-16) | 7% |
| Grad II | 0.8% | 3,1% | 4 (1-33) | 25,6% |
| Grad III | 5,4% | 11.1% | 7 (1-60) | 34,6% |
Medelvärde ±SD.
Förtida LC (inom 72 timmar) bör helst utföras vid AC av grad I och grad II, om Charlson comorbidity index (CCI) och funktionsförmåga enligt klassificeringssystemet från American Society of Anesthesiologists (ASA) tyder på att patienten kan tolerera operation. Tvärtom bör man inleda en första medicinsk behandling (antibiotika och allmänt stöd) och överväga kirurgisk behandling när förhållandena förbättras. Vid AC av grad II läggs rekommendationen att utföra perkutan dränering till när patienten inte kan tolerera kirurgisk behandling.1
I Tokyoriktlinjerna från 2013 (TG13) klassificeras AC som grad III när det finns tecken på organdysfunktion, vilket definieras när det finns kardiovaskulär, neurologisk, respiratorisk, njur-, lever- eller hematologisk insufficiens. Enligt TG13 är akut LC kontraindicerat om det finns dysfunktion i dessa organsystem. År 2017 gav dock Yokoe et al.2 information om behandlingen av AC i en japansk och taiwanesisk population (n=5 329), där LC framgångsrikt utfördes på en majoritet av patienterna med AC av grad III. Samma kohort analyserades senare på nytt, med tonvikt på de patienter med organdysfunktion som säkert kunde genomgå kirurgisk behandling. Patienterna med CCI>6 poäng uppvisade en högre dödlighet. Den huvudsakliga nyttan med den studien var dess multivariata logistiska regressionsanalys, som visade att gulsot, neurologisk dysfunktion och respiratorisk dysfunktion var oberoende prediktiva faktorer för mortalitet efter 30 dagar hos patienter med AC av grad III. Det fanns dock inga bevis för ökad dödlighet hos patienter med AC av grad III som uppvisade andra typer av organsvikt och som genomgick LC.3 TG18 definierar således neurologisk dysfunktion, respiratorisk dysfunktion eller förekomst av gulsot (totala bilirubinnivåer ≥ 2 mg/dl) som prediktiva faktorer för dödlighet vid AC av grad III. Å andra sidan anses njurdysfunktion och kardiovaskulär dysfunktion vara gynnsamma typer av organsvikt, med tanke på att de ofta kan vändas efter upprättandet av initial medicinsk behandling, och följaktligen inte kontraindicerar kirurgisk behandling.1
Indikationer för perkutan kolecystostomiplacering
I generella termer är den vanligaste indikationen för att placera en PC svår AC.4-9 Mindre vanliga indikationer är de indikationer vars syfte är att avleda gallvägarna med hjälp av transkollekystisk åtkomst, vilket anses vara relativt andrahandsalternativ i de flesta fall på grund av att man föredrar att utföra endoskopiska eller transhepatiska diversioner. Sistnämnda scenarier sammanfattas i tabell 3.10-13
Indikationer för perkutan kolecystostomiplacering.
Svår akut kolecystit enligt 2018 års Tokyoriktlinjer
Akut kolecystit och ASA-klassificering >3 eller Charlson komorbiditetsindex >6
Andrahandstillträde till gallvägar:Malign gallgångslesion överbryggningGallgångsstriktur dilatationGallgångsfistel avledning av produktionGallgångsdekompression vid kolangitAndra
Under det som fastställts i TG13,14 understryker TG18 att akut dränering av gallblåsan kan utföras vid AC av grad II när laparoskopi inte är tillgänglig och det finns ett otillräckligt svar på den initiala medicinska behandlingen, främst hos patienter som uppvisar ett ”dåligt” allmäntillstånd (CCI>6 poäng eller ASA-klassificering >3). Detta förslag stöds av en retrospektiv multicenterstudie15 från 2017 som omfattade 1 764 patienter under en tvåårsperiod men som endast parade 330 patienter i två grupper för jämförelse. Grupp 1 bestod av 330 patienter som genomgick transhepatisk perkutan dränering och transhepatisk perkutan aspiration och grupp 2 bestod av 330 patienter som genomgick endoskopisk transpapillär gallblåsedränering. Resultaten analyserades dag 3 och 7 efter förfarandet. På dag 3 var den terapeutiska framgångsgraden 62,5 % (kolecystostomi) och 69,8 % (endoskopisk behandling). På dag 7 var den terapeutiska framgångsfrekvensen 87,6 % (kolecystostomi) och 89,2 % (endoskopisk behandling). Inga signifikanta skillnader hittades i de tidiga eller sena framgångssiffrorna. Komplikationsfrekvensen var 4,8 % i kolecystostomigruppen och 8,2 % i den endoskopiska dräneringsgruppen, och det fanns inga statistiska skillnader i den statistiska analysen. De komplikationer som rapporterades i kolecystostomigruppen var 8 patienter med katetermigration, en patient med blödning och 3 patienter med gallläckage. Den studien visade att perkutan dränering var effektiv och hade samma effektivitet som endoskopisk behandling. Även om patienterna inte stratifierades efter AC-svårighetsgrad, uppgav författarna i diskussionsavsnittet att bias sannolikt förekom i studien på grund av att man inkluderade en hög frekvens av patienter med svår (grad III) och måttlig (grad II) AC.
Behandlingsrekommendationerna i fall av AC av grad III var några av de största förändringarna i TG18, i förhållande till TG13. Tidigare var akut gallblåsedränering (endoskopisk eller transhepatisk) den enda rekommendationen,13 vilket tyder på en icke-explicit tendens att undvika akut kirurgisk behandling, för att inte öka morbiditet och mortalitet. Även om TG18 upprepar den rekommendationen, lades alternativet att utföra tidig LC, efter att ha etablerat antibiotikabehandling och normaliserat organfunktionen, till.16 Därför är det viktigt att vid diagnos av AC, särskilt grad III, beräkna CCI och ASA-funktionsförmåga och identifiera om patienten har gynnsamma prediktiva faktorer för organsvikt (njur- eller kardiovaskulär skada). Dessa patienter skulle kunna uppvisa en snabb återhämtning efter påbörjad medicinsk behandling och bli kandidater för definitiv behandling med LC.
The World Society for Emergency Surgery, rekommenderar att man utför perkutan dränering av gallblåsan hos ”högrisk”-patienter, men ger ingen exakt definition av dessa patienter, vilket kan leda till att olika beslut fattas av olika yrkesgrupper som är involverade i behandlingen av akut kolecystit.17
Trots den allmänna acceptansen av PC-placering hos patienter med svår AC,18,19 och de rapporterade bevisen för en relativt låg dödlighet (17 %),20 är det bästa behandlingsalternativet fortfarande föremål för debatt, med tanke på att vissa grupper rapporterar ett acceptabelt resultat med akut LC hos kritiskt sjuka patienter.21-25
Risk för konvertering från laparoskopisk kolecystektomi till öppen kirurgi
Olika faktorer har också beskrivits för att förutsäga risken för konvertering från LC till öppen kolecystektomi.26,27 Vissa författare föreslår att patienter med hög risk för konvertering bör betraktas som kandidater för initial PC-placering, och när den inflammatoriska processen är avklarad, genomgå sen LC (tabell 4).28,29
Riskfaktorer för konvertering till öppen kolecystektomi.
| Lipman et al. (2007)26 | Manligt kön (OR 4,06, 95 % CI: 2,42-6.82)Leukocytos 3.01 (OR 3.01, 95% CI: 1.77-5.13),Hypoalbuminemi (OR 2.90, 95% CI: 1.70-4.96),Pericholecystisk vätska (OR 2.36, 95% CI: 1.25-4.47)Diabetes mellitus (OR 1.87, 95% CI: 1.03-3.42)Förhöjt totalbilirubin (OR 1.85, 95% CI: 1.01-3.39) |
| Kim et al. (2014)27 | Förhöjd ålder (OR 1.05, 95% CI: 1.008-1.10),Manligt kön (OR 5.0, 95% CI: 1.31-19.05),Pericholecystisk vätska (OR17.22, 95% CI: 4.36-67.94). |
| Masri et al. (2018)79 | Kvinnligt kön (OR 0,09, 95 % KI: 0,03-0,25)Hög ålder (OR 2,15, 95 % KI: 1,62-2,85)Historia av bukkirurgi (OR 4,66, 95 % KI: 1,78-12,17)Historia av lungsjukdom, t.ex, KOL (OR 6,03, 95 % KI: 1,21-29,97)Serumhemoglobin mg/dl (OR 36,57, 95 % KI: 3,16-423,72) |
| Morales Maza et al. (2019)a | Manligt kön (OR 1.64, 95 % CI: 0,48-5,58)Gallblåsans väggdiameter (OR 1,35, 95 % CI: 1,03-1,76)Hög ålder (OR 1,02, 95 % CI: 1,00-1,04)Perikolecystisk vätska (OR 2,84, 95 % CI: 1,04-7.69) |
Under publicering.
Nyttan av en inledande konservativ behandling, där man först placerar en PC och sedan utför intervall-LC hos patienter med AC-symtom med mer än 72 timmars progression, har också studerats. Karakayali et al.30 analyserade en grupp patienter med AC av mer än 72 timmars varaktighet och symtomprogress på 48 timmar efter initial medicinsk behandling. Patienterna (n=92) tilldelades icke slumpmässigt att antingen genomgå PC och därefter intervall-LC eller genomgå akut LC. Gruppen som genomgick intervall-LC hade en lägre konverteringsfrekvens (40 % jämfört med 19 %; p=0,029), mindre intraoperativ blodförlust (33 % jämfört med 9 %; p=0,006), kortare sjukhusvistelse (5,3 dagar jämfört med 3,0; p=0,001) och lägre frekvens av komplikationer generellt (35 % jämfört med 9 %; p=0,003).
El-Gendi et al.31 randomiserade en grupp patienter (n=150) med AC för mer än 72 timmars progression för att genomgå akut LC jämfört med PC och intervall-LC 6 veckor senare. Deras analys visade att PC- och intervallkolecystektomigruppen hade en lägre konverteringsfrekvens (24 % vs 2,27 %; p
0,001), mindre intraoperativ blodförlust (medel 41,73 ml vs 26,33 ml; p=0,008), kortare operationstid (87,8min vs 38,09min; p0.001), lägre andel subtotal kolecystektomi (17,3 % vs. 0,0 %; p0,001), kortare sjukhusvistelse (51,71h vs. 10,76h; p0,001) respektive färre postoperativa komplikationer (26,7 % vs. 2,7 % p0,001).
Patienter med akalkulös AC är en annan grupp värd att nämna. De är ofta kritiskt sjuka patienter med multiorgansvikt och är kandidater för PC som förstahandsbehandling för att lösa de akuta symtomen. Patienter med tecken på perforation av gallblåsan, gangrän eller symtomutveckling efter PC-placering bör dock genomgå akut kolecystektomi.32
Kontraindikationer för perkutan kolecystostomiplacering
Det finns inga absoluta kontraindikationer för PC. De relativa kontraindikationerna är få och omfattar koagulopati som villkorar risken för allvarlig blödning (trombocyter
×109/l eller INR>1.5), allergi mot joderat kontrastmedel (används för att bekräfta adekvat kateterplacering genom fluoroskopi (även om det skulle kunna göras genom ultraljud),33 och överlappning av tarmsegment vid punktionsstället (ytterst sällsynt eftersom levern hindrar segmentöverlappning).34
Paracentes föreslås hos patienter med ascites, före PC-placering. Det bör betonas att frekvensen av PC-komplikationer hos patienter med ascites är låg och inte signifikant annorlunda, jämfört med patienter som inte har ascites. En gallblåsa som är tätt packad med gallstenar kan också hindra en säker placering av PC-katetern.35
Finns det en minskning av mortaliteten vid perkutan kolecystostomiplacering hos ”högrisk”-patienter?
Detaljering av befintlig evidens om minskad mortalitet hos högriskpatienter med AC som genomgår PC, gjordes i en studie från 2014 där man analyserade databasen från California Health System. Det primära syftet var att fastställa mortaliteten och dess tidsmässighet i tre grupper av patienter med AC: de som fick PC-placering, de som genomgick LC och de som inte genomgick någon av de två strategierna på grund av tillståndets svårighetsgrad.36 Totalt studerades 43 341 patienter, vilket resulterade i en mortalitetsfrekvens på 61,7 % hos de patienter som behandlades med PC, 42 % hos de patienter som inte genomgick någon invasiv behandling och 23 % hos de patienter som genomgick LC. Det fanns ingen skillnad i överlevnad hos patienter med svår sepsis och septisk chock vid jämförelsen mellan PC-gruppen och gruppen utan intervention (p=0,256), och det fanns en större överlevnad hos de patienter som genomgick LC (p
0,001). Även om mortaliteten var högre hos de patienter som genomgick PC, hade de en högre CCI (5 jämfört med 3,8), jämfört med de patienter som genomgick LC. Således måste dessa begränsningar i studien beaktas när man tolkar resultaten och drar slutsatser. I en annan studie som publicerades 2014 kunde man inte påvisa minskad morbiditet och mortalitet hos patienter som hanterades med PC,37 men det bör nämnas att protokollet för PC-hantering var heterogent och varierade mellan olika centra, vilket delvis kan ha bidragit till variationen i resultaten.
Chocolate-protokollet publicerades 2012 med avsikten att ge ett mer slutgiltigt svar på PC-debatten. Det var en multicenter, randomiserad, kontrollerad studie om interventionens överlägsenhet. Den försökte jämföra resultatet mellan att utföra LC- respektive PC-placering hos patienter med AC som hade en APACHE-poäng >7 poäng. Antalet patienter som skulle rekryteras var 284 under en tvåårsperiod, vid 30 centra med hög volym. Det primära målet var att analysera komplikationer inom de första tre månaderna efter ingreppet och dödligheten efter ett år (Netherlands Trial Register ; NTR2666).38 Resultaten av protokollet publicerades inte, med tanke på att det avbröts 2016, efter att den preliminära analysen visade på större morbiditet och dödlighet hos de patienter som behandlades med PC.
Dessa studier gör att man tvivlar på den verkliga nyttan av PC hos patienter med svår AC. Det finns dock mycket kontroverser kring det, med tanke på att randomiserade studier behövs så att selektionsbias kan elimineras. Majoriteten av de nu tillgängliga bevisen är retrospektiva och omfattar ett stort antal patienter som är ”så allvarliga” att de har en hög dödlighet, oavsett vilken intervention som erbjuds.
Det är viktigt att understryka att patienter som inte är högriskpatienter, inte har några komorbiditeter och är kandidater för LC, inte har någon som helst nytta av PC-placering. Vissa studier tyder på att resultatet till och med kan försämras vid användning av nämnda strategi.39,40 Enligt vår erfarenhet anser vi inte att det är tillrådligt att utföra laparoskopisk kolecystostomi som en räddningsmetod efter en misslyckad LC, eftersom det är mer rekommenderat att utföra en subtotal kolecystektomi i det scenariot, om det fanns tekniska svårigheter under ingreppet. I de studier som har jämfört PC jämfört med öppen kolecystektomi hos kritiskt sjuka patienter med akalkulös kolecystit har mindre morbiditet, färre dagar av sjukhusvistelse och lägre associerade kostnader observerats hos patienter som har genomgått PC-placering.41
Beskrivning av tekniken för ultraljudsstyrd placering av perkutan kolecystostomi
När man väl har bestämt sig för att utföra PC måste man först definiera vilket tillvägagångssätt som ska användas för att placera dränet, vare sig det ska vara transhepatiskt eller transperitonealt. Beroende på varje patient och varje kirurg kan man välja det ena eller det andra, var och en med sina för- och nackdelar.
För patienter med större risk för blödning beskrivs traditionellt det transperitoneala tillvägagångssättet, för att förhindra leverpunktion. Å andra sidan föredras det transhepatiska tillvägagångssättet hos patienter vars gallblåsa är mycket utspänd (> 10 cm vid den långa axeln eller > 5 cm vid den axiella axeln), för att minska risken för perforation och gallläckage samt gallperitonit.
En annan viktig aspekt att ta hänsyn till är patientens habitus och rörelseförmåga eftersom det kan försvåra det ena eller andra tillvägagångssättet på grund av dålig visualisering av gallblåsan eller svårigheter att nå gallblåsan på grund av en komplicerad tractus. När alla ovan nämnda aspekter har analyserats kan det lämpligaste tillvägagångssättet väljas.
I vår erfarenhet är PC vanligtvis ett ingrepp som utförs vid patientens säng genom trokorteknik, även om den modifierade Seldinger-tekniken traditionellt beskrivs. Vår tekniska framgångsfrekvens liknar den som rapporterats i litteraturen (data kommer att publiceras).
Den steg-för-steg-teknik som används för ultraljudsstyrd PC-placering beskrivs nedan (fig. 1).
- 1
Uppför lämplig asepsis och antisepsis i området kring det högra hypokondriet.
- 2
Skanna gallblåsan med ultraljud för att bekräfta diagnosen AC.
- 3
Infiltrera huden och den subkutana cellvävnaden med 2 % lidokain.
- 4
Korroborera förekomsten av det material som krävs för att placera katetern genom den valda tekniken.
- 5
Lokalisera gallblåsan genom ultraljudsundersökning. Utför den transperitoneala eller transhepatiska punktionen. För sedan in och för fram den multifunktionella katetern genom gallgången (8,5 Fr) över metallstyrtråden tills den är positionerad i gallblåsan (Fig. 2).
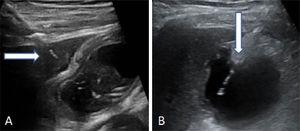 Fig. 2.
Fig. 2.Två sätt att utföra gallblåspunktion på. (A) Transhepatisk ingång för nålen. Pilen pekar på den hepatiska kupolen. (B) Transperitoneal ingång av nålen direkt i gallblåsans fundus.
(0,25 MB).- 6
Utdrag metallstyrtråden och låt katetern vara placerad inne i gallblåsan.
- 7
Fixera katetern på huden med en 3.0 prolensöm.
- 8
Extrahera gallvätska som ska skickas till det mikrobiologiska laboratoriet för odling.
- 9
Placera en uppsamlingspåse vid kateterns distala ände och lämna diversionen.
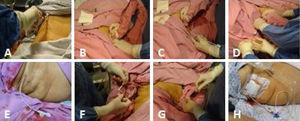 Fig. 1.
Fig. 1.(A) Asepsis av höger hypokondrium. (B) Skanning av gallblåsan. (C) Ultraljudsstyrd introduktion av katetern tillsammans med metallstyrtråden i riktning mot gallblåsan. (D) Metall-styrtråden dras ut med försiktighet så att katetern lämnas på plats, vänd mot gallblåsans lumen, och återigen bekräftas med hjälp av ultraljud att den är korrekt placerad i gallblåsan. (E) Den på plats placerade kolecystostomikatetern. (F) Katetern fästs med ett enkelt stygn på huden med hjälp av prolene 3-0. (G) Gallvätska sugs upp och skickas för odling. (H) Den avledda kolecystostomikatetern med uppsamlingspåse.
(0,2MB).Komplikationer vid perkutan kolecystostomi
PC-placering anses generellt sett vara ett säkert och effektivt förfarande. Mer än 90 % av patienterna förväntas presentera en förbättring av smärta och det systemiska inflammatoriska svaret inom de första 48 timmarna efter PC-placeringen.42 Komplikationer har dock beskrivits i cirka 3 % av fallen. De vanligaste komplikationerna är hemobilia, pneumothorax, gallläckage, gallperitonit, koledokolithiasis och abscesser.43,44 Exteriörisering av katetern är alltid en risk, vilket kan göra det svårt att placera den igen när gallblåsan väl är dekomprimerad.45,46
Risken för recidiv av AC efter avlägsnande av PC varierar mellan 6 och 40 %.47-49 AC-recidiv har rapporterats, även hos patienter med en funktionell och genomsläpplig kateter, och inträffar i allmänhet inom de första två månaderna efter placeringen.50 Längre sjukhusvistelse hos patienter med PC har rapporterats i vissa fallserier.51 Den längre sjukhusvistelsen är sannolikt förknippad med den större svårighetsgraden hos de patienter som erbjuds PC, snarare än att vara en direkt konsekvens av ingreppet.52 Tidig PC-placering, dvs. inom de första 24 timmarna från symtomdebut, är effektiv för att minska sjukhusvistelsen. Det dokumenterades i en studie från 2015, där endast patienter med sen PC-placering hade längre sjukhusvistelse.53
När man ska ta bort kolecystostomikatetern
I allmänhet ska PC tas bort när patienten är stabil och den akuta bilden har avtagit. Den idealiska tidpunkten för avlägsnande har dock inte definierats exakt.54 Kolangiografi utförd genom PC har utförts för att utvärdera cystisk gångpermeabilitet. Lägre AC-recidivfrekvens har rapporterats hos patienter med en permeabel cystisk kanal,55 men uppgifterna är motsägelsefulla. AC-recidiv kan förekomma i vissa fall, även om kolangiografi dokumenterar gallgångspermeabilitet.56
En retrospektiv kohortstudie som publicerades 2017 utvärderade två grupper. Grupp 1 (n=43) genomgick rutinmässig kolangiografi före avlägsnande av kolecystostomi och grupp 2 genomgick endast kolangiografi på begäran (n=41). Patienterna som fick kolangiografi på begäran hade ett bättre resultat, med tanke på att de hade tidigare avlägsnande av dränage, en högre andel tidig kolecystektomi och mindre resursanvändning.57
I samband med att LC utförs som slutgiltig behandling måste särskild försiktighet iakttas, med tanke på att även om inflammationen i gallblåsan har minskat eller försvunnit, så kvarstår i allmänhet patientens komorbiditet, vilket innebär att operationen kan vara mer komplicerad än vad man först hade tänkt sig.58,59 En frekvens av konvertering till öppen kirurgi i det scenariot har rapporterats mellan 11 och 32 %.60-63 Intervallkolecystektomi utförs i allmänhet utan tekniska problem hos unga patienter utan komorbiditeter.64,65
Den slutgiltiga behandlingen
Placering av kolekystostomi är idealt sett en överbryggande behandling före den slutgiltiga behandlingen som utförs när patienten presenterar en förbättring av sitt allmäntillstånd.66,67 Mer än 95 % av patienterna har kolecystektomi som slutgiltig behandling,68 men kolecystostomi har i fallserier rapporterats kvarstå på obestämd tid hos 30 till 50 % av patienterna.69-71 Vissa författare rekommenderar PC-placering som definitiv och permanent behandling hos äldre patienter och patienter med hög kirurgisk risk.72
I en deskriptiv studie som genomfördes inom tidsramen 2000-2011 på 36 patienter som fick PC-placering eftersom de betraktades som ”högriskpatienter”, rapporterade författarna 100 % symtomupplösning 3 dagar efter PC-placering hos alla patienter. PC var den slutgiltiga behandlingen hos 63 % av patienterna, och definitiv LC utfördes hos endast 6 patienter (16 %).73 Andra författare förespråkar att LC utförs under samma sjukhusvistelse, eftersom fördröjd LC är förknippad med att patienterna förlorar sin uppföljning.74 Andra studiegrupper är överens om att frekvensen av kateterrelaterade komplikationer är hög och föreslår att PC avlägsnas så snart det akuta inflammatoriska svaret har kontrollerats, även inom de första 10 dagarna efter kateterplaceringen.75,76
I erfarenheten från vårt center avlägsnas kolecystostomin så snart patienten är programmerad för kolecystektomi inom de följande 2 veckorna, i det enda syftet att förbättra patientens livskvalitet före operation. Katetern avlägsnas endast om patienten är asymtomatisk, inte har några tecken på systemiskt inflammatoriskt svar och har tecken på en permeabel cystisk ductus cysticus. Den avlägsnas också hos patienter som kommer att genomgå definitiv kolecystektomi. Om dessa kriterier inte uppfylls är vår ståndpunkt att låta kolecystostomikatetern sitta kvar på obestämd tid.
Vi föreslår den algoritm som visas i figur 3 för avlägsnande av kolecystostomikatetern.
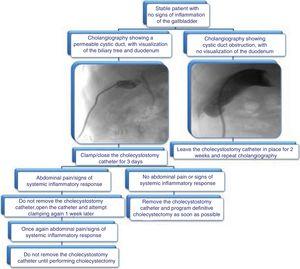 Fig. 3.
Fig. 3.Föreslagen algoritm för hantering av kolecystostomikatetrar: utvärdering av avlägsnande genom kolangiografi och kliniska data.
(0,35MB).Det är viktigt att betona att det har rapporterats om en högre frekvens av infektion på operationsstället hos de patienter som genomgår avlägsnande av kolecystostomi och sedan LC. Sistnämnda infektion har beskrivits i upp till 16 % av fallen.77
Slutsatser
Perkutan dekompression av gallblåsan är en allmänt känd behandling, men det finns fortfarande ingen standardiserad strategi för hantering av kolecystostomikatetern, vilket gör det svårt att studera dessa patienter på ett enhetligt sätt med den litteratur som för närvarande finns tillgänglig. Trots bristen på bevis kan vissa överväganden ändå fastställas:
- –
Högriskkirurgiska patienter med diagnosen AC där akut LC är kontraindicerad verkar vara de bästa kandidaterna för PC-placering.
- –
Det finns inga bevis som stödjer PC-placering hos stabila patienter som inte har någon kontraindikation för att genomgå LC.
- –
PC-kateterborttagning bör endast utföras efter att cystisk gångpermeabilitet har dokumenterats genom kolangiografi, om katetern orsakar patienten obehag och om patienten är en kandidat för definitiv kirurgisk behandling inom en ”rimlig” och läglig tidsperiod för att minska risken för att presentera återkommande akut kolecystit.
Det finns få bevis för hanteringen av perkutana kolecystostomikatetrar och randomiserade studier för att utvärdera den bästa strategin att följa i den patientgruppen krävs för närvarande.
Etiska upplysningar
Skydd av människor och djur. Författarna förklarar att inga experiment har utförts på människor eller djur för den här artikeln.
Datakonfidentialitet för data. Författarna förklarar att de har behandlat alla patientuppgifter med konfidentialitet och anonymitet, enligt protokollen för deras arbetscentrum.
Rätt till personlig integritet och informerat samtycke. Författarna förklarar att inga patientuppgifter förekommer i denna artikel som äventyrar deras identitet och därför var det inte nödvändigt att inhämta deras informerade samtycke.
Finansiellt avslöjande
Inget ekonomiskt stöd har erhållits i samband med denna artikel.
Intressekonflikt
Författarna förklarar att det inte finns någon intressekonflikt.
- 6
Leave a Reply