Perkutan cholecystostomi som behandling af akut cholecystitis: Hvad er der sket i løbet af de sidste fem år? En litteraturgennemgang | Revista de Gastroenterología de México
Introduktion
Galdeblærepatologi er en af de hyppigste sygdomme, som almenkirurgen står over for. I øjeblikket anses laparoskopisk cholecystektomi (LC) for at være den gyldne standard som behandling af akut cholecystitis (AC). Der er blevet gjort en indsats for at reducere den morbiditet og mortalitet, der er forbundet med indgrebet hos kirurgiske højrisikopatienter, ved hjælp af mindre invasive indgreb, såsom perkutan cholecystostomi (PC).
AC er en inflammatorisk sygdom i galdeblæren, hvis patofysiologi består af obstruktion af afløbsvejene i galdeblæren eller dysmotilitet i dens vægge, hvilket betinger en stigning i intraluminalt tryk, vægødem, ændret vaskularitet med iskæmi eller nekrose, bakterieproliferation eller galdeblæreperforation. Formålet med PC ved AC er at gøre det muligt at dræne galdegangen for at løse de akutte symptomer og forhindre udviklingen af lokale og systemiske komplikationer. PC er generelt forbeholdt patienter med AC, der er kirurgiske højrisikopatienter, eller som præsenterer sig med organsvigt. PC har nyttige fordele i denne sammenhæng: Der er ikke behov for generel anæstesi, den kan udføres ved patientens seng, det er en hurtig procedure, succesraten er over 95 %, den har en lav komplikationsrate, og den kan bruges som overgangsbehandling før elektiv kirurgi.
Galdeblæretrænage er en behandlingsmulighed, der indgår i de vigtigste internationale retningslinjer for AC-behandling, men der er stadig en vis uenighed om dens resultater hos kritisk syge patienter, dens præcise indikationer og dens overlegenhed i forhold til endelig kirurgisk behandling.
Der er kun lidt evidens for overvågning og pleje af patienter, der gennemgår PC. Størstedelen af undersøgelserne fokuserer på udvælgelse af patienter, der vil have gavn af proceduren, men kun få beskriver den efterfølgende patientbehandling. Vi analyserer heri evidensen for nytten af PC i AC og foreslår en algoritme for PC-kateterhåndtering.
Kriterier for klassificering af akut cholecystis sværhedsgrad
I 2018 Tokyo Guidelines (TG18) om AC klassificeres sygdommens sværhedsgrad som mild (grad I), moderat (grad II) og svær (grad III).1 Said klassifikation tager hensyn til patientens komorbiditeter, symptomvarighed, fysiske fund ved indlæggelse på hospitalet, tegn på systemisk inflammatorisk respons, tilstedeværelsen af markant lokal inflammation i billeddiagnostiske undersøgelser og udviklingen af organdysfunktion. TG-klassifikationen er nyttig, fordi sværhedsgraden af sygdomspræsentationen korrelerer med mortalitet, morbiditet, længden af hospitalsopholdet og graden af konvertering fra laparoskopisk kirurgi til åben kirurgi (tabel 1 og 2).
Klassifikation af sværhedsgraden af akut cholecystitis i henhold til Tokyo-retningslinjerne fra 2018.1
| Grad I (mild) | Grad II (moderat) | Grad III (svær) |
|---|---|---|
|
En af følgende tilstande:
|
En af følgende organdysfunktioner:
|
Karakteristika for de forskellige sværhedsgrader.
| Dødelighed efter 30 dage2 | Morbiditet78 | Sygehusophold78 | Hospitalsophold78,a | Konverteringsrate78,a | |
|---|---|---|---|---|---|
| Grad I | 1.1% | 2,9% | 3 (1-16) | 7% | |
| Gruppe II | 0.8% | 3,1% | 4 (1-33) | 25,6% | |
| Grad III | 5,4% | 11.1% | 7 (1-60) | 34,6% |
Middelværdi ± SD.
Førlig LC (inden for 72 timer) bør ideelt set udføres i tilfælde af AC af grad I og grad II, hvis Charlson comorbiditetsindeks (CCI) og funktionsevne i henhold til klassifikationssystemet fra American Society of Anesthesiologists (ASA) tyder på, at patienten kan tåle operation. Derimod bør der etableres en indledende medicinsk behandling (antibiotika og generel støtte), og kirurgisk behandling bør overvejes, når forholdene forbedres. Ved AC af grad II tilføjes anbefalingen om at udføre perkutan drænage, når patienten ikke kan tåle kirurgisk behandling.1
I Tokyo-retningslinjerne fra 2013 (TG13) klassificeres AC som grad III, når der er tegn på organdysfunktion, hvilket defineres, når der er kardiovaskulær, neurologisk, respiratorisk, renal, hepatisk eller hæmatologisk insufficiens. Ifølge TG13 er akut LC kontraindiceret, hvis der er dysfunktion i disse organsystemer. I 2017 gav Yokoe et al.2 imidlertid oplysninger om behandlingen af AC i en japansk og taiwanesisk population (n=5 329), hvor LC blev udført med succes på et flertal af patienterne med AC af grad III. Den samme kohorte blev senere genanalyseret, idet der blev lagt vægt på de patienter med organdysfunktion, som sikkert kunne gennemgå kirurgisk behandling. Patienterne med en CCI>6 point udviste en højere dødelighed. Den vigtigste nytte af denne undersøgelse var dens multivariate logistiske regressionsanalyse, som viste, at gulsot, neurologisk dysfunktion og respiratorisk dysfunktion var uafhængige prædiktive faktorer for dødelighed efter 30 dage hos patienter med grad III AC. Ikke desto mindre var der ingen beviser for øget dødelighed hos patienter med grad III AC, der præsenterede sig med andre typer organsvigt, og som gennemgik LC.3 TG18 definerer således neurologisk dysfunktion, respiratorisk dysfunktion eller tilstedeværelsen af gulsot (total bilirubinniveau ≥ 2 mg/dl) som prædiktive faktorer for dødelighed i grad III AC. På den anden side betragtes nyredysfunktion og kardiovaskulær dysfunktion som gunstige typer af organsvigt, da de ofte kan vendes efter etablering af indledende medicinsk behandling og derfor ikke kontraindicerer kirurgisk behandling.1
Indikationer for perkutan cholecystostomiplacering
Generelt set er den hyppigste indikation for placering af en PC alvorlig AC.4-9 Mindre almindelige indikationer er dem, hvis formål er at aflede galdevejene ved hjælp af en transkolecystisk adgang, som i de fleste tilfælde betragtes som relativt sekundær indikation på grund af præferencen for at udføre endoskopiske eller transhepatiske afledninger. De nævnte scenarier er opsummeret i tabel 3.10-13
Indikationer for perkutan cholecystostomiplacering.
Alvorlig akut cholecystitis i henhold til Tokyo-retningslinjerne 2018
Akut cholecystitis og ASA-klassifikation >3 eller Charlson-komorbiditetsindeks >6
Second-line adgang til galdevejene:Maligne galdevejslæsioner brobygningGaldevejsstriktur dilatationGaldevejsfistel udgangsafledningGaldevejsdekompression ved kolangitisAndre
I modsætning til det, der er fastlagt i TG13,14 understreger TG18, at der kan foretages akut galdeblæretrænage ved AC af grad II, når laparoskopi ikke er tilgængelig, og der er et utilstrækkeligt svar på den indledende medicinske behandling, hovedsagelig hos patienter, der præsenterer sig med “dårlige” generelle forhold (CCI>6 point eller ASA-klassifikation >3). Dette forslag understøttes af en multicenter retrospektiv undersøgelse15 fra 2017, der omfattede 1 764 patienter over en 2-årig periode, men kun parrede 330 patienter i to grupper til sammenligning. Gruppe 1 bestod af 330 patienter, der gennemgik transhepatisk perkutan drænage og transhepatisk perkutan aspiration, og gruppe 2 bestod af 330 patienter, der gennemgik endoskopisk transpapillær galdeblæredrænage. Resultaterne blev analyseret på 3 og 7 dage efter proceduren. På dag 3 var den terapeutiske succesrate 62,5 % (cholecystostomi) og 69,8 % (endoskopisk behandling). På dag 7 var den terapeutiske succesrate 87,6 % (cholecystostomi) og 89,2 % (endoskopisk behandling). Der blev ikke fundet nogen signifikante forskelle i de tidlige eller sene succesrater. Komplikationsfrekvensen var 4,8 % i cholecystostomigruppen og 8,2 % i den endoskopiske dræningsgruppe, og der var ingen statistiske forskelle i den statistiske analyse. De komplikationer, der blev rapporteret i cholecystostomigruppen, var 8 patienter med katetermigration, en patient med blødning og 3 patienter med galdeudsivning. Denne undersøgelse viste, at perkutan drænage var effektiv og havde samme effektivitet som endoskopisk behandling. Selv om patienterne ikke blev stratificeret efter AC-sværhedsgrad, anførte forfatterne i diskussionsafsnittet, at der højst sandsynligt opstod bias i undersøgelsen på grund af inklusionen af en høj frekvens af patienter med svær (grad III) og moderat (grad II) AC.
Behandlingsanbefalinger i tilfælde af AC af grad III var nogle af de største ændringer i TG18, i forhold til TG13. Tidligere var akut galdeblæretømning (endoskopisk eller transhepatisk) den eneste anbefaling,13 hvilket indikerer en ikke-eksplicit tendens til at undgå akut kirurgisk behandling for ikke at øge morbiditet og mortalitet. Selv om TG18 gentager denne anbefaling, blev der tilføjet muligheden for at udføre tidlig LC efter etablering af antibiotikabehandling og normalisering af organfunktionen.16 Derfor er det ved diagnosticering af AC, især grad III, vigtigt at beregne CCI og ASA-funktionsevne og identificere, om patienten har gunstige prædiktive faktorer for organsvigt (nyre- eller kardiovaskulær skade). Disse patienter kunne præsentere en hurtig bedring efter påbegyndt medicinsk behandling og blive kandidater til endelig behandling med LC.
The World Society for Emergency Surgery, anbefaler at udføre perkutan drænage af galdeblæren hos “højrisikopatienter”, men giver ikke en præcis definition af de nævnte patienter, hvilket kan resultere i forskellige beslutninger, der træffes af forskellige fagfolk, der er involveret i behandlingen af akut cholecystitis.17
På trods af den generelle accept af PC-placering hos patienter med alvorlig AC,18,19 og den rapporterede dokumentation for en relativt lav dødelighed (17 %)20 , er den bedste behandlingsmulighed stadig genstand for debat, da nogle grupper rapporterer et acceptabelt resultat med akut LC hos kritisk syge patienter.21-25
Risiko for konvertering fra laparoskopisk cholecystektomi til åben kirurgi
Der er også beskrevet forskellige faktorer til at forudsige risikoen for konvertering fra LC til åben cholecystektomi.26,27 Nogle forfattere foreslår, at patienter med høj risiko for konvertering bør betragtes som kandidater til indledende PC-placering, og når den inflammatoriske proces er løst, gennemgå sen LC (tabel 4).28,29
Risikofaktorer for konvertering til åben cholecystektomi.
| Lipman et al. (2007)26 | Mandskøn (OR 4,06, 95% CI: 2,42-6.82)Leukocytose 3.01 (OR 3.01, 95% CI: 1.77-5.13),Hypoalbuminæmi (OR 2.90, 95% CI: 1.70-4.96),Pericholecystisk væske (OR 2.36, 95% CI: 1.25-4.47)Diabetes mellitus (OR 1.87, 95% CI: 1.03-3.42)Forhøjet total bilirubin (OR 1.85, 95% CI: 1.01-3.39) |
| Kim et al. (2014)27 | Videre alder (OR 1.05, 95% CI: 1.008-1.10),Mandligt køn (OR 5.0, 95% CI: 1.31-19.05),Pericholecystisk væske (OR17.22, 95% CI: 4.36-67.94). |
| Masri et al. (2018)79 | Køn af kvinde (OR 0,09, 95% CI: 0,03-0,25)Høj alder (OR 2,15, 95% CI: 1,62-2,85)Historie af abdominal kirurgi (OR 4,66, 95% CI: 1,78-12,17)Historie af lungesygdomme, f.eks, KOL (OR 6,03, 95% CI: 1,21-29,97)Serumhæmoglobin mg/dl (OR 36,57, 95% CI: 3,16-423,72) |
| Morales Maza et al. (2019)a | Mandskøn (OR 1.64, 95% CI: 0.48-5.58)Galdeblærens vægdiameter (OR 1.35, 95% CI: 1.03-1.76)Høj alder (OR 1.02, 95% CI: 1.00-1.04)Pericholecystisk væske (OR 2.84, 95% CI: 1.04-7.69) |
Under publikationsproces.
Nytteværdien af indledende konservativ behandling, først at placere en PC og derefter udføre interval-LC hos patienter med AC-symptomer med mere end 72-timers progression, er også blevet undersøgt. Karakayali et al.30 analyserede en gruppe af patienter med AC af mere end 72 timers varighed og symptomprogression på 48 timer efter initial medicinsk behandling. Patienterne (n=92) blev ikke tilfældigt tildelt enten at gennemgå PC og derefter interval LC eller at gennemgå akut LC. Gruppen, der gennemgik interval-LC, havde en lavere konverteringsrate (40 % vs. 19 %; p=0,029), mindre intraoperativt blodtab (33 % vs. 9 %; p=0,006), kortere hospitalsophold (5,3 dage vs. 3,0; p=0,001) og lavere hyppighed af komplikationer generelt (35 % vs. 9 %; p=0,003).
El-Gendi et al.31 randomiserede en gruppe af patienter (n=150) med AC i mere end 72 timer med progression til at gennemgå akut LC vs. PC og interval-LC 6 uger senere. Deres analyse viste, at PC og interval cholecystectomy gruppen havde en lavere konverteringsfrekvens (24% vs. 2,27%; p
0,001), mindre intraoperativt blodtab (gennemsnit 41,73ml vs. 26,33ml; p=0,008), kortere operationstid (87,8min vs. 38,09min; p0.001), en lavere rate af subtotal cholecystectomi (17,3% vs. 0,0%; p0,001), kortere hospitalsophold (51,71h vs. 10,76h; p0,001) og færre postoperative komplikationer (26,7% vs. 2,7% p0,001), henholdsvis.
Patienter med acalculøs AC er en anden gruppe, der er værd at nævne. Det er ofte kritisk syge patienter med multiorgansvigt, og de er kandidater til PC som første valg af behandling for at løse de akutte symptomer. Patienter med tegn på perforation af galdeblæren, gangræn eller symptomfremgang efter PC-placering bør dog gennemgå akut cholecystektomi.32
Kontraindikationer for perkutan cholecystostomiplacering
Der er ingen absolutte kontraindikationer for PC. De relative kontraindikationer er få, og de omfatter koagulopati, der betinger risikoen for alvorlig blødning (trombocytter
×109/l eller INR>1.5), allergi over for iodiseret kontrastmiddel (anvendes til at bekræfte korrekt kateterplacering ved hjælp af fluoroskopi (selv om det kan gøres ved hjælp af ultralyd),33 og overlapning af tarmsegmenter på punkturstedet (yderst sjældent, fordi leveren forhindrer segmentoverlapning).34
Paracentese foreslås hos patienter med ascites, før PC-placering. Det bør understreges, at hyppigheden af PC-komplikationer hos patienter med ascites er lav og ikke signifikant forskellig, sammenlignet med patienter, der ikke har ascites. En galdeblære tæt pakket med galdesten kan også hindre en sikker placering af PC-katetret.35
Er der et fald i dødeligheden ved perkutan cholecystostomiplacering hos “højrisikopatienter”
I en undersøgelse fra 2014, der analyserede databasen fra California Health System, blev den eksisterende dokumentation for faldet i dødeligheden hos højrisikopatienter med AC, der gennemgår PC, uddybet. Det primære formål var at bestemme dødeligheden og dens tidsmæssige placering i 3 grupper af patienter med AC: de, der fik PC-placering, de, der gennemgik LC, og de, der ikke gennemgik nogen af de to strategier på grund af tilstandens sværhedsgrad.36 I alt 43 341 patienter blev undersøgt, hvilket resulterede i en dødelighed på 61,7 % hos de patienter, der blev behandlet med PC, 42 % hos de patienter, der ikke fik nogen invasiv behandling, og 23 % hos de patienter, der gennemgik LC. Der var ingen forskel i overlevelsen hos patienter med alvorlig sepsis og septisk chok under sammenligningen af PC-gruppen og gruppen uden indgreb (p=0,256), og der var større overlevelse hos de patienter, der gennemgik LC (p
0,001). Selv om dødeligheden var større hos de patienter, der gennemgik PC, havde de en højere CCI (5 versus 3,8) sammenlignet med de patienter, der gennemgik LC. Der skal således tages hensyn til disse undersøgelsesbegrænsninger, når man fortolker resultaterne og drager konklusioner. I en anden undersøgelse, der blev offentliggjort i 2014, kunne der ikke påvises reduceret morbiditet og mortalitet hos patienter, der blev behandlet med PC,37 men det bør nævnes, at protokollen for PC-behandling var heterogen og varierede mellem centrene, hvilket til dels kan have bidraget til variationen i resultaterne.
CHOCOLATE-protokollen blev offentliggjort i 2012 med henblik på at give et mere endegyldigt svar på PC-debatten. Det var en multicenter, randomiseret, kontrolleret undersøgelse af interventionsoverlegenhed. Den forsøgte at sammenligne resultatet mellem at udføre LC versus PC-placering hos patienter med AC, der havde en APACHE-score >7 point. Antallet af patienter, der skulle rekrutteres, var 284 over en 2-årig periode, på 30 centre med stor volumen. Det primære mål var at analysere komplikationerne inden for de første 3 måneder efter indgrebet og dødeligheden efter et år (Netherlands Trial Register ; NTR2666).38 Resultaterne af protokollen blev ikke offentliggjort, da den blev suspenderet i 2016, efter at den foreløbige analyse viste større morbiditet og dødelighed hos de patienter, der blev behandlet med PC.
Disse undersøgelser sætter den reelle nytte af PC hos patienter med svær AC i tvivl. Der er dog stor uenighed omkring det, da der er behov for randomiserede undersøgelser, så udvælgelsesbias kan elimineres. Størstedelen af den nuværende tilgængelige evidens er retrospektiv og omfatter et stort antal patienter, der er “så alvorlige”, at de har en høj dødelighed, uanset hvilken intervention der tilbydes.
Det er vigtigt at understrege, at patienter, der ikke er højrisikopatienter, ikke har nogen komorbiditeter og er kandidater til LC, overhovedet ikke har gavn af PC-placering. Nogle undersøgelser tyder på, at resultatet endog kan forværres ved brug af nævnte strategi.39,40 Efter vores erfaring anser vi det ikke for tilrådeligt at udføre laparoskopisk cholecystostomi som en redningsmetode efter en mislykket LC, fordi det er mere anbefalelsesværdigt at udføre en subtotal cholecystektomi i dette scenarie, hvis der var tekniske vanskeligheder under indgrebet. I de undersøgelser, der har sammenlignet PC versus åben cholecystektomi hos kritisk syge patienter med akalculøs cholecystitis, er der observeret mindre morbiditet, færre dage med hospitalsophold og lavere tilknyttede omkostninger hos patienter, der har gennemgået PC-placering.41
Beskrivelse af teknikken til ultralydsvejledt placering af perkutan cholecystostomi
Når beslutningen er truffet om at udføre PC, skal det først defineres, hvilken tilgang der skal anvendes til placering af drænet, om det er transhepatisk eller transperitonealt. Afhængigt af den enkelte patient og den enkelte kirurg kan man vælge det ene eller det andet, hver med sine fordele og ulemper.
I patienter med større risiko for blødning beskrives traditionelt den transperitoneale tilgang for at undgå leverpunktur. På den anden side foretrækkes den transhepatiske tilgang hos patienter, hvis galdeblære er meget udspilet (> 10 cm på den lange akse eller > 5 cm på den aksiale akse), for at mindske risikoen for perforation og galdeudsivning samt galdeperitonitis.
Et andet vigtigt aspekt at tage hensyn til er patientens habitus og evne til at bevæge sig, fordi det kan hindre den ene eller den anden tilgang på grund af dårlig visualisering af galdeblæren eller vanskeligheder med at nå galdeblæren på grund af en kompleks tractus. Når alle ovennævnte aspekter er blevet analyseret, kan den mest hensigtsmæssige tilgang vælges.
I vores erfaring er PC normalt et indgreb, der udføres ved patientens seng ved hjælp af trokarteknik, selv om den modificerede Seldinger-teknik traditionelt er beskrevet. Vores tekniske succesrate svarer til den, der er rapporteret i litteraturen (data skal offentliggøres).
Den trinvise teknik, der anvendes til ultralydsvejledt PC-placering, er beskrevet nedenfor (Fig. 1).
- 1
Udfør passende asepsis og antisepsis i området omkring højre hypokondrium.
- 2
Scan galdeblæren ved hjælp af ultralyd for at bekræfte diagnosen AC.
- 3
Infiltrer huden og det subkutane cellevæv med 2 % lidocain.
- 4
Korriger tilstedeværelsen af det materiale, der er nødvendigt for at placere kateteret, ved hjælp af den valgte teknik.
- 5
Lokaliser galdeblæren ved hjælp af ultralydsscanning. Udfør den transperitoneale eller transhepatiske punktering. Indfør og fremfør derefter multifunktionskatetret gennem galdevejene (8,5 Fr) over metalstyretråden, indtil det er placeret i galdeblæren (Fig. 2).
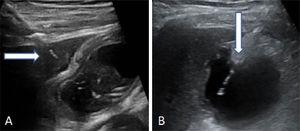 Figur 2.
Figur 2.To måder at udføre galdeblærepunktur på. (A) Transhepatisk indføring af nålen. Pilen peger på den hepatiske kuppel. (B) Transperitoneal indgang af nålen direkte ind i galdeblærens fundus.
(0,25 MB).- 6
Udtræk metalstyretråden, så kateteret forbliver placeret inde i galdeblæren.
- 7
Fiksér kateteret til huden med en 3.0 prolenstik.
- 8
Udtag galdevæsken, der skal sendes til mikrobiologisk laboratorium med henblik på dyrkning.
- 9
Placer en opsamlingspose i den distale ende af kateteret, så afledningen forbliver.
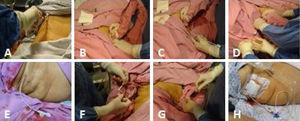 Fig. 1.
Fig. 1.(A) Asepsis af højre hypokondrium. (B) Scanning af galdeblæren. (C) Ultralydsvejledt indføring af kateteret sammen med metalstyretråden i retning af galdeblæren. (D) Metaltråden trækkes ud, idet man sørger for at lade kateteret blive på plads med front mod galdeblærens lumen og endnu en gang bekræfter ved hjælp af ultralyd, at det er korrekt placeret i galdeblæren. (E) Cholecystostomikatetret er på plads. (F) Kateteret fastgøres med et simpelt sting til huden ved hjælp af prolene 3-0. (G) Galdevæske aspireres og sendes til dyrkning. (H) Diversionskolecystostomikatetret med opsamlingsposen.
(0.2MB).Percutane cholecystostomikomplikationer
PC-placering anses generelt for at være en sikker og effektiv procedure. Mere end 90 % af patienterne forventes at præsentere en forbedring af smerter og det systemiske inflammatoriske respons inden for de første 48 timer efter PC-placering.42 Komplikationer er imidlertid blevet beskrevet i ca. 3 % af tilfældene. De hyppigste komplikationer er hæmobili, pneumothorax, galdeudsivning, galdeperitonitis, koledocholithiasis og abscesser.43,44 Eksteriorisering af kateteret er altid en risiko, hvilket kan gøre det vanskeligt at placere det igen, når galdeblæren er dekomprimeret.45,46
Risikoen for recidiv af AC efter fjernelse af PC varierer fra 6 til 40 %.47-49 AC-recidiv er blevet rapporteret, selv hos patienter med et funktionelt og permeabelt kateter, og det forekommer generelt inden for de første 2 måneder efter dets placering.50 Længere hospitalsophold hos patienter med PC er blevet rapporteret i nogle caseserier.51 Dette længere ophold er højst sandsynligt forbundet med den større sværhedsgrad hos de patienter, der tilbydes PC, snarere end at være en direkte konsekvens af proceduren.52 Tidssvarende PC-placering, hvilket betyder inden for de første 24 timer fra symptomdebut, er effektiv med hensyn til at reducere hospitalsopholdet. Det blev dokumenteret i en undersøgelse fra 2015, hvor kun patienter med sen PC-placering havde længere hospitalsophold.53
Hvornår skal cholecystostomikatetret fjernes
Helt generelt bør PC’en fjernes, når patienten er stabil, og det akutte billede er aftaget. Ikke desto mindre er det ideelle tidspunkt for fjernelse ikke blevet præcist defineret.54 Kolangiografi udført gennem PC’en er blevet udført for at vurdere cystisk ductus permeabilitet. Der er rapporteret lavere AC-recidivrater hos patienter med en permeabel cystisk kanal,55 men dataene er modstridende. AC-recidiv kan forekomme i nogle tilfælde, selv om kolangiografi dokumenterer galdegangspermeabilitet.56
Et retrospektivt kohortestudie offentliggjort i 2017 evaluerede to grupper. Gruppe 1 (n=43) gennemgik rutinemæssig kolangiografi før fjernelse af cholecystostomi, og gruppe 2 gennemgik kun on-demand-kolangiografi (n=41). De patienter, der fik on-demand-kolangiografi, havde et bedre resultat, da de havde tidligere fjernelse af drænet, en højere andel af tidlig cholecystektomi og mindre ressourceforbrug.57
På tidspunktet for udførelse af LC som endelig behandling skal man være særlig forsigtig, da selv om betændelse i galdeblæren er aftaget eller forsvundet, er patientens komorbiditeter generelt fortsat, hvilket betyder, at operationen kan være mere kompliceret end først overvejet.58,59 Der er rapporteret en hyppighed af konvertering til åben kirurgi i dette scenarie på mellem 11 og 32 %.60-63 Interval cholecystectomi udføres generelt uden tekniske problemer hos unge patienter uden komorbiditeter.64,65
Den definitive behandling
Colecystostomiplacering er ideelt set en overgangsbehandling før den definitive behandling, der udføres, når patienten præsenterer sig med forbedring af sin almene tilstand.66,67 Mere end 95 % af patienterne får cholecystektomi som definitive behandling,68 men cholecystostomi er i case-serier rapporteret at forblive på ubestemt tid hos 30 til 50 % af patienterne.69-71 Nogle forfattere anbefaler PC-placering som endelig og permanent behandling hos ældre patienter og patienter med en høj kirurgisk risiko.72
I en deskriptiv undersøgelse udført inden for tidsrammen 2000 til 2011 på 36 patienter, der fik PC-placering, fordi de blev betragtet som “højrisikopatienter”, rapporterede forfatterne 100 % symptomløsning 3 dage efter PC-placering hos alle patienterne. PC var den endelige behandling hos 63 % af patienterne, mens der kun blev udført endelig LC hos 6 patienter (16 %).73 Andre forfattere går ind for at udføre LC under samme hospitalsindlæggelse, fordi forsinket LC er forbundet med tab af patienter til opfølgning.74 Andre undersøgelsesgrupper er enige om, at hyppigheden af kateterrelaterede komplikationer er høj, og foreslår, at PC fjernes, så snart det akutte inflammatoriske respons er kontrolleret, selv inden for de første 10 dage efter kateterplaceringen.75,76
I vores centers erfaring fjernes cholecystostomien, når patienten er programmeret til cholecystektomi inden for de følgende 2 uger, med det ene formål at forbedre patientens livskvalitet før operationen. Kateteret fjernes kun, hvis patienten er asymptomatisk, ikke har tegn på systemisk inflammatorisk respons og har tegn på en permeabel cystisk ductus cysticus. Det fjernes også hos patienter, der skal underkastes definitiv cholecystectomi. Hvis disse kriterier ikke er opfyldt, er det vores holdning at lade cholecystostomikatetret blive siddende på ubestemt tid.
Vi foreslår den algoritme, der er vist i fig. 3 for fjernelse af cholecystostomikatetret.
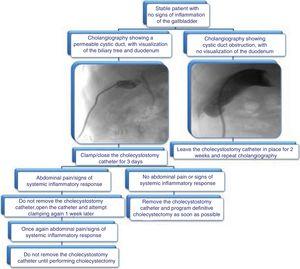 Fig. 3.
Fig. 3.Forslag til algoritme for håndtering af cholecystostomikatetre: evaluering af fjernelse gennem kolangiografi og kliniske data.
(0.35MB).Det er vigtigt at understrege, at der er blevet rapporteret en større hyppighed af infektion på operationsstedet hos de patienter, der gennemgår fjernelse af cholecystostomi og derefter LC. Sagnet infektion er blevet beskrevet i op til 16 % af tilfældene.77
Konklusioner
Percutan dekompression af galdeblæren er en meget kendt behandling, men der findes stadig ikke nogen standardiseret strategi for behandling af cholecystostomikatetre, hvilket gør det vanskeligt at foretage en ensartet undersøgelse af disse patienter med den nuværende tilgængelige litteratur. På trods af den sparsomme evidens kan der alligevel opstilles nogle overvejelser:
- –
Højrisikokirurgiske patienter med diagnosen AC, hos hvem akut LC er kontraindiceret, synes at være de bedste kandidater til PC-placering.
- –
Der er ingen evidens, der støtter PC-placering hos stabile patienter uden kontraindikation for at gennemgå LC.
- –
Fjernelse af PC-kateter bør kun foretages, efter at cystisk ductuspermeabilitet er blevet dokumenteret ved kolangiografi, hvis kateteret giver patienten ubehag, og hvis patienten er kandidat til endelig kirurgisk behandling inden for en “rimelig” og hensigtsmæssig tidsperiode for at reducere muligheden for at præsentere tilbagevendende akut cholecystitis.
Der er kun lidt evidens for håndteringen af perkutane cholecystostomikatetre, og der er i øjeblikket behov for randomiserede undersøgelser for at evaluere den bedste strategi at følge i denne gruppe af patienter.
Etiske oplysninger
Beskyttelse af mennesker og dyr. Forfatterne erklærer, at der ikke blev udført forsøg på mennesker eller dyr i forbindelse med denne artikel.
Fortrolighed af data. Forfatterne erklærer, at de har behandlet alle patientdata med fortrolighed og anonymitet i overensstemmelse med protokollerne for deres arbejdscenter.
Ret til privatlivets fred og informeret samtykke. Forfatterne erklærer, at der ikke optræder patientdata i denne artikel, der kompromitterer deres identitet, og at det derfor ikke var nødvendigt at indhente deres informerede samtykke.
Finansiel oplysning
Der er ikke modtaget økonomisk støtte i forbindelse med denne artikel.
Interessekonflikter
Forfatterne erklærer, at der ikke er nogen interessekonflikter.
- 6
Leave a Reply