Perkutane Cholezystostomie als Behandlung der akuten Cholezystitis: Was hat sich in den letzten fünf Jahren getan? Eine Literaturübersicht | Revista de Gastroenterología de México
Einführung
Die Gallenblasenpathologie ist eine der häufigsten Erkrankungen, mit denen der Allgemeinchirurg konfrontiert wird. Derzeit gilt die laparoskopische Cholezystektomie (LC) als Goldstandard in der Behandlung der akuten Cholezystitis (AC). Es wurden Anstrengungen unternommen, um die mit dem Verfahren verbundene Morbidität und Mortalität bei chirurgischen Hochrisikopatienten durch weniger invasive Eingriffe wie die perkutane Cholezystostomie (PC) zu verringern.
Die AC ist eine entzündliche Erkrankung der Gallenblase, deren Pathophysiologie in einer Obstruktion der Abflusswege der Gallenblase oder einer Dysmotilität ihrer Wände besteht, was zu einem Anstieg des intraluminalen Drucks, einem Wandödem, einer veränderten Vaskularität mit Ischämie oder Nekrose, einer bakteriellen Proliferation oder einer Perforation der Gallenblase führt. Das Ziel der PC bei AC ist es, die Drainage des Gallengangs zu ermöglichen, um die akuten Symptome zu beheben und die Entwicklung lokaler und systemischer Komplikationen zu verhindern. Die PC ist im Allgemeinen Patienten mit AC vorbehalten, die ein hohes chirurgisches Risiko aufweisen oder bei denen ein Organversagen vorliegt. Die PC bietet in diesem Zusammenhang nützliche Vorteile: Sie erfordert keine Vollnarkose, kann am Bett des Patienten durchgeführt werden, ist ein schnelles Verfahren, hat eine Erfolgsquote von über 95 %, eine niedrige Komplikationsrate und kann als Überbrückungstherapie vor einer elektiven Operation eingesetzt werden.
Die Gallenblasendrainage ist eine Behandlungsoption, die in den wichtigsten internationalen Leitlinien für das AC-Management enthalten ist, aber es gibt immer noch einige Kontroversen über ihre Ergebnisse bei kritisch kranken Patienten, ihre genauen Indikationen und ihre Überlegenheit im Vergleich zu einer definitiven chirurgischen Behandlung.
Es gibt nur wenige Erkenntnisse über die Überwachung und Pflege von Patienten, die sich einer PC unterziehen. Die meisten Studien konzentrieren sich auf die Auswahl der Patienten, die von dem Verfahren profitieren, aber nur wenige beschreiben das anschließende Patientenmanagement. Wir analysieren hier die Evidenz zum Nutzen der PC bei AC und schlagen einen Algorithmus für das PC-Kathetermanagement vor.
Kriterien für die Klassifizierung des Schweregrads der akuten Cholezystitis
Die Tokioter Leitlinien 2018 (TG18) zur AC klassifizieren den Schweregrad der Erkrankung als leicht (Grad I), mittelschwer (Grad II) und schwer (Grad III).1 Diese Klassifizierung berücksichtigt die Begleiterkrankungen der Patienten, die Dauer der Symptome, die körperlichen Befunde bei der Krankenhausaufnahme, die Anzeichen einer systemischen Entzündungsreaktion, das Vorhandensein einer ausgeprägten lokalen Entzündung in bildgebenden Untersuchungen und die Entwicklung einer Organfunktionsstörung. Die TG-Klassifikation ist nützlich, da der Schweregrad der Krankheitsdarstellung mit der Sterblichkeit, der Morbidität, der Dauer des Krankenhausaufenthalts und der Rate der Konversion von laparoskopischer Chirurgie zu offener Chirurgie korreliert (Tabellen 1 und 2).
Klassifikation des Schweregrads der akuten Cholezystitis nach den Tokioter Leitlinien 2018.1
| Grad I (leicht) | Grad II (mittelschwer) | Grad III (schwer) |
|---|---|---|
|
Eine der folgenden Erkrankungen:
|
Eine der folgenden Organfunktionsstörungen:
|
Charakteristika der verschiedenen Schweregrade.
| Mortalität nach 30 Tagen2 | Morbidität78 | Krankenhausaufenthalt78,a | Konversionsrate78,a | |
|---|---|---|---|---|
| Grad I | 1.1% | 2,9% | 3 (1-16) | 7% |
| Grad II | 0.8% | 3,1% | 4 (1-33) | 25,6% |
| Grad III | 5,4% | 11.1% | 7 (1-60) | 34,6% |
Mittelwert±SD.
Eine frühzeitige LC (innerhalb von 72h) sollte idealerweise bei AC Grad I und Grad II durchgeführt werden, wenn der Charlson Comorbidity Index (CCI) und die funktionelle Kapazität nach dem Klassifizierungssystem der American Society of Anesthesiologists (ASA) darauf hindeuten, dass der Patient eine Operation vertragen kann. Im Gegenteil, es sollte zunächst eine medizinische Behandlung erfolgen (Antibiotika und allgemeine Unterstützung) und eine chirurgische Behandlung erwogen werden, sobald sich der Zustand verbessert hat. Bei AC des Grades II kommt die Empfehlung hinzu, eine perkutane Drainage durchzuführen, wenn der Patient eine chirurgische Behandlung nicht verträgt.1
Die Tokioter Leitlinien (TG13) von 2013 stufen AC als Grad III ein, wenn Anzeichen für eine Organfunktionsstörung vorliegen, d. h. wenn eine kardiovaskuläre, neurologische, respiratorische, renale, hepatische oder hämatologische Insuffizienz besteht. Laut TG13 ist eine Notfall-LC kontraindiziert, wenn eine Funktionsstörung in diesen Organsystemen vorliegt. Im Jahr 2017 lieferten Yokoe et al.2 jedoch Informationen über die Behandlung von AC in einer japanischen und taiwanesischen Population (n=5.329), in der eine LC bei der Mehrheit der Patienten mit AC Grad III erfolgreich durchgeführt wurde. Dieselbe Kohorte wurde später erneut analysiert, wobei der Schwerpunkt auf Patienten mit Organfunktionsstörungen lag, die sich einer chirurgischen Behandlung sicher unterziehen konnten. Die Patienten mit einem CCI>6 Punkten wiesen eine höhere Sterblichkeitsrate auf. Der größte Nutzen dieser Studie lag in der multivariaten logistischen Regressionsanalyse, aus der hervorging, dass Gelbsucht, neurologische Funktionsstörungen und Atmungsstörungen bei Patienten mit AC Grad III unabhängige prädiktive Faktoren für die Sterblichkeit nach 30 Tagen waren. Es gab jedoch keine Hinweise auf eine erhöhte Sterblichkeit bei Patienten mit AC Grad III, die andere Arten von Organversagen aufwiesen und bei denen eine LC durchgeführt wurde.3 Daher definiert die TG18 neurologische Funktionsstörungen, Atemstörungen oder das Vorhandensein von Gelbsucht (Gesamtbilirubinspiegel ≥ 2 mg/dl) als prädiktive Faktoren für die Sterblichkeit bei AC Grad III. Nierenfunktionsstörungen und kardiovaskuläre Funktionsstörungen werden dagegen als günstige Formen des Organversagens angesehen, da sie sich nach Einleitung einer ersten medizinischen Behandlung häufig rückgängig machen lassen und somit keine Kontraindikation für eine chirurgische Behandlung darstellen.1
Indikationen für die Anlage einer perkutanen Cholezystostomie
Im Allgemeinen ist die häufigste Indikation für die Anlage einer PC eine schwere AC.4-9 Seltener sind Indikationen, bei denen eine Umleitung der Gallenwege über einen transcholezystischen Zugang angestrebt wird, was in der Mehrzahl der Fälle als relativ zweitrangig angesehen wird, da endoskopische oder transhepatische Umleitungen bevorzugt werden. Die genannten Szenarien sind in Tabelle 3.10-13
Indikationen für die Anlage einer perkutanen Cholezystostomie zusammengefasst.
Schwere akute Cholezystitis gemäß den Tokio-Leitlinien 2018
Akute Cholezystitis und ASA-Klassifikation >3 oder Charlson-Komorbiditätsindex >6
Zweitlinienzugang zu den Gallenwegen:Überbrückung bösartiger GallenwegsläsionenGallengangsstrikturdilatationGallengangsfistelausleitungGallengangsdekompression bei CholangitisSonstige
Im Gegensatz zu den in der TG13 festgelegten,14 unterstreicht die TG18 die Tatsache, dass eine Notfall-Gallenblasendrainage bei Grad-II-AC durchgeführt werden kann, wenn eine Laparoskopie nicht verfügbar ist und eine unzureichende Reaktion auf die erste medizinische Behandlung vorliegt, vor allem bei Patienten, die sich in einem „schlechten“ Allgemeinzustand präsentieren (CCI>6 Punkte oder ASA-Klassifizierung >3). Diese Vermutung wird durch eine multizentrische retrospektive Studie aus dem Jahr 2017 gestützt15 , die 1.764 Patienten über einen Zeitraum von zwei Jahren einschloss, aber nur 330 Patienten zu Vergleichszwecken in zwei Gruppen einteilte. Gruppe 1 bestand aus 330 Patienten, die sich einer transhepatischen perkutanen Drainage und einer transhepatischen perkutanen Aspiration unterzogen, und Gruppe 2 bestand aus 330 Patienten, die sich einer endoskopischen transpapillären Gallenblasendrainage unterzogen. Die Ergebnisse wurden am 3. und 7. postoperativen Tag ausgewertet. Am Tag 3 betrug die therapeutische Erfolgsquote 62,5 % (Cholezystostomie) und 69,8 % (endoskopische Behandlung). Am Tag 7 lag die therapeutische Erfolgsrate bei 87,6 % (Cholezystostomie) und 89,2 % (endoskopische Behandlung). Es wurden keine signifikanten Unterschiede zwischen den frühen und späten Erfolgsraten festgestellt. Die Komplikationshäufigkeit lag in der Cholezystostomiegruppe bei 4,8 % und in der endoskopischen Drainagegruppe bei 8,2 %, wobei in der statistischen Auswertung keine Unterschiede festgestellt wurden. Bei den Komplikationen in der Cholezystostomiegruppe handelte es sich um 8 Patienten mit Katheterwanderung, einen Patienten mit Blutung und 3 Patienten mit Gallenleckage. Diese Studie zeigte, dass die perkutane Drainage wirksam ist und die gleiche Wirksamkeit wie die endoskopische Behandlung hat. Obwohl die Patienten nicht nach dem Schweregrad der AC stratifiziert wurden, stellten die Autoren im Diskussionsteil fest, dass es in der Studie höchstwahrscheinlich zu einer Verzerrung kam, da viele Patienten mit schwerer (Grad III) und mittelschwerer (Grad II) AC eingeschlossen waren.
Die Behandlungsempfehlungen bei AC des Grades III gehörten zu den größten Änderungen in der TG18 gegenüber der TG13. Zuvor war die Notfall-Gallenblasendrainage (endoskopisch oder transhepatisch) die einzige Empfehlung,13 was auf eine nicht explizite Tendenz zur Vermeidung einer chirurgischen Notfallbehandlung hinweist, um die Morbidität und Mortalität nicht zu erhöhen. Auch wenn die TG18 diese Empfehlung wiederholen, wurde die Option einer frühen LC nach Einführung einer Antibiotikabehandlung und Normalisierung der Organfunktionen hinzugefügt.16 Daher ist es bei der Diagnose von AC, insbesondere Grad III, wichtig, den CCI und die ASA-Funktionsfähigkeit zu berechnen und festzustellen, ob der Patient günstige prädiktive Faktoren für ein Organversagen (Nieren- oder Herz-Kreislauf-Schäden) aufweist. Diese Patienten könnten sich nach Beginn der medizinischen Behandlung rasch erholen und Kandidaten für eine endgültige Behandlung mit einer LC werden.
Die Weltgesellschaft für Notfallchirurgie empfiehlt die Durchführung einer perkutanen Drainage der Gallenblase bei „Hochrisikopatienten“, gibt aber keine genaue Definition dieser Patienten, was dazu führen kann, dass verschiedene Fachleute, die an der Behandlung der akuten Cholezystitis beteiligt sind, unterschiedliche Entscheidungen treffen.17
Trotz der allgemeinen Akzeptanz der PC-Positionierung bei Patienten mit schwerer AC18,19 und der berichteten Beweise für eine relativ niedrige Sterblichkeitsrate (17 %)20 ist die beste Behandlungsoption immer noch Gegenstand von Debatten, da einige Gruppen über ein akzeptables Ergebnis mit einer Notfall-LC bei kritisch kranken Patienten berichten.21-25
Risiko der Konversion von einer laparoskopischen Cholezystektomie zu einer offenen Operation
Auch für die Vorhersage des Risikos einer Konversion von einer LC zu einer offenen Cholezystektomie wurden verschiedene Faktoren beschrieben.26,27 Einige Autoren schlagen vor, dass Patienten mit hohem Konversionsrisiko als Kandidaten für eine anfängliche PC-Positionierung betrachtet werden sollten und sich nach Abklingen des Entzündungsprozesses einer späten LC unterziehen sollten (Tabelle 4).28,29
Risikofaktoren für die Konversion zur offenen Cholezystektomie.
| Lipman et al. (2007)26 | Männliches Geschlecht (OR 4,06, 95% CI: 2,42-6.82)Leukozytose 3,01 (OR 3,01, 95% CI: 1,77-5,13),Hypoalbuminämie (OR 2,90, 95% CI: 1,70-4,96),pericholezystische Flüssigkeit (OR 2,36, 95% CI: 1,25-4,47)Diabetes mellitus (OR 1,87, 95% CI: 1,03-3,42)Erhöhtes Gesamtbilirubin (OR 1.85, 95% CI: 1.01-3.39) |
| Kim et al. (2014)27 | Höheres Alter (OR 1.05, 95% CI: 1.008-1.10),Männliches Geschlecht (OR 5.0, 95% CI: 1.31-19.05),Pericholezystische Flüssigkeit (OR17.22, 95% CI: 4.36-67.94). |
| Masri et al. (2018)79 | Frauengeschlecht (OR 0,09, 95% CI: 0,03-0,25)Fortgeschrittenes Alter (OR 2,15, 95% CI: 1,62-2,85)Anamnese einer abdominalen Operation (OR 4,66, 95% CI: 1,78-12,17)Anamnese einer Lungenerkrankung, z.B., COPD (OR 6.03, 95% CI: 1.21-29.97)Serumhämoglobin mg/dl (OR 36.57, 95% CI: 3.16-423.72) |
| Morales Maza et al. (2019)a | Männliches Geschlecht (OR 1.64, 95% CI: 0,48-5,58)Gallenblasenwanddurchmesser (OR 1,35, 95% CI: 1,03-1,76)Höheres Alter (OR 1,02, 95% CI: 1,00-1,04)Pericholezystische Flüssigkeit (OR 2,84, 95% CI: 1,04-7.69) |
In Arbeit.
Der Nutzen einer anfänglichen konservativen Behandlung, bei der zunächst ein PC platziert und dann eine Intervall-LC bei Patienten mit AC-Symptomen mit einer Progression von mehr als 72 Stunden durchgeführt wird, wurde ebenfalls untersucht. Karakayali et al.30 analysierten eine Gruppe von Patienten mit einer AC von mehr als 72 Stunden Dauer und einer Symptomprogression von 48 Stunden nach der ersten medizinischen Behandlung. Die Patienten (n=92) wurden nicht zufällig entweder einer PC und dann einer Intervall-LC oder einer Notfall-LC zugewiesen. Die Gruppe, die sich einer Intervall-LC unterzog, hatte eine niedrigere Konversionsrate (40 % vs. 19 %; p=0,029), weniger intraoperativen Blutverlust (33 % vs. 9 %; p=0,006), einen kürzeren Krankenhausaufenthalt (5,3 Tage vs. 3,0; p=0,001) und eine geringere Häufigkeit von Komplikationen im Allgemeinen (35 % vs. 9 %; p=0,003).
El-Gendi et al.31 randomisierten eine Gruppe von Patienten (n=150) mit AC für mehr als 72 Stunden Progression zu einer Notfall-LC vs. PC und Intervall-LC 6 Wochen später. Ihre Analyse ergab, dass die Gruppe mit PC und Intervall-Cholezystektomie eine geringere Konversionshäufigkeit (24% vs. 2,27%; p
0,001), einen geringeren intraoperativen Blutverlust (durchschnittlich 41,73ml vs. 26,33ml; p=0,008), eine kürzere Operationsdauer (87,8min vs. 38,09min; p0.001), eine geringere Rate an subtotalen Cholezystektomien (17,3 % vs. 0,0 %; p0,001), ein kürzerer Krankenhausaufenthalt (51,71h vs. 10,76h; p0,001) und weniger postoperative Komplikationen (26,7 % vs. 2,7 %; p0,001).
Eine weitere erwähnenswerte Gruppe sind Patienten mit akalkulöser AC. Es handelt sich dabei häufig um kritisch kranke Patienten mit Multiorganversagen, die für eine PC als Erstbehandlung der Wahl zur Behebung der akuten Symptome in Frage kommen. Bei Patienten mit Anzeichen einer Gallenblasenperforation, Gangrän oder einer Verschlechterung der Symptome nach der PC-Positionierung sollte jedoch eine Notfall-Cholezystektomie durchgeführt werden.32
Kontraindikationen für die perkutane Cholezystostomie
Es gibt keine absoluten Kontraindikationen für die PC. Es gibt nur wenige relative Kontraindikationen, darunter eine Koagulopathie, die das Risiko für schwere Blutungen bedingt (Thrombozyten
×109/l oder INR>1.5), eine Allergie gegen jodhaltige Kontrastmittel (zur Bestätigung der adäquaten Katheterplatzierung mittels Durchleuchtung (obwohl dies auch mittels Ultraschall möglich ist),33 und die Überlappung von Darmsegmenten an der Punktionsstelle (extrem selten, da die Leber die Überlappung der Segmente behindert).34
Bei Patienten mit Aszites wird vor der PC-Platzierung eine Parazentese empfohlen. Es ist zu betonen, dass die Häufigkeit von PC-Komplikationen bei Patienten mit Aszites gering ist und sich nicht signifikant von Patienten ohne Aszites unterscheidet. Eine dicht mit Gallensteinen gefüllte Gallenblase kann ebenfalls die sichere Platzierung des PC-Katheters erschweren.35
Gibt es einen Rückgang der Sterblichkeit bei der perkutanen Cholezystostomie bei „Hochrisikopatienten“
Die vorhandenen Belege für den Rückgang der Sterblichkeit bei Hochrisikopatienten mit AC, die sich einer PC unterziehen, wurden in einer Studie aus dem Jahr 2014 in der Datenbank des California Health System analysiert. Ihr Hauptziel war es, die Sterblichkeit und ihre zeitliche Entwicklung in drei Gruppen von AC-Patienten zu bestimmen: diejenigen, bei denen eine PC eingesetzt wurde, diejenigen, die sich einer LC unterzogen, und diejenigen, die sich aufgrund der Schwere ihrer Erkrankung keiner der beiden Strategien unterzogen.36 Insgesamt wurden 43.341 Patienten untersucht, wobei sich eine Sterblichkeitsrate von 61,7 % bei den mit PC behandelten Patienten, 42 % bei den Patienten, die keine invasive Behandlung erhielten, und 23 % bei den Patienten, die sich einer LC unterzogen, ergab. Bei Patienten mit schwerer Sepsis und septischem Schock gab es keinen Unterschied im Überleben zwischen der PC-Gruppe und der Gruppe ohne Intervention (p=0,256), während die Patienten, die sich einer LC unterzogen, länger überlebten (p
0,001). Obwohl die Sterblichkeit bei den Patienten, die sich einer PC unterzogen, höher war, hatten sie einen höheren CCI (5 gegenüber 3,8) als die Patienten, die sich einer LC unterzogen. Bei der Interpretation der Ergebnisse und dem Ziehen von Schlussfolgerungen müssen daher diese Einschränkungen der Studie berücksichtigt werden. In einer anderen, 2014 veröffentlichten Studie konnte eine geringere Morbidität und Mortalität bei Patienten, die mit PC behandelt wurden, nicht nachgewiesen werden,37 aber es sollte erwähnt werden, dass das Protokoll der PC-Behandlung heterogen war und zwischen den Zentren variierte, was teilweise zu der Variabilität der Ergebnisse beigetragen haben könnte.
Das CHOCOLATE-Protokoll wurde 2012 mit der Absicht veröffentlicht, eine schlüssigere Antwort auf die PC-Debatte zu geben. Es handelte sich um eine multizentrische, randomisierte, kontrollierte Studie zur Überlegenheit der Intervention. Es wurde versucht, das Ergebnis zwischen der Durchführung einer LC- und einer PC-Platzierung bei Patienten mit AC zu vergleichen, die einen APACHE-Score >7 Punkte hatten. Es wurden 284 Patienten über einen Zeitraum von 2 Jahren in 30 hochvolumigen Zentren rekrutiert. Primäres Ziel war es, die Komplikationen innerhalb der ersten drei Monate nach dem Eingriff und die Sterblichkeitsrate nach einem Jahr zu analysieren (Netherlands Trial Register; NTR2666).38 Die Ergebnisse des Protokolls wurden nicht veröffentlicht, da es 2016 ausgesetzt wurde, nachdem die vorläufige Analyse eine höhere Morbidität und Mortalität bei den mit PC behandelten Patienten gezeigt hatte.
Diese Studien stellen den tatsächlichen Nutzen von PC bei Patienten mit schwerer AC in Frage. Sie ist jedoch sehr umstritten, da randomisierte Studien erforderlich sind, um Selektionsverzerrungen auszuschließen. Der Großteil der derzeit verfügbaren Daten ist retrospektiv und umfasst eine große Anzahl von Patienten, die „so schwer“ sind, dass sie unabhängig von der angebotenen Intervention eine hohe Sterblichkeitsrate aufweisen.
Es ist wichtig zu betonen, dass Patienten, die kein hohes Risiko aufweisen, keine Begleiterkrankungen haben und Kandidaten für eine LC sind, überhaupt nicht von der PC-Platzierung profitieren. Einige Studien deuten darauf hin, dass sich das Ergebnis bei Anwendung dieser Strategie sogar verschlechtern kann.39,40 Unserer Erfahrung nach halten wir es nicht für ratsam, nach einer fehlgeschlagenen LC eine laparoskopische Cholezystostomie als Rettungsmaßnahme durchzuführen, da es in diesem Szenario empfehlenswerter ist, eine subtotale Cholezystektomie vorzunehmen, wenn es während des Eingriffs technische Schwierigkeiten gab. In den Studien, die die PC mit der offenen Cholezystektomie bei kritisch kranken Patienten mit akalkulöser Cholezystitis verglichen haben, wurden bei Patienten, bei denen eine PC gelegt wurde, eine geringere Morbidität, weniger Tage Krankenhausaufenthalt und niedrigere Kosten festgestellt.41
Beschreibung der Technik für die ultraschallgesteuerte Platzierung der perkutanen Cholezystostomie
Wenn die Entscheidung für die PC gefallen ist, muss zunächst der Ansatz für die Platzierung der Drainage, ob transhepatisch oder transperitoneal, festgelegt werden. Je nach Patient und Chirurg kann der eine oder der andere Zugang gewählt werden, wobei jeder seine Vor- und Nachteile hat.
Bei Patienten mit erhöhtem Blutungsrisiko wird traditionell der transperitoneale Zugang beschrieben, um eine Leberpunktion zu vermeiden. Andererseits wird der transhepatische Zugang bei Patienten bevorzugt, deren Gallenblase stark gebläht ist (> 10cm an der Längsachse oder > 5cm an der Achsenachse), um das Risiko einer Perforation und eines Gallenaustrittes sowie einer Gallenperitonitis zu verringern.
Ein weiterer wichtiger Aspekt, den es zu berücksichtigen gilt, ist der Habitus und die Bewegungsfähigkeit des Patienten, da dies den einen oder anderen Zugang aufgrund einer schlechten Sichtbarkeit der Gallenblase oder aufgrund von Schwierigkeiten, die Gallenblase aufgrund eines komplexen Trakts zu erreichen, erschweren kann. Sobald alle oben genannten Aspekte analysiert worden sind, kann der am besten geeignete Zugang gewählt werden.
Nach unserer Erfahrung ist die PC in der Regel ein Verfahren, das am Bett des Patienten mit der Trokar-Technik durchgeführt wird, auch wenn traditionell die modifizierte Seldinger-Technik beschrieben wird. Unsere technische Erfolgsrate ist vergleichbar mit der in der Literatur berichteten (Daten werden noch veröffentlicht).
Die Schritt-für-Schritt-Technik für die ultraschallgesteuerte PC-Platzierung wird im Folgenden beschrieben (Abb. 1).
- 1
Die entsprechende Asepsis und Antisepsis im Bereich des rechten Hypochondriums durchführen.
- 2
Die Gallenblase mittels Ultraschall abtasten, um die Diagnose AC zu bestätigen.
- 3
Die Haut und das subkutane Zellgewebe mit 2% Lidocain infiltrieren.
- 4
Das Vorhandensein des für die Platzierung des Katheters erforderlichen Materials durch die gewählte Technik bestätigen.
- 5
Die Gallenblase durch Ultraschall lokalisieren. Führen Sie die transperitoneale oder transhepatische Punktion durch. Dann den Mehrzweckkatheter durch die Gallenwege (8,5 Fr) über den Metallführungsdraht einführen und vorschieben, bis er in der Gallenblase positioniert ist (Abb. 2).
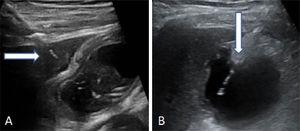 Abb. 2.
Abb. 2.Zwei Arten, die Gallenblase zu punktieren. (A) Transhepatischer Zugang der Nadel. Der Pfeil zeigt auf die Leberkuppel. (B) Transperitonealer Zugang der Nadel direkt in den Fundus der Gallenblase.
(0.25MB). - 6
Den metallischen Führungsdraht herausziehen, wobei der Katheter in der Gallenblase verbleibt.
- 7
Den Katheter mit einem 3.0 Prolenstich.
- 8
Entnehmen Sie die Gallenflüssigkeit und schicken Sie sie zur Kultur an das mikrobiologische Labor.
- 9
Am distalen Ende des Katheters einen Auffangbeutel anbringen und die Umleitung belassen.
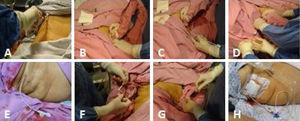
(A) Asepsis des rechten Hypochondriums. (B) Scannen der Gallenblase. (C) Ultraschallgesteuerte Einführung des Katheters zusammen mit dem Metallführungsdraht in Richtung Gallenblase. (D) Der Metallführungsdraht wird herausgezogen, wobei darauf geachtet wird, dass der Katheter mit Blick auf das Gallenblasenlumen an Ort und Stelle verbleibt, und seine adäquate Position in der Gallenblase erneut durch Ultraschall bestätigt wird. (E) Der platzierte Cholezystostomiekatheter. (F) Der Katheter wird mit einer einfachen Naht unter Verwendung von Prolene 3-0 auf der Haut fixiert. (G) Gallenflüssigkeit wird aspiriert und zur Kulturierung eingeschickt. (H) Der Umleitungskatheter für die Cholezystostomie mit dem Auffangbeutel.
Komplikationen bei der perkutanen Cholezystostomie
Die Platzierung des PC gilt allgemein als sicheres und effektives Verfahren. Es wird erwartet, dass bei mehr als 90 % der Patienten innerhalb der ersten 48 Stunden nach der PC-Positionierung eine Besserung der Schmerzen und der systemischen Entzündungsreaktion eintritt.42 In etwa 3 % der Fälle wurden jedoch Komplikationen beschrieben. Die häufigsten Komplikationen sind Hämobilie, Pneumothorax, Gallenleckage, Gallenperitonitis, Choledocholithiasis und Abszesse.43,44 Die Exteriorisation des Katheters stellt immer ein Risiko dar, was eine erneute Platzierung des Katheters erschweren kann, sobald die Gallenblase dekomprimiert ist.45,46
Das Risiko eines erneuten Auftretens von AC nach einer PC-Entfernung schwankt zwischen 6 und 40 %.47-49 Ein Wiederauftreten von AC wurde selbst bei Patienten mit einem funktionierenden und durchlässigen Katheter berichtet und tritt im Allgemeinen innerhalb der ersten 2 Monate nach seiner Platzierung auf.50 In einigen Fallserien wurde über eine längere Krankenhausverweildauer bei Patienten mit PC berichtet.51 Diese längere Verweildauer steht höchstwahrscheinlich im Zusammenhang mit dem höheren Schweregrad bei den Patienten, denen ein PC angeboten wird, und ist nicht eine direkte Folge des Verfahrens.52 Eine rechtzeitige PC-Platzierung, d. h. innerhalb der ersten 24 Stunden nach Auftreten der Symptome, kann die Krankenhausverweildauer wirksam reduzieren. Dies wurde in einer Studie aus dem Jahr 2015 dokumentiert, in der nur Patienten mit einer späten PC-Platzierung einen längeren Krankenhausaufenthalt hatten.53
Wann sollte der Cholezystostomiekatheter entfernt werden
Im Allgemeinen sollte der PC entfernt werden, sobald der Patient stabil ist und das akute Bild abgeklungen ist. Der ideale Zeitpunkt für die Entfernung des Katheters ist jedoch nicht genau definiert.54 Zur Beurteilung der Durchlässigkeit des Zystikus wurde eine Cholangiographie durch den PC durchgeführt. Bei Patienten mit einem durchlässigen Ductus cysticus wurde über niedrigere AC-Rezidivraten berichtet,55 aber die Daten sind widersprüchlich. In einigen Fällen kann ein AC-Rezidiv auftreten, auch wenn die Cholangiographie eine Gallengangspermeabilität dokumentiert.56
In einer 2017 veröffentlichten retrospektiven Kohortenstudie wurden zwei Gruppen untersucht. Gruppe 1 (n=43) unterzog sich einer routinemäßigen Cholangiografie vor der Entfernung der Cholezystostomie und Gruppe 2 unterzog sich nur einer On-demand-Cholangiografie (n=41). Die Patienten, bei denen eine On-Demand-Cholangiographie durchgeführt wurde, hatten ein besseres Ergebnis, da bei ihnen die Drainage früher entfernt wurde, die Cholezystektomierate höher war und weniger Ressourcen verbraucht wurden.57
Bei der Durchführung einer LC als endgültige Behandlung ist besondere Vorsicht geboten, denn auch wenn die Entzündung der Gallenblase zurückgegangen oder verschwunden ist, bleiben die Begleiterkrankungen der Patienten in der Regel bestehen, was bedeutet, dass die Operation komplizierter sein kann als zunächst angenommen.58,59 Die Häufigkeit der Konversion zu einer offenen Operation in diesem Szenario liegt zwischen 11 und 32 %.60-63 Die Intervall-Cholezystektomie wird im Allgemeinen ohne technische Probleme bei jungen Patienten ohne Komorbiditäten durchgeführt.64,65
Definitive Behandlung
Die Anlage einer Cholezystostomie ist idealerweise eine Überbrückungstherapie vor der definitiven Behandlung, die durchgeführt wird, sobald sich der Allgemeinzustand des Patienten verbessert hat.66,67 Bei mehr als 95 % der Patienten wird eine Cholezystektomie als definitive Behandlung durchgeführt,68 aber in Fallserien wurde berichtet, dass die Cholezystostomie bei 30 bis 50 % der Patienten auf unbestimmte Zeit bestehen bleibt.6971 Einige Autoren empfehlen die PC-Positionierung als endgültige und dauerhafte Behandlung bei älteren Patienten und bei Patienten mit hohem chirurgischem Risiko.72
In einer deskriptiven Studie, die im Zeitraum von 2000 bis 2011 an 36 Patienten durchgeführt wurde, bei denen eine PC-Positionierung vorgenommen wurde, weil sie als „Hochrisikopatienten“ eingestuft wurden, berichteten die Autoren über eine 100-prozentige Symptombehebung drei Tage nach der PC-Positionierung bei allen Patienten. Die PC war bei 63 % der Patienten die definitive Behandlung, während die definitive LC nur bei 6 Patienten (16 %) durchgeführt wurde.73 Andere Autoren sprechen sich dafür aus, die LC während desselben Krankenhausaufenthalts durchzuführen, da eine verzögerte LC mit dem Verlust von Patienten zur Nachuntersuchung verbunden ist.74 Andere Studiengruppen stimmen darin überein, dass die Häufigkeit katheterbedingter Komplikationen hoch ist, und empfehlen, den PC zu entfernen, sobald die akute Entzündungsreaktion unter Kontrolle ist, sogar innerhalb der ersten 10 Tage nach der Katheterplatzierung.75,76
Nach den Erfahrungen unseres Zentrums wird die Cholezystostomie entfernt, sobald der Patient für eine Cholezystektomie innerhalb der nächsten 2 Wochen vorgesehen ist, und zwar mit dem einzigen Ziel, die Lebensqualität des Patienten vor der Operation zu verbessern. Der Katheter wird nur dann entfernt, wenn der Patient asymptomatisch ist, keine Anzeichen einer systemischen Entzündungsreaktion aufweist und Anzeichen für einen durchlässigen Zystikus vorhanden sind. Er wird auch bei Patienten entfernt, bei denen eine endgültige Cholezystektomie vorgesehen ist. Wenn diese Kriterien nicht erfüllt sind, belassen wir den Cholezystostomiekatheter auf unbestimmte Zeit an Ort und Stelle.
Wir schlagen den in Abb. 3 dargestellten Algorithmus zur Entfernung des Cholezystostomiekatheters vor.
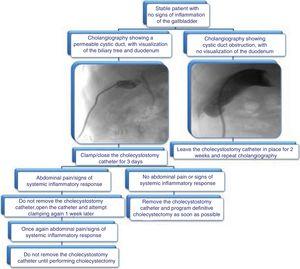
Vorgeschlagener Algorithmus für das Management von Cholezystostomiekathetern: Bewertung der Entfernung durch Cholangiographie und klinische Daten.
Es ist wichtig zu betonen, dass bei Patienten, die sich einer Cholezystostomie-Entfernung und anschließender LC unterziehen, eine größere Häufigkeit von Infektionen an der Operationsstelle berichtet wurde. Eine solche Infektion wurde in bis zu 16 % der Fälle beschrieben.77
Schlussfolgerungen
Die perkutane Dekompression der Gallenblase ist eine weithin bekannte Behandlung, aber es gibt immer noch keine standardisierte Strategie für das Management von Cholezystostomiekathetern, was die einheitliche Untersuchung dieser Patienten mit der derzeit verfügbaren Literatur schwierig macht. Trotz des Mangels an Evidenz können einige Überlegungen angestellt werden:
- –
Hochrisikopatienten, bei denen eine AC diagnostiziert wurde und bei denen eine Notfall-LC kontraindiziert ist, scheinen die besten Kandidaten für eine PC-Platzierung zu sein.
- –
Es gibt keine Evidenz, die eine PC-Platzierung bei stabilen Patienten ohne Kontraindikation für eine LC unterstützt.
- –
Die Entfernung des PC-Katheters sollte nur dann erfolgen, wenn die Durchlässigkeit des Gallengangs mittels Cholangiographie dokumentiert wurde, wenn der Katheter dem Patienten Beschwerden bereitet und wenn der Patient ein Kandidat für eine endgültige chirurgische Behandlung innerhalb eines „vernünftigen“ und angemessenen Zeitraums ist, um die Möglichkeit einer rezidivierenden akuten Cholezystitis zu verringern.
Es gibt nur wenige Erkenntnisse über das Management von perkutanen Cholezystostomiekathetern, und randomisierte Studien zur Bewertung der besten Strategie für diese Patientengruppe sind derzeit erforderlich.
Ethische Angaben
Schutz von Mensch und Tier. Die Autoren erklären, dass für diesen Artikel keine Experimente an Menschen oder Tieren durchgeführt wurden.
Geheimhaltung von Daten. Die Autoren erklären, dass sie alle Patientendaten gemäß den Protokollen ihres Arbeitszentrums vertraulich und anonym behandelt haben.
Recht auf Privatsphäre und informierte Zustimmung. Die Autoren erklären, dass in diesem Artikel keine Patientendaten erscheinen, die ihre Identität gefährden, und dass es daher nicht notwendig war, ihre informierte Zustimmung einzuholen.
Finanzielle Offenlegung
Im Zusammenhang mit diesem Artikel wurde keine finanzielle Unterstützung gewährt.
Interessenkonflikt
Die Autoren erklären, dass es keinen Interessenkonflikt gibt.
Leave a Reply