La cholécystostomie percutanée comme traitement de la cholécystite aiguë : Que s’est-il passé au cours des cinq dernières années ? Une revue de la littérature | Revista de Gastroenterología de México
Introduction
La pathologie de la vésicule biliaire est l’une des maladies les plus fréquentes auxquelles est confronté le chirurgien général. Actuellement, la cholécystectomie laparoscopique (CL) est considérée comme la référence en matière de traitement de la cholécystite aiguë (CA). Un effort a été fait pour réduire la morbidité et la mortalité associées à la procédure chez les patients chirurgicaux à haut risque par des interventions moins invasives, telles que la cholécystostomie percutanée (CP).
L’AC est une maladie inflammatoire de la vésicule biliaire dont la physiopathologie consiste en une obstruction des voies de drainage de la vésicule biliaire ou une dysmotilité de ses parois, ce qui conditionne une augmentation de la pression intraluminale, un œdème de la paroi, une altération de la vascularisation avec ischémie ou nécrose, une prolifération bactérienne ou une perforation de la vésicule biliaire. L’objectif de la PC dans la CA est de permettre le drainage du canal biliaire pour résoudre les symptômes aigus et prévenir le développement de complications locales et systémiques. La PC est généralement réservée aux patients atteints de CA qui sont des patients à haut risque chirurgical ou qui présentent une défaillance organique. La PC présente des avantages utiles dans ce contexte : l’anesthésie générale n’est pas nécessaire, elle peut être réalisée au chevet du patient, c’est une procédure rapide, son taux de réussite est supérieur à 95 %, elle présente un faible taux de complications et elle peut être utilisée comme thérapie de transition avant une chirurgie élective.
Le drainage de la vésicule biliaire est une option thérapeutique incluse dans les principales directives internationales pour la prise en charge de l’AC, mais il existe encore une certaine controverse quant à ses résultats chez les patients gravement malades, ses indications précises et sa supériorité par rapport au traitement chirurgical définitif.
Il existe peu de données probantes sur la surveillance et les soins des patients qui subissent une PC. La majorité des études se concentrent sur la sélection des patients qui bénéficieront de l’intervention, mais peu décrivent la prise en charge ultérieure des patients. Nous analysons ici les preuves de l’utilité de la PC dans la CA et suggérons un algorithme pour la gestion des cathéters de PC.
Critères de classification de la gravité de la cholécystite aiguë
Les lignes directrices de Tokyo 2018 (TG18) sur la CA classent la gravité de la maladie en légère (grade I), modérée (grade II) et sévère (grade III).1 Ladite classification tient compte des comorbidités du patient, de la durée des symptômes, des constatations physiques à l’admission à l’hôpital, des signes de réponse inflammatoire systémique, de la présence d’une inflammation locale marquée dans les études d’imagerie et du développement d’un dysfonctionnement des organes. La classification TG est utile car la gravité de la présentation de la maladie est en corrélation avec la mortalité, la morbidité, la durée du séjour hospitalier et le taux de conversion de la chirurgie laparoscopique en chirurgie ouverte (tableaux 1 et 2).
Classification de la gravité de la cholécystite aiguë selon les lignes directrices de Tokyo 20181.
| Grade I (léger) | Grade II (modéré) | Grade III (sévère) |
|---|---|---|
|
Aucune des conditions suivantes :
|
Un des dysfonctionnements organiques suivants :
|
Caractéristiques des différents grades de gravité.
| Mortalité à 30 jours2 | Morbidité78 | Séjour hospitalier78,a | Taux de conversion78,a | |
|---|---|---|---|---|
| Grade I | 1.1% | 2,9% | 3 (1-16) | 7% |
| Grade II | 0.8% | 3,1% | 4 (1-33) | 25,6% |
| Grade III | 5,4% | 11.1% | 7 (1-60) | 34,6% |
Moyenne±SD.
Une CL précoce (dans les 72h) devrait idéalement être réalisée en cas de CA de grade I et II, si l’indice de comorbidité de Charlson (CCI) et la capacité fonctionnelle selon le système de classification de l’American Society of Anesthesiologists (ASA) suggèrent que le patient peut tolérer la chirurgie. Au contraire, il faut établir un traitement médical initial (antibiotiques et soutien général) et envisager un traitement chirurgical une fois que les conditions s’améliorent. Dans le cas d’un CA de grade II, la recommandation de réaliser un drainage percutané est ajoutée lorsque le patient ne peut pas tolérer un traitement chirurgical.1
Les lignes directrices de Tokyo 2013 (TG13) classent le CA au grade III lorsqu’il existe des preuves de dysfonctionnement des organes, le définissant en cas d’insuffisance cardiovasculaire, neurologique, respiratoire, rénale, hépatique ou hématologique. Selon le TG13, la CL d’urgence est contre-indiquée en cas de dysfonctionnement de ces systèmes organiques. Cependant, en 2017, Yokoe et al.2 ont fourni des informations sur le traitement du CA dans une population japonaise et taïwanaise (n=5 329), dans laquelle la CL a été réalisée avec succès sur une majorité de patients présentant un CA de grade III. La même cohorte a ensuite été réanalysée, en mettant l’accent sur les patients présentant un dysfonctionnement des organes et pouvant subir un traitement chirurgical en toute sécurité. Les patients ayant un CCI>6 points présentaient un taux de mortalité plus élevé. La principale utilité de cette étude était son analyse de régression logistique multivariée, qui a montré que la jaunisse, le dysfonctionnement neurologique et le dysfonctionnement respiratoire étaient des facteurs prédictifs indépendants de la mortalité à 30 jours chez les patients présentant un CA de grade III. Néanmoins, il n’y avait aucune preuve d’une augmentation de la mortalité chez les patients atteints de CA de grade III qui présentaient d’autres types de défaillance d’organes et qui ont subi une CL.3 Ainsi, le TG18 définit la dysfonction neurologique, la dysfonction respiratoire ou la présence d’un ictère (taux de bilirubine totale ≥ 2mg/dl) comme des facteurs prédictifs de mortalité dans le CA de grade III. D’autre part, la dysfonction rénale et la dysfonction cardiovasculaire sont considérées comme des types favorables de défaillance d’organe, étant donné qu’elles peuvent souvent être inversées après la mise en place d’un traitement médical initial, et par conséquent, ne pas contre-indiquer le traitement chirurgical.1
Indications pour la pose d’une cholécystostomie percutanée
En termes généraux, l’indication la plus fréquente pour la pose d’une CP est le CA sévère4.-Les indications les moins fréquentes sont celles dont l’objectif est de dévier la voie biliaire au moyen d’un accès transcholécystique, qui est considéré comme relativement de seconde intention dans la majorité des cas en raison de la préférence pour la réalisation de dérivations endoscopiques ou transhépatiques. Lesdits scénarios sont résumés dans le tableau 3.10-13
Indications pour la pose d’une cholécystostomie percutanée.
Cholécystite aiguë sévère selon les lignes directrices de Tokyo 2018
Cholécystite aiguë et classification ASA >3 ou indice de comorbidité de Charlson >6
Accès de deuxième intention aux voies biliaires :Pontage d’une lésion maligne des voies biliairesDilatation d’une sténose des voies biliairesDérivation du débit d’une fistule des voies biliairesDécompression des voies biliaires dans la cholangiteAutres
Contrairement à ce qui a été établi dans le TG13,14, le TG18 souligne le fait que le drainage de la vésicule biliaire en urgence peut être effectué dans le cas d’un CA de grade II lorsque la laparoscopie n’est pas disponible et qu’il y a une réponse inadéquate au traitement médical initial, principalement chez les patients qui présentent un état général » médiocre » (CCI>6 points ou classification ASA >3). Cette suggestion est étayée par une étude rétrospective multicentrique de 201715 qui a inclus 1 764 patients sur une période de deux ans, mais n’a associé que 330 patients en deux groupes à des fins de comparaison. Le groupe 1 était composé de 330 patients qui ont subi un drainage percutané transhépatique et une aspiration percutanée transhépatique et le groupe 2 était composé de 330 patients qui ont subi un drainage endoscopique transpapillaire de la vésicule biliaire. Les résultats ont été analysés les jours 3 et 7 après l’intervention. Au jour 3, le taux de succès thérapeutique était de 62,5 % (cholécystostomie) et de 69,8 % (traitement endoscopique). Au jour 7, le taux de succès thérapeutique était de 87,6 % (cholécystostomie) et de 89,2 % (traitement endoscopique). Aucune différence significative n’a été constatée dans les taux de réussite précoce ou tardive. La fréquence des complications était de 4,8 % dans le groupe cholécystostomie et de 8,2 % dans le groupe drainage endoscopique, et aucune différence statistique n’a été constatée dans l’analyse statistique. Les complications signalées dans le groupe cholécystostomie étaient les suivantes : 8 patients avec migration du cathéter, un patient avec saignement et 3 patients avec fuite biliaire. Cette étude a montré que le drainage percutané était efficace, ayant la même efficacité que la prise en charge endoscopique. Même si les patients n’ont pas été stratifiés en fonction de la gravité du CA, les auteurs ont déclaré dans la section de discussion qu’un biais s’est probablement produit dans l’étude en raison de l’inclusion d’une fréquence élevée de patients présentant un CA sévère (grade III) et modéré (grade II).
Les recommandations de traitement dans les cas de CA de grade III faisaient partie des plus grands changements dans le TG18, par rapport au TG13. Auparavant, le drainage d’urgence de la vésicule biliaire (endoscopique ou transhépatique) était la seule recommandation,13 indiquant une tendance non explicite à éviter le traitement chirurgical d’urgence, pour ne pas augmenter la morbidité et la mortalité. Même si le TG18 réitère cette recommandation, l’option de réaliser un CL précoce, après avoir établi un traitement antibiotique et normalisé la fonction des organes, a été ajoutée.16 Par conséquent, lors du diagnostic de CA, en particulier de grade III, il est essentiel de calculer la CCI et la capacité fonctionnelle ASA et d’identifier si le patient présente des facteurs prédictifs favorables de défaillance d’organe (lésion rénale ou cardiovasculaire). Ces patients pourraient présenter un rétablissement rapide après le début du traitement médical, devenant ainsi des candidats au traitement définitif par CL.
La Société mondiale de chirurgie d’urgence, recommande d’effectuer un drainage percutané de la vésicule biliaire chez les patients « à haut risque », mais elle ne donne pas de définition précise desdits patients, ce qui peut entraîner des décisions différentes selon les professionnels impliqués dans le traitement de la cholécystite aiguë17.
Malgré l’acceptation généralisée de la mise en place d’une PC chez les patients souffrant d’une AC sévère,18,19 et les preuves rapportées d’un taux de mortalité relativement faible (17%),20 la meilleure option de traitement reste un sujet de débat, étant donné que certains groupes rapportent un résultat acceptable avec la CL d’urgence chez les patients gravement malades.21-25
Risque de conversion de la cholécystectomie laparoscopique en chirurgie ouverte
Différents facteurs ont également été décrits pour prédire le risque de conversion de la CL en cholécystectomie ouverte.26,27 Certains auteurs proposent que les patients présentant un risque élevé de conversion soient considérés comme des candidats à la mise en place initiale d’une PC et, une fois le processus inflammatoire résolu, subissent une LC tardive (tableau 4).28,29
Facteurs de risque de conversion en cholécystectomie ouverte.
| Lipman et al. (2007)26 | Sexe masculin (OR 4,06, IC 95 % : 2,42-6.82)Leucocytose 3,01 (OR 3,01, IC 95 % : 1,77-5,13),Hypoalbuminémie (OR 2,90, IC 95 % : 1,70-4,96),Liquide péricholectique (OR 2,36, IC 95 % : 1,25-4,47)Diabète sucré (OR 1,87, IC 95 % : 1,03-3,42)Bilirubine totale élevée (OR 1.85, IC 95 % : 1,01-3,39) |
| Kim et al. (2014)27 | Age avancé (OR 1,05, IC 95 % : 1,008-1,10),Sexe masculin (OR 5,0, IC 95 % : 1,31-19,05),Liquide péricholectique (OR17,22, IC 95 % : 4,36-67,94). |
| Masri et al. (2018)79 | Sexe féminin (OR 0,09, IC 95 % : 0,03-0,25)Âge avancé (OR 2,15, IC 95 % : 1,62-2,85)Antécédents de chirurgie abdominale (OR 4,66, IC 95 % : 1,78-12,17)Antécédents de maladie pulmonaire, par ex, BPCO (OR 6,03, IC 95 % : 1,21-29,97)Hémoglobine sérique mg/dl (OR 36,57, IC 95 % : 3,16-423,72) |
| Morales Maza et al. (2019)a | Sexe masculin (OR 1.64, IC 95 % : 0,48-5,58)Diamètre de la paroi de la vésicule biliaire (OR 1,35, IC 95 % : 1,03-1,76)Âge avancé (OR 1,02, IC 95 % : 1,00-1,04)Liquide péricholectique (OR 2,84, IC 95 % : 1,04-7.69) |
En cours de publication.
L’utilité d’un traitement conservateur initial, consistant à placer d’abord un PC puis à réaliser une LC par intervalle chez les patients présentant des symptômes de CA de plus de 72 heures d’évolution, a également été étudiée. Karakayali et al.30 ont analysé un groupe de patients présentant un CA d’une durée supérieure à 72 heures et une progression des symptômes de 48 heures après une prise en charge médicale initiale. Les patients (n=92) ont été assignés de manière non aléatoire à subir une PC puis une CL à intervalles ou à subir une CL d’urgence. Le groupe qui a subi une CL d’intervalle avait un taux de conversion plus faible (40 % contre 19 % ; p=0,029), moins de pertes sanguines peropératoires (33 % contre 9 % ; p=0,006), un séjour hospitalier plus court (5,3 jours contre 3,0 ; p=0,001) et une fréquence plus faible de complications en général (35 % contre 9 % ; p=0,003).
El-Gendi et al.31 ont randomisé un groupe de patients (n=150) présentant un AC de plus de 72h de progression pour qu’ils subissent une CL d’urgence vs PC et CL d’intervalle 6 semaines plus tard. Leur analyse a montré que le groupe PC et cholécystectomie d’intervalle avait une fréquence de conversion plus faible (24% vs. 2,27% ; p
0,001), moins de perte de sang peropératoire (moyenne 41,73ml vs. 26,33ml ; p=0,008), une durée de chirurgie plus courte (87,8min vs. 38,09min ; p0.001), un taux plus faible de cholécystectomie subtotale (17,3% vs. 0,0% ; p0,001), un séjour hospitalier plus court (51,71h vs. 10,76h ; p0,001), et moins de complications postopératoires (26,7% vs. 2,7% p0,001), respectivement.
Les patients atteints de CA acalculé constituent un autre groupe digne d’être mentionné. Il s’agit souvent de patients gravement malades, présentant une défaillance de plusieurs organes, et qui sont candidats à la PC comme traitement initial de choix pour résoudre les symptômes aigus. Cependant, les patients présentant des signes de perforation de la vésicule biliaire, de gangrène ou de progression des symptômes après la pose d’une PC doivent subir une cholécystectomie en urgence.32
Contre-indications à la pose d’une cholécystostomie percutanée
Il n’existe pas de contre-indications absolues à la PC. Les contre-indications relatives sont peu nombreuses et comprennent une coagulopathie qui conditionne le risque de saignement grave (plaquettes
×109/l ou INR>1.5), l’allergie au produit de contraste iodé (employé pour confirmer le placement adéquat du cathéter par fluoroscopie (bien que cela puisse être fait par échographie),33 et le chevauchement des segments intestinaux au site de ponction (extrêmement rare car le foie empêche le chevauchement des segments).34
La paracentèse est suggérée chez les patients présentant une ascite, avant le placement du PC. Il faut souligner que la fréquence des complications de la PC chez les patients présentant une ascite est faible et n’est pas significativement différente de celle des patients ne présentant pas d’ascite. Une vésicule biliaire remplie de calculs biliaires peut également empêcher la mise en place sécurisée du cathéter de PC.35
Y a-t-il une diminution de la mortalité avec la mise en place d’une cholécystostomie percutanée chez les patients « à haut risque » ?
Détaillant les preuves existantes sur la diminution de la mortalité chez les patients à haut risque avec AC qui subissent une PC, une étude de 2014 a analysé la base de données du California Health System. Son objectif principal était de déterminer la mortalité et sa temporalité dans 3 groupes de patients atteints de CA : ceux qui ont subi une PC, ceux qui ont subi une CL et ceux qui n’ont subi aucune des deux stratégies en raison de la gravité de leur état.36 Au total, 43 341 patients ont été étudiés, ce qui a donné lieu à un taux de mortalité de 61,7 % chez les patients traités par PC, de 42 % chez les patients qui n’ont subi aucun traitement invasif et de 23 % chez les patients qui ont subi une CL. Il n’y a pas eu de différence de survie chez les patients atteints de sepsis sévère et de choc septique lors de la comparaison entre le groupe PC et le groupe sans intervention (p=0,256), et la survie a été plus grande chez les patients qui ont subi une CL (p
0,001). Même si la mortalité était plus élevée chez les patients qui ont subi une PC, ils avaient une CCI plus élevée (5 contre 3,8), par rapport aux patients qui ont subi une CL. Il faut donc tenir compte de ces limites de l’étude pour interpréter les résultats et tirer des conclusions. Dans une autre étude publiée en 2014, la réduction de la morbidité et de la mortalité chez les patients pris en charge par PC n’a pas pu être démontrée,37 mais il convient de mentionner que le protocole de prise en charge de la PC était hétérogène et variait entre les centres, ce qui pourrait avoir contribué en partie à la variabilité des résultats.
Le protocole CHOCOLATE a été publié en 2012 dans l’intention d’apporter une réponse plus concluante au débat sur la PC. Il s’agissait d’une étude multicentrique, randomisée et contrôlée sur la supériorité de l’intervention. Elle tentait de comparer le résultat entre la pose d’une CL par rapport à la pose d’une PC chez les patients atteints de CA qui avaient un score APACHE >7 points. Le nombre de patients à recruter était de 284 sur une période de 2 ans, dans 30 centres à haut volume. L’objectif principal était d’analyser les complications dans les 3 premiers mois après l’intervention et le taux de mortalité à un an (Netherlands Trial Register ; NTR2666).38 Les résultats du protocole n’ont pas été publiés, étant donné qu’il a été suspendu en 2016, après que l’analyse préliminaire ait montré une plus grande morbidité et mortalité chez les patients traités par PC.
Ces études mettent en doute l’utilité réelle de la PC chez les patients atteints d’AC sévère. Cependant, elle fait l’objet de nombreuses controverses, étant donné que des études randomisées sont nécessaires afin d’éliminer les biais de sélection. La majorité des preuves actuellement disponibles sont rétrospectives et incluent un grand nombre de patients qui sont » si sévères » qu’ils ont un taux de mortalité élevé, quelle que soit l’intervention proposée.
Il est important de souligner que les patients qui ne sont pas à haut risque, qui n’ont pas de comorbidités et qui sont candidats à la CL, ne bénéficient absolument pas de la pose d’une PC. Certaines études suggèrent que les résultats peuvent même s’aggraver avec l’utilisation de cette stratégie.39,40 Dans notre expérience, nous ne considérons pas qu’il soit conseillé de réaliser une cholécystostomie laparoscopique comme méthode de secours après l’échec d’une CL, car il est plus recommandable de réaliser une cholécystectomie subtotale dans ce scénario, en cas de difficultés techniques pendant la procédure. Dans les études qui ont comparé la PC par rapport à la cholécystectomie ouverte chez les patients gravement malades atteints de cholécystite acalculée, une morbidité moindre, moins de jours d’hospitalisation et des coûts associés plus bas ont été observés chez les patients ayant subi la mise en place d’une PC.41
Description de la technique de mise en place échoguidée de la cholécystostomie percutanée
Une fois la décision prise de réaliser une PC, il faut d’abord définir l’approche à utiliser pour mettre en place le drain, qu’il soit transhépatique ou transpéritonéal. En fonction de chaque patient et de chaque chirurgien, l’un ou l’autre peut être choisi, chacun ayant ses avantages et ses inconvénients.
Chez les patients présentant un risque hémorragique plus important, l’approche transpéritonéale est traditionnellement décrite, pour éviter la ponction du foie. En revanche, l’approche transhépatique est préférée chez les patients dont la vésicule biliaire est très distendue (> 10cm dans le grand axe ou > 5cm dans l’axe axial), pour réduire le risque de perforation et de fuite biliaire, ainsi que de péritonite biliaire.
Un autre aspect important à prendre en compte est l’habitus du patient et sa capacité à se déplacer car il peut entraver l’une ou l’autre approche en raison d’une mauvaise visualisation de la vésicule biliaire ou d’une difficulté à atteindre la vésicule biliaire en raison d’un tractus complexe. Une fois que tous les aspects mentionnés ci-dessus ont été analysés, l’approche la plus appropriée peut être choisie.
Dans notre expérience, la PC est généralement une intervention réalisée au lit du patient par la technique du trocart, bien que la technique de Seldinger modifiée soit traditionnellement décrite. Notre taux de réussite technique est similaire à celui rapporté dans la littérature (données à publier).
La technique étape par étape employée pour la mise en place de PC guidée par échographie est décrite ci-dessous (Fig. 1).
- 1
Préparer l’asepsie et l’antisepsie appropriées dans la région de l’hypochondre droit.
- 2
Scanner la vésicule biliaire par échographie pour corroborer le diagnostic de CA.
- 3
Infiltrer la peau et le tissu cellulaire sous-cutané avec de la lidocaïne à 2%.
- 4
Corroborer la présence du matériel nécessaire à la pose du cathéter par la technique choisie.
- 5
Localiser la vésicule biliaire par échographie. Réaliser la ponction transpéritonéale ou transhépatique. Puis introduire et avancer le cathéter polyvalent dans les voies biliaires (8,5 Fr) sur le fil-guide métallique jusqu’à ce qu’il soit positionné dans la vésicule biliaire (Fig. 2).
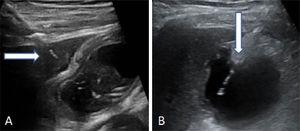 Fig. 2.
Fig. 2.Deux manières d’effectuer la ponction de la vésicule biliaire. (A) Entrée transhépatique de l’aiguille. La flèche pointe vers le dôme hépatique. (B) Entrée transpéritonéale de l’aiguille directement dans le fond de la vésicule biliaire.
(0,25MB). - 6
Extraire le fil guide métallique, laissant le cathéter positionné à l’intérieur de la vésicule biliaire.
- 7
Fixer le cathéter à la peau avec un point de 3.0 point de prolongement.
- 8
Extraire le liquide biliaire qui sera envoyé au laboratoire de microbiologie pour culture.
- 9
Placez une poche de recueil à l’extrémité distale du cathéter en laissant la dérivation.
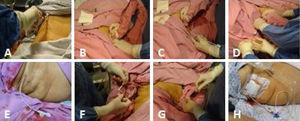
(A) Asepsie de l’hypocondre droit. (B) Scanner de la vésicule biliaire. (C) Introduction échoguidée du cathéter avec le fil-guide métallique en direction de la vésicule biliaire. (D) Le fil-guide métallique est extrait en prenant soin de laisser le cathéter en place, face à la lumière de la vésicule biliaire, et en corroborant à nouveau par échographie sa position adéquate à l’intérieur de la vésicule biliaire. (E) Le cathéter de cholécystostomie en place. (F) Le cathéter est fixé par un simple point de suture à la peau en utilisant du prolène 3-0. (G) Le fluide biliaire est aspiré et envoyé pour culture. (H) Le cathéter de cholécystostomie de dérivation avec le sac de collecte.
Complications de la cholécystostomie percutanée
La mise en place d’une CP est généralement considérée comme une procédure sûre et efficace. Plus de 90% des patients devraient présenter une amélioration de la douleur et de la réponse inflammatoire systémique dans les 48h suivant la pose de la CP.42 Cependant, des complications ont été décrites dans environ 3% des cas. Les complications les plus fréquentes sont l’hémobilie, le pneumothorax, la fuite biliaire, la péritonite biliaire, la cholédocholithiase et les abcès.43,44 L’extériorisation du cathéter est toujours un risque, ce qui pourrait rendre sa remise en place difficile, une fois la vésicule biliaire décompressée.45,46
Le risque de récurrence de l’AC après l’ablation du PC varie de 6 à 40%.47-49 La récurrence de l’AC a été rapportée, même chez les patients dont le cathéter est fonctionnel et perméable, et survient généralement dans les 2 premiers mois de sa mise en place.50 Un séjour hospitalier plus long chez les patients ayant une PC a été rapporté dans certaines séries de cas.51 Ce séjour plus long est très probablement associé à la plus grande sévérité chez les patients à qui l’on propose une PC, plutôt que d’être une conséquence directe de la procédure.52 La pose opportune d’une PC, c’est-à-dire dans les premières 24 heures suivant l’apparition des symptômes, est efficace pour réduire le séjour hospitalier. Cela a été documenté dans une étude de 2015, dans laquelle seuls les patients avec un placement tardif de la CP ont eu un séjour hospitalier plus long.53
Quand retirer le cathéter de cholécystostomie
En général, la CP doit être retirée une fois que le patient est stable et que le tableau aigu a disparu. Néanmoins, le moment idéal de retrait n’a pas été défini avec précision.54 Une cholangiographie réalisée à travers le PC a été effectuée pour évaluer la perméabilité du canal cystique. Des taux de récidive de CA plus faibles ont été rapportés chez les patients ayant un canal cystique perméable,55 mais les données sont contradictoires. La récidive du CA peut se présenter dans certains cas, même si la cholangiographie documente la perméabilité des voies biliaires.56
Une étude de cohorte rétrospective publiée en 2017 a évalué deux groupes. Le groupe 1 (n=43) a subi une cholangiographie de routine avant l’ablation de la cholécystostomie et le groupe 2 a subi uniquement une cholangiographie à la demande (n=41). Les patients qui ont subi une cholangiographie à la demande ont eu de meilleurs résultats, étant donné qu’ils ont bénéficié d’un retrait plus précoce du drain, d’un taux plus élevé de cholécystectomie précoce et d’une utilisation moindre des ressources.57
Au moment de réaliser une CL comme traitement définitif, une attention particulière doit être apportée, étant donné que même si l’inflammation de la vésicule biliaire a diminué ou disparu, les comorbidités du patient persistent généralement, ce qui signifie que la chirurgie peut être plus compliquée que ce qui était envisagé au départ.58,59 Une fréquence de conversion en chirurgie ouverte dans ce scénario a été rapportée entre 11 et 32%.60-63 La cholécystectomie d’intervalle est généralement réalisée sans problème technique chez des patients jeunes et sans comorbidités.64,65
Traitement définitif
La mise en place d’une cholécystostomie est idéalement une thérapie de transition avant le traitement définitif qui est effectué une fois que le patient présente une amélioration de son état général.66,67 Plus de 95 % des patients ont une cholécystectomie comme traitement définitif,68 mais il a été rapporté dans des séries de cas que la cholécystostomie restait indéfiniment chez 30 à 50 % des patients69.-Certains auteurs recommandent la pose d’une CP comme traitement définitif et permanent chez les patients âgés et ceux présentant un risque chirurgical élevé.72
Dans une étude descriptive menée entre 2000 et 2011 sur 36 patients ayant subi une pose de CP parce qu’ils étaient considérés comme des patients » à haut risque « , les auteurs ont rapporté une résolution de 100 % des symptômes 3 jours après la pose de CP chez tous les patients. La PC a été le traitement définitif chez 63% des patients, la CL définitive n’ayant été réalisée que chez 6 patients (16%).73 D’autres auteurs sont favorables à la réalisation de la CL au cours de la même hospitalisation, car la CL tardive est associée à la perte de suivi des patients.74 D’autres groupes d’étude s’accordent à dire que la fréquence des complications liées au cathéter est élevée et suggèrent de retirer le PC dès que la réponse inflammatoire aiguë a été contrôlée, même dans les 10 premiers jours suivant la pose du cathéter.75,76
Dans l’expérience de notre centre, la cholécystostomie est retirée une fois que le patient est programmé pour une cholécystectomie dans les 2 semaines suivantes, dans le seul but d’améliorer la qualité de vie du patient avant la chirurgie. Le cathéter n’est retiré que si le patient est asymptomatique, ne présente aucun signe de réponse inflammatoire systémique et présente des signes de perméabilité du canal cystique. Il est également retiré chez les patients qui vont subir une cholécystectomie définitive. Si ces critères ne sont pas remplis, notre position est de laisser le cathéter de cholécystostomie en place indéfiniment.
Nous proposons l’algorithme présenté dans la figure 3 pour le retrait du cathéter de cholécystostomie.
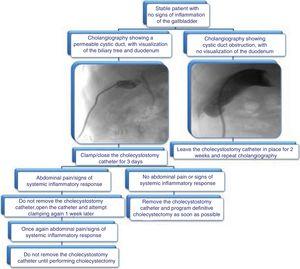
Algorithme proposé pour la gestion des cathéters de cholécystostomie : évaluation de l’ablation par cholangiographie et données cliniques.
Il est important de souligner qu’une plus grande fréquence d’infection du site chirurgical a été rapportée chez les patients qui subissent une ablation de cholécystostomie puis une CL. Ladite infection a été décrite dans jusqu’à 16% des cas.77
Conclusions
La décompression percutanée de la vésicule biliaire est un traitement largement connu, mais il n’existe toujours pas de stratégie standardisée pour la gestion des cathéters de cholécystostomie, ce qui rend difficile l’étude uniforme de ces patients avec la littérature actuellement disponible. Malgré la rareté des preuves, certaines considérations peuvent tout de même être établies :
- –
Les patients chirurgicaux à haut risque diagnostiqués avec un AC chez qui la CL d’urgence est contre-indiquée semblent être les meilleurs candidats pour la mise en place d’un PC.
- –
Il n’existe aucune preuve soutenant la mise en place d’un PC chez les patients stables sans contre-indication à subir une CL.
- –
Le retrait du cathéter PC ne doit être effectué qu’après que la perméabilité du canal cystique ait été documentée par cholangiographie, si le cathéter cause un inconfort au patient, et si le patient est candidat à un traitement chirurgical définitif dans un délai « raisonnable » et opportun pour réduire la possibilité de présenter une cholécystite aiguë récurrente.
Il existe peu de preuves sur la gestion des cathéters de cholécystostomie percutanée et des études randomisées pour évaluer la meilleure stratégie à suivre dans ce groupe de patients sont actuellement nécessaires.
Divulgations éthiques
Protection des sujets humains et animaux. Les auteurs déclarent qu’aucune expérience n’a été réalisée sur des humains ou des animaux pour cet article.
Confidentialité des données. Les auteurs déclarent qu’ils ont traité toutes les données des patients avec confidentialité et anonymat, en suivant les protocoles de leur centre de travail.
Droit à la vie privée et au consentement éclairé. Les auteurs déclarent qu’aucune donnée de patient apparaissant dans cet article ne compromet leur identité et qu’il n’a donc pas été nécessaire d’obtenir leur consentement éclairé.
Divulgation financière
Aucun soutien financier n’a été reçu en relation avec cet article.
Conflit d’intérêt
Les auteurs déclarent qu’il n’y a pas de conflit d’intérêt.
Leave a Reply