Colecistostomia percutanată ca tratament al colecistitei acute: Ce s-a întâmplat în ultimii cinci ani? O analiză a literaturii | Revista de Gastroenterología de México
Introducere
Patologia vezicii biliare este una dintre cele mai frecvente boli cu care se confruntă chirurgul generalist. În prezent, colecistectomia laparoscopică (LC) este considerată standardul de aur ca tratament al colecistitei acute (CA). S-au depus eforturi pentru a reduce morbiditatea și mortalitatea asociate cu procedura la pacienții cu risc chirurgical ridicat prin intervenții mai puțin invazive, cum ar fi colecistostomia percutanată (PC).
AC este o boală inflamatorie a vezicii biliare a cărei fiziopatologie constă în obstrucția căilor de drenaj ale vezicii biliare sau dismotilitatea pereților acesteia, ceea ce condiționează o creștere a presiunii intraluminale, edemul peretelui, alterarea vascularizației cu ischemie sau necroză, proliferarea bacteriană sau perforarea vezicii biliare. Scopul PC în CA este de a permite drenajul căilor biliare pentru a rezolva simptomele acute și a preveni apariția complicațiilor locale și sistemice. PC este în general rezervată pacienților cu CA care sunt pacienți cu risc chirurgical ridicat sau care prezintă insuficiență organică. PC oferă avantaje utile în acest context: nu este necesară anestezia generală, poate fi efectuată la patul pacientului, este o procedură rapidă, rata sa de succes este de peste 95%, are o rată scăzută de complicații și poate fi utilizată ca terapie de tranziție înainte de o intervenție chirurgicală electivă.
Drenajul vezicii biliare este o opțiune de tratament care este inclusă în principalele ghiduri internaționale pentru managementul CA, dar există încă unele controverse în ceea ce privește rezultatele sale la pacienții aflați în stare critică, indicațiile sale precise și superioritatea sa în comparație cu tratamentul chirurgical definitiv.
Există puține dovezi privind supravegherea și îngrijirea pacienților care sunt supuși PC. Majoritatea studiilor se concentrează pe selecția pacienților care vor beneficia de procedură, dar puține descriu managementul ulterior al pacienților. Analizăm aici dovezile privind utilitatea PC în AC și sugerăm un algoritm pentru gestionarea cateterului PC.
Criterii pentru clasificarea severității colecistitei acute
Legitimările Tokyo 2018 (TG18) privind AC clasifică severitatea bolii în ușoară (gradul I), moderată (gradul II) și severă (gradul III).1 Clasificarea menționată ia în considerare comorbiditățile pacientului, durata simptomelor, constatările fizice la admiterea în spital, semnele de răspuns inflamator sistemic, prezența unei inflamații locale marcate în studiile imagistice și dezvoltarea disfuncțiilor de organ. Clasificarea TG este utilă deoarece severitatea prezentării bolii se corelează cu mortalitatea, morbiditatea, durata șederii în spital și rata de conversie de la chirurgia laparoscopică la chirurgia deschisă (Tabelele 1 și 2).
Clasificarea severității colecistitei acute conform ghidurilor de la Tokyo din 2018.1
| Gradul I (ușoară) | Gradul II (moderată) | Gradul III (severă) | |
|---|---|---|---|
|
Care dintre următoarele afecțiuni:
|
Care dintre următoarele disfuncții de organ:
|
Caracteristicile diferitelor grade de gravitate.
| Mortalitatea la 30 de zile2 | Morbiditatea78 | Staționarea în spital78,a | Rata de conversie78,a | |
|---|---|---|---|---|
| Gradul I | 1.1% | 2,9% | 3 (1-16) | 7% |
| Gradul II | 0.8% | 3,1% | 4 (1-33) | 25,6% |
| >Gradul III | 5,4% | 11.1% | 7 (1-60) | 34,6% |
Mediu±SD.
În mod ideal, LC precoce (în decurs de 72h) ar trebui efectuată în cazurile de CA de gradul I și II, dacă indicele de comorbiditate Charlson (ICC) și capacitatea funcțională în conformitate cu sistemul de clasificare al Societății Americane de Anesteziologie (ASA) sugerează că pacientul poate tolera intervenția chirurgicală. Dimpotrivă, trebuie instituit un tratament medical inițial (antibiotice și suport general) și trebuie luat în considerare tratamentul chirurgical odată ce condițiile se ameliorează. În CA de gradul II, se adaugă recomandarea de a efectua un drenaj percutanat atunci când pacientul nu poate tolera tratamentul chirurgical.1
Ghidurile de la Tokyo din 2013 (TG13) clasifică CA ca fiind de gradul III atunci când există dovezi de disfuncție organică, definind-o atunci când există insuficiență cardiovasculară, neurologică, respiratorie, renală, hepatică sau hematologică. Conform TG13, LC de urgență este contraindicată dacă există disfuncție la nivelul acestor sisteme de organe. Cu toate acestea, în 2017, Yokoe et al.2 au furnizat informații privind tratamentul AC la o populație japoneză și taiwaneză (n=5.329), în care LC a fost efectuată cu succes la majoritatea pacienților cu AC de gradul III. Aceeași cohortă a fost ulterior reanalizată, punându-se accentul pe acei pacienți cu disfuncții de organ care puteau fi supuși în siguranță tratamentului chirurgical. Pacienții cu o ICC>6 puncte au prezentat o rată de mortalitate mai mare. Principala utilitate a acestui studiu a fost analiza de regresie logistică multivariată, care a arătat că icterul, disfuncția neurologică și disfuncția respiratorie au fost factori predictivi independenți pentru mortalitatea la 30 de zile la pacienții cu CA de gradul III. Cu toate acestea, nu a existat nicio dovadă de creștere a mortalității la pacienții cu CA de gradul III care au prezentat alte tipuri de insuficiență de organ și care au fost supuși LC.3 Astfel, TG18 definesc disfuncția neurologică, disfuncția respiratorie sau prezența icterului (niveluri de bilirubină totală ≥ 2mg/dl) ca factori predictivi ai mortalității în CA de gradul III. Pe de altă parte, disfuncția renală și disfuncția cardiovasculară sunt considerate tipuri favorabile de insuficiență organică, având în vedere că acestea pot fi adesea reversibile după instituirea tratamentului medical inițial și, în consecință, nu contraindică tratamentul chirurgical.1
Indicații pentru plasarea colecistostomiei percutanate
În termeni generali, cea mai frecventă indicație pentru plasarea unui PC este CA severă.4-9 Indicații mai puțin frecvente sunt cele al căror obiectiv este de a devia tractul biliar prin intermediul accesului transcolecistic, care este considerat relativ de linia a doua în majoritatea cazurilor datorită preferinței de a efectua devieri endoscopice sau transhepatice. Scenariile menționate sunt rezumate în tabelul 3.10-13
Indicații pentru plasarea colecistostomiei percutanate.
Colecistită acută severă în conformitate cu Ghidul Tokyo 2018
Colecistită acută și clasificare ASA >3 sau indice de comorbiditate Charlson >6
Acces de a doua linie la tractul biliar:Leziuni maligne ale căilor biliare punteDilatarea stenozei căilor biliareDirecția de ieșire a fistulei căilor biliareDescompunere a căilor biliare în colangităAlții
În mod diferit de cel stabilit în TG13,14, TG18 subliniază faptul că drenajul de urgență al vezicii biliare poate fi efectuat în CA de gradul II atunci când laparoscopia nu este disponibilă și există un răspuns inadecvat la tratamentul medical inițial, în principal la pacienții care se prezintă cu o stare generală „slabă” (CCI>6 puncte sau clasificare ASA >3). Această sugestie este susținută de un studiu retrospectiv multicentric din 201715 care a inclus 1.764 de pacienți pe o perioadă de 2 ani, dar a împerecheat doar 330 de pacienți în două grupuri pentru comparație. Grupul 1 a fost format din 330 de pacienți care au fost supuși unui drenaj percutanat transhepatic și aspirație percutanată transhepatică, iar grupul 2 a fost format din 330 de pacienți care au fost supuși unui drenaj endoscopic transpapilar al vezicii biliare. Rezultatele au fost analizate în zilele 3 și 7 post-procedură. În ziua 3, rata de succes terapeutic a fost de 62,5% (colecistostomie) și 69,8% (tratament endoscopic). În ziua 7, rata de succes terapeutic a fost de 87,6% (colecistostomie) și 89,2% (tratament endoscopic). Nu s-au constatat diferențe semnificative în ceea ce privește ratele de succes precoce sau tardiv. Frecvența complicațiilor a fost de 4,8% în grupul de colecistostomie și de 8,2% în grupul de drenaj endoscopic, iar în analiza statistică nu au existat diferențe statistice. Complicațiile raportate în grupul de colecistostomie au fost 8 pacienți cu migrare a cateterului, un pacient cu sângerare și 3 pacienți cu scurgere biliară. Studiul respectiv a arătat că drenajul percutanat este eficient, având aceeași eficacitate ca și managementul endoscopic. Chiar dacă pacienții nu au fost stratificați în funcție de severitatea CA, autorii au afirmat în secțiunea de discuții că, cel mai probabil, în cadrul studiului au apărut prejudecăți din cauza includerii unei frecvențe ridicate de pacienți cu CA severă (gradul III) și moderată (gradul II).
Recomandările de tratament în cazurile de CA de gradul III au fost unele dintre cele mai mari modificări din TG18, față de TG13. Anterior, drenajul de urgență al vezicii biliare (endoscopic sau transhepatic) era singura recomandare13, ceea ce indică o tendință neexplicită de evitare a tratamentului chirurgical de urgență, pentru a nu crește morbiditatea și mortalitatea. Chiar dacă TG18 reiterează această recomandare, a fost adăugată opțiunea de a efectua LC precoce, după instituirea tratamentului antibiotic și normalizarea funcției de organ.16 Prin urmare, la diagnosticarea CA, în special a gradului III, este esențial să se calculeze CCI și capacitatea funcțională ASA și să se identifice dacă pacientul prezintă factori predictivi favorabili de insuficiență de organ (leziuni renale sau cardiovasculare). Acei pacienți ar putea prezenta o recuperare rapidă după începerea tratamentului medical, devenind candidați pentru tratamentul definitiv cu LC.
Societatea Mondială de Chirurgie de Urgență, recomandă efectuarea unui drenaj percutanat al vezicii biliare la pacienții cu „risc ridicat”, dar nu oferă o definiție precisă a acestor pacienți, ceea ce poate duce la luarea unor decizii diferite de către diferiți profesioniști implicați în tratamentul colecistitei acute.17
În ciuda acceptării generalizate a plasării PC la pacienții cu CA severă,18,19 și a dovezilor raportate cu privire la o rată relativ scăzută a mortalității (17%),20 cea mai bună opțiune de tratament este încă un subiect de dezbatere, având în vedere că unele grupuri raportează un rezultat acceptabil cu LC de urgență la pacienții aflați în stare critică.21-25
Risc de conversie de la colecistectomia laparoscopică la chirurgia deschisă
Au fost descriși, de asemenea, diferiți factori pentru a prezice riscul de conversie de la LC la colecistectomia deschisă.26,27 Unii autori propun ca pacienții cu risc ridicat de conversie să fie considerați candidați pentru plasarea inițială a PC și, odată ce procesul inflamator este rezolvat, să fie supuși unei LC tardive (Tabelul 4).28,29
Factori de risc pentru conversia la colecistectomia deschisă.
| Lipman et al. (2007)26 | Sexul masculin (OR 4,06, 95% CI: 2,42-6.82)Leucocitoză 3.01 (OR 3.01, 95% CI: 1.77-5.13),Hipoalbuminemie (OR 2.90, 95% CI: 1.70-4.96),Lichid pericolecistic (OR 2.36, 95% CI: 1.25-4.47)Diabet zaharat (OR 1.87, 95% CI: 1.03-3.42)Bilirubină totală ridicată (OR 1.85, 95% CI: 1,01-3,39) | |
| Kim et al. (2014)27 | Vârsta înaintată (OR 1,05, 95% CI: 1,008-1,10),Sexul masculin (OR 5,0, 95% CI: 1,31-19,05),Lichid pericolecistic (OR17,22, 95% CI: 4,36-67,94). | |
| Masri et al. (2018)79 | Sexul feminin (OR 0,09, IC 95%: 0,03-0,25)Vârsta înaintată (OR 2,15, IC 95%: 1,62-2,85)Antecedente de chirurgie abdominală (OR 4,66, IC 95%: 1,78-12,17)Antecedente de boală pulmonară, de ex, BPOC (OR 6,03, IC 95%: 1,21-29,97)Hemoglobina serică mg/dl (OR 36,57, IC 95%: 3,16-423,72) | |
| Morales Maza et al. (2019)a | Sexul masculin (OR 1.64, 95% CI: 0.48-5.58)Diametrul peretelui vezicii biliare (OR 1.35, 95% CI: 1.03-1.76)Vârsta avansată (OR 1.02, 95% CI: 1.00-1.04)Lichidul periciculochistic (OR 2.84, 95% CI: 1.04-7.69) |
În curs de publicare.
A fost studiată, de asemenea, utilitatea tratamentului conservator inițial, plasând mai întâi un PC și apoi efectuând LC la interval la pacienții cu simptome de CA cu evoluție mai mare de 72 de ore. Karakayali și colab.30 au analizat un grup de pacienți cu CA cu o durată mai mare de 72 de ore și progresie a simptomelor de 48 de ore după tratamentul medical inițial. Pacienții (n=92) au fost repartizați în mod nealeatoriu fie să fie supuși PC și apoi LC la interval, fie să fie supuși LC de urgență. Grupul care a fost supus LC de interval a avut o rată de conversie mai mică (40% vs. 19%; p=0,029), o pierdere de sânge intraoperatorie mai mică (33% vs. 9%; p=0,006), o ședere mai scurtă în spital (5,3 zile vs. 3,0; p=0,001) și o frecvență mai mică a complicațiilor în general (35% vs. 9%; p=0,003).
El-Gendi et al.31 au randomizat un grup de pacienți (n=150) cu CA de mai mult de 72h de evoluție pentru a fi supuși unei LC de urgență vs. PC și LC de interval 6 săptămâni mai târziu. Analiza lor a arătat că grupul de colecistectomie PC și interval a avut o frecvență de conversie mai mică (24% vs. 2,27%; p
0,001), o pierdere de sânge intraoperatorie mai mică (medie 41,73ml vs. 26,33ml; p=0,008), o durată mai scurtă a intervenției chirurgicale (87,8min vs. 38,09min; p0.001), o rată mai mică de colecistectomie subtotală (17,3% vs. 0,0%; p0,001), o perioadă mai scurtă de spitalizare (51,71h vs. 10,76h; p0,001) și mai puține complicații postoperatorii (26,7% vs. 2,7% p0,001), respectiv.
Pacienții cu CA acalcaroasă sunt un alt grup care merită menționat. Aceștia sunt frecvent pacienți în stare critică, cu insuficiență multiorganică, și sunt candidați pentru PC ca tratament inițial de alegere pentru rezolvarea simptomelor acute. Cu toate acestea, pacienții cu semne de perforare a vezicii biliare, gangrenă sau progresie a simptomelor după plasarea PC trebuie să fie supuși unei colecistectomii de urgență.32
Contraindicații pentru plasarea colecistostomiei percutanate
Nu există contraindicații absolute pentru PC. Contraindicațiile relative sunt puține și includ o coagulopatie care condiționează riscul de sângerare severă (trombocite
×109/l sau INR>1.5), alergia la substanța de contrast iodată (folosită pentru a confirma plasarea adecvată a cateterului prin fluoroscopie (deși s-ar putea face și prin ecografie),33 și suprapunerea segmentelor intestinale la locul de puncție (extrem de rar, deoarece ficatul împiedică suprapunerea segmentelor).34
Se sugerează paracenteza la pacienții cu ascită, înainte de plasarea PC. Trebuie subliniat faptul că frecvența complicațiilor PC la pacienții cu ascită este scăzută și nu este semnificativ diferită, în comparație cu pacienții care nu au ascită. O vezică biliară strâns plină de calculi biliari poate împiedica, de asemenea, plasarea sigură a cateterului PC.35
Există o scădere a mortalității prin plasarea colecistostomiei percutanate la pacienții cu „risc ridicat”?
Detaliind dovezile existente cu privire la scăderea mortalității la pacienții cu risc ridicat cu CA care sunt supuși PC, un studiu din 2014 a analizat baza de date a sistemului de sănătate din California. Scopul său principal a fost de a determina mortalitatea și temporalitatea acesteia la 3 grupuri de pacienți cu AC: cei cărora li s-a plasat PC, cei cărora li s-a efectuat LC și cei cărora nu li s-a aplicat niciuna dintre cele două strategii din cauza gravității afecțiunii lor.36 Au fost studiați în total 43.341 de pacienți, rezultând o rată de mortalitate de 61,7% la pacienții tratați cu PC, 42% la pacienții care nu au urmat niciun tratament invaziv și 23% la pacienții cărora li s-a efectuat LC. Nu a existat nicio diferență în ceea ce privește supraviețuirea pacienților cu sepsis sever și șoc septic în timpul comparației dintre grupul PC și grupul de non-intervenție (p=0,256), iar supraviețuirea a fost mai mare la pacienții care au fost supuși LC (p
0,001). Chiar dacă mortalitatea a fost mai mare la pacienții care au fost supuși PC, aceștia au avut o ICC mai mare (5 față de 3,8), în comparație cu pacienții care au fost supuși LC. Astfel, aceste limitări ale studiului trebuie luate în considerare atunci când se interpretează rezultatele și se trag concluzii. Într-un alt studiu publicat în 2014, nu a putut fi demonstrată reducerea morbidității și mortalității la pacienții gestionați cu PC,37 dar trebuie menționat faptul că protocolul de gestionare a PC a fost eterogen și a variat de la un centru la altul, ceea ce ar fi putut contribui parțial la variabilitatea rezultatelor.
Protocolul CHOCOLATE a fost publicat în 2012 cu intenția de a oferi un răspuns mai concludent la dezbaterea privind PC. A fost un studiu multicentric, randomizat, controlat, privind superioritatea intervenției. Acesta a încercat să compare rezultatul între efectuarea LC versus plasarea PC la pacienții cu AC care aveau un scor APACHE >7 puncte. Numărul de pacienți de recrutat a fost de 284 pe o perioadă de 2 ani, în 30 de centre cu volum mare de activitate. Scopul principal a fost de a analiza complicațiile în primele 3 luni după intervenție și rata mortalității la un an (Netherlands Trial Register ; NTR2666).38 Rezultatele protocolului nu au fost publicate, având în vedere că acesta a fost suspendat în 2016, după ce analiza preliminară a arătat o morbiditate și o mortalitate mai mare la pacienții tratați cu PC.
Aceste studii pun sub semnul întrebării utilitatea reală a PC la pacienții cu AC severă. Cu toate acestea, există multe controverse în jurul acesteia, având în vedere că sunt necesare studii randomizate, astfel încât să poată fi eliminată prejudecata de selecție. Majoritatea dovezilor disponibile în prezent sunt retrospective și includ un număr mare de pacienți care sunt „atât de severi” încât au o rată mare de mortalitate, indiferent de intervenția oferită.
Este important de subliniat faptul că pacienții care nu prezintă un risc ridicat, nu au comorbidități și sunt candidați pentru LC, nu beneficiază deloc de plasarea PC. Unele studii sugerează că rezultatul poate chiar să se înrăutățească odată cu utilizarea strategiei menționate.39,40 În experiența noastră, nu considerăm că este recomandabilă efectuarea colecistostomiei laparoscopice ca metodă de salvare după o LC eșuată, deoarece este mai recomandabilă efectuarea unei colecistectomii subtotale în acest scenariu, dacă au existat dificultăți tehnice în timpul procedurii. În studiile care au comparat PC față de colecistectomia deschisă la pacienții în stare critică cu colecistită acalculoasă, s-a observat o morbiditate mai mică, mai puține zile de spitalizare și costuri asociate mai mici la pacienții care au fost supuși plasării PC.41
Descrierea tehnicii de plasare a colecistostomiei percutanate ghidate ecografic
După ce s-a luat decizia de a efectua PC, trebuie mai întâi să se definească abordul care va fi utilizat pentru plasarea drenului, fie că este transhepatic sau transperitoneal. În funcție de fiecare pacient și de fiecare chirurg, se poate alege una sau alta, fiecare cu avantajele și dezavantajele sale.
La pacienții cu risc mai mare de sângerare, se descrie în mod tradițional abordul transperitoneal, pentru a preveni puncția hepatică. Pe de altă parte, abordul transhepatic este preferat la pacienții a căror vezică biliară este foarte distinsă (> 10cm pe axa lungă sau > 5cm pe axa axială), pentru a reduce riscul de perforație și scurgere biliară, precum și de peritonită biliară.
Un alt aspect important de luat în considerare este habitusul și capacitatea de mișcare a pacientului, deoarece poate împiedica un abord sau altul din cauza vizualizării slabe a vezicii biliare sau a dificultății de a ajunge la vezica biliară din cauza unui tract complex. Odată ce toate aspectele menționate mai sus au fost analizate, se poate alege cea mai potrivită abordare.
Din experiența noastră, PC este de obicei o procedură efectuată la patul pacientului prin tehnica trocarului, deși în mod tradițional este descrisă tehnica Seldinger modificată. Rata noastră de succes tehnic este similară cu cea raportată în literatura de specialitate (date ce urmează a fi publicate).
Tehnica pas cu pas utilizată pentru plasarea PC-ului ghidat ecografic este descrisă mai jos (Fig. 1).
- 1
Realizați asepsia și antisepsia corespunzătoare în regiunea hipocondrului drept.
- 2
Scanați vezica biliară prin ecografie pentru a corobora diagnosticul de AC.
- 3
Infiltrați pielea și țesutul celular subcutanat cu lidocaină 2%.
- 4
Coroborâți prezența materialului necesar pentru plasarea cateterului prin tehnica aleasă.
- 5
Localizați vezica biliară prin ecografie. Efectuați puncția transperitoneală sau transhepatică. Apoi introduceți și avansați cateterul multifuncțional prin tractul biliar (8,5 Fr) peste firul de ghidare metalic până când este poziționat în vezica biliară (Fig. 2).
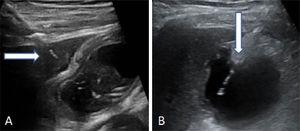 Fig. 2.
Fig. 2.Două moduri în care se poate efectua puncția vezicii biliare. (A) Intrarea transhepatică a acului. Săgeata indică domul hepatic. (B) Intrarea transperitoneală a acului direct în fundul vezicii biliare.
(0.25MB).- 6
Extrageți firul de ghidaj metalic, lăsând cateterul poziționat în interiorul vezicii biliare.
- 7
Fixați cateterul la piele cu un 3.0 prolene stitch.
- 8
Extrageți lichidul biliar pentru a fi trimis la laboratorul de microbiologie pentru cultură.
- 9
Puneți o pungă de colectare la capătul distal al cateterului, lăsând devierea.
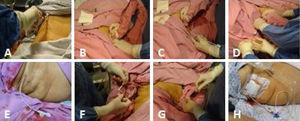 Fig. 1.
Fig. 1.(A) Asepsia hipocondrului drept. (B) Scanarea vezicii biliare. (C) Introducerea ghidată ecografic a cateterului împreună cu firul-ghid metalic în direcția vezicii biliare. (D) Firul de ghidare metalic este extras având grijă să se lase cateterul la locul său, cu fața spre lumenul vezicii biliare, și coroborând încă o dată prin ultrasunete poziția sa adecvată în interiorul vezicii biliare. (E) Cateterul de colecistostomie în poziție. (F) Cateterul este fixat cu o sutură simplă pe piele folosind prolene 3-0. (G) Lichidul biliar este aspirat și trimis pentru cultură. (H) Cateterul de colecistostomie de deviere cu sacul de colectare.
(0.2MB).Complicații ale colecistostomiei percutanate
Punerea PC este, în general, considerată o procedură sigură și eficientă. Se așteaptă ca peste 90% dintre pacienți să prezinte o ameliorare a durerii și a răspunsului inflamator sistemic în primele 48h de la plasarea PC.42 Cu toate acestea, au fost descrise complicații în aproximativ 3% din cazuri. Cele mai frecvente complicații sunt hemobilia, pneumotoraxul, scurgerile biliare, peritonita biliară, coledocolitiaza și abcesele.43,44 Exteriorizarea cateterului reprezintă întotdeauna un risc, ceea ce ar putea îngreuna plasarea acestuia din nou, odată ce vezica biliară este decomprimată.45,46
Riscul de recurență a CA după îndepărtarea PC variază între 6 și 40%.47-49 Recurența CA a fost raportată, chiar și la pacienții cu un cateter funcțional și permeabil, și apare în general în primele 2 luni de la plasarea acestuia.50 În unele serii de cazuri a fost raportată o ședere mai lungă în spital la pacienții cu PC.51 Această ședere mai lungă este cel mai probabil asociată cu gravitatea mai mare la pacienții cărora li se oferă PC, mai degrabă decât să fie o consecință directă a procedurii.52 Plasarea oportună a PC, adică în primele 24 de ore de la debutul simptomelor, este eficientă în reducerea șederii în spital. Acest lucru a fost documentat într-un studiu din 2015, în care doar pacienții cu plasare târzie a PC au avut o ședere mai lungă în spital.53
Când să se îndepărteze cateterul de colecistostomie
În general, PC trebuie îndepărtat odată ce pacientul este stabil și tabloul acut a dispărut. Cu toate acestea, momentul ideal de îndepărtare nu a fost definit cu exactitate.54 Colangiografia efectuată prin PC a fost realizată pentru a evalua permeabilitatea canalului chistic. Au fost raportate rate mai mici de recurență a CA la pacienții cu un canal cistic permeabil,55 dar datele sunt contradictorii. Recurența CA se poate prezenta în unele cazuri, chiar dacă colangiografia documentează permeabilitatea tractului biliar.56
Un studiu de cohortă retrospectiv publicat în 2017 a evaluat două grupuri. Grupul 1 (n=43) a fost supus unei colangiografii de rutină înainte de îndepărtarea colecistostomiei, iar grupul 2 a fost supus doar unei colangiografii la cerere (n=41). Pacienții cărora li s-a efectuat colangiografia la cerere au avut un rezultat mai bun, având în vedere că au avut o îndepărtare mai timpurie a drenajului, o rată mai mare de colecistectomie precoce și o utilizare mai mică a resurselor.57
În momentul efectuării LC ca tratament definitiv, trebuie acordată o atenție deosebită, având în vedere că, deși inflamația vezicii biliare a scăzut sau a dispărut, comorbiditățile pacientului persistă în general, ceea ce înseamnă că intervenția chirurgicală poate fi mai complicată decât se preconiza inițial.58,59 În acest scenariu a fost raportată o frecvență a conversiei la chirurgia deschisă între 11 și 32%.60-63 Colecistectomia de interval se efectuează în general fără probleme tehnice la pacienții tineri fără comorbidități.64,65
Tratament definitiv
Instalarea colecistostomiei este, în mod ideal, o terapie de tranziție înainte de tratamentul definitiv care se efectuează odată ce pacientul prezintă o ameliorare a stării sale generale.66,67 Peste 95% dintre pacienți au colecistectomia ca tratament definitiv,68 dar s-a raportat în serii de cazuri că colecistostomia rămâne pe termen nelimitat la 30 până la 50% dintre pacienți.69-71 Unii autori recomandă plasarea PC ca tratament definitiv și permanent la pacienții vârstnici și la cei cu risc chirurgical ridicat.72
Într-un studiu descriptiv realizat în intervalul de timp 2000-2011 pe 36 de pacienți cărora li s-a plasat PC deoarece au fost considerați pacienți cu „risc ridicat”, autorii au raportat o rezoluție a simptomelor de 100% la 3 zile după plasarea PC la toți pacienții. PC a fost tratamentul definitiv la 63% dintre pacienți, LC definitivă fiind efectuată la doar 6 pacienți (16%).73 Alți autori sunt în favoarea efectuării LC în timpul aceleiași spitalizări, deoarece LC întârziată este asociată cu pierderea pacienților la urmărire.74 Alte grupuri de studiu sunt de acord că frecvența complicațiilor legate de cateter este ridicată și sugerează îndepărtarea PC imediat ce răspunsul inflamator acut a fost controlat, chiar și în primele 10 zile de la plasarea cateterului.75,76
În experiența centrului nostru, colecistostomia este îndepărtată odată ce pacientul este programat pentru colecistectomie în următoarele 2 săptămâni, cu unicul scop de a îmbunătăți calitatea vieții pacientului înainte de operație. Cateterul este îndepărtat doar dacă pacientul este asimptomatic, nu are semne de răspuns inflamator sistemic și prezintă semne de permeabilitate a canalului cistic. De asemenea, acesta este îndepărtat la pacienții care vor fi supuși unei colecistectomii definitive. În cazul în care aceste criterii nu sunt îndeplinite, poziția noastră este de a lăsa cateterul de colecistostomie la locul lui pe termen nelimitat.
Propunem algoritmul prezentat în Fig. 3 pentru îndepărtarea cateterului de colecistostomie.
Fig. 3.Algoritm propus pentru managementul cateterelor de colecistostomie: evaluarea îndepărtării prin colangiografie și date clinice.
(0.35MB).Este important de subliniat faptul că a fost raportată o frecvență mai mare a infecției de situs chirurgical la pacienții care sunt supuși îndepărtării colecistostomiei și apoi LC. Respectiva infecție a fost descrisă în până la 16% din cazuri.77
Concluzii
Decompresia percutanată a vezicii biliare este un tratament cunoscut pe scară largă, dar nu există încă o strategie standardizată pentru managementul cateterului de colecistostomie, ceea ce face ca studiul uniform al acestor pacienți să fie dificil cu literatura disponibilă în prezent. În ciuda lipsei de dovezi, pot fi totuși stabilite unele considerații:
- –
Pacienții cu risc chirurgical ridicat diagnosticați cu AC la care LC de urgență este contraindicată par a fi cei mai buni candidați pentru plasarea PC.
- –
Nu există dovezi care să susțină plasarea PC la pacienții stabili fără contraindicații pentru a fi supuși LC.
- –
Îndepărtarea cateterului PC trebuie efectuată numai după ce permeabilitatea canalului chistic a fost documentată prin colangiografie, dacă cateterul provoacă disconfort pacientului și dacă pacientul este un candidat pentru tratament chirurgical definitiv într-o perioadă de timp „rezonabilă” și oportună pentru a reduce posibilitatea de a prezenta colecistită acută recurentă.
Există puține dovezi privind managementul cateterelor de colecistostomie percutanată și în prezent sunt necesare studii randomizate pentru a evalua cea mai bună strategie de urmat în acest grup de pacienți.
Dezvăluiri etice
Protecția subiecților umani și animali. Autorii declară că nu au fost efectuate experimente pe oameni sau animale pentru acest articol.
Confidențialitatea datelor. Autorii declară că au tratat toate datele pacienților cu confidențialitate și anonimat, respectând protocoalele centrului lor de lucru.
Dreptul la intimitate și consimțământul informat. Autorii declară că în acest articol nu apar date despre pacienți care să le compromită identitatea și, prin urmare, nu a fost necesară obținerea consimțământului lor în cunoștință de cauză.
Dezvăluiri financiare
Nu a fost primit niciun sprijin financiar în legătură cu acest articol.
Conflict de interese
Autorii declară că nu există niciun conflict de interese.
.
- 6
Leave a Reply