Perkutánní cholecystostomie jako léčba akutní cholecystitidy: Co se stalo za posledních pět let? Přehled literatury | Revista de Gastroenterología de México
Úvod
Patologie žlučníku je jedním z nejčastějších onemocnění, se kterým se setkává všeobecný chirurg. V současné době je laparoskopická cholecystektomie (LC) považována za zlatý standard léčby akutní cholecystitidy (AC). Byla vyvinuta snaha snížit morbiditu a mortalitu spojenou s tímto zákrokem u vysoce rizikových chirurgických pacientů prostřednictvím méně invazivních zákroků, jako je perkutánní cholecystostomie (PC).
AC je zánětlivé onemocnění žlučníku, jehož patofyziologie spočívá v obstrukci drenážních cest žlučníku nebo dysmotilitě jeho stěn, což podmiňuje zvýšení intraluminálního tlaku, edém stěny, změněnou vaskularitu s ischémií nebo nekrózou, bakteriální proliferaci nebo perforaci žlučníku. Cílem PC u AC je umožnit drenáž žlučovodu k vyřešení akutních příznaků a zabránit rozvoji lokálních a systémových komplikací. PC je obecně vyhrazena pro pacienty s AC, kteří jsou vysoce rizikovými chirurgickými pacienty nebo u nichž dochází k orgánovému selhání. PC v této souvislosti nabízí užitečné výhody: není nutná celková anestezie, lze ji provést u lůžka pacienta, jedná se o rychlý zákrok, jeho úspěšnost je vyšší než 95 %, má nízkou míru komplikací a lze jej použít jako překlenovací terapii před plánovanou operací.
Drenáž žlučníku je možnost léčby, která je zahrnuta v hlavních mezinárodních doporučeních pro léčbu AK, ale stále existují určité kontroverze ohledně jejích výsledků u kriticky nemocných pacientů, jejích přesných indikací a její nadřazenosti ve srovnání s definitivní chirurgickou léčbou.
Existuje jen málo důkazů o sledování a péči o pacienty, kteří podstoupili PC. Většina studií se zaměřuje na výběr pacientů, kteří budou mít ze zákroku prospěch, ale jen málo jich popisuje následný management pacientů. V tomto článku analyzujeme důkazy o užitečnosti PC u AK a navrhujeme algoritmus pro katetrizační léčbu PC.
Kritéria pro klasifikaci závažnosti akutní cholecystitidy
Tokijská doporučení (TG18) pro AK z roku 2018 klasifikují závažnost onemocnění jako mírnou (stupeň I), středně závažnou (stupeň II) a závažnou (stupeň III).1 Uvedená klasifikace zohledňuje komorbidity pacienta, délku trvání příznaků, fyzikální nález při přijetí do nemocnice, známky systémové zánětlivé reakce, přítomnost výrazného lokálního zánětu v zobrazovacích vyšetřeních a rozvoj orgánové dysfunkce. Klasifikace TG je užitečná, protože závažnost projevů onemocnění koreluje s mortalitou, morbiditou, délkou hospitalizace a mírou konverze z laparoskopické operace na otevřenou operaci (tabulky 1 a 2).
Klasifikace závažnosti akutní cholecystitidy podle Tokijských doporučení 2018.1
| Stupeň I (mírný) | Stupeň II (středně těžký) | Stupeň III (těžký) |
|---|---|---|
|
Každý z následujících stavů:
|
Každá z následujících orgánových dysfunkcí:
|
Charakteristiky jednotlivých stupňů závažnosti.
| Mortalita po 30 dnech2 | Morbidita78 | Hospitalizace78,a | Míra konverze78,a | |
|---|---|---|---|---|
| Stupeň I | 1.1% | 2,9% | 3 (1-16) | 7% |
| Třída II | 0.8% | 3,1% | 4 (1-33) | 25,6% |
| Třída III | 5,4% | 11.1% | 7 (1-60) | 34,6% |
Mean±SD.
Včasná LC (do 72 h) by měla být ideálně provedena v případě AC I. a II. stupně, pokud Charlsonův index komorbidity (CCI) a funkční kapacita podle klasifikačního systému Americké anesteziologické společnosti (ASA) naznačují, že pacient může operaci tolerovat. Naopak by měla být zavedena počáteční medikamentózní léčba (antibiotika a celková podpora) a chirurgická léčba by měla být zvážena po zlepšení stavu. U AC II. stupně se přidává doporučení provést perkutánní drenáž, pokud pacient nemůže tolerovat chirurgickou léčbu.1
Tokijská doporučení z roku 2013 (TG13) klasifikují AC jako III. stupeň při průkazu orgánové dysfunkce a definují ji při kardiovaskulární, neurologické, respirační, renální, jaterní nebo hematologické insuficienci. Podle TG13 je urgentní LC kontraindikována, pokud existuje dysfunkce těchto orgánových systémů. V roce 2017 však Yokoe et al.2 poskytli informace o léčbě AC v japonské a tchajwanské populaci (n=5 329), ve které byla LC úspěšně provedena u většiny pacientů s AC III. stupně. Stejná kohorta byla později znovu analyzována, přičemž byl kladen důraz na pacienty s orgánovou dysfunkcí, kteří mohli bezpečně podstoupit chirurgickou léčbu. Pacienti s CCI>6 bodů vykazovali vyšší mortalitu. Hlavním přínosem této studie byla její multivariační logistická regresní analýza, která ukázala, že žloutenka, neurologická dysfunkce a respirační dysfunkce byly nezávislými prediktivními faktory pro mortalitu po 30 dnech u pacientů s AC III. stupně. Nicméně u pacientů s AC III. stupně, u nichž došlo k jiným typům orgánového selhání a kteří podstoupili LC, nebyla prokázána zvýšená mortalita.3 TG18 tedy definuje neurologickou dysfunkci, respirační dysfunkci nebo přítomnost žloutenky (hladina celkového bilirubinu ≥ 2mg/dl) jako prediktivní faktory mortality u AC III. stupně. Na druhou stranu renální dysfunkce a kardiovaskulární dysfunkce jsou považovány za příznivé typy orgánového selhání vzhledem k tomu, že je lze po zavedení počáteční medikamentózní léčby často zvrátit, a tudíž nejsou kontraindikací chirurgické léčby.1
Indikace k zavedení perkutánní cholecystostomie
Všeobecně lze říci, že nejčastější indikací k zavedení PC je těžká AC.4-9 Méně časté jsou indikace, jejichž cílem je diverze žlučových cest pomocí transcholecystického přístupu, která je ve většině případů považována za relativně druhořadou vzhledem k preferenci provádění endoskopických nebo transhepatálních diverzí. Uvedené scénáře jsou shrnuty v tabulce 3.10-13
Indikace pro perkutánní zavedení cholecystostomie.
Těžká akutní cholecystitida podle Tokijských doporučení 2018
Akutní cholecystitida a ASA klasifikace >3 nebo Charlsonův index komorbidity >6
Přístup do žlučových cest druhé linie:Přemostění maligní léze žlučových cestDilatace striktury žlučových cestOdvod žlučové píštěleDekomprese žlučových cest při cholangitiděOstatní
Na rozdíl od toho, co bylo stanoveno v TG13,14 TG18 zdůrazňují skutečnost, že urgentní drenáž žlučníku může být provedena u AC II. stupně, pokud není k dispozici laparoskopie a je nedostatečná odpověď na počáteční medikamentózní léčbu, především u pacientů, kteří se dostaví se „špatným“ celkovým stavem (CCI>6 bodů nebo ASA klasifikace >3). Tento předpoklad podporuje i multicentrická retrospektivní studie z roku 201715 , která zahrnovala 1 764 pacientů za období 2 let, ale pro srovnání rozdělila pouze 330 pacientů do dvou skupin. Skupinu 1 tvořilo 330 pacientů, kteří podstoupili transhepatální perkutánní drenáž a transhepatální perkutánní aspiraci, a skupinu 2 tvořilo 330 pacientů, kteří podstoupili endoskopickou transpapilární drenáž žlučníku. Výsledky byly analyzovány 3. a 7. den po zákroku. V den 3 byla míra terapeutické úspěšnosti 62,5 % (cholecystostomie) a 69,8 % (endoskopická léčba). V 7. den byla terapeutická úspěšnost 87,6 % (cholecystostomie) a 89,2 % (endoskopická léčba). Nebyly zjištěny žádné významné rozdíly v časné ani pozdní míře úspěšnosti. Četnost komplikací byla 4,8 % ve skupině s cholecystostomií a 8,2 % ve skupině s endoskopickou drenáží a při statistické analýze nebyly zjištěny žádné statistické rozdíly. Ve skupině s cholecystostomií bylo zaznamenáno 8 komplikací s migrací katétru, jeden pacient s krvácením a 3 pacienti s únikem žlučových cest. Tato studie prokázala, že perkutánní drenáž je účinná a má stejnou účinnost jako endoskopické řešení. Přestože pacienti nebyli stratifikováni podle závažnosti AC, autoři v části věnované diskusi uvedli, že ve studii pravděpodobně došlo ke zkreslení v důsledku zahrnutí vysoké četnosti pacientů s těžkým (stupeň III) a středně těžkým (stupeň II) AC.
Doporučení pro léčbu v případech AC III. stupně patřilo v TG18 k největším změnám oproti TG13. Dříve byla jediným doporučením urgentní drenáž žlučníku (endoskopická nebo transhepatální),13 což naznačuje nevýslovnou tendenci vyhnout se urgentní chirurgické léčbě, aby nedošlo ke zvýšení morbidity a mortality. Přestože TG18 toto doporučení opakuje, byla přidána možnost provést časnou LC po zavedení antibiotické léčby a normalizaci orgánových funkcí.16 Proto je při stanovení diagnózy AC, zejména III. stupně, zásadní výpočet CCI a funkční kapacity ASA a zjištění, zda má pacient příznivé prediktivní faktory orgánového selhání (renální nebo kardiovaskulární poškození). U těchto pacientů by po zahájení medikamentózní léčby mohlo dojít k rychlému zotavení a mohli by se stát kandidáty na definitivní léčbu pomocí LC.
Světová společnost pro urgentní chirurgii, doporučuje provádět perkutánní drenáž žlučníku u „vysoce rizikových“ pacientů, ale neuvádí přesnou definici zmíněných pacientů, což může vést k rozdílným rozhodnutím různých odborníků podílejících se na léčbě akutní cholecystitidy.17
Přes všeobecný souhlas s umístěním PC u pacientů s těžkou AK18,19 a uváděné důkazy o relativně nízké mortalitě (17 %),20 je nejlepší způsob léčby stále předmětem diskusí, vzhledem k tomu, že některé skupiny uvádějí přijatelný výsledek při urgentní LC u kriticky nemocných pacientů.21-25
Riziko konverze z laparoskopické cholecystektomie na otevřenou operaci
Různé faktory byly popsány také pro předpověď rizika konverze z LC na otevřenou cholecystektomii.26,27 Někteří autoři navrhují, aby pacienti s vysokým rizikem konverze byli považováni za kandidáty na úvodní zavedení PC a po odeznění zánětlivého procesu podstoupili pozdní LC (tabulka 4)28,29
Rizikové faktory pro konverzi na otevřenou cholecystektomii.
| Lipman et al. (2007)26 | Mužské pohlaví (OR 4,06, 95% CI: 2,42-6.82)Leukocytóza 3,01 (OR 3,01, 95% CI: 1,77-5,13),Hypoalbuminémie (OR 2,90, 95% CI: 1,70-4,96),Pericholecystická tekutina (OR 2,36, 95% CI: 1,25-4,47)Diabetes mellitus (OR 1,87, 95% CI: 1,03-3,42)Zvýšený celkový bilirubin (OR 1.85, 95% CI: 1,01-3,39) |
| Kim et al. (2014)27 | Pokročilý věk (OR 1,05, 95% CI: 1,008-1,10),Mužské pohlaví (OR 5,0, 95% CI: 1,31-19,05),Pericholecystická tekutina (OR17,22, 95% CI: 4,36-67,94). |
| Masri et al. (2018)79 | Ženské pohlaví (OR 0,09, 95% CI: 0,03-0,25)Pokročilý věk (OR 2,15, 95% CI: 1,62-2,85)Operace břicha v minulosti (OR 4,66, 95% CI: 1,78-12,17)Plicní onemocnění v minulosti, např, CHOPN (OR 6,03, 95% CI: 1,21-29,97)Sérový hemoglobin mg/dl (OR 36,57, 95% CI: 3,16-423,72) |
| Morales Maza et al. (2019)a | Mužské pohlaví (OR 1.64, 95% CI: 0,48-5,58)Průměr stěny žlučníku (OR 1,35, 95% CI: 1,03-1,76)Pokročilý věk (OR 1,02, 95% CI: 1,00-1,04)Pericholecystická tekutina (OR 2,84, 95% CI: 1,04-7.69) |
V procesu publikování.
Studována byla také užitečnost počáteční konzervativní léčby, nejprve umístění PC a poté provedení intervalové LC u pacientů s příznaky AC s progresí delší než 72 hodin. Karakayali a spol.30 analyzovali skupinu pacientů s AC trvajícím déle než 72 h a progresí příznaků 48 h po počáteční medikamentózní léčbě. Pacienti (n=92) byli nerandomizovaně přiřazeni k tomu, aby buď podstoupili PC a poté intervalovou LC, nebo podstoupili urgentní LC. Skupina, která podstoupila intervalovou LC, měla nižší míru konverze (40 % vs. 19 %; p=0,029), menší intraoperační krevní ztrátu (33 % vs. 9 %; p=0,006), kratší dobu hospitalizace (5,3 dne vs. 3,0; p=0,001) a obecně nižší četnost komplikací (35 % vs. 9 %; p=0,003).
El-Gendi et al.31 randomizovali skupinu pacientů (n=150) s AC za více než 72 h progrese k podstoupení urgentní LC vs. PC a intervalové LC o 6 týdnů později. Jejich analýza ukázala, že skupina PC a intervalové cholecystektomie měla nižší frekvenci konverzí (24 % vs. 2,27 %; p
0,001), menší intraoperační krevní ztrátu (průměr 41,73 ml vs. 26,33 ml; p=0,008), kratší dobu trvání operace (87,8 min vs. 38,09 min; p0.001), nižší počet subtotálních cholecystektomií (17,3 % vs. 0,0 %; p0,001), kratší doba hospitalizace (51,71 h vs. 10,76 h; p0,001) a méně pooperačních komplikací (26,7 % vs. 2,7 % p0,001), resp.
Pacienti s akalkulózní AC jsou další skupinou, která stojí za zmínku. Často se jedná o kriticky nemocné pacienty s multiorgánovým selháním, kteří jsou kandidáty na PC jako počáteční léčbu volby k odstranění akutních příznaků. Pacienti se známkami perforace žlučníku, gangrény nebo progrese symptomů po zavedení PC by však měli podstoupit urgentní cholecystektomii.32
Kontraindikace pro perkutánní zavedení cholecystostomie
Neexistují žádné absolutní kontraindikace pro zavedení PC. Relativních kontraindikací je jen několik a patří mezi ně koagulopatie, která podmiňuje riziko závažného krvácení (trombocyty
×109/l nebo INR>1.5), alergie na jodovanou kontrastní látku (používá se k potvrzení adekvátního umístění katétru pomocí fluoroskopie (i když by to mohlo být provedeno pomocí ultrazvuku),33 a překrytí střevních segmentů v místě punkce (extrémně vzácné, protože játra brání překrytí segmentů).34
Paracentéza se navrhuje u pacientů s ascitem, před umístěním PC. Je třeba zdůraznit, že četnost komplikací PC u pacientů s ascitem je nízká a významně se neliší ve srovnání s pacienty, kteří ascites nemají. Žlučník těsně zaplněný žlučovými kameny může rovněž bránit bezpečnému umístění katétru PC.35
Dochází ke snížení mortality při perkutánním zavedení cholecystostomie u „vysoce rizikových“ pacientů?
Podrobněji o existujících důkazech o snížení mortality u vysoce rizikových pacientů s AK, kteří podstoupí PC, pojednává studie z roku 2014, která analyzovala databázi California Health System. Jejím primárním cílem bylo zjistit mortalitu a její časový průběh u 3 skupin pacientů s AC: u těch, kterým byla zavedena PC, u těch, kteří podstoupili LC, a u těch, kteří vzhledem k závažnosti svého stavu nepodstoupili ani jednu z těchto dvou strategií.36 Celkem bylo zkoumáno 43 341 pacientů, přičemž výsledkem byla 61,7% mortalita u pacientů léčených pomocí PC, 42% u pacientů, kteří nepodstoupili žádnou invazivní léčbu, a 23% u pacientů, kteří podstoupili LC. Při srovnání skupiny s PC a skupiny bez invazivní léčby nebyl zjištěn rozdíl v přežití u pacientů s těžkou sepsí a septickým šokem (p=0,256) a u pacientů, kteří podstoupili LC, bylo zaznamenáno větší přežití (p
0,001). Přestože mortalita byla vyšší u pacientů, kteří podstoupili PC, měli vyšší CCI (5 versus 3,8) ve srovnání s pacienty, kteří podstoupili LC. Tato omezení studie je tedy třeba vzít v úvahu při interpretaci výsledků a vyvozování závěrů. V jiné studii publikované v roce 2014 se nepodařilo prokázat sníženou morbiditu a mortalitu u pacientů léčených pomocí PC,37 je však třeba zmínit, že protokol léčby pomocí PC byl nejednotný a lišil se mezi jednotlivými centry, což mohlo částečně přispět k variabilitě výsledků.
Protokol CHOCOLATE byl publikován v roce 2012 se záměrem poskytnout přesvědčivější odpověď na diskusi o PC. Jednalo se o multicentrickou, randomizovanou, kontrolovanou studii o superioritě intervence. Pokusila se porovnat výsledek mezi provedením LC versus zavedením PC u pacientů s AK, kteří měli skóre APACHE >7 bodů. Počet pacientů k náboru byl 284 po dobu 2 let, a to ve 30 centrech s velkou kapacitou. Primárním cílem bylo analyzovat komplikace během prvních 3 měsíců po intervenci a mortalitu po jednom roce (Netherlands Trial Register ; NTR2666).38 Výsledky protokolu nebyly publikovány vzhledem k tomu, že byl v roce 2016 pozastaven poté, co předběžná analýza prokázala větší morbiditu a mortalitu u pacientů léčených pomocí PC.
Tyto studie staví skutečnou užitečnost PC u pacientů s těžkou AC do pochybností. Je však kolem ní mnoho kontroverzí vzhledem k tomu, že je zapotřebí randomizovaných studií, aby bylo možné eliminovat výběrové zkreslení. Většina v současnosti dostupných důkazů je retrospektivní a zahrnuje velký počet pacientů, kteří jsou „tak těžcí“, že mají vysokou mortalitu bez ohledu na nabízenou intervenci.
Je důležité zdůraznit, že pacienti, kteří nejsou vysoce rizikoví, nemají žádné komorbidity a jsou kandidáty na LC, nemají z umístění PC vůbec žádný prospěch. Některé studie naznačují, že výsledek se při použití uvedené strategie může dokonce zhoršit.39,40 Podle našich zkušeností nepovažujeme za vhodné provádět laparoskopickou cholecystostomii jako záchrannou metodu po neúspěšné LC, protože v takovém případě je vhodnější provést subtotální cholecystektomii, pokud se během výkonu vyskytly technické obtíže. Ve studiích, které porovnávaly PC oproti otevřené cholecystektomii u kriticky nemocných pacientů s akalkulózní cholecystitidou, byla u pacientů, kteří podstoupili zavedení PC, pozorována menší morbidita, kratší doba hospitalizace a nižší související náklady.41
Popis techniky zavedení perkutánní cholecystostomie pod ultrazvukovou kontrolou
Po rozhodnutí o provedení PC je třeba nejprve definovat přístup, který bude použit pro zavedení drénu, zda transhepatální nebo transperitoneální. V závislosti na každém pacientovi a každém chirurgovi lze zvolit jeden nebo druhý přístup, přičemž každý má své výhody a nevýhody.
U pacientů s vyšším rizikem krvácení je tradičně popisován transperitoneální přístup, aby se zabránilo punkci jater. Na druhou stranu u pacientů, jejichž žlučník je velmi distendovaný (> 10 cm v dlouhé ose nebo > 5 cm v ose axiální), se dává přednost transhepatálnímu přístupu, aby se snížilo riziko perforace a úniku žluči a také žlučové peritonitidy.
Dalším důležitým aspektem, který je třeba vzít v úvahu, je habitus pacienta a jeho schopnost pohybu, protože může bránit jednomu nebo druhému přístupu kvůli špatné vizualizaci žlučníku nebo obtížnému dosažení žlučníku kvůli složitému traktu. Po analýze všech výše uvedených aspektů lze zvolit nejvhodnější přístup.
Podle našich zkušeností je PC obvykle výkon prováděný u lůžka pacienta pomocí trokarů, i když je tradičně popisována modifikovaná Seldingerova technika. Naše technická úspěšnost je podobná jako v literatuře (údaje budou zveřejněny).
Níže je popsána technika krok za krokem používaná při zavádění PC pod ultrazvukovou kontrolou (obr. 1).
- 1
V oblasti pravého hypochondria proveďte příslušnou asepsi a antisepsi.
- 2
Vyšetřete žlučník pomocí ultrazvuku, abyste potvrdili diagnózu AC.
- 3
Infiltrujte kůži a podkožní buněčnou tkáň 2% lidokainem.
- 4
Potvrdit přítomnost materiálu potřebného k zavedení katétru zvolenou technikou.
- 5
Lokalizovat žlučník pomocí ultrazvukového vyšetření. Proveďte transperitoneální nebo transhepatální punkci. Poté zaveďte a posuňte víceúčelový katétr žlučovými cestami (8,5 Fr) přes kovový vodicí drát, dokud nebude umístěn ve žlučníku (obr. 2).
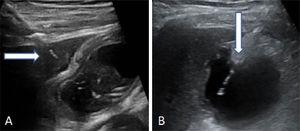 Obr. 2. Punkce žlučníku.
Obr. 2. Punkce žlučníku.Dva způsoby, jak provést punkci žlučníku. (A) Transhepatální vstup jehly. Šipka ukazuje na jaterní kopuli. (B) Transperitoneální vstup jehly přímo do fundu žlučníku.
(0.25MB). - 6
Vyjměte kovový vodicí drát a ponechte katétr umístěný uvnitř žlučníku.
- 7
Připevněte katétr ke kůži pomocí 3. Klíče.0 prolenovým stehem.
- 8
Extrahujte žlučovou tekutinu, kterou odešlete do mikrobiologické laboratoře ke kultivaci.
- 9
Na distální konec katétru umístěte sběrný vak a ponechte diverzi.
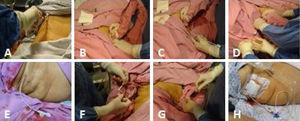
(A) Asepse pravého hypochondria. (B) Skenování žlučníku. (C) Zavedení katétru pod ultrazvukovou kontrolou spolu s kovovým vodicím drátem směrem ke žlučníku. (D) Kovový vodicí drát je vytažen, přičemž je dbáno na to, aby katétr zůstal na místě, směřoval do lumen žlučníku a opět se ultrazvukem potvrdila jeho adekvátní poloha uvnitř žlučníku. (E) Cholecystostomický katétr na místě. (F) Katétr je fixován jednoduchým stehem ke kůži s použitím prolenu 3-0. (G) Žlučová tekutina je odsáta a odeslána na kultivaci. (H) Odváděcí cholecystostomický katétr se sběrným vakem.
Komplikace perkutánní cholecystostomie
Zavedení PC je obecně považováno za bezpečný a účinný postup. U více než 90 % pacientů se očekává zlepšení bolesti a systémové zánětlivé reakce během prvních 48 h po zavedení PC.42 Komplikace však byly popsány přibližně ve 3 % případů. Nejčastějšími komplikacemi jsou hemobilie, pneumotorax, únik žluči, peritonitida žlučníku, choledocholitiáza a abscesy.43,44 Rizikem je vždy exteriorizace katétru, která by mohla po dekompresi žlučníku znesnadnit jeho opětovné umístění.45,46
Riziko recidivy AC po odstranění PC se pohybuje od 6 do 40 %.47-49 Recidiva AC byla zaznamenána i u pacientů s funkčním a průchodným katétrem a obvykle k ní dochází během prvních 2 měsíců od jeho zavedení.50 V některých sériích případů byla zaznamenána delší doba hospitalizace u pacientů s PC.51 Tato delší doba hospitalizace pravděpodobně souvisí spíše s větší závažností u pacientů, kterým je PC nabídnut, než že by byla přímým důsledkem zákroku.52 Včasné umístění PC, což znamená během prvních 24 h od vzniku příznaků, je účinné při zkracování doby hospitalizace. To bylo dokumentováno ve studii z roku 2015, ve které měli delší pobyt v nemocnici pouze pacienti s pozdním umístěním PC.53
Kdy odstranit cholecystostomický katétr
Obecně by měl být PC odstraněn, jakmile je pacient stabilní a akutní obraz odezní. Nicméně ideální doba odstranění nebyla přesně definována.54 Cholangiografie provedená přes PC byla provedena za účelem zhodnocení průchodnosti cystického vývodu. U pacientů s propustným cystickým vývodem byla zaznamenána nižší míra recidivy AC,55 údaje jsou však rozporuplné. V některých případech může dojít k recidivě AC, i když cholangiografie dokumentuje průchodnost žlučových cest.56
Retrospektivní kohortová studie publikovaná v roce 2017 hodnotila dvě skupiny. Skupina 1 (n=43) podstoupila rutinní cholangiografii před odstraněním cholecystostomie a skupina 2 podstoupila pouze cholangiografii na vyžádání (n=41). Pacienti, kteří podstoupili cholangiografii na vyžádání, měli lepší výsledky vzhledem k tomu, že u nich došlo k dřívějšímu odstranění drénu, vyšší míře časné cholecystektomie a menší spotřebě zdrojů.57
V době provádění LC jako definitivní léčby je třeba věnovat zvláštní pozornost vzhledem k tomu, že i když se zánět žlučníku zmenšil nebo vymizel, komorbidity pacientů obvykle přetrvávají, což znamená, že operace může být komplikovanější, než se původně uvažovalo.58,59 Četnost konverze na otevřenou operaci se v takovém případě pohybuje mezi 11 a 32 %.60-63 Intervalová cholecystektomie se u mladých pacientů bez komorbidit obvykle provádí bez technických problémů.64,65
Definitivní léčba
Zavedení cholecystostomie je v ideálním případě přemosťující léčbou před definitivní léčbou, která se provádí, jakmile se u pacienta dostaví zlepšení jeho celkového stavu.66,67 Více než 95 % pacientů má cholecystektomii jako definitivní léčbu,68 ale v sériích případů se uvádí, že cholecystostomie zůstává na dobu neurčitou u 30 až 50 % pacientů.69-71 Někteří autoři doporučují zavedení PC jako definitivní a trvalou léčbu u starších pacientů a pacientů s vysokým chirurgickým rizikem.72
V popisné studii provedené v časovém rozmezí let 2000 až 2011 u 36 pacientů, kterým byla zavedena PC, protože byli považováni za „vysoce rizikové“ pacienty, autoři zaznamenali 100% vymizení příznaků 3 dny po zavedení PC u všech pacientů. PC byla definitivní léčbou u 63 % pacientů, přičemž definitivní LC byla provedena pouze u 6 pacientů (16 %).73 Jiní autoři se vyslovují pro provedení LC během téže hospitalizace, protože opožděné provedení LC je spojeno se ztrátou pacienta při sledování.74 Jiné studijní skupiny se shodují, že četnost komplikací souvisejících s katétrem je vysoká, a doporučují odstranit LC, jakmile je akutní zánětlivá reakce zvládnuta, a to i během prvních 10 dnů od zavedení katétru.75,76
Podle zkušeností našeho centra je cholecystostomie odstraněna, jakmile je pacient během následujících 2 týdnů naprogramován k cholecystektomii, a to z jediného důvodu, aby se zlepšila kvalita života pacienta před operací. Katétr je odstraněn pouze v případě, že je pacient asymptomatický, nemá známky systémové zánětlivé reakce a známky průchodnosti cystického vývodu. Odstraňuje se také u pacientů, kteří podstoupí definitivní cholecystektomii. Pokud tato kritéria nejsou splněna, je naším stanoviskem ponechat cholecystostomický katétr na místě na dobu neurčitou.
Navrhujeme algoritmus pro odstranění cholecystostomického katétru uvedený na obr. 3.
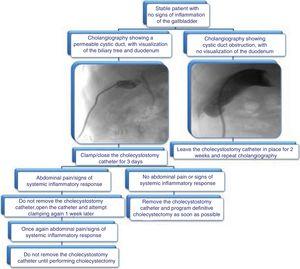
Proposed algorithm for the management of cholecystostomy catheters: removal evaluation through cholangiography and clinical data.
Je důležité zdůraznit, že u pacientů, kteří podstoupili odstranění cholecystostomie a následně LC, byla zaznamenána vyšší frekvence infekce v místě operace. Zmíněná infekce byla popsána až v 16 % případů.77
Závěry
Perkutánní dekomprese žlučníku je všeobecně známá léčba, ale stále neexistuje standardizovaná strategie pro vedení cholecystostomického katétru, což ztěžuje jednotné studium těchto pacientů s pomocí v současnosti dostupné literatury. Navzdory nedostatku důkazů lze přesto stanovit některé úvahy:
- –
Vysoce rizikoví chirurgičtí pacienti s diagnózou AC, u nichž je urgentní LC kontraindikována, se zdají být nejlepšími kandidáty pro zavedení PC.
- –
Neexistují žádné důkazy podporující zavedení PC u stabilních pacientů bez kontraindikace k podstoupení LC.
- –
Odstranění katétru PC by mělo být provedeno až poté, co byla cholangiograficky zdokumentována průchodnost cystického vývodu, pokud katétr způsobuje pacientovi diskomfort a pokud je pacient kandidátem na definitivní chirurgickou léčbu v „rozumné“ a vhodné době, aby se snížila možnost výskytu recidivující akutní cholecystitidy.
O zacházení s perkutánními cholecystostomickými katétry existuje jen málo důkazů a v současné době jsou zapotřebí randomizované studie, které by vyhodnotily nejlepší strategii, kterou je třeba u této skupiny pacientů dodržovat.
Etická sdělení
Ochrana lidských a zvířecích subjektů. Autoři prohlašují, že pro účely tohoto článku nebyly prováděny žádné experimenty na lidech ani na zvířatech.
Důvěrnost údajů. Autoři prohlašují, že se všemi údaji pacientů zacházeli důvěrně a anonymně podle protokolů svého pracoviště.
Právo na soukromí a informovaný souhlas. Autoři prohlašují, že v tomto článku se neobjevují žádné údaje o pacientech, které by ohrožovaly jejich identitu, a proto nebylo nutné získat jejich informovaný souhlas.
Zveřejnění finančních informací
V souvislosti s tímto článkem neobdrželi žádnou finanční podporu.
Střet zájmů
Autoři prohlašují, že nedošlo ke střetu zájmů.
Vyplývá z toho, že v souvislosti s tímto článkem neobdrželi žádnou finanční podporu.
Leave a Reply