Frontiers in Microbiology
Introduction
Viime vuosikymmenen aikana nouseva nosokomiaalinen Candida-laji on aiheuttanut vakavia tapauksia kandidemiaa ja muunlaisia sieni-infektioita. Taudinaiheuttajan eli Candida auriksen taudinpurkauksia on havaittu eri puolilla maailmaa (ks. kuva 1A) (Lockhart ym., 2017) (Lockhart ym., 2017).
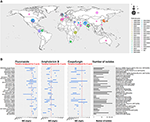
Kuva 1. (A) Kartta, joka esittää isolaattien lukumäärän taudinpurkausta kohti vuodesta 1996 lähtien. Ensimmäinen taudinpurkausvuosi on ruskealla värillä ja viimeisin taudinpurkausvuosi vaaleanpunaisella. Ympyrän koko on verrannollinen kustakin taudinpurkauksesta ilmoitettujen isolaattien määrään. Taudinpurkaustutkimus suoritettiin hyödyntämällä tietoja kolmesta tärkeimmästä katsauksesta (Osei Sekyere, 2018; Jackson et al., 2019; Kenters et al., 2019), ja sitä täydennettiin pubmed-haulla, jossa hakusanoina käytettiin kyselyä ”Candida” AND ”auris” AND ”outbreak”. Tulokset rajattiin ajallisesti Osei Sekyeren systemaattisen katsauksen viimeisimmän tutkimuksen 21/07/2017 ja kirjallisuushaun 31/08/2019 väliseksi ajaksi. Tutkimukset, joita ei ollut Osei Sekyeren katsauksessa: (Biswal et al., 2017; Abdalhamid et al., 2018; Adams et al., 2018; Belkin et al., 2018; Chow et al., 2018; Desoubeaux et al., 2018; Lesho et al., 2018; Mayor, 2018; Parra-Giraldo et al., 2018; Ruiz-Gaitán et al.., 2018, 2019a,b; Sexton et al., 2018; Adam et al., 2019; Barantsevich et al., 2019; Escandón et al., 2019; Leach et al., 2019; O’Connor et al., 2019; Park et al., 2019; Sana et al., 2019; Sayeed et al., 2019). (B) Kolmen sienilääkkeen MIC-alueet mitattuna C. auris -isolaateista eri taudinpurkauksista ympäri maailmaa. Punainen katkoviiva edustaa CDC:n ehdottamaa alustavaa katkaisupistettä. IPSV on lyhenne sanoista ”Intia, Pakistan, Etelä-Afrikka ja Venezuela”, koska näistä maista peräisin olevia kantoja analysoitiin samassa tutkimuksessa. Taudinpurkaustutkimus suoritettiin samalla tavalla kuin (A). Ainoastaan taudinpurkaukset, joissa oli >1 isolaatti, piirrettiin. Osei Sekyeren mainitsemat tutkimukset on merkitty merkinnällä ja Kentersin ym. mainitsemat tutkimukset merkinnällä .
Kokonaisen genomin sekvensoinnilla määritettiin neljä tiettyä kladia C. auris -lajin sisällä: Itä-Aasia, Etelä-Aasia, Etelä-Afrikka ja Etelä-Amerikka. Kaikille kladeille on ominaista erilaiset yhden nukleotidin polymorfismit (SNP:t), mikä korostaa tämän patogeenin itsenäistä ja maailmanlaajuista esiintymistä (Lockhart ym., 2017).
Vertailevat tutkimukset eri eläinmalleilla (hiirillä ja Galleria mellonella -toukilla) osoittivat C. auris -lajin virulenssitasot kannasta riippuen. Useimmissa tapauksissa C.auris-kannat osoittautuivat vähemmän virulenttisiksi kuin C. albicans (Borman et al., 2016; Ben-Ami et al., 2017; Fakhim et al., 2018; Wang et al., 2018). Raportoituihin C. auris -epidemiatapauksiin liittyi kuitenkin korkea kuolleisuus, pääasiassa immuunipuutteisilla potilailla. Myös muut sairaudet, kuten diabetes, sydän- ja/tai verisuoni- ja/tai keuhkosairaudet, sepsis tai aiempi antibioottihoito, näyttivät olevan tärkeitä riskitekijöitä (Osei Sekyere, 2018).
Hiivaksi poikkeuksellisesti C. auris on menestyksekkäästi levinnyt nosokomiaalisissa ympäristöissä. Esimerkiksi eräässä brittiläisessä sairaalassa yksittäinen C. auris -bakteerin kolonisoima potilas johti myöhemmin muiden tapausten tunnistamiseen muiden sairaalapotilaiden keskuudessa. Taudinaiheuttajaa havaittiin myös terveydenhuoltohenkilökunnassa jopa useita kuukausia ensimmäisen eristyksen jälkeen, mikä viittaa tehokkaaseen siirtymiseen ihmisestä toiseen. Lisäksi C. auriksen jälkiä oli löydetty sängyn reunoilta, ikkunalaudoilta, monitoreista ja muista laitteista kaikkialla sairaalassa, mikä osoittaa, että C. auris kykenee pysymään nosokomiaalisilla pinnoilla (Schelenz ym., 2016), toisin kuin muut Candida-lajit. Eräässä toisessa brittiläisessä sairaalassa tapahtuneen taudinpurkauksen tutkimuksessa raportoitiin, että uudelleenkäytettävien laitteiden, kuten kainalolämpöantureiden, käyttö oli ensisijainen syy tartunnan leviämiseen potilaisiin (Eyre ym., 2018), mikä osoittaa edelleen sen kykyä selviytyä pinnoilla.
Kyky selviytyä sairaalaympäristöissä voi johtua C. auriksen kyvystä muodostaa biofilmejä; kasvumuoto, jossa solut järjestäytyvät toisiinsa mikrokolonioiksi, joita suojaa glukaanista koostuva matriisi. Konvention mukaan matriisin ympäröimiä soluja kutsutaan sessiileiksi soluiksi ja sen ulkopuolella olevia soluja planktonisiksi soluiksi. Tämän rakenteen suojaamat C. auris -solut osoittautuivat vaikeasti hävitettäviksi jopa korkeatasoisilla desinfektiomenetelmillä (Kean ym., 2018b).
Sen lisäksi, että C. auris -bakteerin kyky muodostaa biofilmejä mahdollistaa mahdollisesti lisääntyneen eloonjäämisen inertillä pinnalla, sen kyky muodostaa biofilmejä voi olla myös tärkeä tekijä sen vastustuskyvyssä potilaiden hoidossa käytettäviä systeemisiä sienilääkkeitä vastaan. Se, että biofilmiä muodostavia soluja eristettiin haavoista ja katetrin kärjistä, viittaa nimittäin siihen, että jotkut C. auris -solut voivat selviytyä biofilmimuodossa potilailla (Borman ym., 2016), ja osoitettiin, että sessiileillä soluilla oli heikentynyt herkkyys useille sienilääkkeille. (Sherry et al., 2017). Lopuksi biofilmin on myös osoitettu olevan tärkeä virulenssitekijä, sillä biofilmiä muodostavat C. auris -kannat ovat yhteydessä lisääntyneeseen sairastuvuuteen ja kuolleisuuteen (Borman ym, 2016).
Tässä katsauksessa pyrimme korostamaan C. auriksen hankkimia molekulaarisia resistenssimekanismeja, jotka ovat johtaneet sen poikkeukselliseen selviytymiseen nosokomiaalisessa ympäristössä ja sairaalahoitopotilailla.
C. auriksen sienilääkeherkkyys
Kymmenen vuoden ajan kirjattuaan käytettävissä olevien sienilääkeaineiden pienimmän inhiboivan konsentraation (MIK) CDC julkaisi hiljattain murtumispisteiden alustavan määrittelyn, jonka avulla voidaan määritellä tarkemmin C. auriksen sienilääkeaineille aiheuttama sieniherkkyys1. Selvästi kävi ilmi, että C. aurisilla on poikkeuksellisen korkeat MIC-arvot neljälle tärkeimmälle sienilääkkeiden luokalle: atsoleille, ekinokandiineille, polyeneeneille (kuva 1B) ja nukleosidianalogeille. Tässä luvussa tarkastelemme yksityiskohtaisesti kahta tekijää, joilla on osoittautunut olevan merkitystä tässä heikentyneessä herkkyydessä sienilääkehoidoille: molekulaarisia resistenssimekanismeja ja biofilmiin liittyviä resistenssimekanismeja.
2.1. Molekulaariset resistenssimekanismit
Määrittelemme tässä molekulaarisen resistenssin tavoiksi, joilla yksittäiset solut voivat vähentää herkkyyttään sienilääkkeille johtuen geneettisistä muutoksista, jotka johtavat lääkeaineen kohdemuutokseen, efflux-pumppujen yliekspressioon tai aineenvaihdunnan muutoksiin (ks. katsaus: Pemán et al., 2009; Sanglard et al., 2009; Krishnasamy et al., 2018). Tähän jaksoon on koottu kunkin sienilääkeryhmän osalta tärkeimmät C. auriksella tähän mennessä havaitut molekulaariset resistenssimekanismit. Lisäksi taulukossa 1 on yhteenveto kunkin lääkkeen vaikutustavasta, siihen liittyvistä resistenssimekanismeista, jotka on kuvattu muulla kuin Candida auriksella, ja C. auriksella toistaiseksi löydetyistä resistenssimekanismeista.

Taulukko 1. Resistenssimekanismit. Neljän tärkeimmän sienilääkeluokan farmakodynamiikka ja niihin liittyvät resistenssimekanismit Candida spp. yleensä ja C. auris erityisesti.
2.1.1. Resistenssimekanismit atsoleille
2.1.1.1. MFS- ja ABC- effluksipumppujen yliekspressio
Effluksipumput ovat proteiineja, jotka kuljettavat komponentteja solukalvon läpi. Jotkut niistä voivat pumpata lääkkeitä solun ulkopuolelle, jolloin niiden pitoisuus ja vaikutus solussa pienenee. On olemassa kaksi suurta effluksipumppujen perhettä, jotka osallistuvat sienilääkeresistenssiin: ATP:tä sitovat kasettikuljettajat (ATP Binding Cassette, ABC) ja MFS-kuljettajat (Major Facilitator Superfamily, MFS). Effluksipumppujen tehostunut yliekspressio on yksi tärkeimmistä resistenssimekanismeista atsoleille patogeenisissä Candida-lajeissa (Schuetzer-Muehlbauer ym., 2003; Morschhäuser ym., 2007).
Kahdessa eri tutkimuksessa sekvensoiduissa intialaisissa C. auris -bakteerikannoissa on lukuisia geenejä, jotka ovat ortologisia C. albicansin ABC- ja MFS-kuljettajien kanssa (Chatterjee ym., 2015; Sharma ym., 2016). Mielenkiintoista on, että Israelissa eristetyt C. auris -kannat osoittivat C. glabrata- ja C. haemulonii -kantoihin verrattuna luontaisesti korkeaa ABC-transporterin aktiivisuutta mittaamalla fluoresoivan substraatin (Rhodamine 6G) effluksaatiota (Ben-Ami ym., 2017).
C. albicansissa CDR1 on ABC-emisluksaatiopumppua koodaava geeni, jonka rooli atsoliresistenssissä tiedetään olevan merkittävä (Sanglard ym., 1995). CDR1:lle homologinen geeni löydettiin C. auriksesta. (Rybak ym., 2019). Sama tutkimus osoitti myös, että tämän geenin deleetio voi lisätä resistenttien kantojen herkkyyttä 64- ja 128-kertaiseksi (Rybak ym., 2019).
2.1.1.2. Pistemutaatiot ERG11:ssä
Ergosteroli on keskeinen kalvokomponentti sienissä. Candida spp:ssä sen biosynteesiä välittää muun muassa geenin ERG11 koodaama entsyymi lanosteroli-14-alfa-demetyylaasi (LD), joka muuttaa lanosterolin ergosteroliksi. LD on ensisijainen kohde atsoleille, sienilääkkeille, jotka estävät entsyymin toimintaa ja sulkevat ergosterolibiosynteesin tehokkaasti, mikä heikentää kalvon eheyttä (Sanglard ym., 1998).
ERG11:n pistemutaatioiden on osoitettu vähentävän atsoliherkkyyttä Candida spp:ssä, erityisesti kolmella ”hot-spot”-alueella, jotka sijaitsevat aminohappojen 105-165, 266-287 ja 405-488 välissä (Vandeputte et al., 2012).
Interenkiintoista on, että kun 44 Intiasta peräisin olevan C. auris -isolaatin aminohapposekvenssit oli haettu, löydettiin 15 missense-mutaatiota, kun ne oli kohdistettu C. albicansin villityyppiseen ERG11-sekvenssiin (Chowdhary et al., 2018). Viisi näistä mutaatioista oli jo yhdistetty atsoliresistenssiin C. albicansissa. Näistä muunnoksista kaksi löytyi jokaisesta tässä tutkimuksessa testatusta resistentistä kannasta, nimittäin Y132F tai K143R (Chowdhary ym., 2018). Voidaan myös todeta, että nämä mutaatiot ovat ensimmäisessä aiemmin käsitellyssä ”kuumassa pisteessä”.
Kolumbiasta peräisin olevien C. auris -kantojen ERG11-geenin varianttien seulonnassa havaittiin samat Y132F- ja K143R-substituutiot. Kun nämä kaksi mutaatiota ilmentyivät heterologisesti S. cerivisiae -bakteerissa, atsolien MIC-arvot kasvoivat kaksi kertaa verrattuna S. cerevisiae -kantoihin, jotka ilmentävät villityyppistä C. auris ERG11-geeniä (Healey ym., 2018).
2.1.1.3. ERG11:n yliekspressio
C. albicansissa ERG11:n yliekspressio on yhdistetty resistenssiin myös atsolihoitoa vastaan.LD:n lisääntynyt tuotanto ylittää sienilääkkeen kyvyn estää proteiinin aktiivisuutta, jolloin proteiini on aktiivinen lääkehoidosta huolimatta (Lopez-Ribot ym, 1998).
C. auris -bakteerissa reaaliaikaiset PCR-kokeet osoittivat, että flukonatsolin puuttuessa ERG11:n ilmentymisessä ei ollut eroa flukonatsolille herkkien ja flukonatsolille resistenttien kantojen välillä (Chowdhary ym., 2018). Sienilääkkeen läsnä ollessa ERG11-ekspressio nousee resistenteissä kannoissa verrattuna kontrolliin ilman flukonatsolia (Chowdhary et al., 2018). Tämän lääkkeen vaikutusta ERG11-ekspressioon ei kuitenkaan testattu herkillä kannoilla. Siksi ERG11:n ehdollisesti lisääntynyttä ilmentymistä flukonatsolin läsnä ollessa ei ole toistaiseksi osoitettu olevan spesifistä resistenteille kannoille.
2.1.2. Ekinokandiiniresistenssin mekanismit
Beta(1,3)D-glukaani on sienen soluseinän keskeinen komponentti, ja sitä koodaavat FKS1- ja FKS2-geenit, jotka ovat beeta(1,3)D-glukaanisyntaasin kaksi alayksikköä. Ekinokandiinit estävät tätä entsyymiä, mikä vähentää glukaanien määrää soluseinässä (Martins ym., 2011).
C. albicansissa ja muissa Candida-lajeissa, jotka eivät ole aurislajeja, löydettiin useita mutaatioita, jotka johtavat ekinokandiiniresistenssiin, samoilta kahdelta FKS1- ja FKS2-alueelta. Niinpä ne nimettiin ”kuumiksi pisteiksi” 1 ja 2 (HS1 ja HS2). C. albicansin FKS1-geenissä nämä ”hot-spotit” sijaitsevat aminohappojen 641-649 ja 1 345-1 365 välillä (Park ym., 2005). Vastaavien hot-spot-alueiden sekvensointi 38:sta C. auris -kannasta johti S639F-aminohapposubstituution löytämiseen, joka korreloi pan-ekinokandiiniresistenssin kanssa: se esiintyi kaikissa neljässä resistentissä kannassa ja puuttui 34:stä herkästä kannasta. Tämä asema C. auris FKS1:ssä on linjassa C. albicansin aseman 645 (myös seriini) kanssa (Chowdhary ym., 2018). Mielenkiintoista on, että tämä mutaatio on alueella, joka on linjassa C. albicans FKS1:n HS1:n kanssa. Muissa tutkimuksissa havaittiin erilaisia mutaatioita samassa paikassa ekinokandiiniresistenteissä C. auris -kannoissa: S639Y ja S639P (Rhodes ym., 2018). Jälkimmäisen vahvistettiin aiheuttavan ekinokandiiniresistenssiä in vivo hiirimallissa (Kordalewska ym., 2018).
FKS2:sta löytyi myös yksi kopio C. auriksen genomissa (Sharma ym., 2016), mutta tästä geenistä ei tietojemme mukaan löydetty ekinokandiiniresistenssiin liittyviä mutaatioita.
2.1.3. FKS2:n mutaatioita ei löydetty. Polyeeniresistenssin mekanismit
Kuten kuvasta 1B käy ilmi, useat C. auris -kannat ovat resistenttejä amfoterisiini B:lle (AMB). Candida-lajeissa kalvon sterolikoostumuksen muutokset on nostettu esiin resistenssimekanismina (Haynes ym., 1996; Nolte ym., 1997). C. albicansissa mutaatioilla ERG 2:ssa, 3:ssa, 5:ssä, 6:ssa tai 11:ssä on osoitettu olevan tämä vaikutus (Arendrup ja Patterson, 2017). Rhodes et al. seuloivat 27:ää Yhdistyneestä kuningaskunnasta peräisin olevaa C. auris -isolaattia näiden geenien SNP:iden varalta kannoissa, joissa esiintyi alentunutta herkkyyttä AMB:lle. Näitä lääkeherkkyyseroja selittäviä variantteja ei kuitenkaan löytynyt (Rhodes ym., 2018).
2.1.4. Resistenssimekanismit flukitosiinille (5-Fluorosytosiini)
Flukitosiini on nukleosidianalogi, joka estää nukleiinihapposynteesiä. Soluun pääsyn jälkeen flukytosiinin on aktivoiduttava, jotta sillä olisi sienilääkkeellinen vaikutus. Tämä aktivointi edellyttää muun muassa geenin FUR1 Waldorf ja Polak (1983) koodaamaa proteiinia. Muilla kuin auris Candida-lajeilla FUR1:n mutaatioiden osoitettiin olevan yhteydessä flukitosiiniresistenssiin (Vandeputte ym., 2012).
Rhodes ym. sekvensoivat flukitosiiniresistentin C. auris -kannan ja havaitsivat FUR1-geenissä F211I-aminohapon substituution (Rhodes ym., 2018). Tällä spesifisellä missense-mutaatiolla ei ole tunnettua vastinetta muissa Candida-lajeissa, joten tarvitaan lisätutkimuksia sen määrittämiseksi, onko tämä mutaatio syynä testatun C. auris -kannan flukitosiiniresistenssiin (Rhodes ym., 2018). Tätä lääkettä käytetään kuitenkin vähemmän kuin muita sienilääkkeitä. Tämän vuoksi on tehty vähemmän tutkimuksia, jotta voitaisiin ymmärtää paremmin C. auriksen resistenssiä tälle yhdisteelle.
Yhteenvetona voidaan todeta, että jotkin aiemmin Candida-lajeilla, kuten C. glabratalla ja C. albicansilla, havaitut resistenssimekanismit näkyivät myös C. auriksessa. Ne on lueteltu taulukon 1 viimeisessä sarakkeessa. C. auriksen sienilääkeresistenssi selittyy kuitenkin vain osittain näillä aiemmin kuvatuilla resistenssimekanismeilla. Uusien terapeuttisten aineiden suunnittelemiseksi ja yleisemmin potilaiden hoidon parantamiseksi tarvitaan lisätutkimuksia, jotta voidaan ymmärtää paremmin mekanismeja, jotka johtavat joidenkin C. auris -bakteerien poikkeuksellisen korkeisiin MIC-arvoihin. auris-kannat (ks. kuva 1B).
2.2. Biofilmi:
On osoitettu, että useiden sienilääkkeiden MIC-arvot ovat korkeammat C. auriksen sessiilisissa soluissa (jopa 4-, 20- ja 60-kertaiset vorikonatsolille, amfoterisiini B:lle ja mikafungiinille) verrattuna planktonisiin soluihin (Sherry ym., 2017). Vastaavasti minimaalisten biofilmin hävittämispitoisuuksien osoitettiin olevan 512-kertaisia ekinokandiinien ja atsolien MIC-arvoihin verrattuna (Romera ym., 2019). Tämä ilmiö on aiemmin osoitettu C. albicansille (Hawser ja Douglas, 1995). Molekulaariset mekanismit, jotka ovat vastuussa näistä kohonneista MIC-arvoista, ovat vielä suurelta osin tuntemattomia C. auris -bakteerilla, mutta joissakin tutkimuksissa on jo saatu jonkin verran tietoa.
MSF:ää ja ABC-emisluksuspumppua koodaavien geenien havaittiin olevan ylössreguloituneita (2-4-kertaisia) sessiileissä soluissa verrattuna planktonisiin soluihin (Kean ym., 2018a). Vastaavasti vastaavien proteiinien aktiivisuus oli 2-kertainen. Kuitenkin käsiteltäessä effluksipumpun estäjillä sessiilisolujen sienilääkeherkkyys kasvoi 4- 16-kertaiseksi 12 h kuluttua. Tämä viittaa siihen, että effluksipumpuilla on tärkeä rooli tämäntyyppisten solujen osoittamassa sienilääkeresistenssissä (Kean ym., 2018a).
C. albicansissa eksopolymeerimatriisin tiedetään sitoutuvan epäspesifisesti kaikkiin sienilääkeluokkiin ja eristävän ne solujen ulkopuolelle (Nett ym., 2010). Koska Candida spp:llä on yhteinen ydinpolysakkaridiprofiili, ehdotettiin, että tämä mekanismi saattaisi olla konservoitunut myös C. auriksessa (Kean et al., 2018a). Tämä vahvistettiin myöhemmin in vivo- ja in vitro -määrityksissä (Dominguez ym., 2019).
Nosokomiaalinen persistenssi
C. auriksen kyky kolonisoitua ja säilyä pinnoilla on poikkeuksellinen: se pystyy pysymään pidempään kosteilla pinnoilla verrattuna C. albicansiin (Piedrahita ym., 2017). Sillä on myös pitkittynyt metabolinen aktiivisuus pinnoilla, joka on sukua C. parapsilosis -bakteerille, joka on tunnettu ihon ja muovien kolonisaattori (Piedrahita et al., 2017; Welsh et al., 2017).
C. auriksen lisääntynyttä selviytymistä pinnoilla tutkittiin kahdessa tutkimuksessa. Ensimmäisessä väitettiin, että se voisi liittyä lisääntyneeseen ympäristöstressinkestävyyteen lämpötilaa ja muita stressitekijöitä vastaan (Kean et al., 2018b). Toisessa hypoteesissa oletetaan, että se voisi johtua biofilmin muodostumisesta. Tämä on kuitenkin vielä todistamatta, sillä toistaiseksi yhtään biofilmiä muodostavaa isolaattia ei ole saatu talteen ympäristön pinnoilta (Ku et al., 2018). On huomattava, että nämä kaksi mahdollisuutta eivät sulje toisiaan pois, ja että biofilmin muodostuminen saattaa jopa olla syynä lisääntyneeseen stressiresistenssiin (Ku ym., 2018).
C. auriksen pysyvyyttä sairaalaympäristöissä lisää tämän patogeenin resistenssi desinfektiomenetelmiä vastaan. NaOCl:n ja peretikkahapon tehoa testattiin ruostumattomasta teräksestä, polymeeristä (polyesterikansilevyt) ja selluloosapinnoilla. Molemmat desinfiointiaineet tappoivat C. auris -soluja merkittävästi kaikilla pinnoilla. Joitakin elinkykyisiä soluja jäi kuitenkin jäljelle NaOCl:n käytön jälkeen huokosettomille pinnoille (ruostumattomalle teräkselle ja polyesterikansille). Desinfiointiaineen korkeammat pitoisuudet ja pidemmät altistusajat olivat itse asiassa tarpeen jälkikasvun vähentämiseksi, mutta tällöinkään ne eivät pystyneet hävittämään taudinaiheuttajaa kokonaan. Esimerkiksi 10 000 miljoonasosaa (ppm) NaOCl-pitoisuus yhdistettynä 5 minuutin altistusaikaan ruostumattomassa teräksessä riitti pesäkkeiden huomattavaan vähenemiseen. Merkittävää uudelleenkasvua havaittiin kuitenkin sen jälkeen, kun taudinaiheuttaja oli inokuloitu uudelleen rehevään väliaineeseen (Kean et al., 2018b).
Peretikkahapon, joka on korkean tason desinfiointiaine, osalta tämä uudelleenkasvu oli pintariippuvaista, sillä polymeerillä ei havaittu uudelleenkasvua toisin kuin ruostumattomalla teräksellä. He tekivät samat kokeet C. glabrata- ja C. albicans -lajeilla ja saivat samankaltaisia tuloksia (Kean ym., 2018b).
Tämä osoittaa, että korkeatasoiset desinfiointimenettelyt saattavat olla riittämättömiä pinnan täydelliseen puhdistamiseen ja että ennalta vahvistettuja pintadesinfiointia koskevia ohjeita on mukautettava näihin Candida-lajeihin (Kean ym., 2018b). Näiden desinfektiomenetelmien käyttöönotossa olisi otettava huomioon tekijöitä, kuten pintojen tyyppi ja altistusajat (Kean ym., 2018b; Ku ym., 2018), eikä vain kustannuksia ja helppokäyttöisyyttä, kuten usein on tapana (Ku ym., 2018).
Kahden tutkimuksen (Cadnum ym., 2017; Rutala ym., 2019) tulosten perusteella CDC suosittelee käyttämään desinfektioaineita, jotka tehoavat Clostridioides difficile -itiöihin. Jos se ei ole mahdollista, he suosittelevat vaihtoehtoja, kuten vetyperoksidia 0,5-1,4 % tai kvaternaarisia ammoniumyhdisteitä täydennettynä isopropyylialkoholilla ja/tai etyylialkoholilla2. Ultravioletti-C-valo voisi myös olla mielenkiintoinen ehdokas pintojen desinfiointiin. Se osoittautui erittäin tehokkaaksi C. auris -pesäkkeiden tuhoamisessa, kun valotusaika ja -etäisyys ovat riittävät. Lisätutkimukset olisivat kuitenkin tarpeen ennen tällaisten menetelmien käyttöönottoa sairaalaympäristöissä (de Groot ym., 2019).
Johtopäätös
C. auris -bakteerin patogeeniset ja virulentit kyvyt ovat syvästi huolestuttavia. Etenkin, kun taudinpurkauksia esiintyi itsenäisesti eri puolilla maailmaa ja kun niihin liittyvät isolaatit osoittivat alentunutta herkkyyttä yleisimmin käytetyille sienilääkkeille, joita käytetään potilaiden hoidossa (ks. kuva 1).
Tutkijat hyödynsivät C. aurisin alentunutta sienilääkeherkkyyttä selittääkseen C. auriksen alentunutta sienilääkeherkkyyttä laajempaa tietämystä, joka on jo saatavilla muista Candida- eli Candida- eli Candida-taudinaiheuttajalajeista, erityisesti C. albicansista. Tämän tuloksena saatiin esiin joitakin C. auriksen resistenssimekanismeja (ks. taulukko 1). Tarkemmin sanottuna kaksi pistemutaatiota ERG11:ssä ja ABC-transportteri Cdr1:n yliekspressio todistettiin vähentävän flukonatsoliherkkyyttä. Lisäksi osoitettiin, että aminohapon substituutio FKS1:ssä vähentää C. auriksen herkkyyttä ekinokandiinille, joka on tavallisesti ensisijainen lääke tämän patogeenin hoidossa (Bidaud ym., 2018). Lopuksi FUR1:n mutaatio tunnistettiin flukitosiinille resistentissä C. auris -kannassa, mutta sitä ei ole vielä osoitettu tämän vähentyneen herkkyyden syyksi. Biofilmin ajatellaan olevan resistenssimekanismi sinänsä, koska sen osoitettiin vähentävän lääkeherkkyyttä. Lisätutkimuksia tarvitaan kuitenkin vielä, jotta voidaan kuvata tässä kasvumuodossa tapahtuvien prosessien koko kirjo. On tärkeää huomata, että biofilmi on monimutkainen rakenne, jota ymmärretään edelleen huonosti ja jota on vaikea tutkia, jopa tunnetuilla lajeilla, kuten C. albicansilla.
C. auriksen resistenssiominaisuuksiin liittyy taipumus aiheuttaa sairaalainfektioita. Sen kyky tarttua erilaisiin nosokomiaalisiin pintoihin ja selviytyä desinfektiosta ovat kriittisiä leviämistekijöitä. Monentyyppisten pintojen esiintyminen on haaste kliinisille laitoksille, koska tavanomaiset desinfektiomenetelmät ovat tehottomia ja mukautumattomia kuhunkin pintatyyppiin. Tämä ongelma johtuu myös siitä, että aihetta ei ole tutkittu riittävästi. Lisäksi parempi ymmärrys C. auris -desinfektioresistenssin taustalla olevista mekanismeista auttaisi parantamaan hygieniaprotokollia ja välttämään tulevia nosokomiaalisia taudinpurkauksia.
Author Contributions
FC, AG ja LJ osallistuivat tasapuolisesti tämän katsauksen muokkaamiseen. AC valvoi ja osallistui tämän katsauksen muokkaukseen.
Erityisintressiristiriita
Tekijät ilmoittavat, että tutkimus tehtiin ilman mitään kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdolliseksi eturistiriidaksi.
Kiitokset
Kiitämme Clara Heimania äidinkielenään englantia puhuvana siitä, että hän on tarkistanut käsikirjoituksemme.
Alaviitteet
1. ^CDC (2019). Antifungal Susceptibility Testing and Interpretation. Saatavilla verkossa osoitteessa: https://www.cdc.gov/fungal/candida-auris/c-auris-antifungal.html (accessed April 29, 2019).
2. ^CDC (2018). Infektioiden ehkäisy ja torjunta Candida auriksen osalta. Saatavilla verkossa osoitteessa: https://www.cdc.gov/fungal/candida-auris/c-auris-infection-control.html (accessed November 12, 2019).
Abdalhamid, B., Almaghrabi, R., Althawadi, S., and Omrani, A. (2018). Ensimmäinen raportti Candida auris -infektioista Saudi-Arabiasta. J. Infect. Public Health 11, 598-599. doi: 10.1016/j.jiph.2018.05.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Adam, R. D., Revathi, G., Okinda, N., Fontaine, M., Shah, J., Kagotho, E., et al. (2019). Candida auris -fungemian analyysi yhdessä laitoksessa Keniassa. Int. J. Infect. Dis. 85, 182-187. doi: 10.1016/j.ijid.2019.06.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Adams, E., Quinn, M., Tsay, S., Tsay, S., Poirot, E., Chaturvedi, S., S., Southwick, K., et al. (2018). Candida auris terveydenhuollon laitoksissa, New York, Yhdysvallat, 2013-2017. Emerg. infect. Dis. 24, 1816-1824. doi: 10.3201/eid2410.180649
CrossRef Full Text | Google Scholar
Arendrup, M. C., and Patterson, T. F. (2017). Monilääkeresistentti candida: epidemiologia, molekyylimekanismit ja hoito. J. Infect. Dis. 216, S445-S451. doi: 10.1093/infdis/jix131
PubMed Abstract | CrossRef Full Text | Google Scholar
Barantsevich, N. E., Orlova, O. E., Shlyakhto, E. V., Johnson, E. M., Woodford, N., Lass-Floerl, C., et al. (2019). Candida auriksen ilmaantuminen Venäjällä. J. Hosp. Infect. 102, 445-448. doi: 10.1016/j.jhin.2019.02.021
PubMed Abstract | CrossRef Full Text | Google Scholar
Belkin, A., Gazit, Z., Keller, N., Ben-Ami, R., Wieder-Finesod, A., Novikov, A., et al. (2018). Nosokomiaaliseen tartuntaan johtava Candida auris -infektio, Israel, 2017. Emerg. Infect. Dis. Moniresistentit Candida haemulonii ja C. auris, Tel Aviv, Israel. Emerg. Infect. Dis. 23, 195-203. doi: 10.3201/eid2302.161486
PubMed Abstract | CrossRef Full Text | Google Scholar
Bidaud, A. L., Chowdhary, A., and Dannaoui, E. (2018). Candida auris: nouseva lääkkeille vastustuskykyinen hiiva – minikatsaus. J. Mycol. Méd. 28, 568-573. doi: 10.1016/j.mycmed.2018.06.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Biswal, M., Rudramurthy, S. M., S. M., Jain, N., Shamanth, A. S., Sharma, D., Jain, K., et al. (2017). Mahdollisen Candida auris -infektion taudinpurkauksen hallinta: useista interventioista saadut kokemukset. J. Hosp. Infect. 97, 363-370. doi: 10.1016/j.jhin.2017.09.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Borman, A. M., Szekely, A., and Johnson, E. M. (2016). Nousevan taudinaiheuttajan Candida auris ja muiden keskeisten patogeenisten Candida-lajien Yhdistyneen kuningaskunnan isolaattien vertaileva patogeenisuus. mSphere 1:e00189-16. doi: 10.1128/mSphere.00189-16.
CrossRef Full Text | Google Scholar
Cadnum, J. L., Shaikh, A. A., Piedrahita, C. T., Sankar, T., Jencson, A. L., Larkin, E. L., et al. (2017). Desinfiointiaineiden tehokkuus Candida aurisia ja muita Candida-lajeja vastaan. Infect. Control Hosp. Epidemiol. 38, 1240-1243. doi: 10.1017/ice.2017.162
PubMed Abstract | CrossRef Full Text | Google Scholar
Chatterjee, S., Alampalli, S. V., Nageshan, R. K., Chettiar, S. T., Joshi, S. ja Tatu, U. S. (2015). Yleisesti väärin diagnosoidun moniresistentin patogeenin Candida auris genomiluonnos. BMC Genomics 16:686. doi: 10.1186/s12864-015-1863-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Chow, N. A., Gade, L., Tsay, S. V., Forsberg, K., Greenko, J. A., Southwick, K. L., et al. (2018). Monilääkeresistentin Candida auris -bakteerin moninkertainen käyttöönotto ja myöhempi siirtyminen Yhdysvalloissa: molekyyliepidemiologinen tutkimus. Lancet Infect. Dis. 18, 1377-1384. doi: 10.1016/S1473-3099(18)30597-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Chowdhary, A., Prakash, A., Sharma, C., Kordalewska, M., Kumar, A., Sarma, S., ym. et al. (2018). Monikeskustutkimus sienilääkkeiden herkkyysmalleista 350 Candida auris -isolaatin (2009-17) keskuudessa Intiassa: ERG11- ja FKS1-geenien rooli atsoli- ja ekinokandiiniresistenssissä. J. Antimicrob. Chemother. 73, 891-899. doi: 10.1093/jac/dkx480
PubMed Abstract | CrossRef Full Text | Google Scholar
de Groot, T., Chowdhary, A., Meis, J. F., and Voss, A. (2019). Candida auriksen tappaminen UV-C:llä: altistusajan ja -etäisyyden merkitys. Mycoses 62, 408-412. doi: 10.1111/myc.12903
PubMed Abstract | CrossRef Full Text | Google Scholar
Desoubeaux, G., Bailly, E., Guillaume, C., De Kyvon, M.-A., Tellier, A.-C., Morange, V., et al. (2018). Candida auris nykyajan mykologian laboratorioissa: muutamia käytännön niksejä sen luotettavaan tunnistamiseen yhden tuoreen ranskalaisen kokemuksen mukaan. J. Mycol. Med. 28, 407-410. doi: 10.1016/j.mycmed.2018.02.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Dominguez, E. G., Zarnowski, R., Choy, H. L., Zhao, M., Sanchez, H., Nett, J. E., et al. (2019). Conserved role for biofilm matrix polysaccharides in Candida auris drug resistance. mSphere 4:e00680-18. doi: 10.1128/mSphereDirect.00680-18.
PubMed Abstract | CrossRef Full Text | Google Scholar
Escandón, P., Chow, N. A., Caceres, D. H., Gade, L., Berkow, E. L., Armstrong, P., et al. (2019). Candida auris -bakteerin molekyyliepidemiologia Kolumbiassa paljastaa erittäin läheisen, maanlaajuisen kolonisaation, jolla on alueellisia malleja amfoterisiini B -resistenssissä. Clin. Infect. Dis. 68, 15-21. doi: 10.1093/cid/ciy411
CrossRef Full Text | Google Scholar
Eyre, D. W., Sheppard, A. E., Madder, H., Moir, I., Moroney, R., Quan, T. P., et al. (2018). Candida auris -epidemia ja sen hallinta tehohoitoympäristössä. N. Engl. J. Med. 379, 1322-1331. doi: 10.1056/NEJMoa1714373
PubMed Abstract | CrossRef Full Text | Google Scholar
Fakhim, H., Vaezi, A., Dannaoui, E., Chowdhary, A., Nasiry, D., Faeli, L., et al. (2018). Candida auriksen vertaileva virulenssi Candida haemuloniiin, Candida glabrataan ja Candida albicansiin hiirimallissa. Mycoses 61, 377-382. doi: 10.1111/myc.12754
PubMed Abstract | CrossRef Full Text | Google Scholar
Hawser, S. P., and Douglas, L. J. (1995). Candida albicans -biofilmien resistenssi sienilääkkeille in vitro. Antimicrob. Agents Chemother. 39, 2128-2131. doi: 10.1128/AAC.39.9.2128
PubMed Abstract | CrossRef Full Text | Google Scholar
Haynes, M. P., Chong, P. L.-G., Buckley, H. R., and Pieringer, R. A. (1996). Fluoresenssitutkimukset amfoterisiini B:n molekyylivaikutuksesta herkissä ja resistenteissä sienisoluissa. Biochemistry 35, 7983-7992. doi: 10.1021/bi952910c
PubMed Abstract | CrossRef Full Text | Google Scholar
Healey, K. R., Kordalewska, M., Ortigosa, C. J., Singh, A., Berrío, I., Chowdhary, A., et al. (2018). Candida auris -isolaateissa tunnistetut rajoitetut ERG11-mutaatiot vaikuttavat suoraan vähentyneeseen atsoliherkkyyteen. Antimicrob. Agents Chemother. 62, e01427-18. doi: 10.1128/AAC.01427-18
PubMed Abstract | CrossRef Full Text | Google Scholar
Jackson, B. R., Chow, N., Forsberg, K., Litvintseva, A. P., Lockhart, S. R., Welsh, R., et al. (2019). Lajin alkuperästä: mikä voisi selittää Candida auriksen nousun? J. Fungi 5:E58. doi: 10.3390/jof5030058
PubMed Abstract | CrossRef Full Text | Google Scholar
Kean, R., Delaney, C., Sherry, L., Borman, A., Johnson, E. M., Richardson, M. D., et al. (2018a). Candida auris -bakteerin transkriptomin kokoaminen ja profilointi paljastaa uusia oivalluksia biofilmivälitteisestä resistenssistä. mSphere 3:e00334-18. doi: 10.1128/mSphere.00334-18.
PubMed Abstract | CrossRef Full Text | Google Scholar
Kean, R., Sherry, L., Townsend, E., McKloud, E., Short, B., Akinbobola, A., et al. (2018b). Pintadesinfioinnin haasteet Candida aurisille: in vitro -tutkimus. J. Hosp. Infect. 98, 433-436. doi: 10.1016/j.jhin.2017.11.015
PubMed Abstract | CrossRef Full Text | Google Scholar
Kenters, N., Kiernan, M., Chowdhary, A., Denning, D. W., Pemán, J., Saris, K., et al. (2019). Candida auriksen torjunta terveydenhuollon laitoksissa. ISAC:n asiantuntijakokouksen tulokset. Int. J. Antimicrob. Agents 54, 400-406. doi: 10.1016/j.ijantimicag.2019.08.013
CrossRef Full Text | Google Scholar
Kordalewska, M., Lee, A., Park, S., Berrio, I., Chowdhary, A., Zhao, Y., ym. et al. (2018). Echinocandin-resistenssin ymmärtäminen kehittyvässä patogeenissä Candida auris. Antimicrob. Agents Chemother. 62:e00238-18. doi: 10.1128/AAC.00238-18
PubMed Abstract | CrossRef Full Text | Google Scholar
Krishnasamy, L., Krishnakumar, S., Kumaramanickavel, G., and Saikumar, C. (2018). Sienilääkeresistenssin molekyylimekanismit Candida-lajeissa. J. Clin. Diagn. Res. 12, DE01-DE06. doi: 10.7860/JCDR/2018/36218.11961
CrossRef Full Text | Google Scholar
Ku, T. S. N., Walraven, C. J., and Lee, S. A. (2018). Candida auris: desinfiointiaineet ja vaikutukset infektioiden torjuntaan. Front. Microbiol. 9:726. doi: 10.3389/fmicb.2018.00726
CrossRef Full Text | Google Scholar
Leach, L., Russell, A., Zhu, Y., Chaturvedi, S. ja Chaturvedi, V. (2019). Nopea ja automatisoitu näytteestä tulokseen – Candida auris -reaaliaikainen PCR-määritys valvontanäytteiden korkean läpimenon testaukseen BD MAX™ open -järjestelmällä. J. Clin. Microbiol. 57:e00630-19. doi: 10.1128/JCM.00630-19
CrossRef Full Text | Google Scholar
Lesho, E. P., Bronstein, M. Z., McGann, P., Stam, J., Kwak, Y., Maybank, R., et al. (2018). Candida auriksen tuonti, lieventäminen ja genominen epidemiologia suuressa opetussairaalassa. Infect. Control Hosp. Epidemiol. 39, 53-57. doi: 10.1017/ice.2017.231
PubMed Abstract | CrossRef Full Text | Google Scholar
Lockhart, S. R., Etienne, K. A., Vallabhaneni, S., Farooqi, J., Chowdhary, A., Govender, N. P., et al. (2017). Monilääkeresistentin Candida auris -bakteerin samanaikainen ilmaantuminen kolmella mantereella vahvistettuna koko genomin sekvensoinnilla ja epidemiologisilla analyyseillä. Clin. Infect. Dis. 64, 134-140. doi: 10.1093/cid/ciw691
PubMed Abstract | CrossRef Full Text | Google Scholar
Lopez-Ribot, J. L., McAtee, R. K., Lee, L. N., Kirkpatrick, W. R., White, T. C., Sanglard, D., et al. (1998). Erilaiset geeniekspressiomallit, jotka liittyvät flukonatsoliresistenssin kehittymiseen sarjamuotoisissa Candida albicans -isolaateissa, jotka on saatu ihmisen immuunikatoviruksen tartuttamilta potilailta, joilla on orofaryngeaalinen kandidiaasi. Antimicrob. Agents Chemother. 42, 2932-2937. doi: 10.1128/AAC.42.11.2932
PubMed Abstract | CrossRef Full Text | Google Scholar
Martins, I. M., Cortés, J. C. G., Muñoz, J., Moreno, M. B., M. B., Ramos, M., Clemente-Ramos, J. A., et al. (2011). Kolmen spesifisen beeta(1,3)glukaanisyntaasin estäjäperheen erilainen aktiivisuus villityyppisissä ja resistenteissä hiivakannoissa. J. Biol. Chem. 286, 3484-3496. doi: 10.1074/jbc.M110.174300
PubMed Abstract | CrossRef Full Text | Google Scholar
Mayor, S. (2018). Candida auris -epidemia liittyi uudelleenkäytettäviin kainalolämpöantureihin, todetaan tutkimuksessa. BMJ 363:k4133. doi: 10.1136/bmj.k4133
PubMed Abstract | CrossRef Full Text | Google Scholar
Morschhäuser, J., Barker, K. S., Liu, T. T., Bla-Warmuth, J., Homayouni, R. ja Rogers, P. D. (2007). Transkriptiotekijä Mrr1p kontrolloi MDR1-evluksipumpun ilmentymistä ja välittää Candida albicansin monilääkeresistenssiä. PLoS Pathog. 3:e164. doi: 10.1371/journal.ppat.0030164
PubMed Abstract | CrossRef Full Text | Google Scholar
Nett, J. E., Crawford, K., Marchillo, K. ja Andes, D. R. (2010). Fks1p:n ja matriisiglukaanin rooli Candida albicans -biofilmin resistenssissä ekinokandiinille, pyrimidiinille ja polyeenille. Antimicrob. Agents Chemother. 54, 3505-3508. doi: 10.1128/AAC.00227-10
PubMed Abstract | CrossRef Full Text | Google Scholar
Nolte, F. S., Parkinson, T., Falconer, D. J., Dix, S., Williams, J., Gilmore, C., et al. (1997). Flukonatsolia ja amfoterisiini B:tä kestävien Candida albicans -bakteerien eristäminen ja karakterisointi kahden leukemiapotilaan verestä. Antimicrob. Agents Chemother. 41, 196-199. doi: 10.1128/AAC.41.1.196
PubMed Abstract | CrossRef Full Text | Google Scholar
O’Connor, C., Bicanic, T., Dave, J., Evans, T. J., Moxey, P., Adamu, U., et al. (2019). Candida auris -epidemian puhkeaminen verisuonitautien osastolla – odotetun patogeenin odottamaton saapuminen. J. Hosp. Infect. 103, 106-108. doi: 10.1016/j.jhin.2019.06.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Osei Sekyere, J. (2018). Candida auris: systemaattinen katsaus ja meta-analyysi nykyisistä päivityksistä kehittyvästä moniresistentistä patogeenistä. MicrobiologyOpen 7:e00578. doi: 10.1002/mbo3.578
PubMed Abstract | CrossRef Full Text | Google Scholar
Park, J. Y., Bradley, N., Brooks, S., Burney, S., and Wassner, C. (2019). Candida auris -fungemiaa sairastavien potilaiden hoito kunnallisessa sairaalassa, Brooklyn, New York, Yhdysvallat, 2016-20181. Emerg. infect. Dis. 25, 601-602. doi: 10.3201/eid2503.180927
PubMed Abstract | CrossRef Full Text | Google Scholar
Park, S., Kelly, R., Kahn, J. N., Robles, J., Hsu, M.-J., Register, E., et al. (2005). Spesifiset substituutiot ekinokandiinien Fks1p-kohteessa selittävät harvinaisten laboratorio- ja kliinisten Candida sp. -isolaattien alentuneen herkkyyden. Antimicrob. Agents Chemother. 49, 3264-3273. doi: 10.1128/AAC.49.8.3264-3273.2005
CrossRef Full Text | Google Scholar
Parra-Giraldo, C. M., Valderrama, S. L., Cortes-Fraile, G., Garzón, J. R., Ariza, B. E., Morio, F., ym. et al (2018). Ensimmäinen raportti sporadisista Candida auris -tapauksista Kolumbiassa. Int. J. Infect. Dis. 69, 63-67. doi: 10.1016/j.ijid.2018.01.034
PubMed Abstract | CrossRef Full Text | Google Scholar
Pemán, J., Cantón, E., and Espinel-Ingroff, A. (2009). Sienilääkkeiden resistenssimekanismit. Expert Rev. Anti Infect. Ther. 7, 453-460. doi: 10.1586/eri.09.18
PubMed Abstract | CrossRef Full Text | Google Scholar
Piedrahita, C. T., Cadnum, J. L., Jencson, A. L., Shaikh, A. A., Ghannoum, M. A. ja Donskey, C. J. (2017). Ympäristön pinnat terveydenhuollon laitoksissa ovat potentiaalinen lähde Candida auriksen ja muiden Candida-lajien leviämiselle. Infect. Control Hosp. Epidemiol. 38, 1107-1109. doi: 10.1017/ice.2017.127
PubMed Abstract | CrossRef Full Text | Google Scholar
Rhodes, J., Abdolrasouli, A., Farrer, R. A., Cuomo, C. A., Aanensen, D. M., Armstrong-James, D., et al. (2018). Uuden ihmisen sienipatogeenin Candida auris -taudinaiheuttajan Britanniassa puhjenneen epidemian genominen epidemiologia. Emerg. Microbes Infect. 7:43. doi: 10.1101/201343
CrossRef Full Text | Google Scholar
Romera, D., Aguilera-Correa, J. J., Gadea, I., Viñuela-Sandoval, L., García-Rodríguez, J. ja Esteban, J. (2019). Candida auris: planktonisen ja biofilmin herkkyyden vertailu sienilääkkeille. J. Med. Microbiol. 68, 1353-1358. doi: 10.1099/jmm.0.001036
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruiz-Gaitán, A., Martínez, H., Moret, A. M., Calabuig, E., Tasias, M., Alastruey-Izquierdo, A., et al. (2019a). Candida auriksen havaitseminen ja hoito taudinpurkaustilanteessa: riskitekijät tämän uuden lajin aiheuttaman kolonisaation ja kandidemian kehittymiselle kriittisesti sairailla potilailla. Expert Rev. Anti Infect. Ther. 17, 295-305. doi: 10.1080/14787210.2019.1592675
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruiz-Gaitán, A., Moret, A. M., Tasias-Pitarch, M., Aleixandre-López, A. I., Martínez-Morel, H., Calabuig, E., et al. (2018). Candida auris -bakteerin aiheuttama taudinpurkaus, johon liittyi pitkittynyt kolonisaatio ja kandidemia eurooppalaisessa tertiäärisairaalassa. Mycoses 61, 498-505. doi: 10.1111/myc.12781
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruiz-Gaitán, A. C., Cantón, E., Fernández-Rivero, M. E., Ramírez, P., and Pemán, J. (2019b). Candida auris -bakteerin taudinpurkaus Espanjassa: kolmen menetelmän sienilääkkeiden aktiivisuuden vertailu julkaistuihin tietoihin. Int. J. Antimicrob. Agents 53, 541-546. doi: 10.1016/j.ijantimicag.2019.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Rutala, W. A., Kanamori, H., Gergen, M. F., Sickbert-Bennett, E. E. ja Weber, D. J. (2019). Candida auris ja Candida albicans -bakteerien herkkyys 21:lle terveydenhuollon laitoksissa käytetylle mikrobilääkkeelle. Infect. Control Hosp. Epidemiol. 40, 380-382. doi: 10.1017/ice.2019.1
PubMed Abstract | CrossRef Full Text | Google Scholar
Rybak, J. M., Doorley, L. A., Nishimoto, A. T., Barker, K. S., Palmer, G. E., ja Rogers, P. D. (2019). Triatsoliresistenssin kumoaminen CDR1:n deletoinnin seurauksena Candida auriksen kliinisessä isolaatissa. Antimicrob. Agents Chemother. 63, e00057-19. doi: 10.1128/AAC.00057-19
PubMed Abstract | CrossRef Full Text | Google Scholar
Sana, F., Hussain, W., Zaman, G., Satti, L., Khurshid, U. ja Khadim, M. T. (2019). Candida auris -epidemioraportti Pakistanista: infektioiden hallinnan menestystarina tertiäärisairaalan teho-osastoilla. J. Hosp. Infect. 103, 108-110. doi: 10.1016/j.jhin.2019.06.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Sanglard, D., Coste, A., and Ferrari, S. (2009). Sienipatogeenien sienilääkeresistenssimekanismit transkriptionaalisen geenisäätelyn näkökulmasta. FEMS Yeast Res. 9, 1029-1050. doi: 10.1111/j.1567-1364.2009.00578.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Sanglard, D., Ischer, F., Koymans, L. ja Bille, J. (1998). Aminohapposubstituutiot sytokromi P-450 lanosteroli 14-demetyylaasissa (CYP51a1) atsoliresistenteistä Candida albicansin kliinisistä isolaateista edistävät resistenssiä atsolien sienilääkkeille. Antimicrob. Agents Chemother. 42, 241-253.
Google Scholar
Sanglard, D., Kuchler, K., Ischer, F., Pagani, J. L., Monod, M. ja Bille, J. (1995). AIDS-potilaiden Candida albicans -isolaattien resistenssimekanismit atsolilääkkeille liittyvät spesifisiin monilääkekuljettajiin. Antimicrob. Agents Chemother. 39, 2378-2386. doi: 10.1128/AAC.39.11.2378
PubMed Abstract | CrossRef Full Text | Google Scholar
Sayeed, M. A., Farooqi, J., Jabeen, K., Awan, S. ja Mahmood, S. F. (2019). Candida auriksen kliininen kirjo ja lopputulokseen vaikuttavat tekijät: yhden keskuksen tutkimus Pakistanista. BMC Infect. Dis. 19:384. doi: 10.1186/s12879-019-3999-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Schelenz, S., Hagen, F., Rhodes, J. L., Abdolrasouli, A., Chowdhary, A., Hall, A., et al. (2016). Maailmanlaajuisesti leviävän Candida auris -bakteerin ensimmäinen sairaalapurkaus eurooppalaisessa sairaalassa. Antimicrob. Resist. Infect. Control 5:35. doi: 10.1186/s13756-016-0132-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Schuetzer-Muehlbauer, M., Willinger, B., Egner, R., Ecker, G. ja Kuchler, K. (2003). Antifungaalisen resistenssin kumoaminen, jota välittävät hiivassa funktionaalisesti ilmentyvät Candida albicansin ABC-emisluksipumput. Int. J. Antimicrob. Agents 22, 291-300. doi: 10.1016/S0924-8579(03)00213-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Sexton, D. J., Kordalewska, M., Bentz, M. L., Welsh, R. M., Perlin, D. S., ja Litvintseva, A. P. (2018). Emergentti sienipatogeeni Candida auris -bakteerin suora havaitseminen kliinisistä ihon pyyhkäisynäytteistä SYBR green -pohjaisella kvantitatiivisella PCR-määrityksellä. J. Clin. Microbiol. 56:e01337-18. doi: 10.1128/JCM.01337-18
PubMed Abstract | CrossRef Full Text | Google Scholar
Sharma, C., Kumar, N., Pandey, R., Meis, J. F., ja Chowdhary, A. (2016). Intiassa esiintyvien uusien moniresistenttien Candida auris -isolaattien koko genomin sekvensointi osoittaa vähäistä geneettistä vaihtelua. New Microbes New Infect. 13, 77-82. doi: 10.1016/j.nmni.2016.07.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Sherry, L., Ramage, G., Kean, R., Borman, A., Borman, Borman, Borman, Borman, Borman, R., Borman, R., Borman, R., Borman, R., Borman, R., Borman, R., Borman, R., Borman, R., Borman, A., Borman, A., Borman, A., Borman, A., Borman, A., Borman, A., Borman, A. Erittäin virulentin, moniresistentin Candida auris -bakteerin biofilminmuodostuskyky. Emerg. Infect. Dis. 23, 328-331. doi: 10.3201/eid2302.161320
PubMed Abstract | CrossRef Full Text | Google Scholar
Vandeputte, P., Ferrari, S., and Coste, A. T. (2012). Sienilääkeresistenssi ja uudet strategiat sieni-infektioiden torjumiseksi. Int. J. Microbiol. 2012:713687. doi: 10.1155/2012/713687
PubMed Abstract | CrossRef Full Text | Google Scholar
Waldorf, A. R., and Polak, A. (1983). 5-fluorosytosiinin vaikutusmekanismit. Antimicrob. Agents Chemother. 23, 79-85. doi: 10.1128/AAC.23.1.79
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, X., Bing, J., Zheng, Q., Zhang, F., Liu, J., Yue, H., et al. (2018). Ensimmäinen Candida auriksen isolaatti Kiinassa: kliiniset ja biologiset näkökohdat. Emerging Microbes & Infections 7, 1-9. doi: 10.1038/s41426-018-0095-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Welsh, R. M., Bentz, M. L., Shams, A., Houston, H., Lyons, A., Rose, L. J., et al. (2017). Nousevan moniresistentin patogeenisen hiivan Candida auris -hiivan selviytyminen, pysyvyys ja eristäminen muovisella terveydenhuollon pinnalla. J. Clin. Microbiol. 55, 2996-3005. doi: 10.1128/JCM.00921-17
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply