Frontiers in Microbiology
Introduction
W ostatniej dekadzie, pojawiający się szpitalny gatunek Candida powodował ciężkie przypadki kandydemii i innych rodzajów infekcji grzybiczych. Ogniska odpowiedzialnego patogenu, czyli Candida auris, obserwowano na całym świecie (patrz Rycina 1A) (Lockhart et al., 2017).
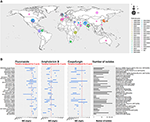
Figura 1. (A) Mapa przedstawiająca liczbę izolatów na ognisko od 1996 roku. Pierwszy rok wybuchu epidemii jest zaznaczony kolorem brązowym, a ostatni rok wybuchu epidemii jest zaznaczony kolorem różowym. Wielkość koła jest proporcjonalna do liczby izolatów zgłoszonych dla każdego ogniska. Badanie ognisk epidemicznych przeprowadzono, odzyskując dane z trzech głównych przeglądów (Osei Sekyere, 2018; Jackson i in., 2019; Kenters i in., 2019) i uzupełnione przez wyszukiwanie w pubmedzie przy użyciu zapytania „Candida” AND „auris” AND „outbreak” jako słów kluczowych. Wyniki były ograniczone w czasie, między 21/07/2017, najnowszym badaniem w przeglądzie systematycznym przez Osei Sekyere, a 31/08/2019, kiedy przeprowadzono wyszukiwanie w literaturze. Badania nieobecne w przeglądzie przeprowadzonym przez Osei Sekyere: (Biswal et al., 2017; Abdalhamid et al., 2018; Adams et al., 2018; Belkin et al., 2018; Chow et al., 2018; Desoubeaux et al., 2018; Lesho et al., 2018; Mayor, 2018; Parra-Giraldo et al., 2018; Ruiz-Gaitán et al., 2018, 2019a,b; Sexton et al., 2018; Adam et al., 2019; Barantsevich et al., 2019; Escandón et al., 2019; Leach et al., 2019; O’Connor et al., 2019; Park et al., 2019; Sana et al., 2019; Sayeed et al., 2019). (B) Zakresy MIC dla trzech leków przeciwgrzybiczych zmierzone w izolatach C. auris z różnych ognisk na całym świecie. Czerwona przerywana linia reprezentuje wstępny punkt przerwania zaproponowany przez CDC. IPSV jest akronimem od „India, Pakistan, South Africa, and Venezuela”, ponieważ szczepy z tych krajów były analizowane w tym samym badaniu. Badanie ognisk epidemicznych przeprowadzono identycznie jak w przypadku (A). Wykreślono tylko ogniska z >1 izolatem. Badania cytowane przez Osei Sekyere oznaczono symbolem , a badania cytowane przez Kenters et al. symbolem
Sekwencjonowanie całego genomu wykazało obecność czterech specyficznych kladów w obrębie gatunku C. auris: Azja Wschodnia, Azja Południowa, Afryka Południowa i Ameryka Południowa. Wszystkie klady charakteryzują się odrębnymi polimorfizmami pojedynczych nukleotydów (SNPs), co podkreśla niezależne i ogólnoświatowe pojawienie się tego patogenu (Lockhart i in., 2017).
Badania porównawcze w różnych modelach zwierzęcych (larwy myszy i Galleria mellonella) wykazały zależne od szczepu poziomy wirulencji dla C. auris. W większości przypadków szczepy C.auris okazały się mniej zjadliwe niż C. albicans (Borman et al., 2016; Ben-Ami et al., 2017; Fakhim et al., 2018; Wang et al., 2018). Jednakże odnotowane przypadki ognisk C. auris były związane z wysoką śmiertelnością, głównie u pacjentów z obniżoną odpornością. Inne stany, takie jak cukrzyca, choroby układu krążenia i/lub płuc, sepsa lub wcześniejsze leczenie antybiotykami, również wydawały się być ważnymi czynnikami ryzyka (Osei Sekyere, 2018).
Wyjątkowo jak na drożdżaka, C. auris z powodzeniem rozprzestrzeniał się w środowiskach szpitalnych. Na przykład, w brytyjskim szpitalu, pojedynczy pacjent skolonizowany C. auris doprowadził do późniejszych identyfikacji innych przypadków wśród innych hospitalizowanych pacjentów. Patogen był również wykrywany u personelu medycznego nawet kilka miesięcy po jego pierwszej izolacji, co sugeruje skuteczną transmisję z człowieka na człowieka. Dodatkowo, ślady C. auris znaleziono na brzegach łóżek, parapetach, monitorach i innym sprzęcie w całym szpitalu, co wskazuje, że C. auris jest zdolna do przetrwania na powierzchniach szpitalnych (Schelenz i in., 2016), w przeciwieństwie do innych gatunków Candida. Dochodzenie w sprawie ogniska w innym szpitalu w Wielkiej Brytanii wykazało, że używanie sprzętu wielokrotnego użytku, takiego jak sondy do pomiaru temperatury pachowej, było główną przyczyną przeniesienia zakażenia na pacjentów (Eyre i in., 2018), co dodatkowo ilustruje jego zdolność do przetrwania na powierzchniach.
Zdolność do przetrwania w środowiskach szpitalnych może wynikać ze zdolności C. auris do tworzenia biofilmów; formy wzrostu, w której komórki są ułożone razem w mikrokolonie chronione przez matrycę glukanu. Umownie, komórki otoczone macierzą nazywane są bezstylowymi, a komórki znajdujące się poza nią – planktonicznymi. Udowodniono, że komórki C. auris chronione przez tę strukturę są trudne do wyeliminowania, nawet przy zastosowaniu procedur dezynfekcji na wysokim poziomie (Kean et al., 2018b).
Oprócz potencjalnego umożliwienia zwiększonej przeżywalności na powierzchniach obojętnych, zdolność C. auris do tworzenia biofilmów może być również ważnym czynnikiem jego oporności na systemowe leki przeciwgrzybicze stosowane w leczeniu pacjentów. Rzeczywiście, fakt, że komórki tworzące biofilm zostały wyizolowane z ran i końcówek cewników wskazuje, że niektóre komórki C. auris mogą przetrwać w formie biofilmu u pacjentów (Borman i in., 2016) i wykazano, że komórki wysepkowe wykazywały zmniejszoną wrażliwość na kilka leków przeciwgrzybiczych. (Sherry i wsp., 2017). Wreszcie wykazano również, że biofilm jest ważnym czynnikiem wirulencji, ponieważ tworzące biofilm szczepy C. auris są związane ze zwiększoną zachorowalnością i śmiertelnością (Borman i in., 2016).
Poprzez ten przegląd chcemy zwrócić uwagę na molekularne mechanizmy oporności nabyte przez C. auris, które doprowadziły do jego niezwykłego przetrwania w środowisku szpitalnym i u hospitalizowanych pacjentów.
Wrażliwość przeciwgrzybicza C. auris
Po 10 latach rejestrowania minimalnych stężeń hamujących (MIC) dla dostępnych leków przeciwgrzybiczych, CDC opublikowało ostatnio wstępną listę punktów załamania, aby lepiej zdefiniować wrażliwość przeciwgrzybiczą C. auris1. Okazało się, że C. auris ma wyjątkowo wysokie MIC dla czterech głównych klas leków przeciwgrzybiczych: azoli, echinokandyn, polienów (Rysunek 1B) i analogów nukleozydów. W tym rozdziale przeanalizujemy szczegółowo dwa czynniki, które okazały się odgrywać rolę w tej zmniejszonej wrażliwości na leczenie przeciwgrzybicze: mechanizmy oporności molekularnej i mechanizmy oporności związane z biofilmem.
2.1. Mechanizmy oporności molekularnej
Oporność molekularną definiujemy tutaj jako sposoby, w jakie poszczególne komórki mogą zmniejszać swoją wrażliwość na leki przeciwgrzybicze w wyniku modyfikacji genetycznych prowadzących do modyfikacji celu lekowego, nadekspresji pomp efflux lub modyfikacji metabolizmu (patrz przegląd: Pemán i wsp., 2009; Sanglard i wsp., 2009; Krishnasamy i wsp., 2018). W tej części zestawiono, dla każdej klasy leków przeciwgrzybiczych, główne molekularne mechanizmy oporności odkryte do tej pory u C. auris. Dodatkowo, Tabela 1 podsumowuje dla każdego leku, sposób działania, powiązane mechanizmy oporności opisane u Candida non-auris oraz mechanizmy oporności odkryte u C. auris, jak dotąd.

Tabela 1. Farmakodynamika czterech głównych klas leków przeciwgrzybiczych i związane z nią mechanizmy oporności u Candida spp. ogólnie i C. auris w szczególności.
2.1.1. Mechanizmy oporności na azole
2.1.1.1. Nadekspresja pomp efflux MFS i ABC
Pompy efflux to białka, które transportują składniki przez błonę komórkową. Niektóre z nich mogą pompować leki na zewnątrz komórki, obniżając ich stężenie i wpływ na komórkę. Istnieją dwie główne rodziny pomp efflux zaangażowane w oporność przeciwgrzybiczą: Transportery ATP Binding Cassette (ABC) i Major Facilitator Superfamily (MFS). Wzmożona nadekspresja pomp efflux jest jednym z głównych mechanizmów oporności na azole u patogennych gatunków Candida (Schuetzer-Muehlbauer i in., 2003; Morschhäuser i in., 2007).
Indyjskie szczepy C. auris sekwencjonowane w dwóch różnych badaniach wykazują liczne geny ortologiczne do transporterów ABC i MFS C. albicans (Chatterjee i in., 2015; Sharma i in., 2016). Co ciekawe, szczepy C. auris, które zostały wyizolowane w Izraelu, wykazały wewnętrznie wysoką aktywność transportera ABC w porównaniu do C. glabrata i C. haemulonii, poprzez pomiar effluxu fluorescencyjnego substratu (Rhodamine 6G) (Ben-Ami i wsp., 2017).
W C. albicans, CDR1 jest genem kodującym pompę efflux ABC, znaną ze swojej roli w oporności na azole (Sanglard i wsp., 1995). Gen homologiczny do CDR1 znaleziono u C. auris. (Rybak i wsp., 2019). W tym samym badaniu wykazano również, że delecja tego genu może zwiększyć wrażliwość szczepów opornych od 64- do 128-krotnie (Rybak i wsp., 2019).
2.1.1.2. Mutacje punktowe w ERG11
Ergosterol jest kluczowym składnikiem błonowym u grzybów. U Candida spp. w jego biosyntezie pośredniczy m.in. enzym lanosterol 14-alfa-demetylaza (LD), kodowany przez gen ERG11, który przekształca lanosterol w ergosterol. LD jest głównym celem azoli, leków przeciwgrzybiczych, które hamują funkcję tego enzymu i skutecznie wyłączają biosyntezę ergosterolu, upośledzając w ten sposób integralność błon (Sanglard i in., 1998).
Mutacje punktowe w ERG11 zostały wykazane w celu zmniejszenia wrażliwości na azole u Candida spp., szczególnie w trzech regionach „hot-spot” zlokalizowanych między aminokwasami 105-165, 266-287 i 405-488 (Vandeputte i in., 2012).
Co ciekawe, po pobraniu sekwencji aminokwasowych 44 izolatów C. auris z Indii, znaleziono 15 mutacji missense, gdy wyrównano je do sekwencji ERG11 typu dzikiego C. albicans (Chowdhary i in., 2018). Pięć z tych mutacji było już związanych z opornością na azole u C. albicans. Wśród tych wariantów dwa znaleziono w każdym opornym szczepie badanym w tym badaniu, a mianowicie Y132F lub K143R (Chowdhary i in., 2018). Można również zauważyć, że mutacje te znajdują się w pierwszym „gorącym miejscu” omówionym wcześniej.
Screen dla wariantów w genie ERG11 szczepów C. auris z Kolumbii zidentyfikował te same substytucje Y132F i K143R. Po heterologicznej ekspresji tych dwóch mutacji w S. cerivisiae, MIC dla azoli przedstawiały dwukrotny wzrost w porównaniu do szczepów S. cerevisiae wyrażających dziki typ genu C. auris ERG11 (Healey et al., 2018).
2.1.1.3. Nadekspresja ERG11
W C. albicans, nadekspresja ERG11 została powiązana również z opornością na leczenie azolami.Zwiększona produkcja LD przytłacza zdolność antygrzybów do hamowania aktywności białka, co skutkuje aktywnym białkiem pomimo leczenia lekami (Lopez-Ribot i in., 1998).
W C. auris, eksperymenty PCR w czasie rzeczywistym wykazały, że przy braku flukonazolu nie było różnicy w ekspresji ERG11 pomiędzy szczepami wrażliwymi na flukonazol i opornymi na flukonazol (Chowdhary i in., 2018). W obecności leku przeciwgrzybiczego ekspresja ERG11 wzrasta u szczepów opornych w porównaniu do kontroli bez flukonazolu (Chowdhary i in., 2018). Jednak wpływ tego leku na ekspresję ERG11 nie był badany na szczepach wrażliwych. Dlatego też nie wykazano, aby warunkowo zwiększona ekspresja ERG11 w obecności flukonazolu była specyficzna dla szczepów opornych, aż do chwili obecnej.
2.1.2. Mechanizmy oporności na echinokandyny
Beta(1,3)D-glukan jest kluczowym składnikiem ściany komórkowej grzybów i jest kodowany przez geny FKS1 i FKS2, dwie podjednostki syntazy Beta(1,3)D-glukanu. Echinokandyny hamują ten enzym, zmniejszając ilość glukanów w ścianie komórkowej (Martins i in., 2011).
W C. albicans i innych nieaurisowych gatunkach Candida znaleziono kilka mutacji prowadzących do oporności na echinokandyny w tych samych dwóch regionach FKS1 i FKS2. Nazwano je więc „hot-spotami” 1 i 2 (HS1 i HS2). W genie FKS1 C. albicans te „gorące punkty” znajdują się pomiędzy aminokwasami 641-649 i 1,345-1,365 (Park i in., 2005). Sekwencjonowanie odpowiednich regionów hot-spot 38 szczepów C. auris doprowadziło do odkrycia substytucji aminokwasowej S639F, która jest skorelowana z opornością na pan-echinokandyny: była ona obecna we wszystkich czterech szczepach opornych i nieobecna w 34 szczepach wrażliwych. Ta pozycja w C. auris FKS1 jest zgodna z pozycją 645 (również seryna) w C. albicans (Chowdhary et al., 2018). Co ciekawe, mutacja ta znajduje się w regionie pokrywającym się z HS1 FKS1 C. albicans. W innych badaniach zaobserwowano różne mutacje w tej samej lokalizacji w szczepach C. auris opornych na echinokandyny: S639Y i S639P (Rhodes et al., 2018). Ta ostatnia została potwierdzona jako powodująca oporność na echinokandyny in vivo w modelu mysim (Kordalewska i wsp., 2018).
FKS2 występowała również w pojedynczej kopii w genomie C. auris (Sharma i wsp., 2016), ale według naszej wiedzy nie znaleziono w tym genie mutacji związanych z opornością na echinokandy.
2.1.3. Mechanizmy oporności na polieny
Jak przedstawiono na rycinie 1B, kilka szczepów C. auris jest opornych na amfoterycynę B (AMB). W gatunkach Candida, modyfikacje składu sterolowego błony zostały podkreślone jako mechanizm oporności (Haynes et al., 1996; Nolte et al., 1997). U C. albicans wykazano, że mutacje w ERG 2, 3, 5, 6 lub 11 wywołują taki efekt (Arendrup i Patterson, 2017). Rhodes i wsp. przebadali 27 izolatów C. auris z Wielkiej Brytanii pod kątem SNPs w tych genach w szczepach wykazujących zmniejszoną wrażliwość na AMB. Nie znaleziono jednak wariantów wyjaśniających te różnice we wrażliwości na lek (Rhodes i in., 2018).
2.1.4. Mechanizmy oporności na flucytozynę (5-Fluorocytozynę)
Flucytozyna jest analogiem nukleozydu, który hamuje syntezę kwasów nukleinowych. Po wniknięciu do komórki, flucytozyna musi zostać aktywowana, aby wywołać działanie przeciwgrzybicze. Do tej aktywacji potrzebne jest m.in. białko kodowane przez gen FUR1 Waldorf i Polak (1983). U gatunków Candida non-auris wykazano, że mutacje w FUR1 są powiązane z opornością na flucytozynę (Vandeputte i wsp., 2012).
Rhodes i wsp. dokonali sekwencjonowania szczepu C. auris opornego na flucytozynę i zaobserwowali substytucję aminokwasową F211I w genie FUR1 (Rhodes i wsp., 2018). Ta specyficzna mutacja typu missense nie ma znanego odpowiednika u innych gatunków Candida, dlatego konieczne są dodatkowe badania w celu ustalenia, czy mutacja ta jest przyczyną oporności na flucytozynę w badanym szczepie C. auris (Rhodes i wsp., 2018). Lek ten jest jednak rzadziej stosowany niż inne leki przeciwgrzybicze. Z tego powodu przeprowadzono mniej badań mających na celu lepsze zrozumienie oporności C. auris na ten związek.
Podsumowując, niektóre mechanizmy oporności odkryte wcześniej u gatunków Candida, takich jak C. glabrata i C. albicans, zostały również zaprezentowane przez C. auris. Są one wymienione w ostatniej kolumnie tabeli 1. Jednak oporność przeciwgrzybicza C. auris jest tylko częściowo wyjaśniona przez te wcześniej opisane mechanizmy oporności. Aby ostatecznie zaprojektować nowe środki terapeutyczne, a bardziej ogólnie, aby poprawić opiekę nad pacjentami, konieczne są dalsze badania w celu lepszego zrozumienia mechanizmów prowadzących do wyjątkowo wysokich zakresów MIC prezentowanych przez niektóre C. auris. szczepy auris (patrz Rysunek 1B).
2.2. Biofilm: An Antifungal Resistant Way of Life
Wykazano, że MIC dla kilku leków przeciwgrzybiczych są wyższe w komórkach sessilnych C. auris (do 4-, 20-, 60-krotnie odpowiednio dla worykonazolu, amfoterycyny B i micafunginy) w porównaniu z komórkami planktonicznymi (Sherry i in., 2017). Podobnie wykazano, że minimalne stężenia eliminujące biofilm są 512-krotnie wyższe niż MIC dla echinokandyn i azoli (Romera i in., 2019). Zjawisko to zostało wcześniej wykazane dla C. albicans (Hawser i Douglas, 1995). Molekularne mechanizmy odpowiedzialne za te podwyższone MIC są nadal w dużej mierze nieznane u C. auris, ale niektóre badania dostarczyły już pewnych spostrzeżeń.
SMSF i ABC efflux pump-encoding genes were found to be upregulated (2- do 4-krotnie) in sessile cells compared to planktonic cells (Kean et al., 2018a). Odpowiednio, aktywność odpowiadających im białek była 2-krotnie zwiększona. Jednakże, gdy poddano je działaniu inhibitorów pomp efflux, wrażliwość przeciwgrzybicza komórek sessile została zwiększona 4- do 16-krotnie po 12 h. Sugeruje to, że pompy efflux odgrywają ważną rolę w oporności na leki przeciwgrzybicze wykazywanej przez ten typ komórek (Kean et al., 2018a).
W C. albicans, macierz egzopolimerowa jest znana z niespecyficznego wiązania się ze wszystkimi klasami leków przeciwgrzybiczych i sekwestrowania ich na zewnątrz komórek (Nett et al., 2010). Ponieważ Candida spp. mają wspólny profil polisacharydowy, zasugerowano, że mechanizm ten może być zachowany również u C. auris (Kean et al., 2018a). Zostało to później potwierdzone w badaniach in vivo i in vitro (Dominguez et al., 2019).
Przetrwanie w warunkach szpitalnych
Zdolność C. auris do kolonizacji i przetrwania na powierzchniach jest wyjątkowa: jest w stanie przetrwać dłużej na wilgotnych powierzchniach w porównaniu z C. albicans (Piedrahita et al., 2017). Ma również przedłużoną aktywność metaboliczną na powierzchniach, podobną do C. parapsilosis, znanego kolonizatora skóry i plastiku (Piedrahita et al., 2017; Welsh et al., 2017).
Wyższa przeżywalność C. auris na powierzchniach była badana przez dwa badania. Pierwsze z nich twierdziło, że może to być związane ze zwiększoną odpornością na stres środowiskowy związany z temperaturą i innymi stresorami (Kean et al., 2018b). W drugim postawiono hipotezę, że może to być spowodowane tworzeniem się biofilmu. Pozostaje to jednak do udowodnienia, gdyż jak dotąd nie udało się odzyskać z powierzchni środowiskowych żadnego izolatu tworzącego biofilm (Ku i in., 2018). Należy zauważyć, że te dwie możliwości nie wykluczają się wzajemnie, a tworzenie biofilmu może być nawet przyczyną zwiększonej odporności na stres (Ku i in., 2018).
Utrzymywanie się C. auris w środowiskach szpitalnych jest potęgowane przez oporność tego patogenu na procedury dezynfekcyjne. Badano skuteczność działania NaOCl i kwasu nadoctowego na powierzchniach ze stali nierdzewnej, polimerowych (poliestrowe szkiełka nakrywkowe) i celulozowych. Oba środki dezynfekcyjne wykazały znaczącą skuteczność w zabijaniu komórek C. auris na wszystkich powierzchniach. Jednakże, niektóre żywe komórki pozostały po zastosowaniu NaOCl na nieporowatych powierzchniach (stal nierdzewna i poliestrowe szkiełka nakrywkowe). W rzeczywistości, wyższe stężenia tego środka dezynfekcyjnego w połączeniu z dłuższym czasem ekspozycji były wymagane do zmniejszenia odrostu, ale nawet wtedy nie były w stanie całkowicie wyeliminować patogenu. Na przykład, stężenie 10,000 części na milion (ppm) NaOCl w połączeniu z 5 minutową ekspozycją na stali nierdzewnej wystarczyło, aby zaobserwować znaczącą redukcję kolonii. Jednakże zaobserwowano znaczny odrost po ponownej inokulacji na bogatej pożywce (Kean et al., 2018b).
W przypadku kwasu nadoctowego, który jest środkiem dezynfekującym wysokiego poziomu, ten odrost był zależny od powierzchni, ponieważ nie zaobserwowano odrostu w przypadku polimeru w przeciwieństwie do stali nierdzewnej. Przeprowadzili oni te same eksperymenty na C. glabrata i C. albicans i uzyskali podobne wyniki (Kean et al., 2018b).
To pokazuje, że procedury dezynfekcji wysokiego poziomu mogą być niewystarczające do całkowitego oczyszczenia powierzchni i że wcześniej ustalone wytyczne dotyczące dezynfekcji powierzchni muszą być dostosowane do tych gatunków Candida (Kean et al., 2018b). Czynniki takie jak rodzaj powierzchni i czas ekspozycji powinny być brane pod uwagę podczas wdrażania tych procedur dezynfekcji (Kean et al., 2018b; Ku et al., 2018), a nie tylko koszt i łatwość użycia, jak to często bywa (Ku et al., 2018).
W oparciu o wyniki dwóch badań (Cadnum et al., 2017; Rutala et al., 2019), CDC zaleca stosowanie środków dezynfekcyjnych skutecznych wobec przetrwalników Clostridioides difficile. Jeśli nie jest to możliwe, sugerują alternatywne rozwiązania, takie jak nadtlenek wodoru 0,5-1,4% lub czwartorzędowe związki amoniowe uzupełnione alkoholem izopropylowym i/lub etylowym2. Wreszcie, światło ultrafioletowe może być również interesującym kandydatem do dezynfekcji powierzchni. Okazało się ono bardzo skuteczne w zabijaniu kolonii C. auris, przy odpowiednim czasie ekspozycji i odległości. Jednak przed wdrożeniem takich metod w warunkach szpitalnych konieczne byłyby dalsze badania (de Groot et al., 2019).
Podsumowanie
Zdolności patogenne i wirulentne C. auris są głęboko niepokojące. Zwłaszcza, że ogniska występowały niezależnie w różnych regionach świata, a związane z nimi izolaty wykazywały zmniejszoną wrażliwość na najczęściej stosowane leki przeciwgrzybicze wykorzystywane w leczeniu pacjentów (patrz Rycina 1).
Aby wyjaśnić zmniejszoną wrażliwość na leki przeciwgrzybicze u C. auris, badacze wykorzystali rozszerzoną wiedzę dostępną już na temat innych gatunków Candida, w szczególności C. albicans. W rezultacie zwrócono uwagę na niektóre mechanizmy oporności C. auris (patrz Tabela 1). Dokładniej, udowodniono, że dwie mutacje punktowe w ERG11 i nadekspresja transportera ABC Cdr1 zmniejszają wrażliwość na flukonazol. Ponadto wykazano, że substytucja aminokwasowa w FKS1 zmniejsza wrażliwość C. auris na echinokandyny, które są zwykle lekami z wyboru w terapii przeciwko temu patogenowi (Bidaud i in., 2018). Wreszcie, mutacja w FUR1 została zidentyfikowana w szczepie C. auris opornym na flucytozynę, ale pozostaje do wykazania jako przyczyna tej zmniejszonej wrażliwości. Biofilm jest uważany za mechanizm oporności per se, ponieważ wykazano, że zmniejsza on wrażliwość na leki. Jednak nadal konieczne są dalsze badania, aby opisać całą różnorodność procesów, które zachodzą w tej formie wzrostu. Należy zauważyć, że biofilm jest złożoną strukturą, która pozostaje słabo poznana i trudna do zbadania, nawet u dobrze znanych gatunków, takich jak C. albicans.
Właściwości opornościowe C. auris są połączone ze skłonnością do wywoływania zakażeń szpitalnych. Jego zdolność do przylegania do różnych powierzchni szpitalnych i przetrwania dezynfekcji są krytycznymi czynnikami rozprzestrzeniania się. Obecność wielu rodzajów powierzchni stanowi wyzwanie dla instytucji klinicznych, ponieważ standardowe procedury dezynfekcji są nieefektywne i niedostosowane do każdego rodzaju powierzchni. Problem ten wynika również z niedostatecznej ilości badań na ten temat. Ponadto, lepsze zrozumienie mechanizmów leżących u podstaw oporności C. auris na środki dezynfekcyjne pomogłoby poprawić protokoły higieny i uniknąć przyszłych epidemii szpitalnych.
Author Contributions
FC, AG i LJ uczestniczyli w równym stopniu w redagowaniu tego przeglądu. AC nadzorował i uczestniczył w redagowaniu tego przeglądu.
Konflikt interesów
Autorzy deklarują, że badania były prowadzone przy braku jakichkolwiek komercyjnych lub finansowych relacji, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Acknowledgments
Chcielibyśmy podziękować Clarze Heiman jako native speakerowi języka angielskiego, która dokonała korekty naszego manuskryptu.
Footnotes
1. ^CDC (2019). Antifungal Susceptibility Testing and Interpretation (Badanie wrażliwości przeciwgrzybiczej i interpretacja). Dostępne online na: https://www.cdc.gov/fungal/candida-auris/c-auris-antifungal.html (dostęp 29 kwietnia 2019 r.).
2. ^CDC (2018). Infection Prevention and Control for Candida auris. Dostępne online na: https://www.cdc.gov/fungal/candida-auris/c-auris-infection-control.html (dostęp 12 listopada 2019 r.).
Abdalhamid, B., Almaghrabi, R., Althawadi, S., and Omrani, A. (2018). First report of Candida auris infections from Saudi Arabia. J. Infect. Public Health 11, 598-599. doi: 10.1016/j.jiph.2018.05.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Adam, R. D., Revathi, G., Okinda, N., Fontaine, M., Shah, J., Kagotho, E., et al. (2019). Analiza fungemii Candida auris w pojedynczej placówce w Kenii. Int. J. Infect. Dis. 85, 182-187. doi: 10.1016/j.ijid.2019.06.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Adams, E., Quinn, M., Tsay, S., Poirot, E., Chaturvedi, S., Southwick, K., et al. (2018). Candida auris w placówkach opieki zdrowotnej, Nowy Jork, USA, 2013-2017. Emerg. Infect. Dis. 24, 1816-1824. doi: 10.3201/eid2410.180649
CrossRef Full Text | Google Scholar
Arendrup, M. C., and Patterson, T. F. (2017). Candida wielolekooporna: epidemiologia, mechanizmy molekularne i leczenie. J. Infect. Dis. 216, S445-S451. doi: 10.1093/infdis/jix131
PubMed Abstract | CrossRef Full Text | Google Scholar
Barantsevich, N. E., Orlova, O. E., Shlyakhto, E. V., Johnson, E. M., Woodford, N., Lass-Floerl, C., et al. (2019). Pojawienie się Candida auris w Rosji. J. Hosp. Infect. 102, 445-448. doi: 10.1016/j.jhin.2019.02.021
PubMed Abstract | CrossRef Full Text | Google Scholar
Belkin, A., Gazit, Z., Keller, N., Ben-Ami, R., Wieder-Finesod, A., Novikov, A., et al. (2018). Candida auris infection leading to nosocomial transmission, Israel, 2017. Emerg. Infect. Dis. 24, 801-804. doi: 10.3201/eid2404.171715
PubMed Abstract | CrossRef Full Text | Google Scholar
Ben-Ami, R., Berman, J., Novikov, A., Bash, E., Shachor-Meyouhas, Y., Zakin, S., et al. (2017). Multidrug-resistant Candida haemulonii and C. auris, Tel Aviv, Israel. Emerg. Infect. Dis. 23, 195-203. doi: 10.3201/eid2302.161486
PubMed Abstract | CrossRef Full Text | Google Scholar
Bidaud, A. L., Chowdhary, A., and Dannaoui, E. (2018). Candida auris: an emerging drug resistant yeast – A mini-review. J. Mycol. Méd. 28, 568-573. doi: 10.1016/j.mycmed.2018.06.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Biswal, M., Rudramurthy, S. M., Jain, N., Shamanth, A. S., Sharma, D., Jain, K., et al. (2017). Kontrolowanie możliwego wybuchu zakażenia Candida auris: wnioski wyciągnięte z wielu interwencji. J. Hosp. Infect. 97, 363-370. doi: 10.1016/j.jhin.2017.09.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Borman, A. M., Szekely, A., and Johnson, E. M. (2016). Comparative pathogenicity of United Kingdom isolates of the emerging pathogen Candida auris and other key pathogenic candida species. mSphere 1:e00189-16. doi: 10.1128/mSphere.00189-16
CrossRef Full Text | Google Scholar
Cadnum, J. L., Shaikh, A. A., Piedrahita, C. T., Sankar, T., Jencson, A. L., Larkin, E. L., et al. (2017). Skuteczność środków dezynfekcyjnych wobec Candida auris i innych gatunków candida. Infect. Control Hosp. Epidemiol. 38, 1240-1243. doi: 10.1017/ice.2017.162
PubMed Abstract | CrossRef Full Text | Google Scholar
Chatterjee, S., Alampalli, S. V., Nageshan, R. K., Chettiar, S. T., Joshi, S., and Tatu, U. S. (2015). Draft genome of a commonly misdiagnosed multidrug resistant pathogen Candida auris. BMC Genomics 16:686. doi: 10.1186/s12864-015-1863-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Chow, N. A., Gade, L., Tsay, S. V., Forsberg, K., Greenko, J. A., Southwick, K. L., et al. (2018). Wielokrotne wprowadzenie i późniejsza transmisja wielolekoopornej Candida auris w USA: molekularne badanie epidemiologiczne. Lancet Infect. Dis. 18, 1377-1384. doi: 10.1016/S1473-3099(18)30597-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Chowdhary, A., Prakash, A., Sharma, C., Kordalewska, M., Kumar, A., Sarma, S., et al. (2018). A multicentre study of antifungal susceptibility patterns among 350 Candida auris isolates (2009-17) in India: role of the ERG11 and FKS1 genes in azole and echinocandin resistance. J. Antimicrob. Chemother. 73, 891-899. doi: 10.1093/jac/dkx480
PubMed Abstract | CrossRef Full Text | Google Scholar
de Groot, T., Chowdhary, A., Meis, J. F., and Voss, A. (2019). Killing of Candida auris by UV-C: znaczenie czasu ekspozycji i odległości. Mycoses 62, 408-412. doi: 10.1111/myc.12903
PubMed Abstract | CrossRef Full Text | Google Scholar
Desoubeaux, G., Bailly, E., Guillaume, C., De Kyvon, M.-A., Tellier, A.-C., Morange, V., et al. (2018). Candida auris we współczesnych laboratoriach mikologicznych: kilka praktycznych sztuczek, aby zidentyfikować go niezawodnie według jednego z ostatnich francuskich doświadczeń. J. Mycol. Med. 28, 407-410. doi: 10.1016/j.mycmed.2018.02.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Dominguez, E. G., Zarnowski, R., Choy, H. L., Zhao, M., Sanchez, H., Nett, J. E., et al. (2019). Conserved role for biofilm matrix polysaccharides in Candida auris drug resistance. mSphere 4:e00680-18. doi: 10.1128/mSphereDirect.00680-18
PubMed Abstract | CrossRef Full Text | Google Scholar
Escandón, P., Chow, N. A., Caceres, D. H., Gade, L., Berkow, E. L., Armstrong, P., et al. (2019). Epidemiologia molekularna Candida auris w Kolumbii ujawnia wysoce powiązaną, ogólnokrajową kolonizację z regionalnymi wzorcami w oporności na amfoterycynę B. Clin. Infect. Dis. 68, 15-21. doi: 10.1093/cid/ciy411
CrossRef Full Text | Google Scholar
Eyre, D. W., Sheppard, A. E., Madder, H., Moir, I., Moroney, R., Quan, T. P., et al. (2018). A Candida auris outbreak and its control in an intensive care setting. N. Engl. J. Med. 379, 1322-1331. doi: 10.1056/NEJMoa1714373
PubMed Abstract | CrossRef Full Text | Google Scholar
Fakhim, H., Vaezi, A., Dannaoui, E., Chowdhary, A., Nasiry, D., Faeli, L., et al. (2018). Comparative virulence of Candida auris with Candida haemulonii, Candida glabrata and Candida albicans in a murine model. Mycoses 61, 377-382. doi: 10.1111/myc.12754
PubMed Abstract | CrossRef Full Text | Google Scholar
Hawser, S. P., and Douglas, L. J. (1995). Resistance of Candida albicans biofilms to antifungal agents in vitro. Antimicrob. Agents Chemother. 39, 2128-2131. doi: 10.1128/AAC.39.9.2128
PubMed Abstract | CrossRef Full Text | Google Scholar
Haynes, M. P., Chong, P. L.-G., Buckley, H. R., and Pieringer, R. A. (1996). Fluorescence studies on the molecular action of amphotericin B on susceptible and resistant fungal cells. Biochemistry 35, 7983-7992. doi: 10.1021/bi952910c
PubMed Abstract | CrossRef Full Text | Google Scholar
Healey, K. R., Kordalewska, M., Ortigosa, C. J., Singh, A., Berrío, I., Chowdhary, A., et al. (2018). Ograniczone mutacje ERG11 zidentyfikowane w izolatach Candida auris bezpośrednio przyczyniają się do zmniejszonej wrażliwości na azole. Antimicrob. Agents Chemother. 62, e01427-18. doi: 10.1128/AAC.01427-18
PubMed Abstract | CrossRef Full Text | Google Scholar
Jackson, B. R., Chow, N., Forsberg, K., Litvintseva, A. P., Lockhart, S. R., Welsh, R., et al. (2019). On the origins of a species: co może wyjaśnić powstanie Candida auris? J. Fungi 5:E58. doi: 10.3390/jof5030058
PubMed Abstract | CrossRef Full Text | Google Scholar
Kean, R., Delaney, C., Sherry, L., Borman, A., Johnson, E. M., Richardson, M. D., et al. (2018a). Transcriptome assembly and profiling of Candida auris reveals novel insights into biofilm-mediated resistance. mSphere 3:e00334-18. doi: 10.1128/mSphere.00334-18
PubMed Abstract | CrossRef Full Text | Google Scholar
Kean, R., Sherry, L., Townsend, E., McKloud, E., Short, B., Akinbobola, A., et al. (2018b). Wyzwania związane z dezynfekcją powierzchni dla Candida auris: badanie in-vitro. J. Hosp. Infect. 98, 433-436. doi: 10.1016/j.jhin.2017.11.015
PubMed Abstract | CrossRef Full Text | Google Scholar
Kenters, N., Kiernan, M., Chowdhary, A., Denning, D. W., Pemán, J., Saris, K., et al. (2019). Kontrola Candida auris w placówkach opieki zdrowotnej. Outcome of an ISAC expert meeting. Int. J. Antimicrob. Agents 54, 400-406. doi: 10.1016/j.ijantimicag.2019.08.013
CrossRef Full Text | Google Scholar
Kordalewska, M., Lee, A., Park, S., Berrio, I., Chowdhary, A., Zhao, Y., et al. (2018). Understanding echinocandin resistance in the emerging pathogen Candida auris. Antimicrob. Agents Chemother. 62:e00238-18. doi: 10.1128/AAC.00238-18
PubMed Abstract | CrossRef Full Text | Google Scholar
Krishnasamy, L., Krishnakumar, S., Kumaramanickavel, G., and Saikumar, C. (2018). Molekularne mechanizmy oporności na leki przeciwgrzybicze u Candida species. J. Clin. Diagn. Res. 12, DE01-DE06. doi: 10.7860/JCDR/2018/36218.11961
CrossRef Full Text | Google Scholar
Ku, T. S. N., Walraven, C. J., and Lee, S. A. (2018). Candida auris: środki dezynfekcyjne i implikacje dla kontroli zakażeń. Front. Microbiol. 9:726. doi: 10.3389/fmicb.2018.00726
CrossRef Full Text | Google Scholar
Leach, L., Russell, A., Zhu, Y., Chaturvedi, S., and Chaturvedi, V. (2019). A rapid and automated sample-to-result Candida auris real-time PCR assay for high-throughput testing of surveillance samples with BD MAX™ open system. J. Clin. Microbiol. 57:e00630-19. doi: 10.1128/JCM.00630-19
CrossRef Full Text | Google Scholar
Lesho, E. P., Bronstein, M. Z., McGann, P., Stam, J., Kwak, Y., Maybank, R., et al. (2018). Importowanie, łagodzenie i genomowa epidemiologia Candida auris w dużym szpitalu dydaktycznym. Infect. Control Hosp. Epidemiol. 39, 53-57. doi: 10.1017/ice.2017.231
PubMed Abstract | CrossRef Full Text | Google Scholar
Lockhart, S. R., Etienne, K. A., Vallabhaneni, S., Farooqi, J., Chowdhary, A., Govender, N. P., et al. (2017). Simultaneous emergence of multidrug-resistant Candida auris on 3 continents confirmed by whole-genome sequencing and epidemiological analyses. Clin. Infect. Dis. 64, 134-140. doi: 10.1093/cid/ciw691
PubMed Abstract | CrossRef Full Text | Google Scholar
Lopez-Ribot, J. L., McAtee, R. K., Lee, L. N., Kirkpatrick, W. R., White, T. C., Sanglard, D., et al. (1998). Distinct patterns of gene expression associated with development of fluconazole resistance in serial Candida albicans isolates from human immunodeficiency virus-infected patients with oropharyngeal candidiasis. Antimicrob. Agents Chemother. 42, 2932-2937. doi: 10.1128/AAC.42.11.2932
PubMed Abstract | CrossRef Full Text | Google Scholar
Martins, I. M., Cortés, J. C. G., Muñoz, J., Moreno, M. B., Ramos, M., Clemente-Ramos, J. A., et al. (2011). Differential activities of three families of specific beta(1,3)glucan synthase inhibitors in wild-type and resistant strains of fission yeast. J. Biol. Chem. 286, 3484-3496. doi: 10.1074/jbc.M110.174300
PubMed Abstract | CrossRef Full Text | Google Scholar
Mayor, S. (2018). Wybuch Candida auris był związany z sondami temperatury pachowej wielokrotnego użytku, badanie wykazało. BMJ 363:k4133. doi: 10.1136/bmj.k4133
PubMed Abstract | CrossRef Full Text | Google Scholar
Morschhäuser, J., Barker, K. S., Liu, T. T., Bla-Warmuth, J., Homayouni, R., and Rogers, P. D. (2007). The transcription factor Mrr1p controls expression of the MDR1 efflux pump and mediates multidrug resistance in Candida albicans. PLoS Pathog. 3:e164. doi: 10.1371/journal.ppat.0030164
PubMed Abstract | CrossRef Full Text | Google Scholar
Nett, J. E., Crawford, K., Marchillo, K., and Andes, D. R. (2010). Role of Fks1p and matrix glucan in Candida albicans biofilm resistance to an echinocandin, pyrimidine, and polyene. Antimicrob. Agents Chemother. 54, 3505-3508. doi: 10.1128/AAC.00227-10
PubMed Abstract | CrossRef Full Text | Google Scholar
Nolte, F. S., Parkinson, T., Falconer, D. J., Dix, S., Williams, J., Gilmore, C., et al. (1997). Isolation and characterization of fluconazole- and amphotericin B-resistant Candida albicans from blood of two patients with leukemia. Antimicrob. Agents Chemother. 41, 196-199. doi: 10.1128/AAC.41.1.196
PubMed Abstract | CrossRef Full Text | Google Scholar
O’Connor, C., Bicanic, T., Dave, J., Evans, T. J., Moxey, P., Adamu, U., et al. (2019). Ognisko Candida auris na oddziale naczyniowym – niespodziewane pojawienie się oczekiwanego patogenu. J. Hosp. Infect. 103, 106-108. doi: 10.1016/j.jhin.2019.06.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Osei Sekyere, J. (2018). Candida auris: przegląd systematyczny i metaanaliza aktualnych aktualizacji na temat pojawiającego się wielolekoopornego patogenu. MicrobiologyOpen 7:e00578. doi: 10.1002/mbo3.578
PubMed Abstract | CrossRef Full Text | Google Scholar
Park, J. Y., Bradley, N., Brooks, S., Burney, S., and Wassner, C. (2019). Management of patients with Candida auris fungemia at community hospital, Brooklyn, New York, USA, 2016-20181. Emerg. Infect. Dis. 25, 601-602. doi: 10.3201/eid2503.180927
PubMed Abstract | CrossRef Full Text | Google Scholar
Park, S., Kelly, R., Kahn, J. N., Robles, J., Hsu, M.-J., Register, E., et al. (2005). Specific substitutions in the echinocandin target Fks1p account for reduced susceptibility of rare laboratory and clinical Candida sp. isolates. Antimicrob. Agents Chemother. 49, 3264-3273. doi: 10.1128/AAC.49.8.3264-3273.2005
CrossRef Full Text | Google Scholar
Parra-Giraldo, C. M., Valderrama, S. L., Cortes-Fraile, G., Garzón, J. R., Ariza, B. E., Morio, F., et al. (2018). Pierwsze doniesienie o sporadycznych przypadkach Candida auris w Kolumbii. Int. J. Infect. Dis. 69, 63-67. doi: 10.1016/j.ijid.2018.01.034
PubMed Abstract | CrossRef Full Text | Google Scholar
Pemán, J., Cantón, E., and Espinel-Ingroff, A. (2009). Antifungal drug resistance mechanisms. Expert Rev. Anti Infect. Ther. 7, 453-460. doi: 10.1586/eri.09.18
PubMed Abstract | CrossRef Full Text | Google Scholar
Piedrahita, C. T., Cadnum, J. L., Jencson, A. L., Shaikh, A. A., Ghannoum, M. A., and Donskey, C. J. (2017). Powierzchnie środowiskowe w placówkach opieki zdrowotnej są potencjalnym źródłem transmisji Candida auris i innych gatunków candida. Infect. Control Hosp. Epidemiol. 38, 1107-1109. doi: 10.1017/ice.2017.127
PubMed Abstract | CrossRef Full Text | Google Scholar
Rhodes, J., Abdolrasouli, A., Farrer, R. A., Cuomo, C. A., Aanensen, D. M., Armstrong-James, D., et al. (2018). Genomowa epidemiologia brytyjskiego ogniska wschodzącego patogenu grzybiczego u ludzi Candida auris. Emerg. Microbes Infect. 7:43. doi: 10.1101/201343
CrossRef Full Text | Google Scholar
Romera, D., Aguilera-Correa, J. J., Gadea, I., Viñuela-Sandoval, L., García-Rodríguez, J., and Esteban, J. (2019). Candida auris: porównanie wrażliwości planktonicznej i biofilmowej na leki przeciwgrzybicze. J. Med. Microbiol. 68, 1353-1358. doi: 10.1099/jmm.0.001036
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruiz-Gaitán, A., Martínez, H., Moret, A. M., Calabuig, E., Tasias, M., Alastruey-Izquierdo, A., et al. (2019a). Wykrywanie i leczenie Candida auris w sytuacji epidemii: czynniki ryzyka rozwoju kolonizacji i kandydemii przez ten nowy gatunek u krytycznie chorych pacjentów. Expert Rev. Anti Infect. Ther. 17, 295-305. doi: 10.1080/14787210.2019.1592675
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruiz-Gaitán, A., Moret, A. M., Tasias-Pitarch, M., Aleixandre-López, A. I., Martínez-Morel, H., Calabuig, E., et al. (2018). Ognisko wywołane przez Candida auris z przedłużoną kolonizacją i candidaemią w europejskim szpitalu o trzeciorzędowej opiece. Mycoses 61, 498-505. doi: 10.1111/myc.12781
PubMed Abstract | CrossRef Full Text | Google Scholar
Ruiz-Gaitán, A. C., Cantón, E., Fernández-Rivero, M. E., Ramírez, P., and Pemán, J. (2019b). Outbreak of Candida auris in Spain: a comparison of antifungal activity by three methods with published data. Int. J. Antimicrob. Agents 53, 541-546. doi: 10.1016/j.ijantimicag.2019.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Rutala, W. A., Kanamori, H., Gergen, M. F., Sickbert-Bennett, E. E., and Weber, D. J. (2019). Susceptibility of Candida auris and Candida albicans to 21 germicides used in healthcare facilities. Infect. Control Hosp. Epidemiol. 40, 380-382. doi: 10.1017/ice.2019.1
PubMed Abstract | CrossRef Full Text | Google Scholar
Rybak, J. M., Doorley, L. A., Nishimoto, A. T., Barker, K. S., Palmer, G. E., and Rogers, P. D. (2019). Abrogation of triazole resistance upon deletion of CDR1 in a clinical isolate of Candida auris. Antimicrob. Agents Chemother. 63, e00057-19. doi: 10.1128/AAC.00057-19
PubMed Abstract | CrossRef Full Text | Google Scholar
Sana, F., Hussain, W., Zaman, G., Satti, L., Khurshid, U., and Khadim, M. T. (2019). Raport z wybuchu Candida auris z Pakistanu: historia sukcesu kontroli zakażeń w oddziałach intensywnej terapii szpitala trzeciorzędowego. J. Hosp. Infect. 103, 108-110. doi: 10.1016/j.jhin.2019.06.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Sanglard, D., Coste, A., and Ferrari, S. (2009). Antifungal drug resistance mechanisms in fungal pathogens from the perspective of transcriptional gene regulation. FEMS Yeast Res. 9, 1029-1050. doi: 10.1111/j.1567-1364.2009.00578.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Sanglard, D., Ischer, F., Koymans, L., and Bille, J. (1998). Amino acid substitutions in the cytochrome P-450 lanosterol 14-demethylase (CYP51a1) from azole-resistant Candida albicans clinical isolates contribute to resistance to azole antifungal agents. Antimicrob. Agents Chemother. 42, 241-253.
Google Scholar
Sanglard, D., Kuchler, K., Ischer, F., Pagani, J. L., Monod, M., and Bille, J. (1995). Mechanisms of resistance to azole antifungal agents in Candida albicans isolates from AIDS patients involve specific multidrug transporters. Antimicrob. Agents Chemother. 39, 2378-2386. doi: 10.1128/AAC.39.11.2378
PubMed Abstract | CrossRef Full Text | Google Scholar
Sayeed, M. A., Farooqi, J., Jabeen, K., Awan, S., and Mahmood, S. F. (2019). Spektrum kliniczne i czynniki wpływające na wynik leczenia Candida auris: badanie jednoośrodkowe z Pakistanu. BMC Infect. Dis. 19:384. doi: 10.1186/s12879-019-3999-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Schelenz, S., Hagen, F., Rhodes, J. L., Abdolrasouli, A., Chowdhary, A., Hall, A., et al. (2016). First hospital outbreak of the globally emerging Candida auris in a European hospital. Antimicrob. Resist. Infect. Control 5:35. doi: 10.1186/s13756-016-0132-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Schuetzer-Muehlbauer, M., Willinger, B., Egner, R., Ecker, G., and Kuchler, K. (2003). Reversal of antifungal resistance mediated by ABC efflux pumps from Candida albicans functionally expressed in yeast. Int. J. Antimicrob. Agents 22, 291-300. doi: 10.1016/S0924-8579(03)00213-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Sexton, D. J., Kordalewska, M., Bentz, M. L., Welsh, R. M., Perlin, D. S., and Litvintseva, A. P. (2018). Direct detection of emergent fungal pathogen Candida auris in clinical skin swabs by SYBR green-based quantitative PCR assay. J. Clin. Microbiol. 56:e01337-18. doi: 10.1128/JCM.01337-18
PubMed Abstract | CrossRef Full Text | Google Scholar
Sharma, C., Kumar, N., Pandey, R., Meis, J. F., and Chowdhary, A. (2016). Whole genome sequencing of emerging multidrug resistant Candida auris isolates in India demonstrates low genetic variation. New Microbes New Infect. 13, 77-82. doi: 10.1016/j.nmni.2016.07.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Sherry, L., Ramage, G., Kean, R., Borman, A., Johnson, E. M., Richardson, M. D., et al. (2017). Zdolność biofilmotwórcza wysoce wirulentnej, wielolekoopornej Candida auris. Emerg. Infect. Dis. 23, 328-331. doi: 10.3201/eid2302.161320
PubMed Abstract | CrossRef Full Text | Google Scholar
Vandeputte, P., Ferrari, S., and Coste, A. T. (2012). Antifungal resistance and new strategies to control fungal infections. Int. J. Microbiol. 2012:713687. doi: 10.1155/2012/713687
PubMed Abstract | CrossRef Full Text | Google Scholar
Waldorf, A. R., and Polak, A. (1983). Mechanisms of action of 5-fluorocytosine. Antimicrob. Agents Chemother. 23, 79-85. doi: 10.1128/AAC.23.1.79
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, X., Bing, J., Zheng, Q., Zhang, F., Liu, J., Yue, H., et al. (2018). Pierwszy izolat Candida auris w Chinach: aspekty kliniczne i biologiczne. Emerging Microbes & Infections 7, 1-9. doi: 10.1038/s41426-018-0095-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Welsh, R. M., Bentz, M. L., Shams, A., Houston, H., Lyons, A., Rose, L. J., et al. (2017). Survival, persistence, and isolation of the emerging multidrug-resistant pathogenic yeast Candida auris on a plastic health care surface. J. Clin. Microbiol. 55, 2996-3005. doi: 10.1128/JCM.00921-17
PubMed Abstract | CrossRef Full Text | Google Scholar
.
Leave a Reply