Frontiers in Microbiology
Introduction
În ultimul deceniu, o specie emergentă de Candida nosocomială a cauzat cazuri severe de candidemie și alte tipuri de infecții fungice. Focare ale agentului patogen responsabil, și anume Candida auris, au fost observate în întreaga lume (a se vedea figura 1A) (Lockhart et al., 2017).
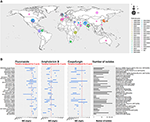
Figura 1. (A) Hartă reprezentând numărul de izolate per focar începând cu 1996. Primul an de izbucnire a focarului este colorat în maro, iar ultimul an de izbucnire este în roz. Dimensiunea cercului este proporțională cu numărul de izolate raportate pentru fiecare focar. Studiul privind focarele a fost realizat recuperând datele din trei recenzii principale (Osei Sekyere, 2018; Jackson et al., 2019; Kenters et al., 2019) și completat de o căutare în Pubmed utilizând interogarea „Candida” ȘI „auris” ȘI „outbreak” ca cuvinte-cheie. Rezultatele au fost limitate în timp, între 21/07/2017, cel mai recent studiu din analiza sistematică realizată de Osei Sekyere și 31/08/2019, când a fost efectuată căutarea în literatura de specialitate. Studii care nu sunt prezente în analiza realizată de Osei Sekyere: (Biswal și colab., 2017; Abdalhamid și colab., 2018; Adams și colab., 2018; Belkin și colab., 2018; Chow și colab., 2018; Desoubeaux și colab., 2018; Lesho și colab., 2018; Mayor, 2018; Parra-Giraldo și colab., 2018; Ruiz-Gaitán și colab, 2018, 2019a,b; Sexton et al., 2018; Adam et al., 2019; Barantsevich et al., 2019; Escandón et al., 2019; Leach et al., 2019; O’Connor et al., 2019; Park et al., 2019; Sana et al., 2019; Sayeed et al., 2019). (B) Intervale MIC pentru trei antifungice măsurate în izolate de C. auris din diferite focare din întreaga lume. Linia punctată roșie reprezintă punctul de ruptură provizoriu propus de CDC. IPSV este un acronim pentru „India, Pakistan, Africa de Sud și Venezuela”, deoarece tulpinile din aceste țări au fost toate analizate în cadrul aceluiași studiu. Studiul focarelor a fost efectuat în mod identic cu (A). Doar focarele cu >1 izolat au fost reprezentate grafic. Studiile citate de Osei Sekyere sunt semnalate cu , iar studiile citate de Kenters et al. cu .
Secvențierea întregului genom a determinat prezența a patru clade specifice în cadrul speciei C. auris: Asia de Est, Asia de Sud, Africa de Sud și America de Sud. Toate cladele sunt caracterizate de polimorfisme de un singur nucleotid (SNP) distincte, ceea ce evidențiază apariția independentă și la nivel mondial a acestui agent patogen (Lockhart et al., 2017).
Studii comparative pe diferite modele animale (larve de murine și de Galleria mellonella) au arătat niveluri de virulență dependente de tulpină pentru C. auris. În majoritatea cazurilor, tulpinile de C.auris s-au dovedit a fi mai puțin virulente decât C. albicans (Borman et al., 2016; Ben-Ami et al., 2017; Fakhim et al., 2018; Wang et al., 2018). Cu toate acestea, cazurile raportate de focare de C. auris au fost legate de o rată ridicată a mortalității, în principal la pacienții imunocompromiși. Alte afecțiuni, cum ar fi diabetul, bolile cardiovasculare și/sau pulmonare, sepsisul sau un tratament anterior cu antibiotice au părut a fi, de asemenea, factori de risc importanți (Osei Sekyere, 2018).
Excepțional pentru o drojdie, C. auris s-a răspândit cu succes în mediile nosocomiale. De exemplu, într-un spital din Marea Britanie, un singur pacient colonizat cu C. auris a dus la identificarea ulterioară a altor cazuri în rândul altor pacienți spitalizați. Agentul patogen a fost, de asemenea, detectat la personalul medical chiar și la câteva luni după prima sa izolare, sugerând o transmitere eficientă de la om la om. În plus, au fost găsite urme de C. auris pe marginea paturilor, pe pervazurile ferestrelor, pe monitoare și pe alte echipamente din tot spitalul, ceea ce arată că C. auris este capabilă să persiste pe suprafețele nosocomiale (Schelenz et al., 2016), spre deosebire de alte specii de Candida. Investigarea unui focar într-un alt spital din Marea Britanie a raportat că utilizarea de echipamente reutilizabile, cum ar fi sondele de temperatură axilară, a fost cauza principală a transmiterii la pacienți (Eyre et al., 2018), ilustrând și mai mult capacitatea sa de a supraviețui pe suprafețe.
Capacitatea de a supraviețui în mediile nosocomiale s-ar putea datora capacității lui C. auris de a forma biofilme; o formă de creștere în care celulele sunt aranjate împreună în microcolonii protejate de o matrice de glucan. Prin convenție, celulele închise în matrice se numesc sesile, iar celulele din afara acesteia se numesc planctonice. S-a dovedit că celulele de C. auris protejate de această structură sunt dificil de eliminat, chiar și cu proceduri de dezinfecție de nivel înalt (Kean et al., 2018b).
Pe lângă faptul că ar putea permite o supraviețuire crescută pe suprafețe inerte, abilitatea C. auris de a forma biofilme poate fi, de asemenea, un factor important al rezistenței sale la antifungicele sistemice utilizate în tratamentul pacienților. Într-adevăr, faptul că celulele care formează biofilme au fost izolate din răni și vârfuri de catetere indică faptul că unele celule de C. auris ar putea supraviețui sub formă de biofilm la pacienți (Borman et al., 2016) și s-a demonstrat că celulele sesile au prezentat o sensibilitate redusă pentru mai multe antifungice. (Sherry et al., 2017). În cele din urmă, s-a demonstrat, de asemenea, că biofilmul este un factor de virulență important, deoarece tulpinile de C. auris care formează biofilme sunt legate de creșterea morbidității și mortalității (Borman et al., 2016).
Cu această trecere în revistă ne propunem să evidențiem mecanismele moleculare de rezistență dobândite de C. auris, care au dus la supraviețuirea sa extraordinară în mediul nosocomial și la pacienții spitalizați.
Sensibilitatea antifungică a C. auris
După 10 ani de înregistrare a concentrației minime inhibitorii (CMI) pentru antifungicele disponibile, CDC a publicat recent o tentativă de puncte de rupere pentru a defini mai bine sensibilitatea antifungică a C. auris1. A reieșit în mod clar că C. auris are CMI excepțional de ridicate pentru cele patru clase principale de medicamente antifungice: azoli, echinocandine, poliene (figura 1B) și analogi nucleozidici. În acest capitol, vom examina în detaliu doi factori care s-au dovedit a juca un rol în această sensibilitate scăzută la tratamentele antifungice: mecanismele moleculare de rezistență și mecanismele de rezistență asociate biofilmului.
2.1. Mecanismele de rezistență moleculară
Definim aici rezistența moleculară ca fiind modalitățile prin care celulele individuale își pot scădea sensibilitatea la antifungice datorită modificărilor genetice care duc la modificarea țintei medicamentelor, supraexprimarea pompelor de eflux sau modificări ale metabolismului (a se vedea pentru analiză: Pemán et al., 2009; Sanglard et al., 2009; Krishnasamy et al., 2018). Această secțiune compilează, pentru fiecare clasă de antifungice, principalele mecanisme moleculare de rezistență găsite până în prezent la C. auris. În plus, Tabelul 1 sintetizează, pentru fiecare medicament, modul de acțiune, mecanismele de rezistență aferente descrise la Candida non-auris și mecanismele de rezistență descoperite la C. auris, până în prezent.

Tabel 1. Farmacodinamica celor patru clase principale de antifungice și mecanismele de rezistență asociate la Candida spp. în general și la C. auris în special.
2.1.1. Mecanismele de rezistență la azoli
2.1.1.1.1. Supraexprimarea pompelor de eflux MFS și ABC
Pompele de eflux sunt proteine care transportă componente prin membrana celulară. Unele dintre ele pot pompa medicamente în afara celulei, scăzând concentrația și efectul acestora asupra celulei. Există două familii majore de pompe de eflux implicate în rezistența antifungică: Transportatorii ABC (ATP Binding Cassette) și transportatorii MFS (Major Facilitator Superfamily). Supraexprimarea crescută a pompelor de eflux este unul dintre mecanismele majore de rezistență la azoli la speciile patogene de Candida (Schuetzer-Muehlbauer et al., 2003; Morschhäuser et al., 2007).
Secvențele indiene de C. auris secvențiate în două studii diferite prezintă numeroase gene ortologe cu transportoarele ABC și MFS ale lui C. albicans (Chatterjee et al., 2015; Sharma et al., 2016). În mod interesant, tulpinile de C. auris care au fost izolate în Israel au prezentat o activitate de transport ABC intrinsecă ridicată în comparație cu C. glabrata și C. haemulonii, prin măsurarea efluxului unui substrat fluorescent (Rodamina 6G) (Ben-Ami et al., 2017).
În C. albicans, CDR1 este o genă care codifică pentru o pompă de eflux ABC, cunoscută pentru rolul său în rezistența la azoli (Sanglard et al., 1995). O genă omologă cu CDR1 a fost găsită la C. auris. (Rybak et al., 2019). Același studiu a arătat, de asemenea, că deleția acestei gene ar putea crește susceptibilitatea tulpinilor rezistente de la 64 până la 128 de ori (Rybak et al., 2019).
2.1.1.1.2. Mutații punctiforme în ERG11
Ergosterolul este o componentă cheie a membranei la ciuperci. La Candida spp. biosinteza sa este mediată, printre altele, de enzima Lanosterol 14-alfa-demetilază (LD), codificată de gena ERG11, care transformă lanosterolul în ergosterol. LD este ținta principală a azolilor, antifungice care inhibă funcția enzimei și oprește efectiv biosinteza ergosterolului, afectând astfel integritatea membranară (Sanglard et al., 1998).
Mutații punctiforme în ERG11 au demonstrat că reduc sensibilitatea la azoli la Candida spp, în special în trei regiuni „hot-spot” situate între aminoacizii 105-165, 266-287 și 405-488 (Vandeputte et al., 2012).
În mod interesant, după ce am recuperat secvențele de aminoacizi a 44 de izolate de C. auris din India, au fost găsite 15 mutații missense atunci când au fost aliniate la secvența ERG11 de tip sălbatic din C. albicans (Chowdhary et al., 2018). Cinci dintre aceste mutații au fost deja asociate cu rezistența la azoli la C. albicans. Dintre aceste variante, două au fost găsite în fiecare tulpină rezistentă testată în acest studiu, și anume Y132F sau K143R (Chowdhary et al., 2018). Se poate observa, de asemenea, că aceste mutații se află în primul „hot spot” discutat anterior.
Un screening pentru variantele din gena ERG11 a tulpinilor de C. auris din Columbia a identificat aceleași substituții Y132F și K143R. La exprimarea heterologă a acestor două mutații în S. cerivisiae, CMI pentru azoli au prezentat o creștere de două ori mai mare în comparație cu tulpinile de S. cerevisiae care exprimă gena ERG11 de tip sălbatic din C. auris (Healey et al., 2018).
2.1.1.3. Supraexpresia ERG11
În C. albicans, o supraexpresie a ERG11 a fost legată și de o rezistență la tratamentul cu azoli. producția crescută de LD copleșește capacitatea antifungicului de a inhiba activitatea proteinei, rezultând o proteină activă în ciuda tratamentului medicamentos (Lopez-Ribot et al, 1998).
La C. auris, experimentele PCR în timp real au arătat că, în absența fluconazolului, nu a existat nicio diferență în expresia ERG11 între tulpinile sensibile la fluconazol și cele rezistente la fluconazol (Chowdhary et al., 2018). În prezența antifungicului, expresia ERG11 crește în cazul tulpinilor rezistente, în comparație cu un control fără fluconazol (Chowdhary et al., 2018). Cu toate acestea, efectul acestui medicament asupra expresiei ERG11 nu a fost testat pe tulpini sensibile. Prin urmare, până în prezent, nu s-a demonstrat că expresia condiționată crescută a ERG11 în prezența fluconazolului este specifică tulpinilor rezistente.
2.1.2. Mecanisme de rezistență la echinocandine
Beta(1,3)D-glucan este o componentă cheie a peretelui celular fungic și este codificat de genele FKS1 și FKS2, două subunități ale Beta(1,3)D-glucan sintetazei. Echinocandinele inhibă această enzimă, scăzând cantitatea de glucani din peretele celular (Martins et al., 2011).
La C. albicans și la alte specii de Candida non-auris, mai multe mutații care duc la rezistența la echinocandine au fost găsite în aceleași două regiuni ale FKS1 și FKS2. Astfel, acestea au fost denumite „puncte fierbinți” 1 și 2 (HS1 și HS2). În gena FKS1 din C. albicans, aceste „puncte fierbinți” sunt situate între aminoacizii 641-649 și 1.345-1.365 (Park et al., 2005). Secvențierea regiunilor „hot-spot” corespunzătoare din 38 de tulpini de C. auris a dus la descoperirea unei substituții de aminoacizi S639F care este corelată cu rezistența la pan-echinocandine: a fost prezentă în toate cele patru tulpini rezistente și absentă în cele 34 de tulpini sensibile. Această poziție în C. auris FKS1 este aliniată la poziția 645 (de asemenea, o serină) în C. albicans (Chowdhary et al., 2018). Este interesant faptul că această mutație se află în regiunea care se aliniază la HS1 din C. albicans FKS1. Alte studii au observat mutații diferite în aceeași locație în tulpinile de C. auris rezistente la echinocandine: S639Y și S639P (Rhodes et al., 2018). Aceasta din urmă a fost confirmată ca fiind cauza rezistenței la echinocandine in vivo într-un model de șoarece (Kordalewska et al., 2018).
FKS2 a fost, de asemenea, găsită într-o singură copie în genomul C. auris (Sharma et al., 2016), dar, după cunoștințele noastre, nu au fost găsite mutații asociate cu rezistența la echinocandine în această genă.
2.1.3. Mecanisme de rezistență la polieni
Cum se arată în figura 1B, mai multe tulpini de C. auris sunt rezistente la amfotericina B (AMB). La speciile de Candida, modificările compoziției sterolice a membranei au fost evidențiate ca fiind un mecanism de rezistență (Haynes et al., 1996; Nolte et al., 1997). La C. albicans, s-a demonstrat că mutațiile în ERG 2, 3, 5, 6 sau 11 au acest efect (Arendrup și Patterson, 2017). Rhodes și colab. au analizat 27 de izolate de C. auris din Regatul Unit pentru SNP-uri în aceste gene în tulpini care prezintă o sensibilitate redusă la AMB. Cu toate acestea, nu au fost găsite variante care să explice aceste diferențe în ceea ce privește sensibilitatea la medicamente (Rhodes et al., 2018).
2.1.4. Mecanismele de rezistență la flucitozină (5-Fluorocitosină)
Flucitozina este un analog nucleozidic care inhibă sinteza acidului nucleic. După intrarea în celule, flucitozina trebuie să fie activată pentru a avea un efect antifungic. Această activare necesită, printre altele, proteina codificată de gena FUR1 Waldorf și Polak (1983). La speciile de Candida non-auris s-a demonstrat că mutațiile în FUR1 sunt legate de rezistența la flucitozină (Vandeputte et al., 2012).
Rhodes et al. au secvențiat o tulpină de C. auris rezistentă la flucitozină și au observat o substituție de aminoacizi F211I în gena FUR1 (Rhodes et al., 2018). Această mutație missense specifică nu are un echivalent cunoscut la alte specii de Candida, prin urmare, sunt necesare studii suplimentare pentru a determina dacă această mutație este cauza rezistenței la flucitozină în tulpina de C. auris testată (Rhodes et al., 2018). Cu toate acestea, acest medicament este mai puțin angajat decât alte antifungice. Din acest motiv, au fost efectuate mai puține studii pentru a înțelege mai bine rezistența lui C. auris la acest compus.
Pentru a rezuma, unele mecanisme de rezistență descoperite anterior la speciile de Candida, cum ar fi C. glabrata și C. albicans, au fost prezentate și de C. auris. Acestea sunt enumerate în ultima coloană a tabelului 1. Cu toate acestea, rezistența antifungică a C. auris este explicată doar parțial prin aceste mecanisme de rezistență descrise anterior. Pentru a concepe în cele din urmă noi agenți terapeutici și, în general, pentru a îmbunătăți îngrijirea pacienților, sunt necesare studii suplimentare pentru a înțelege mai bine mecanismele de bază care conduc la intervalele MIC excepțional de ridicate prezentate de unele C. auris (a se vedea figura 1B).
2.2. Biofilm: Un mod de viață rezistent la antifungice
A fost demonstrat că CMI pentru mai multe antifungice sunt mai mari în celulele sesile de C. auris (de până la 4, 20, 60 de ori pentru voriconazol, amfotericină B și, respectiv, micafungină) în comparație cu celulele planctonice (Sherry et al., 2017). În mod similar, s-a demonstrat că concentrațiile minime de eradicare a biofilmului sunt de 512 ori mai mari decât CMI-urile pentru echinocandine și azoli (Romera et al., 2019). Acest fenomen a fost demonstrat anterior pentru C. albicans (Hawser și Douglas, 1995). Mecanismele moleculare responsabile pentru aceste CMI ridicate sunt încă în mare parte necunoscute la C. auris, dar unele studii au oferit deja unele informații.
S-a constatat că genele care codifică pompele de eflux ABC și MSF au fost suprareglate (de 2 până la 4 ori) în celulele sesile în comparație cu celulele planctonice (Kean et al., 2018a). În concordanță, activitatea proteinelor corespunzătoare a fost de 2 ori mai mare. Cu toate acestea, atunci când au fost tratate cu inhibitori ai pompelor de eflux, sensibilitatea antifungică a celulelor sesile a crescut de 4 până la 16 ori după 12 h. Acest lucru sugerează că pompele de eflux joacă un rol important în rezistența la antifungice afișată de acest tip de celule (Kean et al., 2018a).
La C. albicans, se știe că matricea exopolimerică se leagă în mod nespecific de toate clasele de antifungice și le sechestrează în afara celulelor (Nett et al., 2010). Deoarece Candida spp. au în comun un profil polizaharidic de bază, s-a sugerat că acest mecanism ar putea fi conservat și în C. auris (Kean et al., 2018a). Acest lucru a fost confirmat ulterior în teste in vivo și in vitro (Dominguez et al., 2019).
Persistență nosocomială
Capacitatea lui C. auris de a coloniza și persista pe suprafețe este excepțională: este capabil să persiste mai mult timp pe suprafețe umede în comparație cu C. albicans (Piedrahita et al., 2017). De asemenea, are o activitate metabolică prelungită pe suprafețe, asemănătoare cu C. parapsilosis, un colonizator cunoscut al pielii și al plasticului (Piedrahita et al., 2017; Welsh et al., 2017).
Supraviețuirea crescută a lui C. auris pe suprafețe a fost investigată prin două studii. Primul a susținut că ar putea fi legată de o rezistență sporită la stresul mediului la temperatură și la alți factori de stres (Kean et al., 2018b). Cel de-al doilea formulează ipoteza că s-ar putea datora formării biofilmului. Cu toate acestea, acest lucru rămâne să fie dovedit, deoarece, până în prezent, niciun izolat care formează biofilme nu a fost recuperat de pe suprafețele mediului (Ku et al., 2018). Trebuie remarcat faptul că aceste două posibilități nu se exclud reciproc și că formarea biofilmului ar putea fi chiar cauza rezistenței crescute la stres (Ku et al., 2018).
Prezența lui C. auris în mediile nosocomiale este accentuată de rezistența acestui agent patogen la procedurile de dezinfecție. A fost testată eficacitatea NaOCl și a acidului peracetic pe suprafețe din oțel inoxidabil, polimer (coverlips din poliester) și celuloză. Ambii dezinfectanți au demonstrat o eficacitate semnificativă în ceea ce privește distrugerea celulelor de C. auris pe toate suprafețele. Cu toate acestea, unele celule viabile au rămas după aplicarea NaOCl pe suprafețe neporoase (coperți din oțel inoxidabil și poliester). De fapt, au fost necesare concentrații mai mari ale acestui dezinfectant, împreună cu timpi de expunere mai lungi, pentru a reduce regenerarea, dar chiar și așa, acestea nu au fost capabile să eradicheze complet agentul patogen. De exemplu, o concentrație de 10.000 de părți pe milion (ppm) de NaOCl, cuplată la o expunere de 5 minute pe oțel inoxidabil, a fost suficientă pentru a observa o reducere semnificativă a coloniilor. Cu toate acestea, s-a observat o regenerare substanțială după reinocularea pe un mediu bogat (Kean et al., 2018b).
Pentru acidul peracetic, care este un dezinfectant de nivel înalt, această regenerare a fost dependentă de suprafață, deoarece nu s-a observat nicio regenerare pentru polimer, spre deosebire de oțelul inoxidabil. Aceștia au efectuat aceleași experimente pe C. glabrata și C. albicans și au obținut rezultate similare (Kean et al., 2018b).
Acesta arată că procedurile de dezinfecție de nivel înalt pot fi insuficiente pentru o curățare completă a suprafețelor și că liniile directoare prestabilite pentru dezinfecția suprafețelor trebuie să fie adaptate la aceste specii de Candida (Kean et al., 2018b). Factori precum tipul de suprafețe și timpii de expunere ar trebui luați în considerare atunci când se implementează aceste proceduri de dezinfecție (Kean et al., 2018b; Ku et al., 2018), nu doar costul și ușurința de utilizare, așa cum se întâmplă adesea (Ku et al., 2018).
Bazându-se pe rezultatele a două studii (Cadnum et al., 2017; Rutala et al., 2019), CDC recomandă utilizarea unor dezinfectanți eficienți împotriva sporilor de Clostridioides difficile. Dacă nu este posibil, aceștia sugerează alternative, cum ar fi peroxidul de hidrogen 0,5-1,4 % sau compușii de amoniu cuaternar suplimentați cu alcool izopropilic și/sau alcool etilic2. În cele din urmă, lumina ultravioletă-C ar putea fi, de asemenea, un candidat interesant pentru dezinfectarea suprafețelor. Aceasta s-a dovedit a fi foarte eficientă în distrugerea coloniilor de C. auris, în condițiile unui timp de expunere și a unei distanțe suficiente. Cu toate acestea, ar fi necesare studii suplimentare înainte de a implementa astfel de metode în mediul spitalicesc (de Groot et al., 2019).
Concluzie
Capacitatea patogenă și virulentă a C. auris este profund îngrijorătoare. Mai ales că focarele au apărut independent în diferite regiuni ale lumii și că izolatele asociate au prezentat o sensibilitate redusă la cele mai frecvent utilizate medicamente antifungice folosite pentru tratamentul pacienților (a se vedea figura 1).
Pentru a explica sensibilitatea antifungică redusă la C. auris, cercetătorii au utilizat cunoștințele extinse deja disponibile cu privire la alte specii de Candida, în special C. albicans. Ca urmare, au fost evidențiate unele dintre mecanismele de rezistență ale C. auris (a se vedea tabelul 1). Mai precis, s-a dovedit că două mutații punctiforme în ERG11 și supraexprimarea transportatorului ABC Cdr1 reduc sensibilitatea la fluconazol. În plus, s-a demonstrat că o substituție de aminoacizi în FKS1 reduce sensibilitatea C. auris la echinocandine, care este, în mod normal, medicamentul de alegere pentru tratamentul împotriva acestui agent patogen (Bidaud et al., 2018). În cele din urmă, o mutație în FUR1 a fost identificată într-o tulpină de C. auris rezistentă la flucitozină, dar rămâne să fie demonstrată ca fiind cauza acestei sensibilități reduse. Se crede că biofilmul este un mecanism de rezistență în sine, deoarece s-a demonstrat că acesta reduce sensibilitatea la medicamente. Cu toate acestea, sunt încă necesare cercetări suplimentare pentru a descrie întreaga varietate de procese care au loc în această formă de creștere. Este important de remarcat faptul că biofilmul este o structură complexă care rămâne slab înțeleasă și dificil de investigat, chiar și în cazul unor specii bine cunoscute, cum ar fi C. albicans.
Proprietățile de rezistență ale C. auris sunt cuplate cu o înclinație de a provoca infecții nosocomiale. Capacitatea sa de a adera la o varietate de suprafețe nosocomiale și de a supraviețui dezinfecției sunt factori critici de propagare. Prezența mai multor tipuri de suprafețe reprezintă o provocare pentru instituțiile clinice, deoarece procedurile standard de dezinfecție sunt ineficiente și neadaptate pentru fiecare tip de suprafață în parte. Această problemă, apare și din cauza cercetării insuficiente pe această temă. În plus, o mai bună înțelegere a mecanismelor care stau la baza rezistenței C. auris la dezinfectanți ar ajuta la îmbunătățirea protocoalelor de igienă și la evitarea viitoarelor focare nosocomiale.
Contribuții ale autorilor
FC, AG și LJ au participat în mod egal la redactarea acestei analize. AC a supravegheat și a participat la redactarea acestei recenzii.
Conflict de interese
Autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Recunoștințe
Am dori să-i mulțumim Clarei Heiman, în calitate de vorbitoare nativă de limba engleză, pentru că a revizuit manuscrisul nostru.
Notele de subsol
1. ^CDC (2019). Antifungal Susceptibility Testing and Interpretation (Teste de sensibilitate antifungică și interpretare). Disponibil online la adresa: https://www.cdc.gov/fungal/candida-auris/c-auris-antifungal.html (accesat la 29 aprilie 2019).
2. ^CDC (2018). Prevenirea și controlul infecțiilor pentru Candida auris. Disponibil online la adresa: https://www.cdc.gov/fungal/candida-auris/c-auris-infection-control.html (accesat la 12 noiembrie 2019).
Abdalhamid, B., Almaghrabi, R., Althawadi, S., și Omrani, A. (2018). Primul raport de infecții cu Candida auris din Arabia Saudită. J. Infect. Public Health 11, 598-599. doi: 10.1016/j.jiph.2018.05.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Adam, R. D., Revathi, G., Okinda, N., Fontaine, M., Shah, J., Kagotho, E., et al. (2019). Analiza fungiei Candida auris la o singură unitate din Kenya. Int. J. Infect. Dis. 85, 182-187. doi: 10.1016/j.ijid.2019.06.001
PubMed Abstract | Ref. Full Text | Google Scholar
Adams, E., Quinn, M., Tsay, S., Poirot, E., Chaturvedi, S., Southwick, K., et al. (2018). Candida auris în unitățile de asistență medicală, New York, SUA, 2013-2017. Emerg. infect. Dis. 24, 1816-1824. doi: 10.3201/eid2410.180649
CrossRef Full Text | Google Scholar
Arendrup, M. C., și Patterson, T. F. (2017). Candida rezistentă la mai multe medicamente: epidemiologie, mecanisme moleculare și tratament. J. Infect. Dis. 216, S445-S451. doi: 10.1093/infdis/jix131
PubMed Abstract | CrossRef Full Text | Google Scholar
Barantsevich, N. E., Orlova, O. E., Shlyakhto, E. V., Johnson, E. M., Woodford, N., Lass-Floerl, C., et al. (2019). Apariția Candida auris în Rusia. J. Hosp. Infect. 102, 445-448. doi: 10.1016/j.jhin.2019.02.021
PubMed Abstract | Reflect Full Text | Google Scholar
Belkin, A., Gazit, Z., Keller, N., Ben-Ami, R., Wieder-Finesod, A., Novikov, A., et al. (2018). Infecția cu Candida auris care duce la transmiterea nosocomială, Israel, 2017. Emerg. infect. Dis. 24, 801-804. doi: 10.3201/eid2404.171715
PubMed Abstract | CrossRef Full Text | Google Scholar
Ben-Ami, R., Berman, J., Novikov, A., Bash, E., Shachor-Meyouhas, Y., Zakin, S., et al. (2017). Candida haemulonii și C. auris multidrog-rezistente, Tel Aviv, Israel. Emerg. infect. Dis. 23, 195-203. doi: 10.3201/eid2302.161486
PubMed Abstract | CrossRef Full Text | Google Scholar
Bidaud, A. L., Chowdhary, A. și Dannaoui, E. (2018). Candida auris: o drojdie emergentă rezistentă la medicamente – O mini-revizuire. J. Mycol. Méd. 28, 568-573. doi: 10.1016/j.mycmed.2018.06.007
PubMed Abstract | Reflect Full Text | Google Scholar
Biswal, M., Rudramurthy, S. M., Jain, N., Shamanth, A. S., Sharma, D., Jain, K., et al. (2017). Controlul unui posibil focar de infecție cu Candida auris: lecții învățate din mai multe intervenții. J. Hosp. Infect. 97, 363-370. doi: 10.1016/j.jhin.2017.09.009
PubMed Abstract | Full CrossRef Text | Google Scholar
Borman, A. M., Szekely, A., și Johnson, E. M. (2016). Patogenitatea comparativă a izolatelor din Regatul Unit ale agentului patogen emergent Candida auris și a altor specii de candida patogene cheie. mSphere 1:e00189-16. doi: 10.1128/mSphere.00189-16. doi: 10.1128/mSphere.00189-16
CrossRef Full Text | Google Scholar
Cadnum, J. L., Shaikh, A. A., Piedrahita, C. T., Sankar, T., Jencson, A. L., Larkin, E. L., et al. (2017). Eficacitatea dezinfectanților împotriva Candida auris și a altor specii de candida. Infect. Control Hosp. epidemiol. 38, 1240-1243. doi: 10.1017/ice.2017.162
PubMed Abstract | Full Text | Google Scholar
Chatterjee, S., Alampalli, S. V., Nageshan, R. K., Chettiar, S. T., Joshi, S., și Tatu, U. S. (2015). Proiectul de genom al unui agent patogen multidrog rezistent, frecvent diagnosticat greșit, Candida auris. BMC Genomics 16:686. doi: 10.1186/s12864-015-1863-z
PubMed Abstract | Reflect Full Text | Google Scholar
Chow, N. A., Gade, L., Tsay, S. V., Forsberg, K., Greenko, J. A., Southwick, K. L., et al. (2018). Introducerile multiple și transmiterea ulterioară a Candida auris multirezistentă în SUA: un studiu epidemiologic molecular. Lancet Infect. Dis. 18, 1377-1384. doi: 10.1016/S1473-3099(18)30597-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Chowdhary, A., Prakash, A., Sharma, C., Kordalewska, M., Kumar, A., Sarma, S., et al. (2018). Un studiu multicentric al modelelor de sensibilitate antifungică în rândul izolatelor 350 Candida auris (2009-17) din India: rolul genelor ERG11 și FKS1 în rezistența la azoli și echinocandine. J. Antimicrob. Chemother. 73, 891-899. doi: 10.1093/jac/dkx480
PubMed Abstract | Text integral | Google Scholar
de Groot, T., Chowdhary, A., Meis, J. F., și Voss, A. (2019). Uciderea Candida auris de către UV-C: importanța timpului de expunere și a distanței. Mycoses 62, 408-412. doi: 10.1111/myc.12903
PubMed Abstract | Full CrossRef Text | Google Scholar
Desoubeaux, G., Bailly, E., Guillaume, C., De Kyvon, M.-A., Tellier, A.-C., Morange, V., et al. (2018). Candida auris în laboratoarele de micologie contemporane: câteva trucuri practice pentru a o identifica în mod fiabil, conform unei experiențe franceze recente. J. Mycol. Med. 28, 407-410. doi: 10.1016/j.mycmed.2018.02.011
PubMed Abstract | Reflect Full Text | Google Scholar
Dominguez, E. G., Zarnowski, R., Choy, H. L., Zhao, M., Sanchez, H., Nett, J. E., et al. (2019). Rolul conservat pentru polizaharidele matricei biofilmului în rezistența la medicamente Candida auris. mSphere 4: e00680-18. doi: 10.1128/mSphereDirect.00680-18
PubMed Abstract | CopyRef Full Text | Google Scholar
Escandón, P., Chow, N. A., Caceres, D. H., Gade, L., Berkow, E. L., Armstrong, P., et al. (2019). Epidemiologia moleculară a Candida auris în Columbia relevă o colonizare foarte legată, la nivelul întregii țări, cu modele regionale în ceea ce privește rezistența la amfotericină B. Clin. Infect. Dis. 68, 15-21. doi: 10.1093/cid/ciy411
CrossRef Full Text | Google Scholar
Eyre, D. W., Sheppard, A. E., Madder, H., Moir, I., Moroney, R., Quan, T. P., et al. (2018). Un focar de Candida auris și controlul acestuia într-un mediu de terapie intensivă. N. Engl. J. Med. 379, 1322-1331. doi: 10.1056/NEJMoa1714373
PubMed Abstract | Full CrossRef Text | Google Scholar
Fakhim, H., Vaezi, A., Dannaoui, E., Chowdhary, A., Nasiry, D., Faeli, L., et al. (2018). Virulența comparativă a Candida auris cu Candida haemulonii, Candida glabrata și Candida albicans într-un model murin. Mycoses 61, 377-382. doi: 10.1111/myc.12754
PubMed Abstract | Full CrossRef Text | Google Scholar
Hawser, S. P., și Douglas, L. J. (1995). Rezistența biofilmelor de Candida albicans la agenții antifungici in vitro. Antimicrob. Agents Chemother. 39, 2128-2131. doi: 10.1128/AAC.39.9.2128
PubMed Abstract | Textul integral | Google Scholar
Haynes, M. P., Chong, P. L.-G., Buckley, H. R. R., și Pieringer, R. A. (1996). Studii de fluorescență privind acțiunea moleculară a amfotericinei B asupra celulelor fungice sensibile și rezistente. Biochimie 35, 7983-7992. doi: 10.1021/bi952910c
PubMed Abstract | Refef Full Text | Google Scholar
Healey, K. R., Kordalewska, M., Ortigosa, C. J., Singh, A., Berrío, I., Chowdhary, A., et al. (2018). Mutațiile ERG11 limitate identificate în izolate de Candida auris contribuie direct la o sensibilitate redusă la azoli. Antimicrob. Agents Chemother. 62, e01427-18. doi: 10.1128/AAC.01427-18
PubMed Abstract | CrossRef Full Text | Google Scholar
Jackson, B. R., Chow, N., Forsberg, K., Litvintseva, A. P., Lockhart, S. R., Welsh, R., et al. (2019). Despre originile unei specii: ce ar putea explica apariția lui Candida auris? J. Fungi 5:E58. doi: 10.3390/jof5030058
PubMed Abstract | Full CrossRef Text | Google Scholar
Kean, R., Delaney, C., Sherry, L., Borman, A., Johnson, E. M., Richardson, M. D., et al. (2018a). Ansamblarea și profilarea transcriptomului de Candida auris dezvăluie noi informații despre rezistența mediată de biofilm. mSphere 3:e00334-18. doi: 10.1128/mSphere.00334-18
PubMed Abstract | CopyRef Full Text | Google Scholar
Kean, R., Sherry, L., Townsend, E., McKloud, E., Short, B., Akinbobola, A., et al. (2018b). Provocări de dezinfectare a suprafețelor pentru Candida auris: un studiu in-vitro. J. Hosp. Infect. 98, 433-436. doi: 10.1016/j.jhin.2017.11.015
PubMed Abstract | Full CrossRef Text | Google Scholar
Kenters, N., Kiernan, M., Chowdhary, A., Denning, D. W., Pemán, J., Saris, K., et al. (2019). Controlul Candida auris în instituțiile de sănătate. Rezultatul unei reuniuni de experți ISAC. Int. J. Antimicrob. Agents 54, 400-406. doi: 10.1016/j.ijantimicag.2019.08.013
CrossRef Full Text | Google Scholar
Kordalewska, M., Lee, A., Park, S., Berrio, I., Chowdhary, A., Zhao, Y., et al. (2018). Înțelegerea rezistenței la echinocandine în patogenul emergent Candida auris. Antimicrob. Agents Chemother. 62:e00238-18. doi: 10.1128/AAC.00238-18
PubMed Abstract | Full CrossRef Text | Google Scholar
Krishnasamy, L., Krishnakumar, S., Kumaramanickavel, G., și Saikumar, C. (2018). Mecanismele moleculare ale rezistenței la medicamente antifungice în speciile de Candida. J. Clin. Diagn. Res. 12, DE01-DE06. doi: 10.7860/JCDR/2018/36218.11961
CrossRef Full Text | Google Scholar
Ku, T. S. N., Walraven, C. J., și Lee, S. A. (2018). Candida auris: dezinfectanți și implicații pentru controlul infecțiilor. Front. Microbiol. 9:726. doi: 10.3389/fmicb.2018.00726
CrossRef Full Text | Google Scholar
Leach, L., Russell, A., Zhu, Y., Chaturvedi, S., și Chaturvedi, V. (2019). Un test PCR în timp real rapid și automatizat de la probă la rezultat pentru Candida auris pentru testarea de mare capacitate a probelor de supraveghere cu sistemul deschis BD MAX™. J. Clin. Microbiol. 57:e00630-19. doi: 10.1128/JCM.00630-19
CrossRef Full Text | Google Scholar
Lesho, E. P., Bronstein, M. Z., McGann, P., Stam, J., Kwak, Y., Maybank, R., et al. (2018). Importul, atenuarea și epidemiologia genomică a Candida auris la un mare spital universitar. Infect. Control Hosp. epidemiol. 39, 53-57. doi: 10.1017/ice.2017.231
PubMed Abstract | CrossRef Full Text | Google Scholar
Lockhart, S. R., Etienne, K. A., Vallabhaneni, S., Farooqi, J., Chowdhary, A., Govender, N. P., et al. (2017). Apariția simultană a Candida auris multirezistentă la medicamente pe 3 continente, confirmată prin secvențierea întregului genom și analize epidemiologice. Clin. Infect. Dis. 64, 134-140. doi: 10.1093/cid/ciw691
PubMed Abstract | CrossRef Full Text | Google Scholar
Lopez-Ribot, J. L., McAtee, R. K., Lee, L. N., Kirkpatrick, W. R., White, T. C., Sanglard, D., et al. (1998). Modele distincte de expresie genetică asociate cu dezvoltarea rezistenței la fluconazol în izolatele seriale de Candida albicans de la pacienții infectați cu virusul imunodeficienței umane cu candidoză orofaringiană. Antimicrob. Agents Chemother. 42, 2932-2937. doi: 10.1128/AAC.42.11.2932
PubMed Abstract | CrossRef Full Text | Google Scholar
Martins, I. M., Cortés, J. C. G., Muñoz, J., Moreno, M. B., Ramos, M., Clemente-Ramos, J. A., et al. (2011). Activități diferențiate a trei familii de inhibitori specifici ai beta(1,3)glucan sintetazei în tulpini de drojdie de fisiune de tip sălbatic și rezistent. J. Biol. Chem. 286, 3484-3496. doi: 10.1074/jbc.M110.174300
PubMed Abstract | Textul integral | Google Scholar
Mayor, S. (2018). Epidemia de Candida auris a fost legată de sondele de temperatură axilară reutilizabile, constată un studiu. BMJ 363:k4133. doi: 10.1136/bmj.k4133
PubMed Abstract | Cross Full Text | Google Scholar
Morschhäuser, J., Barker, K. S., Liu, T. T. T., Bla-Warmuth, J., Homayouni, R., și Rogers, P. D. (2007). Factorul de transcripție Mrr1p controlează expresia pompei de eflux MDR1 și mediază rezistența multidrog în Candida albicans. PLoS Pathog. 3:e164. doi: 10.1371/journal.ppat.0030164
PubMed Abstract | Refef Full Text | Google Scholar
Nett, J. E., Crawford, K., Marchillo, K., și Andes, D. R. (2010). Rolul lui Fks1p și al glucanului matricial în rezistența biofilmului Candida albicans la o echinocandină, pirimidină și polienă. Antimicrob. Agents Chemother. 54, 3505-3508. doi: 10.1128/AAC.00227-10
PubMed Abstract | Full CrossRef Text | Google Scholar
Nolte, F. S., Parkinson, T., Falconer, D. J., Dix, S., Williams, J., Gilmore, C., et al. (1997). Izolarea și caracterizarea Candida albicans rezistentă la fluconazol și amfotericină B din sângele a doi pacienți cu leucemie. Antimicrob. Agents Chemother. 41, 196-199. doi: 10.1128/AAC.41.1.196
PubMed Abstract | Text integral | Google Scholar
O’Connor, C., Bicanic, T., Dave, J., Evans, T. J., Moxey, P., Adamu, U., et al. (2019). Focar de Candida auris pe o secție vasculară – sosirea neașteptată a unui agent patogen anticipat. J. Hosp. Infect. 103, 106-108. doi: 10.1016/j.jhin.2019.06.002
PubMed Abstract | Full CrossRef Text | Google Scholar
Osei Sekyere, J. (2018). Candida auris: o revizuire sistematică și o meta-analiză a actualizărilor actuale privind un agent patogen emergent multidrog rezistent. MicrobiologyOpen 7:e00578. doi: 10.1002/mbo3.578
PubMed Abstract | CrossRef Full Text | Google Scholar
Park, J. Y., Bradley, N., Brooks, S., Burney, S., și Wassner, C. (2019). Managementul pacienților cu fungemie cu Candida auris la spitalul comunitar, Brooklyn, New York, SUA, 2016-20181. Emerg. infect. Dis. 25, 601-602. doi: 10.3201/eid2503.180927
PubMed Abstract | CrossRef Full Text | Google Scholar
Park, S., Kelly, R., Kahn, J. N., Robles, J., Hsu, M.-J., Register, E., et al. (2005). Substituțiile specifice în ținta Fks1p a echinocandinei explică sensibilitatea redusă a izolatelor rare de laborator și clinice de Candida sp. Antimicrob. Agents Chemother. 49, 3264-3273. doi: 10.1128/AAC.49.8.3264-3273.2005
CrossRef Full Text | Google Scholar
Parra-Giraldo, C. M., Valderrama, S. L., Cortes-Fraile, G., Garzón, J. R., Ariza, B. E., Morio, F., et al. (2018). Primul raport de cazuri sporadice de Candida auris în Columbia. Int. J. Infect. Dis. 69, 63-67. doi: 10.1016/j.ijid.2018.01.034
PubMed Abstract | CrossRef Full Text | Google Scholar
Pemán, J., Cantón, E., și Espinel-Ingroff, A. (2009). Mecanisme de rezistență la medicamente antifungice. Expert Rev. Anti Infect. Ther. 7, 453-460. doi: 10.1586/eri.09.18
PubMed Abstract | Full Text | Google Scholar
Piedrahita, C. T., Cadnum, J. L., Jencson, A. L., Shaikh, A. A. A., Ghannoum, M. A., și Donskey, C. J. (2017). Suprafețele de mediu din unitățile de asistență medicală sunt o sursă potențială de transmitere a Candida auris și a altor specii de candida. Infect. Control Hosp. epidemiol. 38, 1107-1109. doi: 10.1017/ice.2017.127
PubMed Abstract | CrossRef Full Text | Google Scholar
Rhodes, J., Abdolrasouli, A., Farrer, R. A., Cuomo, C. A. A., Aanensen, D. M., Armstrong-James, D., et al. (2018). Epidemiologia genomică a epidemiei din Marea Britanie a agentului patogen fungic uman emergent Candida auris. Emerg. Microbes Infect. 7:43. doi: 10.1101/201343
CrossRef Full Text | Google Scholar
Romera, D., Aguilera-Correa, J. J., Gadea, I., Viñuela-Sandoval, L., García-Rodríguez, J., și Esteban, J. (2019). Candida auris: o comparație între sensibilitatea planctonică și biofilm la medicamente antifungice. J. Med. Microbiol. 68, 1353-1358. doi: 10.1099/jmm.0.001036
PubMed Abstract | Refef Full Text | Google Scholar
Ruiz-Gaitán, A., Martínez, H., Moret, A. M., Calabuig, E., Tasias, M., Alastruey-Izquierdo, A., et al. (2019a). Detectarea și tratamentul Candida auris într-o situație de focar: factori de risc pentru dezvoltarea colonizării și a candidemiei de către această nouă specie la pacienții grav bolnavi. Expert Rev. Anti Infect. Ther. 17, 295-305. doi: 10.1080/14787210.2019.1592675
PubMed Abstract | Full CrossRef Text | Google Scholar
Ruiz-Gaitán, A., Moret, A. M., Tasias-Pitarch, M., Aleixandre-López, A. I., Martínez-Morel, H., Calabuig, E., et al. (2018). Un focar datorat Candida auris cu colonizare prelungită și candidaemie într-un spital european de îngrijire terțiară. Mycoses 61, 498-505. doi: 10.1111/myc.12781
PubMed Abstract | Refef Full Text | Google Scholar
Ruiz-Gaitán, A. C., Cantón, E., Fernández-Rivero, M. E., Ramírez, P., și Pemán, J. (2019b). Epidemia de Candida auris în Spania: o comparație a activității antifungice prin trei metode cu datele publicate. Int. J. Antimicrob. Agents 53, 541-546. doi: 10.1016/j.ijantimicag.2019.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Rutala, W. A., Kanamori, H., Gergen, M. F., Sickbert-Bennett, E. E., și Weber, D. J. (2019). Susceptibilitatea Candida auris și Candida albicans la 21 de germicide utilizate în unitățile sanitare. Infect. Control Hosp. epidemiol. 40, 380-382. doi: 10.1017/ice.2019.1
PubMed Abstract | Text integral | Google Scholar
Rybak, J. M., Doorley, L. A., Nishimoto, A. T., Barker, K. S., Palmer, G. E., și Rogers, P. D. (2019). Abrogarea rezistenței la triazol în urma deleției CDR1 într-un izolat clinic de Candida auris. Antimicrob. Agents Chemother. 63, e00057-19. doi: 10.1128/AAC.00057-19
PubMed Abstract | CrossRef Full Text | Google Scholar
Sana, F., Hussain, W., Zaman, G., Satti, L., Khurshid, U. și Khadim, M. T. (2019). Raport de focar de Candida auris din Pakistan: o poveste de succes a controlului infecțiilor în ICU dintr-un spital de îngrijire terțiară. J. Hosp. Infect. 103, 108-110. doi: 10.1016/j.jhin.2019.06.011
PubMed Abstract | Full CrossRef Text | Google Scholar
Sanglard, D., Coste, A., și Ferrari, S. (2009). Mecanismele de rezistență la medicamente antifungice în agenții patogeni fungici din perspectiva reglementării transcripționale a genelor. FEMS Yeast Res. 9, 1029-1050. doi: 10.1111/j.1567-1364.2009.00578.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Sanglard, D., Ischer, F., Koymans, L., și Bille, J. (1998). Substituțiile de aminoacizi în citocromul P-450 lanosterol 14-demetilază (CYP51a1) din izolatele clinice de Candida albicans rezistente la azole contribuie la rezistența la agenții antifungici azole. Antimicrob. Agents Chemother. 42, 241-253.
Google Scholar
Sanglard, D., Kuchler, K., Ischer, F., Pagani, J. L., Monod, M., și Bille, J. (1995). Mecanismele de rezistență la agenții antifungici azolici în izolatele de Candida albicans de la pacienții cu SIDA implică transportatori multidrog specifici. Antimicrob. Agents Chemother. 39, 2378-2386. doi: 10.1128/AAC.39.11.2378
PubMed Abstract | Full CrossRef Text | Google Scholar
Sayeed, M. A., Farooqi, J., Jabeen, K., Awan, S., și Mahmood, S. F. (2019). Spectrul clinic și factorii care influențează rezultatul Candida auris: un studiu dintr-un singur centru din Pakistan. BMC Infect. Dis. 19:384. doi: 10.1186/s12879-019-3999-y
PubMed Abstract | Text integral | Google Scholar
Schelenz, S., Hagen, F., Rhodes, J. L., Abdolrasouli, A., Chowdhary, A., Hall, A., et al. (2016). Primul focar spitalicesc de Candida auris, emergentă la nivel mondial, într-un spital european. Antimicrob. Resist. Infect. Control 5:35. doi: 10.1186/s13756-016-0132-5
PubMed Abstract | Full Text | Google Scholar
Schuetzer-Muehlbauer, M., Willinger, B., Egner, R., Ecker, G., și Kuchler, K. (2003). Inversarea rezistenței antifungice mediată de pompele de eflux ABC din Candida albicans exprimate funcțional în drojdie. Int. J. Antimicrob. Agents 22, 291-300. doi: 10.1016/S0924-8579(03)00213-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Sexton, D. J., Kordalewska, M., Bentz, M. L., Welsh, R. M., Perlin, D. S., și Litvintseva, A. P. (2018). Detectarea directă a agentului patogen fungic emergent Candida auris în tampoane cutanate clinice prin testul PCR cantitativ bazat pe SYBR green. J. Clin. Microbiol. 56:e01337-18. doi: 10.1128/JCM.01337-18
PubMed Abstract | Full CrossRef Text | Google Scholar
Sharma, C., Kumar, N., Pandey, R., Meis, J. F. și Chowdhary, A. (2016). Secvențierea întregului genom al izolatelor de Candida auris multidrog rezistente emergente din India demonstrează o variație genetică scăzută. New Microbes New Infect. 13, 77-82. doi: 10.1016/j.nmni.2016.07.003
PubMed Abstract | Full CrossRef Text | Google Scholar
Sherry, L., Ramage, G., Kean, R., Borman, A., Johnson, E. M., Richardson, M. D., et al. (2017). Capacitatea de formare a biofilmului de Candida auris extrem de virulentă și multirezistentă la medicamente. Emerg. infect. Dis. 23, 328-331. doi: 10.3201/eid2302.161320
PubMed Abstract | Text integral | Google Scholar
Vandeputte, P., Ferrari, S., și Coste, A. T. (2012). Rezistența antifungică și noile strategii de control al infecțiilor fungice. Int. J. Microbiol. 2012:713687. doi: 10.1155/2012/713687
PubMed Abstract | Reflect Full Text | Google Scholar
Waldorf, A. R., și Polak, A. (1983). Mecanismele de acțiune ale 5-fluorocitosinei. Antimicrob. Agents Chemother. 23, 79-85. doi: 10.1128/AAC.23.1.79
PubMed Abstract | Text integral | Google Scholar
Wang, X., Bing, J., Zheng, Q., Zhang, F., Liu, J., Yue, H., et al. (2018). Primul izolat de Candida auris în China: aspecte clinice și biologice. Emerging Microbes & Infections 7, 1-9. doi: 10.1038/s41426-018-0095-0
PubMed Abstract | Ref Full Text | Google Scholar
Welsh, R. M., Bentz, M. L., Shams, A., Houston, H., Lyons, A., Rose, L. J., et al. (2017). Supraviețuirea, persistența și izolarea drojdiei patogene emergente multirezistente la medicamente Candida auris pe o suprafață de plastic pentru îngrijirea sănătății. J. Clin. Microbiol. 55, 2996-3005. doi: 10.1128/JCM.00921-17
PubMed Abstract | Text integral | Google Scholar
.
Leave a Reply