Atlas histologii roślin i zwierząt
1. Morfologia
2. cykl życiowy
3. funkcje
– trawienie
– ochrona
Enterocyty są komórkami kolumnowymi, które tworzą większość nabłonka jelitowego (ryc. 1 i 2). Są one bardziej liczne w jelicie cienkim niż w jelicie grubym i wyrostku robaczkowym. W jelicie cienkim ilość enterocytów stanowi około 80 % wszystkich enterocytów jelitowych. Główną funkcją enterocytów jest wchłanianie cząsteczek ze światła jelita i transportowanie ich do wewnętrznej tkanki łącznej i naczyń krwionośnych. Należy zauważyć, że nabłonek jelitowy jest większą powierzchnią ciała w kontakcie ze środowiskiem zewnętrznym (światło jelita jest zewnętrzne w stosunku do tkanek ciała).


Morfologia
Enterocyty mają mikrowypustki na powierzchni apikalnej (wolnej) (ryc. 3), wiele mitochondriów w części podstawnej oraz dobrze rozwinięty aparat Golgiego i retikulum endoplazmatyczne. Integralność mechaniczna nabłonka jelitowego, czyli spójność między enterocytami i brak przejść międzykomórkowych, zależy od kompleksów adhezji komórkowej między sąsiadującymi enterocytami. W pobliżu domeny apikalnej enterocytu znajdują się połączenia ścisłe (tight junctions) i połączenia przylegające (adherent junctions). W błonie latero-bazalnej znajdują się desmosomy. W błonach latero-bazalnych obserwuje się również połączenia typu gap junctions. Hemidesmosomy znajdują się w błonie podstawnej enterocytów zakotwiczając komórkę do błony podstawnej.
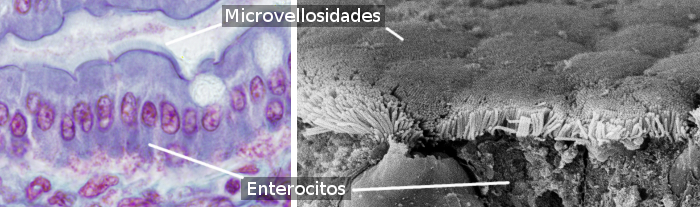
Enterocyty mają dwie domeny: apikalną i basolateralną. Z tego powodu są komórkami spolaryzowanymi. Polaryzacja jest wynikiem działania dobrze zorganizowanego cytoszkieletu oraz dobrze rozwiniętego ruchu pęcherzykowego, który rozprowadza cząsteczki w sposób zróżnicowany pomiędzy obiema domenami. Ciasne połączenia zapobiegają bocznej dyfuzji cząsteczek pomiędzy obiema domenami, co pomaga w utrzymaniu polaryzacji. Enterocyty wykazuj± wysoce upakowane mikrowiciany w domenie apikalnej, które zwiększaj± powierzchnię błony około 100-krotnie (Rycina 3). W błonach apikalnych znajduje się wiele transporterów, które są bramami dla cząsteczek powstających w wyniku trawienia, aby dostać się do enterocytu. W błonach podstawnych znajdują się inne transportery, dzięki którym cząsteczki te mogą opuścić enterocyt i dotrzeć do naczyń krwionośnych. To rozdzielone rozmieszczenie receptorów jest generowane przez handel pęcherzykowy.
Cykl życia
Światło jelita jest pełne cząsteczek potencjalnie toksycznych dla enterocytów. Zamiast naprawiać każdą szkodę, uszkodzone i stare enterocyty umierają na drodze apoptozy, są następnie wysuwane z warstwy nabłonka i stale zastępowane przez nowe. Błona śluzowa jelita cienkiego jest silnie pofałdowana i tworzy wiele uwypukleń lub kosmków oraz wgłębień lub gruczołów, zwanych kryptami Lieberkühna. W jelicie grubym znajdują się krypty Lieberkühna. Cykl życiowy enterocytów rozpoczyna się w dolnej części gruczołów Lieberkühna, a kończy w wypustkach kosmków jelita cienkiego lub na powierzchni nabłonka jelita grubego. Czas życia enterocytu wynosi około 2 do 5 dni. U człowieka nabłonek jelitowy odnawia się co 4 do 5 dni.
Enterocyty różnicują się z dorosłych komórek macierzystych, które znajdują się w dolnej części gruczołów Lieberkühna (rysunek 4). Początkowo dorosłe komórki macierzyste stają się przejściowymi komórkami wzmacniającymi (komórkami progenitorowymi), które znajdują się nieco dalej od niszy dorosłych komórek macierzystych. Przejściowe komórki wzmacniające dzielą się 4 do 6 razy, aby zwiększyć populację komórek progenitorowych, a następnie różnicują się w różne typy komórek występujących w nabłonku jelitowym. Większość z nich staje się enterocytami, ale także komórkami globularnymi, komórkami M i innymi typami komórek. Nowe enterocyty przesuwają się stopniowo w kierunku końcówek kosmków lub do powierzchni nabłonka. Po osiągnięciu tych pozycji obumierają i są wyciskane z nabłonka. Wyciskanie obejmuje zarówno nacisk mechaniczny, jak i utratę połączeń adhezyjnych z sąsiednimi komórkami. Część komórek obumiera na drodze apoptozy, a następnie zostaje wydalona z nabłonka. Nie wiadomo, jaki jest mechanizm przemieszczania enterocytów z gruczołów na powierzchnię nabłonka. Molekularne składniki blaszki podstawowej są różne wzdłuż drogi enterocytów i uważa się, że mogą przyczyniać się do ich przemieszczania. Uważa się, że dieta jest również zaangażowana w dynamikę życia enterocytów.

Funkcje
Trawienie
Główną funkcją enterocytów jest wchłanianie składników odżywczych po żołądkowym i enzymatycznym trawieniu pokarmu. Enterocyty mogą wykorzystywać jako źródło energii glutaminian i glutaminę, a także kwasy tłuszczowe i glukozę. Jest to o tyle ciekawe, że przez enterocyty przechodzą wszystkie rodzaje składników pokarmowych. Pomagają one również w trawieniu poprzez wydzielanie enzymów rozkładających peptydy i disacharydy. Glikokaliks domeny wierzchołkowej enterocytu tworzy warstwę o grubości około 400 do 500 nm, czasami nawet 1 µm. Niektóre enzymy biorące udział w trawieniu są zakotwiczone do tej glikokaliksy. Tak więc enterocyty nie tylko wybierają i wychwytują substancje z trawienia, ale także przetwarzają niektóre z nich. Właściwie mówi się, że istnieją dwie fazy trawienia, jedna zachodząca w świetle jelita, przeprowadzana przez enzymy trzustkowe, a druga na powierzchni enterocytów, wykonywana przez inne enzymy trawienne. Większość wchłaniania składników odżywczych jest realizowana przez enterocyty jelita cienkiego, podczas gdy enterocyty jelita grubego wchłaniają głównie wodę. Ponadto, z końcówek mikrowypustek uwalniane są małe pęcherzyki zawierające enzymy takie jak fosfatazy, które mogą pełnić funkcję obronną przed patogenami.
Substancje powstałe w wyniku trawienia muszą przekroczyć nabłonek jelitowy, aby dotrzeć do krwiobiegu. Może się to odbywać kilkoma drogami: przezkomórkową, endocytozy/transcytozy i parakomórkową.
Transcelullar. Większość cząsteczek przekracza warstwę nabłonkową jelita przechodząc przez enterocyty. Najpierw przekraczając błonę apikalną, a następnie bazolateralną. Cząsteczki mogą być przemieszczane na drodze swobodnej dyfuzji biernej, ułatwionej dyfuzji biernej lub transportu aktywnego. W wolnej dyfuzji biernej cząsteczki przekraczają błony bez żadnej pomocy, natomiast w transporcie ułatwionym i aktywnym cząsteczki muszą być rozpoznane przez specyficzne transportery umieszczone w błonach. Woda, etanol i wiele lipidów przenika przez enterocyty na drodze swobodnej dyfuzji biernej. Glukoza, niektóre lipidy i aminokwasy przechodzą przez enterocyty dzięki ułatwionemu transportowi biernemu lub transportowi aktywnemu.
Domena apikalna komórki nosi zestaw białek do wchłaniania substancji, podczas gdy błony latero-bazalne mają inne transportery transmembranowe do wyprowadzania cząsteczek z enterocytu.
Współczynnik wchłaniania zależy od etapu różnicowania enterocytu, co oznacza szereg sodowych pomp błonowych, bardziej obfite jak enterocyty przejść dalej od głębi krypt. Tak więc, większość absorpcji cukrów i aminokwasów odbywa się w górnej trzeciej części kosmków jelita cienkiego i blisko powierzchni jelita grubego. Na przykład, aktywność hydrolazy wzrasta, gdy enterocyty oddalają się od nisz komórek macierzystych (głębokie części krypt).
Wchłanianie glukozy jest przykładem typowego mechanizmu wchłaniania. Glukoza przekracza błonę apikalną enterocytu przez ko-transport sprzężony z gradientem sodowym. Ten gradient jest generowany przez pompy sodowo-potasowe i może wprowadzić glukozę do enterocytu wbrew gradientowi stężenia glukozy. Sodowy transporter glukozy (SGLT) umożliwia ten współtransport. Z drugiej strony, w błonach laterobazalnych znajduje się transporter GLUT2, który przenosi glukozę z cytoplazmy do przestrzeni międzykomórkowej. Tak więc SGLT zwiększa stężenie glukozy w cytoplazmie enterocytów, a GLUT2 umożliwia ucieczkę glukozy w kierunku naczyń krwionośnych. Precyzyjna lokalizacja obu transporterów powoduje przepływ glukozy przez enterocyty, ze światła jelita do naczyń krwionośnych.
Tłuszcz jest wśród najbardziej energetycznych substancji, oprócz tego, że jest niezbędny dla błon komórkowych. Większość tłuszczu posiłku, który jest włączony z jelita jest w postaci triacylogliceroli, chociaż inne rodzaje mogą być wchłaniane zbyt, takie jak cholesterol. Po pierwsze, enzymy trzustkowe rozkładają tłuszcz w świetle jelita, a triacyloglicerole są przekształcane w kwasy tłuszczowe i monoacyloglicerole (rysunek 5). Cząsteczki te, wraz z cholesterolem, witaminami rozpuszczalnymi w tłuszczach i fosfolipidami, tworzą micele, czyli małe kropelki lipidów, które dzięki kwasom żółciowym są rozpuszczalne w wodzie. Micele swobodnie przekraczają błonę apikalną enterocytów. Transportery CD36 y FABP (fatty acid binding protein) s 3 umożliwiają niektórym substancjom tłuszczowym przekraczanie błony apikalnej enterocytów poprzez ułatwiony transport bierny. Większa część transportu tłuszczów odbywa się w postaci miceli, natomiast transportery błonowe wyglądają jak system sensoryczny wykrywający kwasy tłuszczowe o długich łańcuchach w jelicie. Cholesterol, jako pojedyncza cząsteczka, może być również transportowany przez transporter NPC1L1 (Niemann-Pick C1-like 1), który przenosi cholesterol ze światła jelita do cytoplazmy enterocytów.

Po znalezieniu się w enterocycie tłuszcze są łączone z niektórymi białkami i przemieszczane do retikulum endoplazmatycznego, gdzie ponownie syntetyzowane są triacyloglicerole. Są one łączone z niektórymi białkami, tworząc prechylomikrony. Białko ApoB jest syntetyzowane w retikulum endoplazmatycznym. ApoB, wraz z MTP (microsome transfer protein) i kwasami tłuszczowymi tworzy pierwotną cząsteczkę lipoproteiny. W retikulum endoplazmatycznym gładkim ApoB jest zastępowane przez białko Apo A-IV. Wszystkie te składniki tworzą prechylomikrony, które są włączane do pęcherzyków i przemieszczane do aparatu Golgiego. Tutaj pre-chylomikrony łączą się ze sobą tworząc chylomikrony, które są włączane do pęcherzyków egzocytarnych i uwalniane w domenie laterobazalnej enterocytu. W ten sposób chylomikrony mogą dotrzeć do naczyń krwionośnych i limfatycznych. Chylomikrony są lipoproteinami, których ciało składa się głównie z triacylogliceroli, a płaszcz z fosfolipidów, cholesterolu i apolipoprotein. Odgrywają one główną rolę w transporcie triacylogliceroli i witamin rozpuszczalnych w liposomach.
Poza enterocytem chylomikrony dostają się do naczyń limfatycznych kosmków jelitowych, a następnie do splotów limfatycznych myenteric plexus, z których przechodzą do naczyń krwionośnych. Oprócz chylomikronów tłuszcz jest również pakowany do lipoprotein o bardzo małej gęstości (VLDL), które również są egzocytowane z enterocytów. Tłuszcz może być przechowywany w kroplach lipidowych enterocytów, jak również.
Enterocyty również uzyskać żelazo po trawieniu. Żelazo jest ważne dla wielu białek, takich jak hemoglobina, i można je znaleźć w żywności jako część grup hemowych lub związane z ferrytyną (w mięsie zwierzęcym) (rysunek 6). Żelazo z pokarmu dostaje się do organizmu poprzez transporter DMT1 (divalent metal transporter 1) znajdujący się w apikalnych błonach enterocytów. U transgenicznych myszy pozbawionych tego transportera rozwija się ciężka niedokrwistość. DMT1 jest ko-transporterem sprzężonym z gradientem protonowym. Gradient protonowy jest generowany przez pompę Na+/K+, również znajduj±c± się w błonie apikalnej enterocytów. DMT1 transportuje Fe2+, ale większość żelaza z posiłku występuje w postaci Fe3+. Redukcja żelaza (Fe3+ do Fe2+) jest przeprowadzana przez enzym reduktazę znajdującą się w apikalnej powierzchni enterocytu. Żelazo związane z grupami hemowymi wydaje się być wbudowywane przez endocytozę pośredniczoną przez receptory. Po wejściu do enterocytu, grupa hemowa jest degradowana i żelazo może dostać się do cytozolu.

Niezależnie od drogi wejścia, po znalezieniu się w cytozolu, ruch żelaza w kierunku błon podstawnych wydaje się być pośredniczony przez białka metalochaperonowe. W błonach podstawnych, żelazo jest translokowane do przestrzeni zewnątrzkomórkowej przez transporter ferroportin. Ferroportyna wyprowadza formę Fe2+. Jednak ferrytyna jest białkiem transportującym żelazo do układu żyły wrotnej i żelazo musi być w formie Fe3+. W błonie podstawnej enterocytu znajdują się ferrooksydazy, które umożliwiają przemianę Fe2+ do Fe3+. Żelazo może być przechowywane w cytozolu enterocytu związane z ferrytyną.
Endocytoza/transcytoza. Cząsteczki takie jak immunoglobuliny są endocytowane przez endocytozę pośredniczoną przez receptor i transportowane do innych domen błonowych przez transcytozę. U podstawy mikrowypustek powstają pęcherzyki, które następnie łączą się z endosomami. Immunoglobuliny są następnie zamykane w pęcherzykach powstających w endosomach i kierowane do błon domeny podstawno-bocznej. W ten sposób immunoglobuliny wymykają się lizosomalnej ścieżce degradacji.
Parakomórkowa. Woda i jony przechodzą przez epitel drogą parakomórkową.
Ochrona
Enterocyty tworzą barierę odrzucającą antygeny, cząsteczki toksyczne i mikroorganizmy, a jednocześnie przepuszczają substancje odżywcze. Enterocyty są w kontakcie z wieloma mikroorganizmami. Tymi, które są mikroorganizmami rezydującymi w jelicie, ale mogą być niebezpieczne, jeśli dostaną się do tkanek wewnętrznych, oraz tymi nierezydentnymi patogenami, które dostają się wraz z posiłkiem. Powierzchnia wierzchołkowa enterocytów pokryta jest warstwą substancji śluzowych wydzielanych przez komórki globularne. Warstwa ta składa się z węglowodanów i ma gęstą lepkość, która umożliwia dyfuzję cząsteczek, ale odrzuca komórki i największe cząsteczki. Ponadto, mikrokosmki enterocytów wykazują dobrze rozwiniętą glikokaliksę w wierzchołkach każdej mikrokosmków, która działa jako bariera fizyczna i elektryczna, ponieważ jest pełna ładunków ujemnych. Mikrokosmki te utrudniają bezpośredni kontakt fizyczny pomiędzy mikroorganizmami a błoną enterocytu. Jednakże, nawet jeśli mikroorganizmy pokonają te dwie bariery, powinny pokonać mechanizm transportu mikrofilmów.
Mucyny są wysoce glikozylowanymi białkami występującymi w błonie apikalnej enterocytów. Przyczyniają się one do dobrze rozwiniętej glikokaliksy. Mucyny są białkami transmembranowymi połączonymi z cytoszkieletem przez ich domenę cytozolową. MUC3, MUC12 i MUC17 są najliczniej występującymi mucynami. Zawierają one około 5000 aminokwasów, a ich składnik węglowodanowy może rozciągać się do 1 µm od powierzchni komórki. Mucyny tworzą fizyczną barierę trudną do przekroczenia przez bakterie.
Enterocyty są zdolne do uruchamiania i regulowania procesów zapalnych poprzez uwalnianie szeregu chimer i cytokin. Posiadają również receptory dla tych cząsteczek. Enterocyty uwalniają cząsteczki prozapalne, które wpływają na komórki odpornościowe znajdujące się w błonie śluzowej jelita.
Innym, mniej znanym mechanizmem ochronnym jest uwalnianie pęcherzyków z apikalnej powierzchni enterocytów. Aktyna i miozyna, aparaty ruchowe mikrokosmków, wytwarzają siły mechaniczne, które ciągną błony w kierunku wierzchołka każdego mikrokosmka. Nagromadzenie błon kończy się w postaci pęcherzyków, które są uwalniane do światła jelita. Pęcherzyki te zawierają dużą ilość fosfatazy alkalicznej, która jest silnym czynnikiem anty-patogennym, zmniejszającym toksyczność lipopolisacharydu i stan zapalny jelit. Utrudnia ona również przyczepianie się bakterii do nabłonka jelitowego i zmniejsza proliferację bakterii. Pęcherzyki uwalniane przez enterocyt są sposobem na wysyłanie cząsteczek anty-mikrobowych do obszarów odległych od nabłonka.
Bibliografia
Barker N. 2014. Adult intestinal stem cells: critical drivers of epithelial homeostasis and regeneration. Nature. 15: 19-33.
Giammanco A, Cefalù AB, Noto D, Averna MR. 2015. Patofizjologia produkcji jelitowych lipoprotein. Frontiers in physiology. 6: 61.
Knutson MD. 2014. Adult intestinal stem cells: critical drivers of epithelial homeostasis and regeneration. Nature review in molecular cell biology. 15:19-33.
Knutson MD. 2017. Iron transport proteins: gateways of cellular and systemic iron homeostasis. Journal of biological chemistry Nature review in molecular cell biology. 292: 12735-12743.
Shifrin DA, McConell RE, Nambiar R, Higginbotham JN, Coffey RJ, Tyska MJ. 2012. Enterocyte microvillus-derived vesicles detoxify bacterial products and regulate epithelial-microbial interactions. Current biology. 22: 627-631.
Snoeck V, Goddeeries B, Cox E. 2005. The role of enterocytes in the intestinal barrier function and antigen uptake. Microbes and infection. 7: 997-1004.
Leave a Reply