Atlas d’histologie végétale et animale
1. Morphologie
2. Cycle de vie
3. Fonctions
– Digestion
– Protection
Les entérocytes sont des cellules colonnaires qui forment la majeure partie de l’épithélium de l’intestin grêle (figures 1 et 2). Ils sont plus abondants dans l’intestin grêle que dans le gros intestin et l’appendice. Dans l’intestin grêle, la quantité d’entérocytes représente environ 80 % du total des entérocytes de l’intestin. La principale fonction des entérocytes est d’absorber les molécules de la lumière intestinale et de les transporter vers le tissu conjonctif interne et les vaisseaux sanguins. Il est à noter que l’épithélium de l’intestin est la plus grande surface du corps en contact avec l’environnement extérieur (la lumière de l’intestin est extérieure aux tissus du corps).


Morphologie
Les entérocytes ont des microvillosités dans la surface apicale (libre) (Figure 3), de nombreuses mitochondries dans la partie basale, et un appareil de Golgi et un réticulum endoplasmique bien développés. L’intégrité mécanique de l’épithélium intestinal, c’est-à-dire la cohésion entre les entérocytes et l’absence de passages intercelulaires, dépend des complexes d’adhésion cellulaire entre les entérocytes adjacents. Il existe des jonctions serrées et des jonctions adhérentes près du domaine apical de l’entérocyte. Des desmosomes sont présents dans les membranes latéro-basales. Des jonctions à fente sont également observées dans les membranes latéro-basales. Des hémidesmosomes sont trouvés dans la membrane basale des entérocytes ancrant la cellule à la membrane basale.
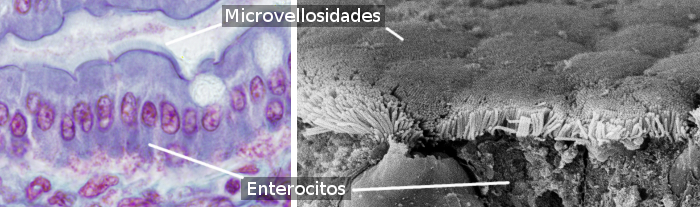
Les entérocytes ont deux domaines : apical et basolatéral. C’est pourquoi ce sont des cellules polarisées. La polarisation est produite par l’activité d’un cytosquelette bien agencé et d’un trafic vésiculaire bien développé qui distribue les molécules de façon différentielle entre les deux domaines. Les jonctions serrées empêchent la diffusion latérale des molécules entre les deux domaines, contribuant ainsi à maintenir la polarité. Les entérocytes présentent une microvallée fortement emballée dans le domaine apical, qui multiplie environ 100 fois la surface de la membrane (Figure 3). Dans les membranes apicales, on trouve de nombreux transporteurs qui sont les portes d’entrée des molécules issues de la digestion dans l’entérocyte. Dans les membranes basolatérales, d’autres transporteurs permettent à ces molécules de sortir de l’entérocyte et d’atteindre les vaisseaux sanguins. Cette distribution ségrégative des récepteurs est générée par le trafic vésiculaire.
Cycle de vie
La lumière de l’intestin est pleine de molécules potentiellement toxiques pour les entérocytes. Au lieu de réparer chaque insulte, les entérocytes endommagés et anciens meurent par apoptose,sont ensuite extrudés de la couche épithéliale, et remplacés continuellement par de nouveaux. La muqueuse de l’intestin grêle est très pliée et forme de nombreuses évaginations ou villosités et invaginations ou glandes, connues sous le nom de cryptes de Lieberkühn. Dans le gros intestin, on trouve des cryptes de Lieberkühn. Le cycle de vie des entérocytes commence dans la partie inférieure des glandes de Lieberkühn et se termine dans les extrémités des villosités de l’intestin grêle ou dans la surface épithéliale du gros intestin. La vie d’un entérocyte dure environ 2 à 5 jours. Chez l’homme, l’épithélium intestinal est renouvelé tous les 4 à 5 jours.
Les entérocytes se différencient à partir de cellules souches adultes qui se trouvent au fond des glandes de Lieberkühn (figure 4). Initialement, les cellules souches adultes deviennent des cellules amplificatrices transitoires (cellules progénitrices), qui sont situées un peu plus loin de la niche des cellules souches adultes. Les cellules amplificatrices transitoires se divisent 4 à 6 fois pour augmenter la population de progéniteurs, puis se différencient dans la variété de types de cellules que l’on trouve dans l’épithélium intestinal. La plupart d’entre elles deviennent des entérocytes, mais aussi des cellules du globule, des cellules M et d’autres types de cellules. Les nouveaux entérocytes se déplacent progressivement vers les extrémités des villosités ou vers la surface épithéliale luminale. Une fois qu’ils ont atteint ces positions, ils meurent et sont extrudés de l’épithélium. L’extrusion implique à la fois une pression mécanique et la perte des liens d’adhésion avec les cellules voisines. Certaines cellules meurent par apoptose et sont ensuite expulsées de l’épithélium. On ne sait pas quel est le mécanisme de déplacement des entérocytes des glandes vers la surface épithéliale. Les composants moléculaires de la lame basale sont différents le long du trajet des entérocytes, et on pense qu’ils peuvent contribuer au mouvement. On pense également que le régime alimentaire est impliqué dans la dynamique de la vie des entérocytes.

Fonctions
Digestion
La fonction principale des entérocytes est d’absorber les nutriments après la digestion stomacale et enzymatique des aliments. Les entérocytes peuvent utiliser le glutamate et la glutamine, ainsi que les acides gras et le glucose, comme source d’énergie. Ceci est curieux car tous les types de nutriments passent par les entérocytes. Ils aident également à la digestion en sécrétant des enzymes qui dégradent les peptides et les disacarides. Le glycocalyx du domaine apical de l’entérocyte forme une couche d’environ 400 à 500 nm d’épaisseur, parfois même de 1 µm. Certaines enzymes qui participent à la digestion sont ancrées à ce glycocalyx. Ainsi, les entérocytes non seulement sélectionnent et capturent les substances issues de la digestion, mais ils en traitent également certaines. En fait, on dit qu’il existe deux phases de digestion, l’une se déroulant dans la lumière de l’intestin, réalisée par les enzymes pancréatiques, et l’autre à la surface des entérocytes, effectuée par d’autres enzymes digestives. La majeure partie de l’absorption des nutriments est réalisée par les entérocytes de l’intestin grêle, tandis que les entérocytes du gros intestin absorbent principalement de l’eau. En outre, de petites vésicules sont libérées des extrémités des microvillosités contenant des enzymes comme les phosphatases, qui peuvent avoir une fonction de défense contre les agents pathogènes.
Les substances résultant de la digestion doivent traverser l’épithélium intestinal pour atteindre la circulation sanguine. Cela peut se faire par plusieurs voies : transcellulaire, endocytose/transcytose et paracellulaire.
Transcelullaire. La plupart des molécules traversent la couche épithéliale de l’intestin en passant par les entérocytes. En traversant d’abord la membrane apicale, puis la membrane basolatérale. Les molécules peuvent être déplacées par diffusion passive libre, diffusion passive facilitée ou transport actif. Dans la diffusion passive libre, les molécules traversent les membranes sans aucune aide, tandis que dans le transport actif et facilité, les molécules doivent être reconnues par des transporteurs spécifiques insérés dans les membranes. L’eau, l’éthanol et de nombreux lipides traversent les entérocytes par diffusion passive libre. Le glucose, certains lipides et les acides aminés traversent les entérocytes par transport passif facilité ou par transport actif.
Le domaine apical de la cellule porte un ensemble de protéines pour l’absorption des substances, alors que les membranes latéro-basales ont un autre transporteur transmembranaire pour faire sortir les molécules de l’entérocyte.
La capacité d’absorption dépend du stade de différenciation de l’entérocyte, ce qui implique un certain nombre de pompes membranaires sodiques, d’autant plus abondantes que les entérocytes s’éloignent du fond des cryptes. Ainsi, la majeure partie de l’absorption des sucres et des acides aminés se fait dans le tiers supérieur des villosités de l’intestin grêle et près de la surface du gros intestin. Ainsi, l’activité hydrolase augmente à mesure que les entérocytes s’éloignent des niches de cellules souches (parties profondes des cryptes).
L’absorption du glucose est un exemple de mécanisme d’absorption typique. Le glucose traverse la membrane apicale de l’entérocyte par un co-transport couplé à un gradient de sodium. Ce gradient est généré par des pompes sodium/potassium, et peut faire entrer le glucose dans l’entérocyte contre le gradient de concentration en glucose. Le transporteur de glucose sodique (SGLT) permet ce co-transport. D’autre part, le transporteur GLUT2 se trouve dans les membranes latérobasales, qui transloque le glucose du cytoplasme vers l’espace intercellulaire. Ainsi, le SGLT augmente la concentration de glucose dans le cytoplasme de l’entérocyte et le GLUT2 permet au glucose de s’échapper vers les vaisseaux sanguins. La localisation précise de ces deux transporteurs produit un flux de glucose à travers les entérocytes, de la lumière de l’intestin vers les vaisseaux sanguins.
Les graisses font partie des substances les plus énergétiques, en plus d’être nécessaires aux membranes cellulaires. La majorité des graisses du repas qui sont incorporées à partir de l’intestin sont sous forme de triacylglycérol, bien que d’autres types puissent être absorbés aussi, comme le cholestérol. Tout d’abord, les enzymes pancréatiques dégradent la graisse du repas dans la lumière de l’intestin et les triacylglycérols sont convertis en acides gras et en monoacylglycérols (figure 5). Ces molécules, associées au cholestérol, aux vitamines liposolubles et aux phospholipides, forment des micelles, qui sont de petites gouttelettes lipidiques solubles dans l’eau grâce aux acides biliaires. Les micelles traversent librement la membrane apicale de l’entérocyte. Les transporteurs CD36 y FABP (fatty acid binding protein) s 3permettent à certains corps gras de traverser la membrane apicale des entérocytes par un transport passif facilité. La majeure partie du transport des graisses se fait sous forme de micelles, tandis que les transporteurs membranaires ressemblent à un système sensoriel permettant de détecter les acides gras s 3à longues chaînes dans l’intestin. Le cholestérol, en tant que molécule individuelle, peut également être transporté par le transporteur NPC1L1 (Niemann-Pick C1-like 1), qui transfère le cholestérol de la lumière de l’intestin au cytoplasme de l’entérocyte.

Une fois dans l’entérocyte, les graisses sont jointes à certaines protéines et déplacées vers le réticulum endoplasmique, où les triacylglycérols sont synthétisés à nouveau. Ils sont combinés à certaines protéines pour former des pré-chylomicrons. La protéine ApoB est synthétisée dans le réticulum endoplasmique. L’ApoB, associée à la MTP (microsome tranfer protein) et aux acides gras, forme la particule primordiale de lipoprotéine. Dans le réticulum endoplasmique lisse, l’ApoB est remplacée par la protéine Apo A-IV. Tous ces composants constituent les pré-chylomicrons, qui sont inclus dans des vésicules et déplacés vers l’appareil de Golgi. Là, les pré-chylomicrons sont réunis pour former des chylomicrons, qui sont inclus dans des vésicules exocytaires et libérés dans le domaine latérobasal de l’entérocyte. De cette façon, les chylomicrons peuvent atteindre les vaisseaux sanguins et lymphatiques. Les chylomicrons sont des lipoprotéines dont le corps est principalement composé de triacylglycérols et l’enveloppe de phospholipides, de cholestérol et d’apolipoprotéines. Ils jouent un rôle majeur dans le transport des triacylglycérols et des vitamines liposolubles.
A l’extérieur de l’entérocyte, les chylomicrons entrent dans les vaisseaux lymphatiques des villosités intestinales, puis dans les plexus myentériques lymphatiques d’où ils passent dans les vaisseaux sanguins. Outre les chylomicrons, les graisses sont également concentrées dans les lipoprotéines de très basse densité (VLDL), qui sont également exocytées par les entérocytes. Les graisses peuvent également être stockées dans les gouttelettes lipidiques des entérocytes.
Les entérocytes reçoivent également le fer après la digestion. Le fer est important pour de nombreuses protéines, comme l’hémoglobine, et il peut être trouvé dans les aliments comme partie des groupes hémo ou lié à la ferritine (dans la viande animale) (Figure 6). Le fer issu de la digestion pénètre dans l’organisme par le biais du transporteur DMT1 (transporteur de métaux divalents 1) situé dans les membranes apicales des entérocytes. Les souris transgéniques dépourvues de ce transporteur développent une anémie sévère. Le DMT1 est un co-transporteur couplé à un gradient de protons. Le gradient de protons est généré par la pompe Na+/K+, également présente dans la membrane apicale des entérocytes. DMT1 transporte du Fe2+ mais la plupart du fer des repas est sous forme de Fe3+. La réduction du fer (Fe3+ en Fe2+) est effectuée par une enzyme réductase située dans la surface apicale de l’entérocyte. Le fer lié aux groupes hémostatiques semble être incorporé par endocytose médiée par des récepteurs. Une fois dans l’entérocyte, le groupe hémo est dégradé et le fer peut passer dans le cytosol.

Quoi que soit la voie d’entrée, une fois dans le cytosol, le mouvement du fer vers les membranes basolatérales semble être médié par les protéines métallochaperones. Dans les membranes basolatérales, le fer est transloqué vers l’espace extracellulaire par le transporteur ferroportine. La ferroportine prélève la forme Fe2+. Cependant, la ferritine est la protéine qui transporte le fer vers le système de la veine porte et le fer doit être sous forme Fe3+. Il existe des ferro-oxydases dans les membranes basolatérales de l’entérocyte qui rendent possible la conversion de Fe2+ en Fe3+. Le fer peut être stocké dans le cytosol de l’entérocyte lié à la ferritine.
Endocytose/transcytose. Des molécules comme les immunoglobulines sont endocytées par endocytose médiée par les récepteurs et transportées vers d’autres domaines membranaires par transcytose. Des vésicules se forment à la base des microvillosités et fusionnent ensuite avec les endosomes. Les immunoglobulines sont alors enfermées dans les vésicules générées dans les endosomes et ciblées vers les membranes du domaine basolatéral. De cette manière, les immunoglobulines échappent à la voie de dégradation lysosomale.
Paracellulaire. L’eau et les ions traversent l’épithélium par voie paracellulaire.
Protection
Les entérocytes forment une barrière rejetant les antigènes, les molécules toxiques et les micro-organismes, tout en laissant passer les substances nutritives. Les entérocytes sont en contact avec de nombreux microorganismes. Ceux qui sont des micro-organismes résidents de l’intestin, mais qui peuvent être dangereux s’ils atteignent les tissus internes, et les pathogènes non résidents qui accompagnent le repas. La surface apicale des entérocytes est recouverte d’une couche de substances muqueuses libérées par les cellules globettiques. Cette couche est composée de glucides et possède une viscosité dense qui permet la diffusion des molécules, mais rejette les cellules et les plus grosses molécules. En outre, les microvillosités des entérocytes présentent un glycocalyx bien développé dans les extrémités apicales de chaque microvillosités, qui agit comme une barrière physique et électrique puisqu’il est rempli de charges négatives. Ces microvillosités rendent difficile un contact physique direct entre les micro-organismes et la membrane de l’entérocyte. Cependant, même si les passent ces deux barrières, les microorganismes devraient surmonter le mécanisme de transport des microvillosités.
Les mucines sont des protéines hautement glycosylées présentes dans la membrane apicale des entérocytes. Elles contribuent au glycocalyx bien développé. Les mucines sont des protéines transmembranaires liées au cytosquelette par leur domaine cytosolique. MUC3, MUC12 et MUC17 sont les mucines les plus abondantes. Elles contiennent environ 5000 acides aminés et leur composant glucidique peut s’étendre jusqu’à 1 µm de la surface de la cellule. Les mucines forment une barrière physique difficile à franchir par les bactéries.
Les entérocytes sont capables de déclencher et de réguler les processus inflammatoires en libérant plusieurs chimiocines et cytokines. Ils possèdent également des récepteurs pour ces molécules. Les entérocytes libèrent des molécules pro-inflammatoires qui influencent les cellules immunitaires présentes dans la muqueuse intestinale.
Un autre mécanisme de protection moins connu est la libération de vésicules à partir de la surface apicale des entérocytes. L’actine et la myosine, l’appareil moteur des microvillosités, produisent des forces mécaniques qui entraînent les membranes vers l’extrémité de chaque microvillosités. L’accumulation de membranes aboutit à des vésicules, qui sont libérées dans la lumière intestinale. Ces vésicules contiennent une grande quantité de phosphatase alcaline qui est un puissant agent anti-pathogène en réduisant la toxicité du lipopolysacharide et l’inflammation intestinale. Elle entrave également l’attachement des bactéries à l’épithélium instestinal et diminue la prolifération des bactéries. Les vésicules libérées par l’entérocyte sont un moyen d’envoyer des molécules anti-microbes vers des zones éloignées de l’épithélium.
Bibliographie
Barker N. 2014. Cellules souches intestinales adultes : moteurs critiques de l’homéostasie et de la régénération épithéliales. Nature. 15 : 19-33.
Giammanco A, Cefalù AB, Noto D, Averna MR. 2015. La physiopathologie de la production de lipoprotéines intestinales. Frontières de la physiologie. 6 : 61.
Knutson MD. 2014. Cellules souches intestinales adultes : moteurs critiques de l’homéostasie et de la régénération épithéliales. Revue de la nature en biologie cellulaire moléculaire. 15:19-33.
Knutson MD. 2017. Les protéines de transport du fer : passerelles de l’homéostasie du fer cellulaire et systémique. Journal of biological chemistry Nature review in molecular cell biology. 292 : 12735-12743.
Shifrin DA, McConell RE, Nambiar R, Higginbotham JN, Coffey RJ, Tyska MJ. 2012. Les vésicules dérivées des microvillosités des entérocytes détoxifient les produits bactériens et régulent les interactions épithéliales-microbiennes. Biologie actuelle. 22 : 627-631.
Snoeck V, Goddeeries B, Cox E. 2005. Le rôle des entérocytes dans la fonction de barrière intestinale et la captation d’antigènes. Microbes et infection. 7 : 997-1004.
Leave a Reply