Atlas of plant and animal histology
1. 形態
2.生活環
3.機能
-消化
-保護
腸球は腸管の上皮の大部分を形成する柱状細胞(図1、図2)である。 大腸や虫垂よりも小腸に多く存在する。 小腸では、腸管細胞全体の約80%を占めている。 腸管細胞の主な機能は、腸管内腔から分子を吸収し、内部の結合組織や血管に輸送することである。 なお、腸管上皮は、外部環境と接触する体の大きな表面である(腸管内腔は体組織の外部)。


形態
腸管細胞は頂面(自由面)に微絨毛があり(図3)、基底部には多くのミトコンドリア、発達したゴルジ装置と小胞体がある。 腸管上皮の機械的な完全性、すなわち腸管細胞間の凝集力と細胞間通路の欠如は、隣接する腸管細胞間の細胞接着複合体に依存している。 腸細胞の先端領域近くには、タイトジャンクションとアドヒーレントジャンクションが存在する。 デスモソームは側底部膜に見られる。 ギャップジャンクションは側底膜にも存在する。 ヘミデスモソームは腸細胞の基底膜に存在し、細胞を基底膜に固定する。
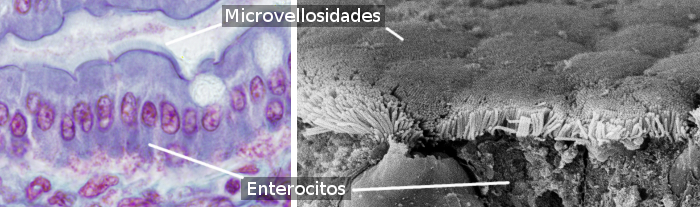
腸管細胞は頂膜側と底膜側の2つの領域を持っている。 そのため、偏光細胞である。 細胞骨格と小胞輸送が発達しており、両ドメイン間で分子を差動的に分配しているため、偏光が生じる。 タイトジャンクションは、両ドメイン間の分子の横方向の拡散を防ぎ、極性を維持するのに役立っている。 腸管細胞は、頂膜ドメインに高度にパッケージ化された小胞を有し、膜表面を約100倍に拡大している(図3)。 頂膜には多くのトランスポーターが存在し、消化の結果生じた分子が腸管内に入るためのゲートとなる。 基底膜には、これらの分子が腸管から出て血管に到達するための別のトランスポーターが存在する。 このような受容体の分離分布は、小胞輸送によって生み出される。
ライフサイクル
腸管内腔には腸管細胞にとって有害となりうる分子があふれている。 腸管細胞はダメージを受けたり古くなったりしたものを修復するのではなく、アポトーシスによって死滅させ、上皮層から押し出され、新しいものと絶えず入れ替わる。 小腸粘膜は高度に褶曲しており、リーベルキュン陰窩と呼ばれる多数の絨毛と陥入および腺を形成している。 大腸では、リーベルキュン陰窩が存在する。 腸管細胞のライフサイクルは、リーベルキュン腺の下部から始まり、小腸の絨毛の先端や大腸の上皮表面で終わる。 腸球の寿命は2〜5日程度である。 ヒトの場合、腸管上皮は4〜5日ごとに更新される。
腸管細胞はリーベルキューン腺の底に存在する成体幹細胞から分化する(図4)。 当初、成体幹細胞は成体幹細胞ニッチから少し離れたところにある一過性の増幅細胞(前駆細胞)となる。 一過性増幅細胞は4〜6回分裂して前駆細胞集団を増やし、その後、腸管上皮に見られる様々な細胞型に分化する。 その多くは腸管細胞になるが、グロベット細胞、M細胞、その他の細胞種にもなる。 新しい腸管細胞は、徐々に絨毛の先端や内腔上皮表面へと移動する。 これらの位置に到達した腸管細胞は死滅し、上皮から押し出される。 押し出されるには、機械的な圧力と隣接する細胞との接着結合が失われることの両方が必要である。 一部の細胞はアポトーシスによって死滅し、上皮から排出される。 腸管細胞が腺から上皮表面に移動するメカニズムについては不明である。 基底膜の分子成分が腸球の通り道に沿って異なっており、それが移動に寄与している可能性が考えられている。 また、腸球の生命の躍動には、食事が関与していると考えられている。

機能
消化
腸球の主な機能は、食物を胃や酵素で消化した後に栄養を吸収することである。 腸球はグルタミン酸やグルタミンのほか、脂肪酸やグルコースもエネルギー源として利用することがある。 これは、あらゆる種類の栄養素が腸細胞を通過するため、不思議なことである。 また、ペプチドや二糖類を分解する酵素を分泌して、消化を助けている。 腸細胞先端部の糖鎖は、約400〜500nm、時には1μmの厚さの層を形成している。 消化に関与するいくつかの酵素は、このグリコカリックスに固定されている。 このように、腸管細胞は、消化される物質を選別してキャッチするだけでなく、その一部を処理することも行っているのである。 実は、消化には、膵臓の酵素によって行われる腸の内腔での消化と、他の消化酵素によって行われる腸細胞の表面での消化の2段階があると言われている。 栄養吸収の大部分は小腸の腸管細胞で行われ、大腸の腸管細胞は主に水分を吸収する。 また、微絨毛の先端からは、ホスファターゼなどの酵素を含む小胞が放出されるが、これは病原体に対する防御機能を有すると考えられる。
消化によって生じた物質は、腸管上皮を通過して血流に到達する必要がある。 その経路は、細胞貫通型、エンドサイトーシス/トランスサイトーシス型、細胞外型がある。
トランスセルラー ほとんどの分子は腸管細胞を経由して腸の上皮層を通過する。 まず頂膜を越え、次に底膜を越える。 分子の移動には、自由拡散、促進型拡散、能動輸送がある。 自由受動拡散では、分子は何の助けも借りずに膜を通過するが、促進受動輸送と能動輸送では、分子は膜に挿入された特定のトランスポーターに認識される必要がある。 水、エタノール、多くの脂質は、自由受動拡散によって腸管細胞を通過する。 グルコース、いくつかの脂質、アミノ酸は、促進受動輸送または能動輸送によって腸管細胞内に入る。
細胞の頂膜には物質を吸収するための一連のタンパク質があり、一方、後基膜には腸細胞の外に分子を出すための別の膜貫通型輸送体がある。
吸収能力は腸細胞の分化段階に依存し、これは腸細胞がクリプトの深部から遠く離れるほど、より豊富なナトリウム膜ポンプを意味する。 したがって、糖やアミノ酸の吸収は、小腸の絨毛の上3分の1と大腸の表面付近で行われることがほとんどである。 例えば、腸管細胞が幹細胞ニッチ(クリプトの深い部分)から離れると、ヒドロラーゼ活性は増加する。
典型的な吸収機構の例として、グルコースの吸収が挙げられる。 グルコースは、ナトリウム勾配と結合した共輸送によって腸細胞の頂膜を通過する。 この勾配はナトリウム/カリウムポンプによって生じ、グルコースの濃度勾配に逆らって腸管細胞内のグルコースに入ることができる。 この共輸送を可能にするのが、ナトリウムグルコーストランスポーター(SGLT)である。 一方、後葉膜にはGLUT2トランスポーターが存在し、細胞質から細胞間隙にグルコースをトランスロケーションしている。 このように、SGLTは腸管細胞質内のグルコース濃度を高め、GLUT2はグルコースを血管の方へ逃がすことができるのである。 この2つのトランスポーターの正確な位置関係により、腸管細胞を通して、腸管内腔から血管へのグルコースのフラックスが生み出されるのである。
脂肪は、細胞膜に必要な物質であると同時に、最もエネルギーに満ちた物質の一つです。 腸から取り込まれる食事脂肪の大部分はトリアシルグリセロールの形をしていますが、コレステロールのように他の形のものも吸収されます。 まず、腸管内腔で膵臓の酵素により食事脂肪が分解され、トリアシルグリセロールは脂肪酸とモノアシルグリセロールに変換される(図5)。 これらの分子は、コレステロール、脂溶性ビタミン、リン脂質とともに、胆汁酸によって水に溶ける小さな脂質小滴であるミセラを形成する。 ミセルは腸管細胞の頂膜を自由に通過することができる。 CD36 と FABP (fatty acid binding protein) トランスポーター s 3 により、一部の脂肪性物質は腸管細胞頂膜を通過することが可能であり、促進された受動輸送が行われる。 脂肪の輸送の大部分はミセルとして行われるが、膜輸送体は腸内の長鎖脂肪酸を検出する感覚システムのように見える。 また、コレステロールはNPC1L1 (Niemann-Pick C1-like 1) トランスポーターによって、腸管内腔から腸管細胞質へ輸送される。
腸管細胞で脂肪はいくつかのタンパク質と結合して小胞体に移動し、そこでトリアシルグリセロールが再び合成される。 そして、いくつかのタンパク質と結合してプレキロミクロンを形成する。 ApoBタンパク質は小胞体で合成される。 ApoBはMTP (microsome tranfer protein) と脂肪酸とともにリポ蛋白質始原粒子を形成する。 平滑小胞体では、ApoBはApo A-IVタンパク質に置換される。 これらの成分はすべてプレキロミクロンを構成し、小胞に含まれゴルジ体へ移動する。 ここでプレキロミクロンが結合してカイロミクロンとなり、外分泌小胞に取り込まれて腸管後底部で放出される。 このようにして、カイロミクロンは血液やリンパ管に到達することができる。 カイロミクロンは、本体がトリアシルグリセロールを主成分とし、リン脂質、コレステロール、アポリポタンパク質で被覆されたリポタンパク質である。
カイロミクロンは腸球の外側で腸絨毛のリンパ管に入り、さらに腸管リンパ叢で血管に流れ込む。 カイロミクロン以外にも、脂肪は超低密度リポタンパク質(VLDL)に詰め込まれ、これも腸管細胞から排出される。 脂肪は腸細胞の脂質滴にも貯蔵される。
腸細胞は消化後、鉄分も摂取している。 鉄はヘモグロビンなど多くのタンパク質に重要であり、食品中にヘモグループの一部として、あるいはフェリチンと結合して(動物の肉に)存在する(図6)。 消化物からの鉄は、腸管細胞の頂膜に存在するDMT1トランスポーター(2価金属輸送体1)を介して体内に入る。 このトランスポーターを欠損したトランスジェニックマウスは、重度の貧血を起こす。 DMT1はプロトン勾配に結合した共輸送体である。 プロトン勾配は、同じく腸管細胞の頂膜に存在するNa+/K+ポンプによって生成される。 DMT1 は Fe2+ を輸送するが、食事からの鉄はほとんど Fe3+ 型である。 鉄の還元(Fe3+→Fe2+)は、腸管細胞の頂膜に存在する還元酵素によって行われる。 ヘモ基と結合した鉄は、受容体介在型エンドサイトーシスにより取り込まれるようである。 腸球の中に入ると、ヘモグループは分解され、鉄は細胞質へ入ることができる。

どのような侵入経路であれ、いったん細胞質に入った鉄が基底側膜に向かって移動するのは、メタロシャペロンタンパク質が媒介するようである。 側底膜ではフェロポルティントランスポーターによって鉄は細胞外へと移動する。 フェロポルティンは鉄を2+の形で取り出す。 しかし、フェリチンは門脈系に鉄を輸送するタンパク質であり、鉄はFe3+の形でなければならない。 腸細胞の基底膜にはフェロオキシダーゼがあり、Fe2+からFe3+への変換を可能にしている。 鉄はフェリチンと結合して腸細胞の細胞質内に貯蔵されることができる。
エンドサイトーシス/トランスサイトーシス。 免疫グロブリンのような分子は、受容体介在エンドサイトーシスによりエンドサイトーシスされ、トランスサイトーシスにより他の膜ドメインに輸送される。 微絨毛の基部で小胞が形成され、後にエンドソームと融合する。 そして、エンドソームで生成された小胞に免疫グロブリンが封入され、基底膜側ドメイン膜に標的化される。 このようにして、免疫グロブリンはリソソーム分解経路を回避する。
Paracellular. 水やイオンは副細胞性経路で上皮を通過する。
保護
腸管細胞は、抗原、毒性分子、微生物を拒絶するバリアを形成すると同時に、栄養物質を通過させる。 腸管細胞は多くの微生物と接触している。 腸内常在菌でありながら体内組織に侵入すると危険なもの、食事とともに侵入してくる非常在菌などである。 腸管細胞の先端表面は、グロベール細胞から放出される粘液物質で覆われている。 この層は炭水化物で構成され、分子の拡散を可能にする密な粘性を持つが、細胞や大きな分子は拒絶する。 また、腸細胞の微絨毛は、それぞれの微絨毛の先端部に発達したグリコカリックスを示し、これが負電荷に満ちているため、物理的・電気的バリアとして機能する。 この微絨毛があるために、微生物と腸細胞膜が直接物理的に接触することは困難である。 しかし、この2つの障壁を越えても、微生物は微絨毛の輸送機構に打ち勝たなければならない。
ムチンは腸管細胞の先端膜に存在する糖鎖の高いタンパク質である。 ムチンは腸管細胞の先端膜に存在する高糖度タンパク質で、よく発達したグリコカリックスに寄与している。 ムチンは細胞質ドメインによって細胞骨格に結合している膜貫通型タンパク質である。 MUC3、MUC12、MUC17が最も多く存在するムチンである。 約5000個のアミノ酸を含み、その炭水化物成分は細胞表面から1μmまで伸びることができる。 ムチンは細菌が通過しにくい物理的なバリアーを形成している。
腸管細胞は、いくつかのキモカインやサイトカインを放出することにより、炎症プロセスを開始し、制御することができる。 また、これらの分子に対する受容体も持っている。 腸管細胞は炎症性分子を放出し、腸管粘膜に存在する免疫細胞に影響を与える。
もう一つのあまり知られていない保護機構は、腸細胞の頂膜表面から小胞が放出されることである。 微絨毛の運動装置であるアクチンとミオシンが機械的な力を発生させ、膜を各微絨毛の先端に向かって引きずり出すのである。 蓄積された膜は小胞となり、腸管内腔に放出される。 この小胞には、リポポリサッカライドの毒性や腸の炎症を抑える強力な抗病原体であるアルカリホスファターゼが多量に含まれている。 また、細菌の腸管上皮への付着を妨げ、細菌の増殖を減少させる。 腸管細胞が放出する小胞は、上皮から遠く離れた場所に抗微生物分子を送り込む手段である。
文献
Barker N. 2014. 成体腸管幹細胞:上皮のホメオスタシスと再生の重要なドライバー。 Nature. 15: 19-33.
Giammanco A, Cefalù AB, Noto D, Averna MR.2015年. 腸管リポタンパク質産生の病態生理。 フロンティアーズ・イン・ファイオロジー。 6: 61.
クヌートソンMD. 2014. 成体腸管幹細胞:上皮のホメオスタシスと再生の重要なドライバー。 分子細胞生物学におけるネイチャーレビュー。 15:19-33.
クヌートソンMD. 2017. 鉄輸送タンパク質:細胞および全身の鉄ホメオスタシスのゲートウェイ。 ジャーナル オブ バイオロジカル ケミストリー ネイチャーレビュー イン モレキュラー セル バイオロジー. 292: 12735-12743.
Shifrin DA, McConell RE, Nambiar R, Higginbotham JN, Coffey RJ, Tyska MJ. 2012. 腸管細胞微小胞由来小胞は細菌産物を解毒し、上皮-微生物相互作用を制御する。 カレントバイオロジー。 22: 627-631.
Snoeck V, Goddeeries B, Cox E. 2005. 腸管バリア機能と抗原の取り込みにおける腸細胞の役割。 Microbes and infection. 7: 997-1004.
Leave a Reply