Atlante di istologia vegetale e animale
1. Morfologia
2. Ciclo vitale
3. Funzioni
– Digestione
– Protezione
Gli enterociti sono cellule colonnari che formano la maggior parte dell’epitelio dell’intestino (figure 1 e 2). Sono più abbondanti nell’intestino tenue che nell’intestino crasso e nell’appendice. Nell’intestino tenue, la quantità di enterociti è circa l’80% del totale degli enterociti intestinali. La funzione principale degli enterociti è assorbire molecole dal lume intestinale e trasportarle al tessuto connettivo interno e ai vasi sanguigni. È da notare che l’epitelio intestinale è la più grande superficie del corpo in contatto con l’ambiente esterno (il lume dell’intestino è esterno ai tessuti del corpo).


Morfologia
Gli enterociti hanno microvilli nella superficie apicale (libera) (Figura 3), molti mitocondri nella parte basale, e apparato di Golgi e reticolo endoplasmatico ben sviluppato. L’integrità meccanica dell’epitelio intestinale, cioè la coesione tra gli enterociti e la mancanza di passaggi intercellulari, dipende dai complessi di adesione cellulare tra enterociti adiacenti. Ci sono giunzioni strette e giunzioni aderenti vicino al dominio apicale dell’enterocita. I desmosomi si trovano nelle membrane latero-basali. Anche nelle membrane latero-basali si osservano giunzioni di gap. Gli emidesmosomi si trovano nella membrana basale degli enterociti che ancorano la cellula alla membrana basale.
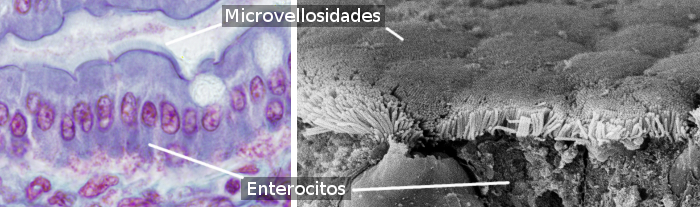
Gli enterociti hanno due domini: apicale e basolaterale. Questo è il motivo per cui sono cellule polarizzate. La polarizzazione è prodotta dall’attività di un citoscheletro ben organizzato e da un traffico vescicolare ben sviluppato che distribuisce le molecole in modo differenziale tra i due domini. Le giunzioni strette impediscono la diffusione laterale delle molecole tra i due domini, aiutando così a mantenere la polarità. Gli enterociti mostrano un microvillo altamente confezionato nel dominio apicale, che aumenta la superficie della membrana di circa 100 volte (Figura 3). Nelle membrane apicali, ci sono molti trasportatori che sono i cancelli per le molecole risultanti dalla digestione per venire nell’enterocita. Nelle membrane basali ci sono altri trasportatori per queste molecole per uscire dall’enterocita e raggiungere i vasi sanguigni. Questa distribuzione segregata dei recettori è generata dal traffico vescicolare.
Ciclo vitale
Il lume intestinale è pieno di molecole potenzialmente tossiche per gli enterociti. Invece di riparare ogni insulto, gli enterociti danneggiati e vecchi muoiono per apoptosi, vengono poi espulsi dallo strato epiteliale e sostituiti continuamente da nuovi. La mucosa dell’intestino tenue è molto ripiegata e forma molte evaginazioni o villi e invaginazioni o ghiandole, note come cripte di Lieberkühn. Nell’intestino crasso, ci sono cripte di Lieberkühn. Il ciclo di vita degli enterociti inizia nella parte inferiore delle ghiandole di Lieberkühn e finisce nelle punte dei villi dell’intestino tenue o nella superficie epiteliale dell’intestino crasso. La vita di un enterocita dura circa 2-5 giorni. Nell’uomo l’epitelio intestinale si rinnova ogni 4 o 5 giorni.
Gli enterociti si differenziano da cellule staminali adulte che si trovano sul fondo delle ghiandole di Lieberkühn (Figura 4). Inizialmente, le cellule staminali adulte diventano cellule amplificanti transitorie (cellule progenitrici), che si trovano un po’ più lontano dalla nicchia delle cellule staminali adulte. Le cellule amplificatrici transitorie si dividono da 4 a 6 volte per aumentare la popolazione di progenitori e poi si differenziano nella varietà di tipi cellulari che si trovano nell’epitelio intestinale. La maggior parte di esse diventano enterociti, ma anche cellule globet, cellule M e altri tipi di cellule. I nuovi enterociti si spostano progressivamente verso le punte dei villi o verso la superficie luminale dell’epitelio. Una volta raggiunte queste posizioni, muoiono e vengono estrusi dall’epitelio. L’estrusione coinvolge sia la pressione meccanica che la perdita della connessione di adesione con le cellule vicine. Alcune cellule muoiono per apoptosi e poi vengono espulse dall’epitelio. Non si sa quale sia il meccanismo di spostamento degli enterociti dalle ghiandole alla superficie epiteliale. I componenti molecolari della lamina basale sono diversi lungo il percorso degli enterociti, e si pensa che possano contribuire al movimento. Si è anche pensato che la dieta sia coinvolta nella dinamica della vita degli enterociti.

Funzioni
Digestione
La funzione principale degli enterociti è quella di assorbire i nutrienti dopo la digestione gastrica ed enzimatica del cibo. Gli enterociti possono usare il glutammato e la glutammina, così come gli acidi grassi e il glucosio, come rifornimento energetico. Questo è curioso perché tutti i tipi di nutrienti passano attraverso gli enterociti. Essi aiutano anche la digestione secernendo enzimi che degradano peptidi e disacaridi. Il glicocalice del dominio apicale degli enterociti forma uno strato di circa 400-500 nm di spessore, a volte anche 1 µm. Alcuni enzimi che partecipano alla digestione sono ancorati a questo glicocalice. Così, gli enterociti non solo selezionano e catturano le sostanze della digestione, ma ne elaborano anche alcune. In realtà, si dice che ci sono due fasi di digestione, una che avviene nel lume dell’intestino, realizzata dagli enzimi pancreatici, e l’altra nella superficie degli enterociti, realizzata da altri enzimi digestivi. La maggior parte dell’assorbimento dei nutrienti è realizzata dagli enterociti dell’intestino tenue, mentre gli enterociti dell’intestino crasso assorbono principalmente acqua. Inoltre, dalle punte dei microvilli vengono rilasciate piccole vescicole contenenti enzimi come le fosfatasi, che possono avere una funzione di difesa contro gli agenti patogeni.
Le sostanze risultanti dalla digestione devono attraversare l’epitelio intestinale per raggiungere il flusso sanguigno. Ciò può avvenire attraverso diverse vie: transcellulare, endocitosi/transcitosi e paracellulare.
Transcellulare. La maggior parte delle molecole attraversano lo strato epiteliale dell’intestino passando attraverso gli enterociti. Attraversando prima la membrana apicale e poi quella basolaterale. Le molecole possono essere spostate per diffusione passiva libera, diffusione passiva facilitata o trasporto attivo. Nella diffusione passiva libera, le molecole attraversano le membrane senza alcun aiuto, mentre nel trasporto facilitato e attivo, le molecole devono essere riconosciute da trasportatori specifici inseriti nelle membrane. Acqua, etanolo e molti lipidi attraversano gli enterociti per diffusione passiva libera. Il glucosio, alcuni lipidi e gli aminoacidi entrano negli enterociti per trasporto passivo facilitato o per trasporto attivo.
Il dominio apicale della cellula porta un insieme di proteine per l’assorbimento delle sostanze, mentre le membrane latero-basali hanno un altro trasportatore transmembrana per far uscire le molecole dall’enterocita.
La capacità di assorbimento dipende dallo stadio di differenziazione dell’enterocita, il che significa un certo numero di pompe di membrana del sodio, più abbondanti quando gli enterociti si allontanano dal profondo delle cripte. Così, la maggior parte dell’assorbimento di zuccheri e aminoacidi avviene nel terzo superiore dei villi dell’intestino tenue e vicino alla superficie dell’intestino crasso. Per esempio, l’attività dell’idrolasi aumenta quando gli enterociti si allontanano dalle nicchie delle cellule staminali (parti profonde delle cripte).
L’assorbimento del glucosio è un esempio di meccanismo tipico di assorbimento. Il glucosio attraversa la membrana apicale dell’enterocita tramite un co-trasporto accoppiato a un gradiente di sodio. Questo gradiente è generato dalle pompe sodio/potassio, e può entrare il glucosio nell’enterocita contro il gradiente di concentrazione del glucosio. Il trasportatore sodico del glucosio (SGLT) permette questo co-trasporto. D’altra parte, il trasportatore GLUT2 si trova nelle membrane laterobasali, che traslocano il glucosio dal citoplasma allo spazio intercellulare. Così, SGLT aumenta la concentrazione di glucosio nel citoplasma dell’enterocita e GLUT2 permette la fuga del glucosio verso i vasi sanguigni. La posizione precisa dei due trasportatori produce un flusso di glucosio attraverso gli enterociti, dal lume dell’intestino ai vasi sanguigni.
Il grasso è tra le sostanze più energetiche, oltre ad essere necessario per le membrane cellulari. La maggior parte del grasso dei pasti che viene incorporato dall’intestino è in forma di triacilglicerolo, anche se possono essere assorbiti anche altri tipi, come il colesterolo. In primo luogo, gli enzimi pancreatici degradano il grasso del pasto nel lume intestinale e i triacilgliceroli vengono convertiti in acidi grassi e monoacilgliceroli (Figura 5). Queste molecole, insieme al colesterolo, alle vitamine liposolubili e ai fosfolipidi, formano le micelle, che sono piccole gocce lipidiche solubili in acqua grazie agli acidi biliari. Le micelle attraversano liberamente la membrana apicale dell’enterocita. I trasportatori CD36 e FABP (fatty acid binding protein) s 3 rendono possibile che alcune sostanze grasse attraversino la membrana apicale dell’enterocita mediante un trasporto passivo facilitato. La maggior parte del trasporto dei grassi avviene sotto forma di micelle, mentre i trasportatori di membrana sembrano un sistema sensoriale per rilevare gli acidi grassi s 3con lunghe catene nell’intestino. Il colesterolo, come singola molecola, può essere trasportato anche dal trasportatore NPC1L1 (Niemann-Pick C1-like 1), che trasferisce il colesterolo dal lume intestinale al citoplasma degli enterociti.

Una volta nell’enterocita, i grassi sono uniti ad alcune proteine e trasferiti al reticolo endoplasmatico, dove i triacilgliceroli sono sintetizzati nuovamente. Sono combinati con alcune proteine per formare i preciclomicroni. La proteina ApoB è sintetizzata nel reticolo endoplasmatico. ApoB, insieme a MTP (microsome tranfer protein) e agli acidi grassi forma la particella lipoproteica primordiale. Nel reticolo endoplasmatico liscio, l’ApoB è sostituita dalla proteina Apo A-IV. Tutti questi componenti costituiscono i preciclomicroni, che sono inclusi nelle vescicole e trasferiti all’apparato di Golgi. Qui, i prechilomicroni si uniscono per formare i chilomicroni, che sono inclusi nelle vescicole esocitiche e rilasciati nel dominio laterobasale dell’enterocita. In questo modo, i chilomicroni possono raggiungere i vasi sanguigni e linfatici. I chilomicroni sono lipoproteine con un corpo composto principalmente da triacilgliceroli e un rivestimento di fosfolipidi, colesterolo e apolipoproteine. Hanno un ruolo importante nel trasporto dei triacilgliceroli e delle vitamine liposolubili.
Al di fuori dell’enterocita, i chilomicroni entrano nei vasi linfatici dei villi intestinali, e poi nei plessi linfatici mienterici da cui passano ai vasi sanguigni. Oltre ai chilomicroni, il grasso è anche impacchettato in lipoproteine a bassissima densità (VLDL), che sono anche esocitate dagli enterociti. Il grasso può essere immagazzinato anche nelle goccioline lipidiche degli enterociti.
Gli enterociti ottengono anche il ferro dopo la digestione. Il ferro è importante per molte proteine, come l’emoglobina, e può essere trovato negli alimenti come parte dei gruppi emo o legato alla ferritina (nella carne animale) (Figura 6). Il ferro dalla digestione entra nel corpo attraverso il trasportatore DMT1 (trasportatore di metalli divalenti 1) che si trova nelle membrane apicali degli enterociti. I topi transgenici privi di questo trasportatore sviluppano una grave anemia. DMT1 è un co-trasportatore accoppiato a un gradiente protonico. Il gradiente protonico è generato dalla pompa Na+/K+, che si trova anche nella membrana apicale degli enterociti. DMT1 trasporta Fe2+ ma la maggior parte dei ferri del pasto è in forma Fe3+. La riduzione del ferro (da Fe3+ a Fe2+) è effettuata da un enzima reduttasi situato nella superficie apicale dell’enterocita. Il ferro legato ai gruppi emo sembra essere incorporato dall’endocitosi mediata dai recettori. Una volta all’interno dell’enterocita, il gruppo emo viene degradato e il ferro può entrare nel citosol.

Qualunque sia la via di ingresso, una volta nel citosol, il movimento del ferro verso le membrane basolaterali sembra essere mediato da proteine metallochaperone. Nelle membrane basolaterali, il ferro viene traslocato nello spazio extracellulare dal trasportatore ferroportina. La ferroportina elimina la forma Fe2+. Tuttavia, la ferritina è la proteina che trasporta il ferro al sistema della vena porta e il ferro deve essere in forma Fe3+. Ci sono ferro-ossidasi nelle membrane basolaterali dell’enterocita che rendono possibile la conversione da Fe2+ a Fe3+. Il ferro può essere immagazzinato nel citosol dell’enterocita legato alla ferritina.
Endocitosi/transcitosi. Molecole come le immunoglobuline sono endocitate dall’endocitosi mediata dal recettore e trasportate in altri domini di membrana per transcitosi. Le vescicole si formano alla base dei microvilli, e si fondono successivamente con gli endosomi. Le immunoglobuline sono poi racchiuse in vescicole generate negli endosomi e indirizzate alle membrane del dominio basolaterale. In questo modo, le immunoglobuline sfuggono alla via di degradazione lisosomiale.
Paracellulare. Acqua e ioni attraversano l’epitelio per via paracellulare.
Protezione
Gli enterociti formano una barriera che respinge antigeni, molecole tossiche e microrganismi, e allo stesso tempo lasciano passare le sostanze nutritive. Gli enterociti sono in contatto con molti microrganismi. Quelli che sono microrganismi residenti nell’intestino, ma che possono essere pericolosi se raggiungono i tessuti interni, e quelli patogeni non residenti che arrivano con il pasto. La superficie apicale degli enterociti è ricoperta da uno strato di sostanze mucose rilasciate dalle cellule globet. Questo strato è composto da carboidrati e ha una viscosità densa che permette la diffusione delle molecole, ma respinge le cellule e le molecole più grandi. Inoltre, i microvilli degli enterociti mostrano un glicocalice ben sviluppato nelle punte apicali di ogni microvillo, che agisce come barriera fisica ed elettrica poiché è pieno di cariche negative. Questi microvilli rendono difficile un contatto fisico diretto tra i microrganismi e la membrana dell’enterocita. Tuttavia, anche se il passaggio di queste due barriere, i microrganismi dovrebbero superare il meccanismo di trasporto dei microvilli.
Le mucine sono proteine altamente glicosilate che si trovano nella membrana apicale degli enterociti. Contribuiscono al glicocalice ben sviluppato. Le mucine sono proteine transmembrana legate al citoscheletro dal loro dominio citosolico. MUC3, MUC12 e MUC17 sono le mucine più abbondanti. Contengono circa 5000 aminoacidi e la loro componente di carboidrati può estendersi fino a 1 µm dalla superficie cellulare. Le mucine formano una barriera fisica difficile da attraversare per i batteri.
Gli enterociti sono in grado di avviare e regolare i processi infiammatori rilasciando diverse chimocine e citochine. Hanno anche dei recettori per queste molecole. Gli enterociti rilasciano molecole pro-infiammatorie che influenzano le cellule immunitarie presenti nella mucosa intestinale.
Un altro meccanismo di protezione meno conosciuto è il rilascio di vescicole dalla superficie apicale degli enterociti. L’actina e la miosina, gli apparati motori dei microvilli, producono forze meccaniche che trascinano le membrane verso la punta di ogni microvillo. L’accumulo di membrane finisce sotto forma di vescicole, che vengono rilasciate nel lume intestinale. Queste vescicole contengono un’alta quantità di fosfatasi alcalina che è un potente agente anti-patogeno riducendo la tossicità del lipopolisaccaride e l’infiammazione intestinale. Inoltre ostacola l’attaccamento dei batteri all’epitelio istestinale e diminuisce la proliferazione dei batteri. Le vescicole rilasciate dagli enterociti sono un modo per inviare molecole anti-microbo a zone lontane dall’epitelio.
Bibliografia
Barker N. 2014. Cellule staminali intestinali adulte: driver critici dell’omeostasi epiteliale e della rigenerazione. Natura. 15: 19-33.
Giammanco A, Cefalù AB, Noto D, Averna MR. 2015. La fisiopatologia della produzione di lipoproteine intestinali. Frontiers in physiology. 6: 61.
Knutson MD. 2014. Cellule staminali intestinali adulte: driver critici dell’omeostasi epiteliale e della rigenerazione. Natura recensione in biologia cellulare molecolare. 15:19-33.
Knutson MD. 2017. Proteine di trasporto del ferro: gateway dell’omeostasi del ferro cellulare e sistemica. Journal of biological chemistry Nature review in molecular cell biology. 292: 12735-12743.
Shifrin DA, McConell RE, Nambiar R, Higginbotham JN, Coffey RJ, Tyska MJ. 2012. Enterocyte microvillus-derivato vescicole detossificare prodotti batterici e regolare epiteliale-microbica interazioni. Biologia corrente. 22: 627-631.
Snoeck V, Goddeeries B, Cox E. 2005. Il ruolo degli enterociti nella funzione di barriera intestinale e l’assorbimento dell’antigene. Microbi e infezioni. 7: 997-1004.
Leave a Reply