Frontiers in Celland Developmental Biology
Background
L’unità di base dell’apparato di Golgi è solitamente considerata come una pila di cisterne altamente polarizzata, con la faccia cis che riceve il carico dall’ER e la faccia trans della pila, il TGN, associata allo smistamento del carico per l’esportazione post-Golgi (Boncompain e Perez, 2013). Tuttavia, l’organizzazione di questi mini-stacks nella cellula varia tra i diversi organismi. Nelle piante e negli invertebrati le singole pile di Golgi sono sparse indipendentemente nel citoplasma, mentre nella maggior parte delle cellule dei vertebrati durante l’interfase, le singole pile di Golgi sono fuse insieme in una struttura a nastro compatta situata in prossimità del MTOC (Wei e Seemann, 2017). La struttura del nastro di Golgi nelle cellule di mammifero è meglio rivelata dalla microscopia elettronica (Rambourg e Clermont, 1997); la microscopia ottica ad alta risoluzione che utilizza marcatori cis e trans può anche rilevare l’organizzazione del nastro (Gosavi et al., 2018). Un’importante domanda in corso di studio nel campo è la rilevanza della struttura del nastro di Golgi e le differenze funzionali del nastro di Golgi rispetto ai “mini-stacks di Golgi isolati” o altri stati dell’architettura di Golgi. In altre parole, qual è il vantaggio evolutivo della morfologia a nastro più complessa dell’apparato del Golgi nelle cellule vertebrate e quali funzioni possono essere regolate da una transizione verso una struttura non a nastro?
Gli studi degli ultimi anni stanno rivelando che le membrane del Golgi forniscono una piattaforma per la regolazione di una serie di processi cellulari tra cui la polarizzazione cellulare (Kupfer et al, 1983), migrazione diretta (Millarte e Farhan, 2012), stress (Sasaki e Yoshida, 2015), riparazione del DNA (Farber-Katz et al., 2014), mitosi (Rabouille e Kondylis, 2007), metabolismo (Abdel Rahman et al., 2015), risposte pro-infiammatorie (Chen e Chen, 2018) e autofagia (Yamamoto et al., 2012; Lamb et al., 2013). In effetti, nelle cellule di mammifero ci sono ora notevoli prove che il Golgi, come altri organelli intracellulari, può agire come un sensore cellulare (Farhan e Rabouille, 2011; Mayinger, 2011; Millarte e Farhan, 2012; Sasaki e Yoshida, 2015; Luini e Parashuraman, 2016; Gosavi e Gleeson, 2017; Makhoul et al., 2018). Sta anche diventando chiaro che la morfologia precisa del Golgi è rilevante per la regolazione di un certo numero di questi processi cellulari (Makhoul et al., 2018). L’associazione della morfologia del Golgi con la segnalazione è stata sostenuta da uno schermo di kinome e fosfatome a livello di genoma che ha identificato una grande coorte di chinasi e fosfatasi (20% del totale nel genoma) che ha influenzato la morfologia del Golgi (Chia et al., 2012). I cambiamenti nella morfologia del Golgi includevano o la frammentazione del Golgi (perdita del nastro del Golgi) o la formazione di un Golgi molto compatto e condensato nella posizione perinucleare. La rilevanza dell’actina nella regolazione della morfologia del Golgi è stata evidenziata in questo studio dall’identificazione di una serie di chinasi, per esempio ROCK1 e PAK1, che regolano la dinamica dell’actina e modulano la struttura del Golgi (Chia et al., 2012). Altre analisi a livello di genoma hanno anche evidenziato la probabilità che il Golgi possa ricevere e trasmettere un’ampia varietà di segnali che potrebbero influenzare, non solo le vie di trasporto di membrana, ma anche altri processi, apoptosi, mitosi, autofagia e risposte allo stress (Farhan et al., 2010; Millarte et al., 2015).
La struttura a nastro del Golgi è altamente dinamica e può subire un rimodellamento molto rapido durante una serie di condizioni diverse. Per esempio, durante la mitosi il disassemblaggio del nastro del Golgi è un evento precoce nella transizione G2/M e gioca un ruolo importante come checkpoint del ciclo cellulare nel promuovere l’entrata mitotica (Wei e Seemann, 2010; Corda et al., 2012). La regolazione della dinamica del Golgi è mediata dalle interazioni tra le impalcature molecolari situate sulla membrana del Golgi e il citoscheletro. Le dinamiche MT possono regolare la posizione del nastro del Golgi al centrosoma e il riposizionamento del Golgi per facilitare il traffico polarizzato e la secrezione diretta (Millarte e Farhan, 2012; Sanders e Kaverina, 2015). Inoltre, i componenti di membrana del Golgi possono anche nucleare e stabilizzare i microtubuli sia al cis- che al trans-Golgi, e quindi il Golgi stesso è anche un MTOC (Efimov et al., 2007; Wu et al., 2016). Anche i processi mediati dall’actina contribuiscono alla forma e alla funzione del Golgi e sono stati identificati almeno nove scaffold molecolari localizzati nel Golgi che interagiscono con il citoscheletro di actina. L’aumento della polimerizzazione dell’actina al Golgi risulta nella dispersione del nastro, mentre l’inibizione della polimerizzazione dell’actina con farmaci specifici come latrunculin A risulta nella compattazione del Golgi (Lazaro-Dieguez et al., 2006; Makhoul et al., 2018, 2019). Date queste reti di regolazione che modulano la struttura del nastro del Golgi, riteniamo molto plausibile che l’equilibrio tra il nastro del Golgi e i mini-stacks del Golgi possa definire sia le risposte qualitative che quantitative delle vie di segnalazione. La connessione tra la morfologia del Golgi e la segnalazione ha anche importanti ramificazioni sulla comprensione della base molecolare di una serie di malattie che sono associate con la perdita del nastro del Golgi e la comparsa di un Golgi disperso. Per esempio, è stato dimostrato che la sopravvivenza di alcune cellule tumorali è associata a un Golgi disperso che riduce il livello di apoptosi (Farber-Katz et al., 2014; Petrosyan, 2015).
Cosa significa frammentazione del Golgi?
Il termine “frammentazione del Golgi” è comunemente usato per descrivere lo stato morfologico di un Golgi disperso nelle cellule di mammifero, come rilevato dalla microscopia ottica colorata con marcatori Golgi. Un Golgi disperso è spesso osservato in sistemi sperimentali, ad esempio quando le cellule sono trattate con farmaci per perturbare il citoscheletro, ad esempio, nocodazolo (Wei e Seemann, 2010), quando il flusso di membrana è perturbato, o quando i componenti del macchinario di trasporto del Golgi, o il sistema di interazione citoscheletrico, sono abbattuti, eliminati o sovraespressi (Zappa et al., 2018). In vari stati fisiologici, per esempio lo stress (Serebrenik et al., 2018) e condizioni patologiche, in particolare il cancro e la neurodegenerazione, il Golgi ha spesso perso la tipica posizione compatta juxtanucleare e viene osservato dalla microscopia confocale come strutture disperse in tutto il citoplasma . Ci sono un numero crescente di rapporti che descrivono la frammentazione del Golgi in condizioni fisiologiche e patologiche (Figura 1A). Tuttavia, un problema con l’uso del termine “frammentato” è che implica che l’integrità strutturale del Golgi è perso e che la morfologia associata alla struttura “frammentata” rappresenta un organello disintegrato, anormale o distrutto. In un certo numero di casi questo è chiaramente fuorviante in quanto le singole pile di Golgi possono rimanere intatte e possono mantenere le funzioni classiche dell’organello, cioè la glicosilazione e il trasporto di membrana. Infatti, mini-stacks di Golgi dispersi si verificano in alcune cellule specializzate, come i mioblasti differenziati (Lu et al., 2001), neuroni differenziati che contengono pile di Golgi individuali o “avamposti” lungo i dendriti (Lasiecka e Winckler, 2011), cellule parietali gastriche (Gunn et al., 2011), e cellule uroepiteliali della vescica urinaria (Kreft et al., 2010), senza apparente carenza di trasporto di membrana e glicosilazione. Piuttosto, la dispersione del nastro di Golgi associata a condizioni sperimentali e patologiche può riflettere uno spostamento dell’equilibrio dinamico tra la morfologia compatta del nastro e i singoli mini-stacks di Golgi o può risultare in una perturbazione dell’architettura del nastro così come dell’integrità dello stack di Golgi. Si tratta di una questione rilevante perché lo stato morfologico preciso del Golgi influenzerà molto probabilmente, in alcuni casi, l’efficienza del trasporto e della glicosilazione (Puthenveedu et al., 2006), e in altri casi una varietà di reti di segnalazione ma non necessariamente il trasporto o la glicosilazione. È importante distinguere tra mini-stacchi di Golgi intatti e perdita dell’integrità degli stacchi di Golgi nel definire cosa si intende per Golgi “frammentato”. Qui passiamo in rassegna le diverse morfologie del Golgi che sono state rilevate e caratterizzate in ambito sperimentale, fisiologico e patologico.
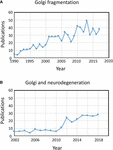
Figura 1. Pubblicazioni che identificano la frammentazione del nastro di Golgi. (A) Numero di pubblicazioni per anno con il termine frammentazione del Golgi nel titolo o nell’abstract. (B) Numero di pubblicazioni per anno in cui il Golgi è stato esaminato nelle malattie neurodegenerative. I dati sono di Alexandru Dan Corlan. Medline trend: statistiche annuali automatizzate dei risultati di PubMed per qualsiasi query, 2004. Risorsa web all’URL: http://dan.corlan.net/medline-trend.html. Accessed: 2019-04-29.
Ripensare la terminologia degli stati morfologici del Golgi
Le strutture dei frammenti del Golgi differiscono a seconda della natura del percorso coinvolto per perturbare o modulare il nastro del Golgi. È importante avere una migliore caratterizzazione ultrastrutturale dei “frammenti” del Golgi in seguito alla perdita del nastro del Golgi, poiché il risultato funzionale sarà probabilmente molto diverso a seconda delle strutture precise del Golgi. A parte le condizioni che risultano in un nastro di Golgi allungato, possiamo identificare dalla letteratura almeno 4 diversi scenari associati alla “frammentazione” del nastro di Golgi. Questi sono rappresentati nella figura 2 e descritti come segue:
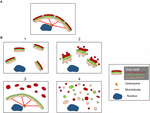
Figura 2. Modello che mostra diverse morfologie di Golgi dopo la “frammentazione” della struttura del nastro di Golgi. (A) Struttura intatta del nastro di Golgi e (B) diversi scenari che mostrano la perdita del nastro di Golgi. (1) Uno scenario in cui intatto Golgi mini-stacks sono dispersi in tutto il citoplasma; (2) Uno scenario in cui l’integrità delle pile Golgi dispersi è compromessa con cisterne accorciate, gonfiore di cisterne e aumento del Golgi associati tubuli e vescicole; (3) Uno scenario in cui vi è dispersione di un compartimento Golgi. Qui il TGN è selettivamente disperso in tutto il citoplasma mentre il resto della pila rimane in una struttura a nastro; (4) Scenario in cui c’è perdita di nastro e pile con membrane di Golgi disperse prevalentemente come tubuli e vescicole. I numeri si riferiscono alla classificazione delle morfologie di Golgi date nel testo.
(1) Conversione del nastro di Golgi in pile di Golgi. Qui la perdita (o la riduzione della lunghezza) del nastro di Golgi è associata a mini-stacks di Golgi dispersi e intatti. Questa situazione si verifica in un certo numero di tipi di cellule e anche in sistemi modello, come il trattamento con nocodazolo o la modulazione dei livelli di TGN golgin GCC88. Il trasporto di membrana sembra essere in gran parte inalterato in queste condizioni, con l’eccezione di un possibile carico di grandi dimensioni (Ferraro et al., 2014; Lavieu et al., 2014), mentre la segnalazione mTOR è ridotta e l’autofagia potenziata (Gosavi et al., 2018).
(2) Perdita sia del nastro di Golgi che dell’integrità delle pile di Golgi. In questo scenario, la struttura del nastro è persa e, inoltre, le cisterne dei singoli stack sono ridotte in lunghezza e/o numero e possono anche essere associate a compartimenti gonfiati, per esempio il knockout di GM130 (Liu et al., 2017) e le mutazioni delle subunità COG (Blackburn e Lupashin, 2016). Il trasporto di membrana e la glicosilazione sono probabilmente interessati in questo scenario insieme a varie reti di segnalazione.
(3) Dispersione di un compartimento Golgi. In questo scenario, solo un compartimento del Golgi è disperso, come la dispersione del TGN recentemente segnalata attivazione dell’inflammasoma NLRP3 (Chen e Chen, 2018). Il resto della pila/rimbalzo rimane inalterato. L’identificazione di queste strutture Golgi richiede l’incorporazione di EM e microscopia ottica e una serie di marcatori Golgi attraverso lo stack per definire i precisi cambiamenti nella morfologia Golgi.
(4) Conversione del nastro Golgi in elementi tubulovescicolari. In questo scenario, sia il nastro che gli stack del Golgi sono ampiamente perturbati con drammatici aumenti delle strutture tubulovescicolari, come nel caso durante la mitosi (Wei e Seemann, 2017), vari farmaci e il trattamento delle cellule con amiloide β (Joshi et al., 2014). Qui si anticiperebbe un impatto su molte delle funzioni del Golgi.
Non deduciamo che la Figura 2 rappresenti le uniche morfologie dei “frammenti” di Golgi ed è possibile che vengano identificati ulteriori scenari man mano che le strutture dei “frammenti” di Golgi vengono studiate più estesamente.
Esempi di una relazione tra morfologia del Golgi e processo cellulare
Il coordinamento dei cambiamenti nella morfologia del Golgi e vari processi cellulari ha ricevuto notevole attenzione. Per una sintesi più dettagliata delle informazioni di base dei processi influenzati dai cambiamenti nella morfologia del Golgi, come il traffico, la glicosilazione, lo stress, la riparazione del DNA, si rimanda il lettore a una serie di recenti recensioni (Farhan e Rabouille, 2011; Millarte e Farhan, 2012; Sasaki e Yoshida, 2015; Gosavi e Gleeson, 2017; Makhoul et al., 2019). Di seguito sono riportati alcuni esempi per evidenziare la gamma di processi cellulari che sono regolati o coordinati da diversi stati morfologici del Golgi. In un certo numero di altri casi, come alcuni tumori e risposte allo stress, il nastro di Golgi è disperso come frammenti, tuttavia, la morfologia di questi frammenti di Golgi non è stata ben caratterizzata. La discussione qui si concentrerà sugli esempi in cui la morfologia del Golgi è ben definita.
DNA Repair and Cancer
C’è un’intima associazione tra la morfologia del Golgi e la risposta al danno al DNA (Farber-Katz et al., 2014). Il legante della membrana del Golgi, GOLPH3, è un oncogene e la sovraespressione di GOLPH3 si traduce in una maggiore sopravvivenza cellulare in seguito a danni al DNA (Scott et al., 2009; Farber-Katz et al., 2014). Al contrario, la perdita di GOLPH3 impedisce la dispersione del nastro di Golgi, aumenta il nastro di Golgi e promuove l’apoptosi dopo un danno al DNA. La risposta al danno al DNA è mediata dalla chinasi DNA-PK, che fosforila GOLPH3 e promuove la “frammentazione” del Golgi aumentando la polimerizzazione dell’actina sulle membrane del Golgi (Dippold et al., 2009). mTOR è modulato dai cambiamenti nella morfologia del Golgi mediati da GOLPH3 (Scott et al., 2009) e probabilmente contribuisce all’esito della risposta al DNA. Quindi, la struttura precisa del Golgi è legata alla sopravvivenza cellulare e all’apoptosi. L’identità delle strutture del Golgi dopo la dispersione del nastro del Golgi da parte di fosfo-GOLPH3 deve ancora essere caratterizzata. Chiaramente, gli studi futuri che esaminano la relazione tra la frammentazione del Golgi e la segnalazione di mTOR nelle cellule tumorali saranno di grande utilità.
Disordini genetici associati ad un’alterata morfologia del Golgi
Molte malattie sono state identificate con disordini monogenici causati da mutazioni ereditarie dei componenti associati al macchinario di trasporto o degli enzimi residenti nel Golgi. Molte di queste malattie sono associate alla frammentazione del nastro del Golgi, per esempio, difetti nel complesso oligomerico conservato del Golgi (COG) nei disturbi congeniti della glicosilazione (Miller e Ungar, 2012). In molti casi i disturbi sono associati a patologie limitate a un numero limitato di organi o tessuti. La base della specificità tissutale è poco compresa, ma probabilmente dovuta a carenze nella glicosilazione e nella secrezione e anche ad alterazioni nelle reti di segnalazione associate alla perdita del nastro del Golgi, come le risposte allo stress del Golgi. Il Golgi in tutte le linee cellulari knockout della subunità COG mostra un cambiamento da moderato a grave nella morfologia come caratterizzato da EM, associato alla perdita del nastro, cisterne dilatate e in alcuni casi la rottura dei mini-stacks. L’applicazione dell’EM è stata fondamentale nella definizione dei cambiamenti morfologici (Blackburn e Lupashin, 2016).
Malattie neurodegenerative
Lo stato del Golgi nelle malattie neurodegenerative ha recentemente ricevuto notevole attenzione (Figura 1B). La perdita del nastro di Golgi è una caratteristica comune di molte malattie neurodegenerative tra cui il morbo di Alzheimer, la malattia di Huntington, la sclerosi laterale amiotrofica e il morbo di Parkinson (Gonatas et al., 2006; Haase e Rabouille, 2015; Rabouille e Haase, 2015; Sundaramoorthy et al., 2015). È molto probabile che le perturbazioni dell’architettura del Golgi in queste malattie contribuiscano ai processi patologici. Nella maggior parte dei casi la struttura morfologica precisa dei frammenti di Golgi in queste malattie neurodegenerative non sono stati definiti. Tuttavia, due sistemi sperimentali hanno recentemente studiato i cambiamenti nella struttura del Golgi e la degenerazione neuronale in qualche dettaglio. In primo luogo, è stato dimostrato che il knock out condizionale di GM130, una golgina strutturale che regola il nastro del Golgi, nel sistema nervoso centrale, causa frammentazione del Golgi, atrofia dei dendriti e degenerazione neuronale nei topi (Liu et al., 2017). L’analisi EM delle cellule di Purkinje GM130 KO ha mostrato una riduzione della lunghezza cisternale e dell’impilamento del Golgi e, inoltre, i tipici avamposti dei dendriti del Golgi erano assenti in queste cellule di Purkinje GM130 -/- (Liu et al., 2017). In un secondo studio, i neuroni ippocampali di topi transgenici per la mutazione svedese della proteina precursore dell’amiloide (APP) e una subunità mutante della presenilina 1 della γ-secretasi, dove entrambe le mutazioni sono associate alla malattia di Alzheimer ad insorgenza precoce, hanno rivelato un’estesa frammentazione del Golgi mediante microscopia ottica (Joshi et al., 2014). L’EM quantitativo dei neuroni in questi topi ha mostrato una riduzione del numero e della lunghezza delle cisterne negli stack rispetto ai neuroni dei topi wild type. Inoltre, le cisterne erano gonfiate. I cambiamenti nella morfologia del Golgi in questi neuroni primari è stato dimostrato di essere direttamente associato con il livello elevato di produzione di amiloide-β. I neuroni primari trattati con amiloide-β sintetica hanno anche mostrato una simile frammentazione del Golgi così come un aumento delle strutture tubulovescicolari associate alle cisterne del Golgi rispetto alle cellule non trattate. La perdita del nastro del Golgi era dovuta alla fosforilazione di GRASP65, una proteina strutturale del Golgi che gioca un ruolo chiave nel disassemblaggio del nastro del Golgi e delle pile nella mitosi (Joshi et al., 2014). Il confronto di questi due studi sopra è informativo in quanto le vie che mediano i cambiamenti nella morfologia del Golgi differiscono in ogni caso portando a differenze nella morfologia dei “frammenti” di Golgi. Bisogna considerare come questi diversi percorsi che influenzano la morfologia del Golgi influenzano le risposte a valle.
mTOR Signaling
Il nostro laboratorio ha stabilito un approccio sperimentale per perturbare l’equilibrio tra il nastro del Golgi e i mini-stacks del Golgi modulando la dose di GCC88, una golgina situata nel TGN. Questa strategia ha permesso di stabilire una linea cellulare stabile, HeLa-B6, che manca di un nastro di Golgi. Abbiamo dimostrato che GCC88 regola l’equilibrio tra i nastri del Golgi e i mini-stacks attraverso un processo dipendente dall’actina (Makhoul et al., 2019) e abbiamo identificato intersectin-1 (ITSN1), un fattore di scambio di guanina nucleotide per cdc42 (Hussain et al., 2001), come un interagente di GCC88 responsabile della perdita del nastro del Golgi (Makhoul et al., 2019). Le analisi delle cellule HeLa B6, che mancano di un nastro di Golgi, hanno dimostrato una ridotta attività di mTOR e un associato aumento della biogenesi degli autofagosomi (Gosavi et al., 2018). mTOR è una delle principali vie di segnalazione delle cellule eucariotiche e nota per essere un regolatore negativo dell’autofagia (Wullschleger et al., 2006). Quindi, l’equilibrio delle pile di Golgi al nastro di Golgi ha un effetto diretto sul percorso mTORC1. L’uso di marcatori specifici cis- e trans- compartimento, e la tomografia EM, è stato fondamentale nel rivelare i cambiamenti morfologici nel nastro di Golgi.
Infiammazione
Inflammasomi del sistema immunitario innato agiscono come impalcatura per l’attivazione caspasi 1-dipendente di citochine pro-infiammatorie (Broz e Dixit, 2016). Il NLRP3 (nucleotide-binding domain, leucine-rich-containing family, pyrin domain-containing-3) è un inflammasoma versatile che può essere attivato da una serie di stimoli microbici e non microbici con conseguente secrezione di citochine pro-infiammatorie interleuchina 1β (IL-1β) e interleuchina 18 (IL-18) e morte cellulare programmata per piroptosi. Uno studio recente ha dimostrato che l’attivazione della NLRP3 citosolica da parte di stimoli comporta il reclutamento della NLRP3 alle membrane TGN disperse per facilitare l’assemblaggio dell’impalcatura NLRP3 (Chen e Chen, 2018). Il TGN disperso, ma non gli altri compartimenti sottostanti, recluta specificamente NLRP3, tramite PI4P, per assemblare il complesso adattatore a valle ASC che subisce la polimerizzazione nella regione peri-nucleare prima di reclutare la caspasi-1 per attivare la via di segnalazione a valle (Chen e Chen, 2018). Quindi questa importante scoperta dimostra che la modulazione dell’architettura del TGN in modo selettivo, è critica nell’attivazione di questo percorso. L’uso di marcatori specifici del compartimento (TGN e cis-Golgi) insieme all’analisi ottica e EM è stato fondamentale nel rivelare i cambiamenti morfologici nel nastro del Golgi.
Raccomandazioni conclusive
La precisa architettura della morfologia del Golgi è definita dalla microscopia ottica ad alta risoluzione e dalla EM. L’inclusione di queste informazioni nei futuri studi sul campo fornirà una notevole comprensione della dinamica del Golgi, dei percorsi di perturbazione della struttura del nastro e delle conseguenze funzionali associate a questi diversi percorsi.
In sintesi, proponiamo che l’uso del termine “Golgi frammentato” è inadeguato a descrivere le strutture del Golgi associate a molti trattamenti e condizioni e le differenze in queste strutture del Golgi sono probabilmente rilevanti a livello fisiologico. Data la natura dinamica dell’apparato del Golgi, è possibile che ci sia un equilibrio tra diversi stati morfologici del Golgi in qualsiasi momento, cioè mini-stacks e strutture a nastro. Comprendere l’equilibrio dinamico tra le diverse morfologie del Golgi in dettaglio molecolare è fondamentale per un pieno apprezzamento di questo organello durante i processi cellulari normali e anche in condizioni patologiche. Sarà affascinante vedere cosa si sviluppa man mano che impariamo di più sulle funzioni di rilevamento delle cellule di questo complesso organello e la relazione tra queste funzioni e le strutture del Golgi.
Data Availability
Tutti i set di dati analizzati per questo studio sono inclusi nel manoscritto e nei file supplementari.
Contributi degli autori
Tutti gli autori elencati hanno dato un contributo sostanziale, diretto e intellettuale al lavoro e lo hanno approvato per la pubblicazione.
Finanziamento
Questo lavoro è stato sostenuto da un finanziamento dell’Australian Research Council (DP160102394).
Conflict of Interest Statement
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Abbreviazioni
GM130, proteina della matrice cis-Golgi; GMAP210, proteina associata al microtubulo del Golgi; GOLPH3, fosfoproteina 3 del Golgi; GRASP, proteina di riassemblaggio del Golgi; MTOC, centro di organizzazione dei microtubuli; mTOR, obiettivo meccanico della rapamicina; PI4P, fosfatidilinositolo-4-fosfato; TGN, rete trans-Golgi.
Abdel Rahman, A. M., Ryczko, M., Nakano, M., Pawling, J., Rodrigues, T., Johswich, A., et al. (2015). Golgi N-glicano ramificazione N-acetilglucosaminiltransferasi I, V e VI promuovere l’assorbimento dei nutrienti e il metabolismo. Glycobiology 25, 225-240. doi: 10.1093/glycob/cwu105
PubMed Abstract | CrossRef Full Text | Google Scholar
Blackburn, J. B., e Lupashin, V. V. (2016). Creazione di knockout di conservati oligomerici subunità complesso di Golgi utilizzando CRISPR-mediata gene editing accoppiato con una strategia di selezione basata su difetti di glicosilazione associati con compromessa funzione COG complesso. Metodi Mol. Biol. 1496, 145-161. doi: 10.1007/978-1-4939-6463-5_12
PubMed Abstract | CrossRef Full Text | Google Scholar
Boncompain, G., e Perez, F. (2013). Le molte vie del traffico Golgi-dipendente. Istochimica. Cell Biol. 140, 251-260. doi: 10.1007/s00418-013-1124-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Broz, P., e Dixit, V. M. (2016). Inflammasomi: meccanismo di assemblaggio, regolazione e segnalazione. Nat. Rev. Immunol. 16, 407-420. doi: 10.1038/nri.2016.58
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, J., and Chen, Z. J. (2018). PtdIns4P sulla rete trans-Golgi dispersa media l’attivazione dell’inflammasoma NLRP3. Nature 564, 71-76. doi: 10.1038/s41586-018-0761-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Chia, J., Goh, G., Racine, V., Ng, S., Kumar, P., e Bard, F. (2012). RNAi screening rivela una grande rete di segnalazione che controlla l’apparato di Golgi nelle cellule umane. Mol. Syst. Biol. 8:629. doi: 10.1038/msb.2012.59
PubMed Abstract | CrossRef Full Text | Google Scholar
Corda, D., Barretta, M. L., Cervigni, R. I., e Colanzi, A. (2012). Frammentazione del complesso del Golgi nella transizione G2/M: un checkpoint del ciclo cellulare basato sull’organello. IUBMB Life 64, 661-670. doi: 10.1002/iub.1054
PubMed Abstract | CrossRef Full Text | Google Scholar
De Matteis, M. A., Mironov, A. A., e Beznoussenko, G. V. (2008). Il nastro del Golgi e la funzione del Golgins. New York, NY: Springer-Verlag/Wein.
Google Scholar
Dippold, H. C., Ng, M. M., Farber-Katz, S. E., Lee, S. K., Kerr, M. L., Peterman, M. C., et al. (2009). GOLPH3 ponti fosfatidilinositolo-4-fosfato e actomiosina per allungare e modellare il Golgi per promuovere gemmazione. Cell 139, 337-351. doi: 10.1016/j.cell.2009.07.052
PubMed Abstract | CrossRef Full Text | Google Scholar
Efimov, A., Kharitonov, A., Efimova, N., Loncarek, J., Miller, P. M., Andreyeva, N., et al. Asimmetrica CLASP-dipendente nucleazione di microtubuli non centrosomiale alla rete trans-Golgi. Dev. Cell 12, 917-930. doi: 10.1016/j.devcel.2007.04.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Farber-Katz, S. E., Dippold, H. C., Buschman, M. D., Peterman, M. C., Xing, M., Noakes, C. J., et al. (2014). Danno al DNA innesca la dispersione Golgi via DNA-PK e GOLPH3. Cell 156, 413-427. doi: 10.1016/j.cell.2013.12.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Farhan, H., e Rabouille, C. (2011). Segnalazione da e verso la via secretoria. J. Cell Sci. 124, 171-180. doi: 10.1242/jcs.076455
PubMed Abstract | CrossRef Full Text | Google Scholar
Farhan, H., Wendeler, M. W., Mitrovic, S., Fava, E., Silberberg, Y., Sharan, R., et al. (2010). Segnalazione MAPK alla via secretoria precoce rivelato da chinasi / fosfatasi screening funzionale. J. Cell Biol. 189, 997-1011. doi: 10.1083/jcb.200912082
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferraro, F., Kriston-Vizi, J., Metcalf, D. J., Martin-Martin, B., Freeman, J., Burden, J. J., et al. (2014). Un controllo a due livelli Golgi-based di dimensioni dell’organello è alla base della plasticità funzionale delle cellule endoteliali. Dev. Cell 29, 292-304. doi: 10.1016/j.devcel.2014.03.021
PubMed Abstract | CrossRef Full Text | Google Scholar
Gonatas, N. K., Stieber, A., e Gonatas, J. O. (2006). Frammentazione dell’apparato di Golgi nelle malattie neurodegenerative e nella morte cellulare. J. Neurol. Sci. 246, 21-30. doi: 10.1016/j.jns.2006.01.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Gosavi, P., e Gleeson, P. A. (2017). La funzione della struttura a nastro del Golgi – Un mero mistero duraturo si dispiega! Bioessays 39:1700063. doi: 10.1002/bies.201700063
PubMed Abstract | CrossRef Full Text | Google Scholar
Gosavi, P., Houghton, F. J., Mcmillan, P. J., Hanssen, E., and Gleeson, P. A. (2018). Il nastro del Golgi nelle cellule di mammifero regola negativamente l’autofagia modulando l’attività di mTOR. J. Cell Sci. 131:jcs211987. doi: 10.1242/jcs.211987
PubMed Abstract | CrossRef Full Text | Google Scholar
Gunn, P. A., Gliddon, B. L., Londrigan, S. L., Lew, A. M., Van Driel, I. R., and Gleeson, P. A. (2011). L’apparato di Golgi nelle cellule parietali gastriche ricche di endomembrana esistono come funzionale stabile mini-stacks dispersi nel citoplasma. Biol. Cell 103, 559-572. doi: 10.1042/BC20110074
PubMed Abstract | CrossRef Full Text | Google Scholar
Haase, G., e Rabouille, C. (2015). Frammentazione del Golgi nei motoneuroni della SLA. Nuovi meccanismi di targeting microtubuli, legami, e vescicole di trasporto. Fronte. Neurosci. 9:448. doi: 10.3389/fnins.2015.00448
PubMed Abstract | CrossRef Full Text | Google Scholar
Hussain, N. K., Jenna, S., Glogauer, M., Quinn, C. C., Wasiak, S., Guipponi, M., et al. La proteina endocitica intersectina-l regola l’assemblaggio dell’actina tramite Cdc42 e N-WASP. Nat. Cell Biol. 3, 927-932. doi: 10.1038/ncb1001-927
PubMed Abstract | CrossRef Full Text | Google Scholar
Joshi, G., Chi, Y., Huang, Z., e Wang, Y. (2014). La frammentazione del Golgi indotta da Abeta nella malattia di Alzheimer aumenta la produzione di Abeta. Proc. Natl. Acad. Sci. U.S.A. 111, E1230-E1239. doi: 10.1073/pnas.1320192111
PubMed Abstract | CrossRef Full Text | Google Scholar
Kreft, M. E., Di Giandomenico, D., Beznoussenko, G. V., Resnik, N., Mironov, A. A., e Jezernik, K. (2010). Frammentazione dell’apparato di Golgi come meccanismo responsabile della consegna uniforme di uroplakin alla membrana plasmatica apicale delle cellule uroepiteliali. Biol. Cell 102, 593-607. doi: 10.1042/bc20100024
PubMed Abstract | CrossRef Full Text | Google Scholar
Kupfer, A., Dennert, G., e Singer, S. J. (1983). Polarizzazione dell’apparato di Golgi e del centro di organizzazione dei microtubuli all’interno delle cellule killer naturali clonate legate ai loro obiettivi. Proc. Natl. Acad. Sci. U.S.A. 80, 7224-7228. doi: 10.1073/pnas.80.23.7224
PubMed Abstract | CrossRef Full Text | Google Scholar
Lamb, C. A., Yoshimori, T., and Tooze, S. A. (2013). L’autofagosoma: origini sconosciute, biogenesi complesso. Nat. Rev. Mol. Cell Biol. 14, 759-774. doi: 10.1038/nrm3696
PubMed Abstract | CrossRef Full Text | Google Scholar
Lasiecka, Z. M., e Winckler, B. (2011). Meccanismi di traffico di membrana polarizzata nei neuroni – concentrandosi su endosomi. Mol. Cell. Neurosci. 48, 278-287. doi: 10.1016/j.mcn.2011.06.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Lavieu, G., Dunlop, M. H., Lerich, A., Zheng, H., Bottanelli, F., e Rothman, J. E. (2014). La struttura a nastro del Golgi facilita il trasporto anterogrado di grandi carichi. Mol. Biol. Cell 25, 3028-3036. doi: 10.1091/mbc.E14-04-093
PubMed Abstract | CrossRef Full Text | Google Scholar
Lazaro-Dieguez, F., Jimenez, N., Barth, H., Koster, A. J., Renau-Piqueras, J., Llopis, J. L., et al. I filamenti di actina sono coinvolti nel mantenimento della morfologia delle cisterne del Golgi e del pH intra-Golgi. Cell Motil. Cytoskeleton 63, 778-791. doi: 10.1002/cm.20161
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, C., Mei, M., Li, Q., Roboti, P., Pang, Q., Ying, Z., et al. (2017). Perdita del golgin GM130 provoca interruzione del Golgi, perdita di neuroni Purkinje e atassia nei topi. Proc. Natl. Acad. Sci. U.S.A. 114, 346-351. doi: 10.1073/pnas.1608576114
PubMed Abstract | CrossRef Full Text | Google Scholar
Lu, Z., Joseph, D., Bugnard, E., Zaal, K. J., e Ralston, E. (2001). Riorganizzazione del complesso di Golgi durante la differenziazione muscolare: visualizzazione in cellule viventi e meccanismo. Mol. Biol. Cell 12, 795-808. doi: 10.1091/mbc.12.4.795
PubMed Abstract | CrossRef Full Text | Google Scholar
Luini, A., e Parashuraman, S. (2016). Segnalazione al Golgi: rilevamento e controllo dei flussi di membrana. Curr. Opin. Cell Biol. 39, 37-42. doi: 10.1016/j.ceb.2016.01.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Makhoul, C., Gosavi, P., Duffield, R., Delbridge, B., Williamson, N. A., e Gleeson, P. A. (2019). Intersectin-1 interagisce con il golgin GCC88 per accoppiare la rete di actina e l’architettura del Golgi. Mol. Biol. Cell 30, 370-386. doi: 10.1091/mbc.E18-05-0313
PubMed Abstract | CrossRef Full Text | Google Scholar
Makhoul, C., Gosavi, P., e Gleeson, P. A. (2018). L’architettura del Golgi e il rilevamento delle cellule. Biochem. Soc. Trans. 46, 1063-1072. doi: 10.1042/BST20180323
PubMed Abstract | CrossRef Full Text | Google Scholar
Mayinger, P. (2011). Segnalazione al Golgi. Cold Spring Harb. Perspect. Biol. 3:a005314.
Google Scholar
Millarte, V., Boncompain, G., Tillmann, K., Perez, F., Sztul, E., and Farhan, H. (2015). Fosfolipasi C gamma1 regola il traffico secretorio precoce e la migrazione cellulare attraverso l’interazione con p115. Mol. Biol. Cell 26, 2263-2278. doi: 10.1091/mbc.E15-03-0178
PubMed Abstract | CrossRef Full Text | Google Scholar
Millarte, V., e Farhan, H. (2012). Il Golgi nella migrazione cellulare: la regolazione della trasduzione del segnale e le sue implicazioni per la metastasi delle cellule tumorali. ScientificWorldJournal 2012:498278. doi: 10.1100/2012/498278
PubMed Abstract | CrossRef Full Text | Google Scholar
Miller, V. J., e Ungar, D. (2012). Re’COG’nition al Golgi. Traffico 13, 891-897. doi: 10.1111/j.1600-0854.2012.01338.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Petrosyan, A. (2015). Onco-Golgi: è la frammentazione un cancello per la progressione del cancro? Biochem. Mol. Biol. J. 1:16.
PubMed Abstract | Google Scholar
Puthenveedu, M. A., Bachert, C., Puri, S., Lanni, F., e Linstedt, A. D. (2006). GM130 e GRASP65-dipendente fusione laterale cisternale permette uniforme distribuzione Golgi-enzima. Nat. Cell Biol. 8, 238-248. doi: 10.1038/ncb1366
PubMed Abstract | CrossRef Full Text | Google Scholar
Rabouille, C., e Haase, G. (2015). Editoriale: patologia golgi nelle malattie neurodegenerative. Fronte. Neurosci. 9:489. doi: 10.3389/fnins.2015.00489
PubMed Abstract | CrossRef Full Text | Google Scholar
Rabouille, C., e Kondylis, V. (2007). Scollegamento del nastro di Golgi: un checkpoint G2/M basato sull’organello. Cell Cycle 6, 2723-2729. doi: 10.4161/cc.6.22.4896
PubMed Abstract | CrossRef Full Text | Google Scholar
Rambourg, A., e Clermont, Y. (1997). Struttura tridimensionale dell’apparato di Golgi nelle cellule di mammifero. Basilea: Birkhauser.
Google Scholar
Sanders, A. A., and Kaverina, I. (2015). Nucleazione e dinamica dei microtubuli derivati dal Golgi. Front. Neurosci. 9:431. doi: 10.3389/fnins.2015.00431
CrossRef Full Text | Google Scholar
Sasaki, K., e Yoshida, H. (2015). Risposte di autoregolazione-stress organelli nell’ER, Golgi, mitocondri e lisosoma. J. Biochem. 157, 185-195. doi: 10.1093/jb/mvv010
PubMed Abstract | CrossRef Full Text | Google Scholar
Scott, K. L., Kabbarah, O., Liang, M. C., Ivanova, E., Anagnostou, V., Wu, J., et al. GOLPH3 modula la segnalazione mTOR e la sensibilità alla rapamicina nel cancro. Nature 459, 1085-1090. doi: 10.1038/nature08109
PubMed Abstract | CrossRef Full Text | Google Scholar
Serebrenik, Y. V., Hellerschmied, D., Toure, M., Lopez-Giraldez, F., Brookner, D., and Crews, C. M. (2018). Targeted protein unfolding scopre una risposta allo stress trascrizionale specifica per il Golgi. Mol. Biol. Cell 29, 1284-1298. doi: 10.1091/mbc.E17-11-0693
PubMed Abstract | CrossRef Full Text | Google Scholar
Sundaramoorthy, V., Sultana, J. M., e Atkin, J. D. (2015). Frammentazione del Golgi nella sclerosi laterale amiotrofica, una panoramica di possibili trigger e conseguenze. Front. Neurosci. 9:400. doi: 10.3389/fnins.2015.00400
PubMed Abstract | CrossRef Full Text | Google Scholar
Wei, J. H., e Seemann, J. (2010). Svelare il nastro di Golgi. Traffic 11, 1391-1400. doi: 10.1111/j.1600-0854.2010.01114.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Wei, J. H., and Seemann, J. (2017). Disassemblaggio del nastro di Golgi durante la mitosi, la differenziazione e la progressione della malattia. Curr. Opin. Cell Biol. 47, 43-51. doi: 10.1016/j.ceb.2017.03.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, J., De Heus, C., Liu, Q., Bouchet, B. P., Noordstra, I., Jiang, K., et al. (2016). Percorso molecolare di organizzazione dei microtubuli all’apparato di Golgi. Dev. Cell 39, 44-60. doi: 10.1016/j.devcel.2016.08.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Wullschleger, S., Loewith, R., e Hall, M. N. (2006). Segnalazione TOR nella crescita e nel metabolismo. Cell 124, 471-484.
Google Scholar
Yamamoto, H., Kakuta, S., Watanabe, T. M., Kitamura, A., Sekito, T., Kondo-Kakuta, C., et al. Atg9 vescicole sono una fonte importante membrana durante le prime fasi di formazione autofagosoma. J. Cell Biol. 198, 219-233. doi: 10.1083/jcb.201202061
PubMed Abstract | CrossRef Full Text | Google Scholar
Zappa, F., Failli, M., e De Matteis, M. A. (2018). Il complesso del Golgi nella malattia e nella terapia. Curr. Opin. Cell Biol. 50, 102-116. doi: 10.1016/j.ceb.2018.03.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply