Frontiers in Celland Developmental Biology
Bakgrund
Golgiapparatens basenhet anses vanligen vara en stapel av cisterner som är starkt polariserade, med cis-ytan som tar emot last från ER och trans-ytan av stapeln, TGN, associerad med sortering av last för post-Golgi-export (Boncompain och Perez, 2013). Organisationen av dessa ministackar i cellen varierar dock bland olika organismer. I växter och ryggradslösa djur är enskilda Golgi-stackar utspridda oberoende av varandra i cytoplasman medan i de flesta ryggradsdjursceller under interfasen är enskilda Golgi-stackar sammanfogade till en kompakt bandstruktur som är belägen i nära anslutning till MTOC (Wei och Seemann, 2017). Golgibandets struktur i däggdjursceller avslöjas bäst genom elektronmikroskopi (Rambourg och Clermont, 1997); optisk mikroskopi med hög upplösning med hjälp av cis- och transmarkörer kan också upptäcka bandorganisationen (Gosavi et al., 2018). En viktig fråga som undersöks inom området är relevansen av Golgibandets struktur och Golgibandets funktionella skillnader jämfört med ”isolerade Golgi-ministackar” eller andra tillstånd av Golgiarkitektur. Med andra ord, vad är den evolutionära fördelen med Golgiapparatens mer komplexa bandmorfologi i ryggradsdjursceller och vilka funktioner kan regleras av en övergång till en struktur utan band?
Studier under de senaste åren avslöjar att Golgimembranen utgör en plattform för reglering av en rad cellulära processer, inklusive cellpolarisering (Kupfer et al, 1983), riktad migration (Millarte och Farhan, 2012), stress (Sasaki och Yoshida, 2015), DNA-reparation (Farber-Katz et al., 2014), mitos (Rabouille och Kondylis, 2007), metabolism (Abdel Rahman et al., 2015), proinflammatoriska reaktioner (Chen och Chen, 2018) och autofagi (Yamamoto et al., 2012; Lamb et al., 2013). I däggdjursceller finns det nu faktiskt betydande bevis för att Golgi, liksom andra intracellulära organeller, kan fungera som en cellsensor (Farhan och Rabouille, 2011; Mayinger, 2011; Millarte och Farhan, 2012; Sasaki och Yoshida, 2015; Luini och Parashuraman, 2016; Gosavi och Gleeson, 2017; Makhoul et al., 2018). Det blir också allt tydligare att Golgis exakta morfologi är relevant för regleringen av ett antal av dessa cellprocesser (Makhoul et al., 2018). Sambandet mellan Golgimorfologin och signalering bärs upp av en genomomfattande kinom- och fosfatomscreening som identifierade en stor kohort av kinaser och fosfataser (20 % av det totala antalet i genomet) som påverkade Golgimorfologin (Chia et al., 2012). Förändringarna i Golgimorfologin omfattade antingen fragmentering av Golgi (förlust av Golgiband) eller bildandet av ett mycket kompakt och kondenserat Golgi i det perinukleära läget. Aktins betydelse för regleringen av Golgi-morfologin betonades i denna studie genom identifieringen av ett antal kinaser, till exempel ROCK1 och PAK1, som reglerar aktindynamiken och modulerar Golgi-strukturen (Chia et al., 2012). Andra genomövergripande analyser har också belyst sannolikheten för att Golgi kan ta emot och överföra en mängd olika signaler som kan påverka, inte bara membrantransportvägar, utan även andra processer, apoptos, mitos, autofagi och stressreaktioner (Farhan et al., 2010; Millarte et al., 2015).
Golgibandstrukturen är mycket dynamisk och kan genomgå en mycket snabb omformning under en rad olika förhållanden. Under mitos är till exempel nedmonteringen av Golgibandet en tidig händelse i G2/M-övergången och spelar en viktig roll som en cellcykelkontrollpunkt för att främja mitotisk inträde (Wei och Seemann, 2010; Corda et al., 2012). Regleringen av Golgi-dynamiken förmedlas av interaktioner mellan molekylära ställningar som finns på Golgimembranet och cytoskelettet. MT-dynamiken kan reglera Golgibandets placering vid centrosomen och omplaceringen av Golgi för att underlätta polariserad trafikering och riktad sekretion (Millarte och Farhan, 2012; Sanders och Kaverina, 2015). Dessutom kan membrankomponenterna i Golgi också bilda kärnor och stabilisera mikrotubuli vid både cis- och trans-Golgi, och därför är Golgi i sig självt också en MTOC (Efimov et al., 2007; Wu et al., 2016). Aktinmedierade processer bidrar också till Golgis form och funktion och minst nio Golgi-lokaliserade molekylära ställningar har identifierats som interagerar med aktincytoskelettet . En förstärkning av aktinpolymeriseringen vid Golgi resulterar i en spridning av bandet, medan en hämning av aktinpolymeriseringen med specifika läkemedel som latrunculin A resulterar i en kompaktering av Golgi (Lazaro-Dieguez et al., 2006; Makhoul et al., 2018, 2019). Med tanke på dessa regleringsnätverk som modulerar Golgibandets struktur anser vi att det är mycket troligt att balansen mellan Golgibandet och Golgi-ministaplarna kan definiera både de kvalitativa och kvantitativa svaren av signalvägar. Kopplingen mellan Golgi-morfologi och signalering har också viktiga förgreningar när det gäller att förstå den molekylära grunden för ett antal sjukdomar som är förknippade med förlust av Golgibandet och uppkomsten av ett utspritt Golgi. Till exempel har överlevnaden av vissa cancerceller visat sig vara förknippad med en spridd Golgi som minskar nivån av apoptos (Farber-Katz et al., 2014; Petrosyan, 2015).
Vad betyder Golgi-fragmentering?
Uttrycket ”Golgi-fragmentering” används vanligen för att beskriva den morfologiska statusen av en spridd Golgi i däggdjursceller, som detekteras genom optisk mikroskopi färgad med Golgi-markörer. En dispergerad Golgi observeras ofta i experimentella system till exempel när celler behandlas med läkemedel som stör cytoskelettet, t.ex. nocodazol (Wei och Seemann, 2010), när membranflödet störs eller när komponenter i Golgi transportmaskineriet, eller cytoskelettets interaktionssystem, slås ut, knockas ner eller överuttrycks (Zappa et al., 2018). I olika fysiologiska tillstånd, till exempel stress (Serebrenik et al., 2018) och patologiska tillstånd, särskilt cancer och neurodegeneration, har Golgi ofta förlorat den typiska kompakta juxtankärniga placeringen och observeras med konfokalmikroskopi som spridda strukturer i hela cytoplasman . Det finns ett ökande antal rapporter som beskriver Golgi-fragmentering under fysiologiska och patologiska förhållanden (figur 1A). Ett problem med användningen av termen ”fragmenterad” är dock att den innebär att Golgis strukturella integritet har gått förlorad och att den morfologi som är förknippad med den ”fragmenterade” strukturen representerar en sönderdelad, onormal eller förstörd organell. I ett antal fall är detta uppenbart missvisande, eftersom de enskilda Golgi-staplarna kan förbli intakta och upprätthålla organellens klassiska funktioner, nämligen glykosylering och membrantransport. Det förekommer faktiskt spridda Golgi-ministackar i vissa specialiserade celler, t.ex. differentierade myoblaster (Lu et al., 2001), differentierade neuroner som innehåller enskilda Golgistackar eller ”utposter” längs dendriterna (Lasiecka och Winckler, 2011), gastriska parietalceller (Gunn et al., 2011) och uroepitelceller i urinblåsan (Kreft et al., 2010), utan att det finns uppenbara brister i membrantransport och glykosylering. Snarare kan spridningen av Golgibandet i samband med experimentella och patologiska förhållanden återspegla en förskjutning av den dynamiska balansen mellan den kompakta bandmorfologin och de enskilda Golgi-ministackarna eller kan resultera i en störning av bandarkitekturen samt Golgistackens integritet. Detta är en relevant fråga eftersom Golgis exakta morfologiska status med stor sannolikhet kommer att påverka, i vissa fall transportens och glykosyleringens effektivitet (Puthenveedu et al., 2006), och i andra fall en rad olika signalnätverk men inte nödvändigtvis transport eller glykosylering. Det är viktigt att skilja mellan intakta Golgi-ministackar och förlust av integriteten hos Golgistackarna när man definierar vad som menas med ett ”fragmenterat” Golgi. Här går vi igenom de olika Golgi-morfologier som har upptäckts och karakteriserats i experimentell, fysiologisk och patologisk miljö.
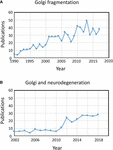
Figur 1. Publikationer som identifierar fragmentering av Golgibandet. (A) Antal publikationer per år med termen Golgi-fragmentering i antingen titel eller abstrakt. (B) Antal publikationer per år där Golgi har undersökts i neurodegenerativa sjukdomar. Uppgifterna kommer från Alexandru Dan Corlan. Medline trend: automatiserad årlig statistik över PubMed-resultat för alla frågor, 2004. Webbresurs på URL: http://dan.corlan.net/medline-trend.html. Accessed: 2019-04-29.
Rethinking the Terminology of Golgi Morphological States
Strukturerna hos Golgifragmenten skiljer sig åt beroende på vilken typ av väg som är inblandad för att störa eller modulera Golgibandet. Det är viktigt att få en bättre ultrastrukturell karakterisering av Golgi-”fragmenten” efter förlust av Golgibandet, eftersom det funktionella resultatet sannolikt kommer att vara mycket olika beroende på de exakta Golgistrukturerna. Förutom förhållanden som resulterar i ett förlängt Golgiband kan vi från litteraturen identifiera minst fyra olika scenarier som är förknippade med Golgibandets ”fragmentering”. Dessa avbildas i figur 2 och beskrivs enligt följande:
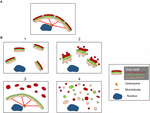
Figur 2. Modell som visar olika Golgi-morfologier efter ”fragmentering” av Golgibandstrukturen. (A) Intakt Golgibandstruktur och (B) olika scenarier som visar förlust av Golgibandet. (1) Ett scenario där intakta Golgi-ministackar är utspridda i hela cytoplasman. (2) Ett scenario där integriteten hos de utspridda Golgistackarna äventyras med förkortade cisterner, svullnad av cisternerna och ökning av Golgi-associerade tubuli och vesiklar. (3) Ett scenario där det finns en utspridning av ett Golgi-avdelning. Här sprids TGN selektivt i hela cytoplasman medan resten av stapeln förblir i en bandstruktur. (4) Scenario där band och staplar försvinner och Golgimembranen sprids huvudsakligen i form av tubuli och vesiklar. Numren hänvisar till den klassificering av Golgi-morfologierna som anges i texten.
(1) Omvandling av Golgiband till Golgistaplar. Här är förlusten (eller minskningen av längden) av Golgibandet förknippad med utspridda, intakta Golgi-ministackar. Denna situation uppstår i ett antal celltyper och även i modellsystem, t.ex. vid behandling med nocodazol eller vid modulering av nivåerna av TGN golgin GCC88. Membrantransporten verkar vara i stort sett opåverkad under dessa förhållanden, med undantag för eventuellt stora laster (Ferraro et al., 2014; Lavieu et al., 2014), medan mTOR-signalering minskas och autofagi förstärks (Gosavi et al., 2018).
(2) Förlust av både Golgiband och integritet av Golgistackar. I detta scenario går bandstrukturen förlorad och dessutom är cisternerna i enskilda staplar reducerade i längd och/eller antal och kan också vara associerade med svullna fack, till exempel knockout av GM130 (Liu et al., 2017) och mutationer av COG-underenheter (Blackburn och Lupashin, 2016). Membrantransport och glykosylering påverkas sannolikt i detta scenario tillsammans med olika signalnätverk.
(3) Spridning av ett Golgi-kompartment. I detta scenario sprids endast ett Golgi-kompartment, såsom spridningen av TGN nyligen rapporterad aktivering av NLRP3-inflammasomen (Chen och Chen, 2018). Resten av stapeln/ribban förblir opåverkad. För att identifiera dessa Golgi-strukturer krävs inkorporering av EM och optisk mikroskopi och ett antal Golgi-markörer över stapeln för att definiera de exakta förändringarna i Golgi-morfologin.
(4) Omvandling av Golgiband till tubulovesikulära element. I detta scenario störs både Golgibandet och stacken i stor utsträckning med dramatiska ökningar av tubulovesikulära strukturer, som i fallet under mitos (Wei och Seemann, 2017), olika läkemedel och behandling av celler med amyloid β (Joshi et al., 2014). Här skulle man kunna förvänta sig en påverkan på många av Golgis funktioner.
Vi drar inte slutsatsen att figur 2 representerar de enda morfologierna hos Golgi-”fragment” och det är möjligt att ytterligare scenarier kommer att identifieras i takt med att strukturerna hos Golgi-”fragment” undersöks mer ingående.
Exempel på ett samband mellan Golgi-morfologi och cellprocesser
Koordinationen mellan förändringar i Golgi-morfologi och olika cellprocesser har fått stor uppmärksamhet. För en mer detaljerad sammanfattning av bakgrundsinformationen om de processer som påverkas av förändringarna i Golgi-morfologin, t.ex. trafikering, glykosylering, stress, DNA-reparation, hänvisas läsaren till ett antal nyligen publicerade översikter (Farhan och Rabouille, 2011; Millarte och Farhan, 2012; Sasaki och Yoshida, 2015; Gosavi och Gleeson, 2017; Makhoul et al., 2019). Nedan följer några exempel för att belysa det utbud av cellprocesser som regleras eller samordnas av olika morfologiska tillstånd hos Golgi. I ett antal andra fall, t.ex. vid vissa cancerformer och stressreaktioner, sprids Golgibandet som fragment, men morfologin hos dessa Golgifragment har inte karakteriserats väl. Diskussionen här kommer att fokusera på de exempel där Golgi-morfologin är väldefinierad.
DNA-reparation och cancer
Det finns ett intimt samband mellan Golgi-morfologin och DNA-skadereaktionen (Farber-Katz et al., 2014). Golgimembranets tether, GOLPH3, är en onkogen och överuttryck av GOLPH3 resulterar i ökad cellöverlevnad efter DNA-skador (Scott et al., 2009; Farber-Katz et al., 2014). Omvänt förhindrar förlust av GOLPH3 spridningen av Golgibandet, förstärker Golgibandet och främjar apoptos efter DNA-skador. DNA-skadesvaret medieras av kinasen DNA-PK, som fosforylerar GOLPH3 och främjar Golgi-”fragmentering” genom att öka aktinpolymeriseringen vid Golgimembranen (Dippold et al., 2009). mTOR moduleras av de förändringar i Golgimorfologin som medieras av GOLPH3 (Scott et al., 2009) och bidrar troligen till resultatet av DNA-svaret. Därför är den exakta Golgistrukturen knuten till cellöverlevnad och apoptos. Identiteten hos de Golgistrukturer som följer på att Golgibandet sprids av phospho-GOLPH3 återstår att karakterisera. Det är uppenbart att framtida studier som undersöker förhållandet mellan Golgi-fragmentering och mTOR-signalering i cancerceller kommer att vara väl värda att genomföra.
Geniska sjukdomar som är associerade med förändrad Golgi-morfologi
Många sjukdomar har identifierats som monogena störningar orsakade av ärftliga mutationer av antingen komponenter som är associerade med transportmaskineriet eller av de enzymer som finns i Golgi. Många av dessa sjukdomar är förknippade med fragmentering av Golgibandet, till exempel defekter i det konserverade oligomeriska Golgikomplexet (COG) vid medfödda störningar av glykosylering (Miller och Ungar, 2012). I många fall är störningarna förknippade med patologier som är begränsade till ett begränsat antal organ eller vävnader. Grunden för vävnadsspecificiteten är dåligt förstådd, men beror sannolikt på brister i glykosylering och sekretion och även förändringar i signalnätverk som är förknippade med förlusten av Golgibandet, t.ex. Golgi-stressreaktioner. Golgi i alla cellinjer med knockout av COG-underenhet uppvisar måttliga till allvarliga förändringar i morfologin enligt EM, i samband med förlust av bandet, utvidgade cisterner och i vissa fall upplösning av ministaplarna. Tillämpningen av EM var grundläggande för att definiera de morfologiska förändringarna (Blackburn och Lupashin, 2016).
Neurodegenerativa sjukdomar
Golgis status i neurodegenerativa sjukdomar har nyligen fått stor uppmärksamhet (figur 1B). Förlust av Golgibandet är ett vanligt inslag i många neurodegenerativa sjukdomar, inklusive Alzheimers sjukdom, Huntingtons sjukdom, amyotrofisk lateralskleros och Parkinsons sjukdom (Gonatas et al., 2006; Haase och Rabouille, 2015; Rabouille och Haase, 2015; Sundaramoorthy et al., 2015). Det är mycket troligt att störningarna i Golgiarkitekturen i dessa sjukdomar bidrar till de patologiska processerna. I de flesta fall har den exakta morfologiska strukturen hos Golgifragmenten i dessa neurodegenerativa sjukdomar inte definierats. Två experimentella system har dock nyligen undersökt förändringar i Golgistrukturen och neuronal degeneration i viss detalj. För det första visades villkorlig knock-out av GM130, ett strukturellt golgin som reglerar Golgibandet, i det centrala nervsystemet orsaka Golgifragmentering, atrofi av dendriter och neuronal degeneration hos möss (Liu et al., 2017). EM-analys av GM130 KO Purkinjecellerna visade en minskning av Golgi cisternernas längd och stapling och dessutom saknades de typiska Golgi dendritutposterna i dessa GM130 -/- Purkinjeceller (Liu et al., 2017). I en andra studie visade hippocampala neuroner från möss transgena för den svenska mutationen av amyloid prekursorprotein (APP) och en muterad presenilin 1-underenhet av γ-sekretas, där båda mutationerna är förknippade med tidig Alzheimers sjukdom, omfattande Golgi-fragmentering genom optisk mikroskopi (Joshi et al., 2014). Kvantitativ EM av neuroner i dessa möss visade en minskning av antalet och längden på cisternerna i staplarna jämfört med neuroner från vildtypmöss. Dessutom var cisternerna svullna. Förändringarna i Golgi-morfologin i dessa primära neuroner visades vara direkt kopplade till den förhöjda nivån av amyloid-β-produktion. Primära neuroner som behandlats med syntetiskt amyloid-β uppvisade också en liknande fragmentering av Golgi samt en ökning av tubulovesikulära strukturer i samband med Golgi-cisternerna jämfört med obehandlade celler. Förlusten av Golgibandet berodde på fosforylering av GRASP65, ett Golgistrukturprotein som spelar en nyckelroll i nedmonteringen av Golgibandet och staplarna i mitos (Joshi et al., 2014). En jämförelse av dessa två studier ovan är informativ eftersom de vägar som medierar förändringarna i Golgimorfologin skiljer sig åt i båda fallen vilket leder till skillnader i morfologin hos Golgi-”fragmenten”. Man måste ta hänsyn till hur dessa olika vägar som påverkar Golgi-morfologin påverkar reaktionerna nedströms.
mTOR-signalering
Vårt labb har etablerat ett experimentellt tillvägagångssätt för att störa balansen mellan Golgibandet och Golgi-ministacken genom att modulera dosen av GCC88, en golgin som finns vid TGN. Denna strategi gjorde det möjligt att etablera en stabil cellinje, HeLa-B6, som saknar Golgiband. Vi har visat att GCC88 reglerar balansen mellan Golgiband och ministackar genom en aktinberoende process (Makhoul et al., 2019) och identifierat intersectin-1 (ITSN1), en guaninnukleotidutbytesfaktor för cdc42 (Hussain et al., 2001), som en interaktör till GCC88 som är ansvarig för förlusten av Golgibandet (Makhoul et al., 2019). Analyser av HeLa B6-celler, som saknar Golgiband, visade minskad mTOR-aktivitet och en associerad ökning av autofagosombiogenesen (Gosavi et al., 2018). mTOR är en av de viktigaste signalvägarna i eukaryota celler och är känd som en negativ regulator av autofagi (Wullschleger et al., 2006). Därför har balansen mellan Golgistaplar och Golgiband en direkt effekt på mTORC1-banan. Användningen av cis- och trans-fackspecifika markörer och EM-tomografi var avgörande för att avslöja de morfologiska förändringarna i Golgibandet.
Inflammation
Inflammasomerna i det medfödda immunförsvaret fungerar som en ställningen för caspase 1-beroende aktivering av proinflammatoriska cytokiner (Broz och Dixit, 2016). NLRP3 (nucleotide-binding domain, leucine-rich-containing family, pyrin domain-containing-3) är en mångsidig inflammasom som kan aktiveras av en rad mikrobiella och icke-mikrobiella stimuli vilket resulterar i utsöndring av proinflammatoriska cytokiner interleukin 1β (IL-1β) och interleukin 18 (IL-18) och programmerad celldöd genom pyroptos. En nyligen genomförd studie har visat att aktiveringen av det cytosoliska NLRP3 genom stimuli involverar rekrytering av NLRP3 till spridda TGN-membran för att underlätta NLRP3-ställningars sammansättning (Chen och Chen, 2018). Den spridda TGN, men inte de underliggande andra kompartmenten, rekryterar specifikt NLRP3, via PI4P, för att montera nedströmsadaptorkomplexet ASC som genomgår polymerisering i den perikärniga regionen innan det rekryterar caspase-1 för att aktivera nedströms signalväg (Chen och Chen, 2018). Därför visar detta viktiga fynd att moduleringen av arkitekturen i TGN selektivt, är kritisk i aktiveringen av denna väg. Användningen av fackspecifika markörer (TGN och cis-Golgi) tillsammans med optisk och EM-analys var avgörande för att avslöja de morfologiska förändringarna i Golgibandet.
Slutsatser
Den exakta arkitekturen av Golgimorfologin definieras av optisk mikroskopi med hög upplösning och av EM. Införandet av denna information i framtida studier på fältet kommer att ge en avsevärd insikt i Golgis dynamik, vägarna för störning av bandstrukturen och de funktionella konsekvenserna som är förknippade med dessa olika vägar.
Sammanfattningsvis föreslår vi att användningen av begreppet ”fragmenterad Golgi” är otillräcklig för att beskriva Golgistrukturer som är förknippade med många behandlingar och tillstånd, och skillnaderna mellan dessa Golgistrukturer är troligen relevanta rent fysiologiskt. Med tanke på Golgiapparatens dynamiska natur är det möjligt att det kan finnas en balans mellan olika morfologiska tillstånd hos Golgi vid varje given tidpunkt, dvs. mini-stackar och bandstrukturer. Att förstå den dynamiska balansen mellan de olika Golgi-morfologierna i molekylär detalj är avgörande för en fullständig förståelse av denna organell under normala cellprocesser och även under patologiska förhållanden. Det kommer att bli fascinerande att se vad som utvecklas när vi lär oss mer om de cellkännande funktionerna hos denna komplexa organell och förhållandet mellan dessa funktioner och Golgi-strukturer.
Datatillgänglighet
Alla datamängder som analyserats för den här studien ingår i manuskriptet och de kompletterande filerna.
Författarbidrag
Alla angivna författare har gjort ett väsentligt, direkt och intellektuellt bidrag till arbetet och godkänt det för publicering.
Finansiering
Detta arbete stöddes av finansiering från Australian Research Council (DP160102394).
Intressekonfliktförklaring
Författarna förklarar att forskningen utfördes i avsaknad av kommersiella eller finansiella relationer som skulle kunna tolkas som en potentiell intressekonflikt.
Abkortningar
GM130, cis-Golgi matrix protein; GMAP210, Golgi microtubule associated protein; GOLPH3, Golgi phosphoprotein 3; GRASP, Golgi reassembly stacking protein; MTOC, microtubule organizing center; MTOC, microtubule organizing center; mTOR, mechanistic target of rapamycin; PI4P, phosphatidylinositol-4-phosphate; TGN, trans-Golgi network.
Abdel Rahman, A. M., Ryczko, M., Nakano, M., Pawling, J., Rodrigues, T., Johswich, A., et al. (2015). Golgi N-glykanförgrenade N-acetylglukosaminyltransferaser I, V och VI främjar näringsupptag och metabolism. Glycobiology 25, 225-240. doi: 10.1093/glycob/cwu105
PubMed Abstract | CrossRef Full Text | Google Scholar
Blackburn, J. B. och Lupashin, V. V. (2016). Skapa knockouts av konserverade oligomeriska golgi-komplexunderenheter med hjälp av CRISPR-medierad genredigering parat med en urvalsstrategi baserad på glykosyleringsdefekter som är associerade med nedsatt COG-komplexfunktion. Methods Mol. Biol. 1496, 145-161. doi: 10.1007/978-1-4939-6463-5_12
PubMed Abstract | CrossRef Full Text | Google Scholar
Boncompain, G., and Perez, F. (2013). De många vägarna för Golgi-beroende trafikering. Histochem. Cell Biol. 140, 251-260. doi: 10.1007/s00418-013-1124-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Broz, P., and Dixit, V. M. (2016). Inflammasomer: mekanism för sammansättning, reglering och signalering. Nat. Rev. Immunol. 16, 407-420. doi: 10.1038/nri.2016.58
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, J. och Chen, Z. J. (2018). PtdIns4P på spridda trans-Golgi-nätverk medierar NLRP3-inflammasomaktivering. Nature 564, 71-76. doi: 10.1038/s41586-018-0761-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Chia, J., Goh, G., Racine, V., Ng, S., Kumar, P. och Bard, F. (2012). RNAi-screening avslöjar ett stort signalnätverk som kontrollerar Golgiapparaten i mänskliga celler. Mol. Syst. Biol. 8:629. doi: 10.1038/msb.2012.59
PubMed Abstract | CrossRef Full Text | Google Scholar
Corda, D., Barretta, M. L., Cervigni, R. I., and Colanzi, A. (2012). Golgikomplexfragmentering vid G2/M-övergång: en organellbaserad cellcykelkontrollpunkt. IUBMB Life 64, 661-670. doi: 10.1002/iub.1054
PubMed Abstract | CrossRef Full Text | Google Scholar
De Matteis, M. A., Mironov, A. A., and Beznoussenko, G. V. (2008). Golgibandet och Golgins funktion. New York, NY: Springer-Verlag/Wein.
Google Scholar
Dippold, H. C., Ng, M. M., Farber-Katz, S. E., Lee, S. K., Kerr, M. L., Peterman, M. C., et al. (2009). GOLPH3 överbryggar fosfatidylinositol-4-fosfat och aktomyosin för att sträcka ut och forma Golgi för att främja knoppbildning. Cell 139, 337-351. doi: 10.1016/j.cell.2009.07.052
PubMed Abstract | CrossRef Full Text | Google Scholar
Efimov, A., Kharitonov, A., Efimova, N., Loncarek, J., Miller, P. M., Andreyeva, N., et al. (2007). Asymmetrisk CLASP-beroende kärnbildning av icke-centrosomala mikrotubuli vid trans-Golgi-nätverket. Dev. Cell 12, 917-930. doi: 10.1016/j.devcel.2007.04.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Farber-Katz, S. E., Dippold, H. C., Buschman, M. D., Peterman, M. C., Xing, M., Noakes, C. J., et al. (2014). DNA-skador utlöser Golgispridning via DNA-PK och GOLPH3. Cell 156, 413-427. doi: 10.1016/j.cell.2013.12.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Farhan, H., and Rabouille, C. (2011). Signalering till och från den sekretoriska vägen. J. Cell Sci. 124, 171-180. doi: 10.1242/jcs.076455
PubMed Abstract | CrossRef Full Text | Google Scholar
Farhan, H., Wendeler, M. W., Mitrovic, S., Fava, E., Silberberg, Y., Sharan, R., et al. (2010). MAPK-signalering till den tidiga sekretoriska vägen avslöjad genom funktionell screening av kinaser/fosfataser. J. Cell Biol. 189, 997-1011. doi: 10.1083/jcb.200912082
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferraro, F., Kriston-Vizi, J., Metcalf, D. J., Martin-Martin, B., Freeman, J., Burden, J. J., et al. (2014). En Golgi-baserad kontroll av organellstorlek i två nivåer ligger till grund för endotelcellernas funktionella plasticitet. Dev. Cell 29, 292-304. doi: 10.1016/j.devcel.2014.03.021
PubMed Abstract | CrossRef Full Text | Google Scholar
Gonatas, N. K., Stieber, A. och Gonatas, J. O. (2006). Fragmentering av Golgiapparaten vid neurodegenerativa sjukdomar och celldöd. J. Neurol. Sci. 246, 21-30. doi: 10.1016/j.jns.2006.01.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Gosavi, P., and Gleeson, P. A. (2017). Funktionen hos Golgis bandstruktur- En bestående mytologi utvecklas! Bioessays 39:1700063. doi: 10.1002/bies.201700063
PubMed Abstract | CrossRef Full Text | Google Scholar
Gosavi, P., Houghton, F. J., Mcmillan, P. J., Hanssen, E. och Gleeson, P. A. (2018). Golgibandet i däggdjursceller reglerar autofagi negativt genom att modulera mTOR-aktiviteten. J. Cell Sci. 131:jcs211987. doi: 10.1242/jcs.211987
PubMed Abstract | CrossRef Full Text | Google Scholar
Gunn, P. A., Gliddon, B. L., Londrigan, S. L., Lew, A. M., Van Driel, I. R. och Gleeson, P. A. (2011). Golgiapparaten i de endomembranrika gastriska parietalcellerna existerar som funktionella stabila ministackar spridda i hela cytoplasman. Biol. Cell 103, 559-572. doi: 10.1042/BC20110074
PubMed Abstract | CrossRef Full Text | Google Scholar
Haase, G., and Rabouille, C. (2015). Golgifragmentering i ALS motorneuroner. Nya mekanismer som riktar in sig på mikrotubuli, tethers och transportvesiklar. Front. Neurosci. 9:448. doi: 10.3389/fnins.2015.00448
PubMed Abstract | CrossRef Full Text | Google Scholar
Hussain, N. K., Jenna, S., Glogauer, M., Quinn, C. C., Wasiak, S., Guipponi, M., et al. (2001). Det endocytiska proteinet intersectin-l reglerar aktinsammansättningen via Cdc42 och N-WASP. Nat. Cell Biol. 3, 927-932. doi: 10.1038/ncbb1001-927
PubMed Abstract | CrossRef Full Text | Google Scholar
Joshi, G., Chi, Y., Huang, Z. och Wang, Y. (2014). Abeta-inducerad Golgi-fragmentering vid Alzheimers sjukdom ökar Abeta-produktionen. Proc. Natl. Acad. Sci. U.S.A. 111, E1230-E1239. doi: 10.1073/pnas.1320192111
PubMed Abstract | CrossRef Full Text | Google Scholar
Kreft, M. E., Di Giandomenico, D., Beznoussenko, G. V., Resnik, N., Mironov, A. A. och Jezernik, K. (2010). Fragmentering av Golgiapparaten som en mekanism som är ansvarig för enhetlig leverans av uroplakiner till det apikala plasmamembranet hos uroepitelceller. Biol. Cell 102, 593-607. doi: 10.1042/bc20100024
PubMed Abstract | CrossRef Full Text | Google Scholar
Kupfer, A., Dennert, G., and Singer, S. J. (1983). Polarisation av Golgiapparaten och det mikrotubuli-organiserande centret inom klonade naturliga mördarceller som är bundna till sina mål. Proc. Natl. Acad. Sci. U.S.A. 80, 7224-7228. doi: 10.1073/pnas.80.23.7224
PubMed Abstract | CrossRef Full Text | Google Scholar
Lamb, C. A., Yoshimori, T. och Tooze, S. A. (2013). Autofagosomen: ursprung okänt, biogenesekomplex. Nat. Rev. Mol. Cell Biol. 14, 759-774. doi: 10.1038/nrm3696
PubMed Abstract | CrossRef Full Text | Google Scholar
Lasiecka, Z. M., and Winckler, B. (2011). Mekanismer för polariserad membrantrafik i neuroner – med fokus på endosomer. Mol. Cell. Neurosci. 48, 278-287. doi: 10.1016/j.mcn.2011.06.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Lavieu, G., Dunlop, M. H., Lerich, A., Zheng, H., Bottanelli, F., and Rothman, J. E. (2014). Golgis bandstruktur underlättar anterograd transport av stora laster. Mol. Biol. Cell 25, 3028-3036. doi: 10.1091/mbc.E14-04-093
PubMed Abstract | CrossRef Full Text | Google Scholar
Lazaro-Dieguez, F., Jimenez, N., Barth, H., Koster, A. J., Renau-Piqueras, J., Llopis, J. L. L. et al. (2006). Aktinfilament är involverade i upprätthållandet av Golgi cisternae morfologi och intra-Golgi pH. Cell Motil. Cytoskeleton 63, 778-791. doi: 10.1002/cm.20161
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, C., Mei, M., Li, Q., Roboti, P., Pang, Q., Ying, Z., et al. (2017). Förlust av golgin GM130 orsakar Golgi-störning, förlust av Purkinje neuron och ataxi hos möss. Proc. Natl. Acad. Sci. U.S.A. 114, 346-351. doi: 10.1073/pnas.1608576114
PubMed Abstract | CrossRef Full Text | Google Scholar
Lu, Z., Joseph, D., Bugnard, E., Zaal, K. J. och Ralston, E. (2001). Golgikomplexets omorganisering under muskeldifferentiering: visualisering i levande celler och mekanism. Mol. Biol. Cell 12, 795-808. doi: 10.1091/mbc.12.4.795
PubMed Abstract | CrossRef Full Text | Google Scholar
Luini, A., and Parashuraman, S. (2016). Signalering vid Golgi: att känna av och kontrollera membranflödena. Curr. Opin. Cell Biol. 39, 37-42. doi: 10.1016/j.ceb.2016.01.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Makhoul, C., Gosavi, P., Duffield, R., Delbridge, B., Williamson, N. A., and Gleeson, P. A. (2019). Intersectin-1 interagerar med golgin GCC88 för att koppla ihop aktinnätverket och Golgiarkitekturen. Mol. Biol. Cell 30, 370-386. doi: 10.1091/mbc.E18-05-0313
PubMed Abstract | CrossRef Full Text | Google Scholar
Makhoul, C., Gosavi, P. och Gleeson, P. A. (2018). Golgiarkitekturen och cellkännedom. Biochem. Soc. Trans. 46, 1063-1072. doi: 10.1042/BST20180323
PubMed Abstract | CrossRef Full Text | Google Scholar
Mayinger, P. (2011). Signalering vid Golgi. Cold Spring Harb. Perspect. Biol. 3:a005314.
Google Scholar
Millarte, V., Boncompain, G., Tillmann, K., Perez, F., Sztul, E. och Farhan, H. (2015). Fosfolipas C gamma1 reglerar tidig sekretorisk trafikering och cellmigration via interaktion med p115. Mol. Biol. Cell 26, 2263-2278. doi: 10.1091/mbc.E15-03-0178
PubMed Abstract | CrossRef Full Text | Google Scholar
Millarte, V. och Farhan, H. (2012). Golgi i cellmigration: reglering genom signaltransduktion och dess implikationer för metastasering av cancerceller. ScientificWorldJournal 2012:498278. doi: 10.1100/2012/498278
PubMed Abstract | CrossRef Full Text | Google Scholar
Miller, V. J., and Ungar, D. (2012). Re’COG’nition at the Golgi. Traffic 13, 891-897. doi: 10.1111/j.1600-0854.2012.01338.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Petrosyan, A. (2015). Onco-Golgi: är fragmentering en port till cancerutveckling? Biochem. Mol. Biol. J. 1:16.
PubMed Abstract | Google Scholar
Puthenveedu, M. A., Bachert, C., Puri, S., Lanni, F. och Linstedt, A. D. (2006). GM130- och GRASP65-beroende lateral cisternal fusion möjliggör en jämn fördelning av Golgi-enzymer. Nat. Cell Biol. 8, 238-248. doi: 10.1038/ncb1366
PubMed Abstract | CrossRef Full Text | Google Scholar
Rabouille, C. och Haase, G. (2015). Editorial: Golgi-patologi vid neurodegenerativa sjukdomar. Front. Neurosci. 9:489. doi: 10.3389/fnins.2015.00489
PubMed Abstract | CrossRef Full Text | Google Scholar
Rabouille, C., och Kondylis, V. (2007). Golgi ribbon unlinking: en organellbaserad G2/M-kontrollpunkt. Cell Cycle 6, 2723-2729. doi: 10.4161/cc.6.22.4896
PubMed Abstract | CrossRef Full Text | Google Scholar
Rambourg, A. och Clermont, Y. (1997). Tredimensionell struktur för Golgiapparaten i däggdjursceller. Basel: Birkhauser.
Google Scholar
Sanders, A. A., and Kaverina, I. (2015). Kärnbildning och dynamik hos Golgi-deriverade mikrotubuli. Front. Neurosci. 9:431. doi: 10.3389/fnins.2015.00431
CrossRef Full Text | Google Scholar
Sasaki, K. och Yoshida, H. (2015). Organell autoreglering-stressreaktioner i ER, Golgi, mitokondrier och lysosom. J. Biochem. 157, 185-195. doi: 10.1093/jb/mvvv010
PubMed Abstract | CrossRef Full Text | Google Scholar
Scott, K. L., Kabbarah, O., Liang, M. C., Ivanova, E., Anagnostou, V., Wu, J., et al. (2009). GOLPH3 modulerar mTOR-signalering och rapamycin-känslighet i cancer. Nature 459, 1085-1090. doi: 10.1038/nature08109
PubMed Abstract | CrossRef Full Text | Google Scholar
Serebrenik, Y. V., Hellerschmied, D., Toure, M., Lopez-Giraldez, F., Brookner, D., and Crews, C. M. (2018). Riktad proteinavveckling avslöjar ett Golgi-specifikt transkriptionellt stressrespons. Mol. Biol. Cell 29, 1284-1298. doi: 10.1091/mbc.E17-11-0693
PubMed Abstract | CrossRef Full Text | Google Scholar
Sundaramoorthy, V., Sultana, J. M. och Atkin, J. D. (2015). Golgi-fragmentering vid amyotrofisk lateralskleros, en översikt över möjliga utlösare och konsekvenser. Front. Neurosci. 9:400. doi: 10.3389/fnins.2015.00400
PubMed Abstract | CrossRef Full Text | Google Scholar
Wei, J. H., and Seemann, J. (2010). Att avslöja Golgibandet. Traffic 11, 1391-1400. doi: 10.1111/j.1600-0854.2010.01114.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Wei, J. H., and Seemann, J. (2017). Golgibandets nedmontering under mitos, differentiering och sjukdomsprogression. Curr. Opin. Cell Biol. 47, 43-51. doi: 10.1016/j.ceb.2017.03.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, J., De Heus, C., Liu, Q., Bouchet, B. P., Noordstra, I., Jiang, K., et al. (2016). Molekylär väg för organisering av mikrotubuli vid Golgiapparaten. Dev. Cell 39, 44-60. doi: 10.1016/j.devcel.2016.08.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Wullschleger, S., Loewith, R., and Hall, M. N. (2006). TOR-signalering i tillväxt och metabolism. Cell 124, 471-484.
Google Scholar
Yamamamoto, H., Kakuta, S., Watanabe, T. M., Kitamura, A., Sekito, T., Kondo-Kakuta, C., et al. (2012). Atg9-vesiklar är en viktig membrankälla under tidiga steg av autofagosombildning. J. Cell Biol. 198, 219-233. doi: 10.1083/jcb.201202061
PubMed Abstract | CrossRef Full Text | Google Scholar
Zappa, F., Failli, M., and De Matteis, M. A. (2018). Golgikomplexet i sjukdom och terapi. Curr. Opin. Cell Biol. 50, 102-116. doi: 10.1016/j.ceb.2018.03.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply