Atlas over plante- og dyrehistologi
1. Morfologi
2. Livscyklus
3. Funktioner
– Fordøjelse
– Beskyttelse
Enterocytter er søjleformede celler, der udgør det meste af tarmens epitel (figur 1 og 2). De er mere talrige i tyndtarmen end i tyktarmen og blindtarmen. I tyndtarmen udgør mængden af enterocytter ca. 80 % af det samlede antal tarmenterocytter. Enterocytternes hovedfunktion er at optage molekyler fra tarmens lumen og transportere dem til det indre bindevæv og blodkar. Det skal bemærkes, at tarmepitelet er den største overflade i kroppen, der er i kontakt med det ydre miljø (tarmens lumen er uden for kroppens væv).


Morfologi
Enterocytter har mikrovilli i den apikale (frie) overflade (figur 3), mange mitokondrier i den basale del og et veludviklet Golgi-apparat og endoplasmatisk reticulum. Tarmepitelets mekaniske integritet, dvs. samhørigheden mellem enterocytter og manglen på intercelulære passager, afhænger af celleadhæsionskomplekserne mellem tilstødende enterocytter. Der findes tight junctions og adherente junctions tæt på enterocyttens apikale domæne. Der findes desmosomer i de latero-basale membraner. Gap junctions er også observeret i de latero-basale membraner. Der findes hemidesmosomer i enterocytternes basalmembran, som forankrer cellen til basalmembranen.
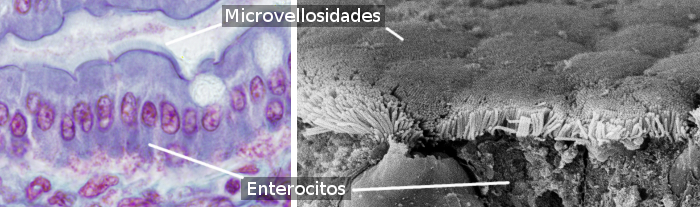
Enterocytter har to domæner: apikale og basolaterale. Det er derfor, at de er polariserede celler. Polariseringen produceres af aktiviteten af et velordnet cytoskelet og en veludviklet vesikulær trafik, der distribuerede molekyler differentielt mellem de to domæner. Tight junctions forhindrer lateral diffusion af molekyler mellem de to domæner og er således med til at opretholde polariteten. Enterocytter viser en meget pakket mikrovilly i det apikale domæne, som øger membranoverfladen ca. 100 gange (figur 3). I de apikale membraner er der mange transportører, som er portene for, at molekyler, der stammer fra fordøjelsen, kan komme ind i enterocytten. I de basolateale membraner findes der andre transportører, som gør det muligt for disse molekyler at forlade enterocytten og nå blodkarrene. Denne adskilte fordeling af receptorer er resultatet af vesikulær trafikering.
Livscyklus
Tarmlumen er fyldt med molekyler, der er potentielt giftige for enterocytterne. I stedet for at reparere hver enkelt fornærmelse dør beskadigede og gamle enterocytter ved apoptose,bliver derefter udstødt fra epithellaget og løbende erstattet af nye. Tyndtarmens slimhinde er stærkt foldet og danner mange udposninger eller villi og indposninger eller kirtler, kendt som Lieberkühn-krypter. I tyktarmen findes der Lieberkühn-krypter. Enterocytternes livscyklus begynder i den nederste del af Lieberkühn-kirtlerne og slutter i spidserne af tyndtarmens villi eller i tyktarmens epiteloverflade. Livet for en enterocyt er ca. 2 til 5 dage langt. Hos mennesker fornyer tarmepitelet sig hver 4. til 5. dag.
Enterocytter differentierer sig fra voksne stamceller, der findes i bunden af Lieberkühn-kirtlerne (figur 4). I første omgang bliver de voksne stamceller til forbigående forstærkende celler (progenitorceller), som befinder sig lidt længere væk fra den voksne stamcelles niche. Transiente forstærkende celler deler sig 4 til 6 gange for at øge progenitorpopulationen og differentierer derefter i de forskellige celletyper, der findes i tarmepitelet. De fleste af dem bliver til enterocytter, men også globetceller, M-celler og de andre celletyper. Nye enterocytter bevæger sig gradvist mod spidserne af villierne eller mod den luminale epiteloverflade. Når de når disse positioner, dør de og bliver udstødt fra epitelet. Ekstrudering indebærer både mekanisk pres og tab af adhæsionsforbindelse med nabocellerne. Nogle celler dør ved apoptose og bliver derefter udstødt fra epitelet. Det vides ikke, hvad mekanismen er for flytning af enterocytter fra kirtlerne til epiteloverfladen. Molekylære komponenter i basallaminaen er forskellige langs enterocytvejen, og man mener, at de kan bidrage til bevægelsen. Man har også ment, at kosten er involveret i dynamikken i enterocytternes liv.

Funktioner
Fordøjelse
Den vigtigste funktion for enterocytter er at optage næringsstoffer efter mave- og enzymatisk fordøjelse af maden. Enterocytter kan bruge glutamat og glutamin samt fedtsyrer og glukose som energiforsyning. Dette er besynderligt, fordi alle typer næringsstoffer går gennem enterocytter. De hjælper også med fordøjelsen ved at udskille enzymer, der nedbryder peptider og disacarider. Glykokalyxet i enterocyttens apikale domæne danner et ca. 400 til 500 nm tykt lag, nogle gange endda 1 µm tykt. Nogle enzymer, der deltager i fordøjelsen, er forankret i dette glycocalyx. Enterocytterne udvælger og opfanger således ikke kun stoffer fra fordøjelsen, men de forarbejder også nogle af dem. Man siger faktisk, at der er to fordøjelsesfaser, hvoraf den ene foregår i tarmens lumen og udføres af pancreasenzymer, mens den anden foregår på enterocytternes overflade og udføres af andre fordøjelsesenzymer. Det meste af næringsstofoptagelsen sker i tyndtarmens enterocytter, mens tyktarmens enterocytter hovedsageligt optager vand. Desuden frigives der små vesikler fra spidserne af mikrovilli, der indeholder enzymer som f.eks. fosfataser, som kan have en forsvarsfunktion mod patogener.
Stoffer, der stammer fra fordøjelsen, skal krydse tarmepitelet for at nå ud i blodbanen. Det kan ske ad flere veje: transcellulært, endocytose/transcytose og paracellulært.
Transcellulær. De fleste molekyler krydser tarmens epithellag og går gennem enterocytter. Først krydser de den apikale membran og derefter den basolaterale membran. Molekyler kan flyttes ved fri passiv diffusion, ved faciliteret passiv diffusion eller ved aktiv transport. Ved fri passiv diffusion krydser molekylerne membranerne uden nogen hjælp, mens molekylerne ved faciliteret og aktiv transport skal genkendes af specifikke transportører, der er indsat i membranerne. Vand, ethanol og mange lipider passerer gennem enterocytter ved fri passiv diffusion. Glukose, nogle lipider og aminosyrer kommer ind i enterocytterne ved hjælp af faciliteret passiv transport eller ved aktiv transport.
Det apikale domæne af cellen bærer et sæt proteiner til optagelse af stoffer, mens de latero-basale membraner har andre transmembrantransportere til at få molekyler ud af enterocytten.
Absorptionsevnen afhænger af enterocyttens differentieringsstadie, hvilket betyder en række natriummembranpumper, der er mere talrige, efterhånden som enterocytterne bevæger sig længere væk fra kryptens dybde. Således sker størstedelen af absorptionen af sukkerstoffer og aminosyrer i den øverste tredjedel af tyndtarmens villi og nær overfladen af tyktarmen. F.eks. stiger hydrolaseaktiviteten, efterhånden som enterocytterne bevæger sig væk fra stamcelle-nicherne (de dybe dele af krypterne).
Absorptionen af glukose er et eksempel på en typisk absorptionsmekanisme. Glukose krydser enterocyttens apikale membran ved hjælp af samtransport koblet til en natriumgradient. Denne gradient genereres af natrium/kalium-pumper, og kan indtaste glukose i enterocytten mod glukosekoncentrationsgradienten. Natriumglukosetransporteren (SGLT) muliggør denne samtransport. På den anden side findes GLUT2-transporteren i de laterobasale membraner, som translokaliserer glukose fra cytoplasmaet til det intercellulære rum. SGLT øger således glukosekoncentrationen i enterocytcytoplasmaet, og GLUT2 tillader glukose at slippe ud i retning af blodkarrene. Den præcise placering af de to transportører skaber en glukoseflux gennem enterocytterne fra tarmens lumen til blodkarrene.
Fedt er blandt de mest energirige stoffer, ud over at det er nødvendigt for cellemembraner. Størstedelen af det måltidsfedt, der optages fra tarmen, er i triacylglycerolform, selv om andre typer også kan optages, f.eks. kolesterol. Først nedbryder enzymer fra bugspytkirtlen måltidsfedt i tarmens lumen, og triacylglyceroler omdannes til fedtsyrer og monoacylglyceroler (figur 5). Disse molekyler danner sammen med kolesterol, fedtopløselige vitaminer og fosfolipider micelaer, som er små lipiddråber, der er opløselige i vand takket være galdesyrerne. Micellerne kan frit krydse den apikale membran i enterocytten. CD36 y FABP (fedtsyrebindende protein)-transportørerne s 3 gør det muligt for visse fedtstoffer at krydse enterocyttens apikale membran ved hjælp af en lempelig passiv transport. Hovedparten af fedttransporten foregår som miceller, mens membrantransportørerne ligner et sensorisk system til at opdage fedtsyrer s 3 med lange kæder i tarmen. Kolesterol, som enkeltmolekyle, kan også transporteres af NPC1L1 (Niemann-Pick C1-like 1)-transportøren, som overfører kolesterol fra tarmens lumen til enterocytcytoplasmaet.

Når de er i enterocytten, bindes fedtstoffer sammen med nogle proteiner og flyttes til det endoplasmatiske reticulum, hvor triacylglyceroler syntetiseres igen. De kombineres med nogle proteiner for at danne præ-chylomikroner. ApoB-protein syntetiseres i det endoplasmatiske reticulum. ApoB danner sammen med MTP (microsome tranfer protein) og fedtsyrer den primordiale lipoproteinpartikel. I det glatte endoplasmatiske reticulum er ApoB erstattet af Apo A-IV-protein. Alle disse komponenter udgør præ-chylomikroner, som indgår i vesikler og flyttes til Golgi-apparatet. Her bliver præ-chylomikroner forenet til chylomikroner, som indgår i exocytiske vesikler og frigives i det laterobasale område af enterocytten. På denne måde kan chylomikronerne nå frem til blod- og lymfekar. Chylomikroner er lipoproteiner med et legeme, der hovedsagelig består af triacylglyceroler og en belægning af phospholipider, kolesterol og apolipoproteiner. De spiller en vigtig rolle i transporten af triacylglyceroler og fedtopløselige vitaminer.
Uden for enterocytten kommer chylomikroner ind i lymfekarrene i tarmvilli og derefter i de lymfatiske myenteriske plexus plexus myenterica, hvorfra de passerer til blodkarrene. Ud over chylomikroner er fedt også pakket ind i lipoproteiner med meget lav densitet (VLDL), som også eksocyttes fra enterocytter. Fedt kan også lagres i enterocytternes lipiddråber.
Enterocytter får også jern efter fordøjelsen. Jern er vigtigt for mange proteiner, f.eks. hæmoglobin, og det kan findes i fødevarerne som en del af hæmogrupper eller bundet til ferritin (i animalsk kød) (figur 6). Jern fra fordøjelsen kommer ind i kroppen gennem DMT1-transportøren (divalent metal transporter 1), som findes i enterocytternes apikale membraner. Transgene mus, der mangler denne transportør, udvikler alvorlig anæmi. DMT1 er en co-transporter, der er koblet til en protongradient. Protongradienten genereres af Na+/K+-pumpen, som også findes i enterocytternes apikale membran. DMT1 transporterer Fe2+, men det meste jern fra måltid er Fe3+-form. Jernreduktion (Fe3+ til Fe2+) udføres af et reduktaseenzym, der er placeret i enterocyttens apikale overflade. Det jern, der er bundet til hæmogrupper, synes at blive optaget ved receptormedieret endocytose. Når de er inde i enterocytten, nedbrydes hæmogruppen, og jernet kan komme ind i cytosolen.

Uanset indgangsvejen synes jernets bevægelse mod de basolaterale membraner, når det først er i cytosolen, at være medieret af metallochaperonproteiner. I de basolaterale membraner translokeres jern til det ekstracellulære rum af ferroportin-transporteren. Ferroportin optager Fe2+-formen. Ferritin er imidlertid det protein, der transporterer jern til portvenesystemet, og jern skal være i Fe3+ -form. Der findes ferro-oxidaser i de basolaterale membraner i enterocytterne, som muliggør omdannelsen fra Fe2+ til Fe3+. Jern kan lagres i enterocyttens cytosol bundet til ferritin.
Endocytose/transcytose. Molekyler som immunoglobuliner endocyttes ved receptormedieret endocytose og transporteres til andre membrandomæner ved transcytose. Vesikler dannes ved basen af mikrovilli, og de smelter senere sammen med endosomer. Immunglobulinerne indesluttes derefter i vesikler, der dannes i endosomer, og er målrettet mod de basolaterale domænemembraner. På denne måde undgår immunoglobulinerne den lysosomale nedbrydningsvej.
Paracellulært. Vand og ioner krydser epithelim ved hjælp af paracellulære veje.
Beskyttelse
Enterocytter danner en barriere, der afviser antigener, giftige molekyler og mikroorganismer og samtidig lader næringsstoffer passere. Enterocytter er i kontakt med mange mikroorganismer. Dem, der er residente mikroorganismer i tarmen, men som kan være farlige, hvis de når ind i det indre væv, og de ikke-residente patogener, der kommer med måltidet. Enterocytternes apikale overflade er dækket af et lag af slimhinder, der frigives af globetcellerne. Dette lag er sammensat af kulhydrater og har en tæt viskositet, der tillader diffusion af molekyler, men afviser celler og de største molekyler. Desuden viser enterocytmikrovillerne et veludviklet glykocalyx i de apikale spidser af hver mikrovill, som fungerer som fysisk og elektrisk barriere, da det er fyldt med negative ladninger. Disse mikrovilli vanskeliggør en direkte fysisk kontakt mellem mikroorganismer og enterocytmembranen. Men selv hvis de passerer disse to barrierer, skal mikroorganismerne overvinde mikrovilliernes transportmekanisme.
Muciner er stærkt glykosylerede proteiner, der findes i den apikale membran i enterocytter. De bidrager til det veludviklede glykocalyx. Muciner er transmembranproteiner, der er knyttet til cytoskelettet via deres cytosoliske domæne. MUC3, MUC12 og MUC17 er de hyppigst forekommende muciner. De indeholder omkring 5000 aminosyrer, og deres kulhydratkomponent kan strække sig op til 1 µm fra celleoverfladen. Muciner danner en fysisk barriere, som er vanskelig at passere for bakterier.
Enterocytter er i stand til at starte og regulere inflammatoriske processer ved at frigive flere chimokiner og cytokiner. De har også receptorer for disse molekyler. Enterocytter frigiver proinflammatoriske molekyler, der påvirker de immunceller, der findes i tarmslimhinden.
En anden mindre kendt beskyttelsesmekanisme er frigivelsen af vesikler fra enterocytternes apikale overflade. Actin og myosin, mikrovilliernes motoriske apparat, producerer mekaniske kræfter, der trækker membraner mod spidsen af hver mikrovillus. Membranansamlingen ender som vesikler, som frigives i tarmlumen. Disse vesikler indeholder en stor mængde alkalisk fosfatase, som er et kraftigt antipatogen middel ved at reducere lipopolysacharid-toksicitet og tarmbetændelse. Det forhindrer også bakteriernes fasthæftning til tarmepitelet og mindsker bakterieproliferationen. De vesikler, som enterocytterne frigiver, er en måde at sende antimikrobielle molekyler til områder langt væk fra epitelet på.
Bibliografi
Barker N. 2014. Voksne tarmstamceller: kritiske drivkræfter for epitelhjemostase og regeneration. Nature. 15: 19-33.
Giammanco A, Cefalù AB, Noto D, Noto D, Averna MR. 2015. Patofysiologien i produktionen af intestinale proteiner. Frontiers in physiology. 6: 61.
Knutson MD. 2014. Voksne tarmstamceller: kritiske drivere af epithelial homeostase og regeneration. Nature review in molecular cell biology. 15:19-33.
Knutson MD. 2017. Jerntransportproteiner: gateways af cellulær og systemisk jernhomøostase. Journal of biological chemistry Nature review in molecular cell biology. 292: 12735-12743.
Shifrin DA, McConell RE, Nambiar R, Higginbotham JN, Coffey RJ, Tyska MJ. 2012. Enterocytmikrovillus-afledte vesikler detoxicerer bakterielle produkter og regulerer epitel-mikrobielle interaktioner. Current biology. 22: 627-631.
Snoeck V, Goddeeries B, Cox E. 2005. Enterocytternes rolle i tarmens barrierefunktion og antigenoptagelse. Mikrober og infektion. 7: 997-1004.
Leave a Reply