Atlas der Pflanzen- und Tierhistologie
1. Morphologie
2. Lebenszyklus
3. Funktionen
– Verdauung
– Schutz
Enterozyten sind säulenförmige Zellen, die den größten Teil des Epithels des Darms bilden (Abbildungen 1 und 2). Sie kommen im Dünndarm häufiger vor als im Dickdarm und Blinddarm. Im Dünndarm beträgt die Anzahl der Enterozyten etwa 80 % der gesamten Enterozyten des Darms. Die Hauptfunktion der Enterozyten ist die Aufnahme von Molekülen aus dem Darmlumen und deren Transport zum inneren Bindegewebe und zu den Blutgefäßen. Es ist zu beachten, dass das Darmepithel die größere Oberfläche des Körpers ist, die mit der äußeren Umgebung in Kontakt steht (das Lumen des Darms ist außerhalb des Körpergewebes).


Morphologie
Enterozyten haben Mikrovilli an der apikalen (freien) Oberfläche (Abbildung 3), viele Mitochondrien im basalen Teil und einen gut entwickelten Golgi-Apparat und ein endoplasmatisches Reticulum. Die mechanische Integrität des Darmepithels, d. h. der Zusammenhalt zwischen den Enterozyten und das Fehlen von interzellulären Passagen, hängt von den Zelladhäsionskomplexen zwischen benachbarten Enterozyten ab. In der Nähe des apikalen Bereichs der Enterozyten gibt es tight junctions und adherent junctions. Desmosomen finden sich in den latero-basalen Membranen. Gap Junctions werden ebenfalls in den latero-basalen Membranen beobachtet. Hemidesmosomen befinden sich in der Basalmembran von Enterozyten und verankern die Zelle an der Basalmembran.
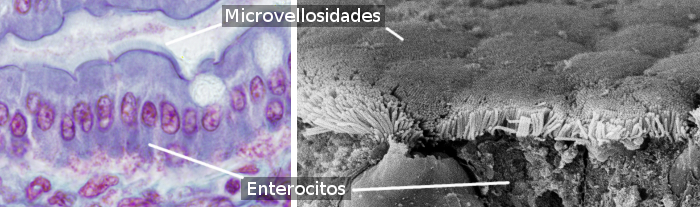
Enterozyten haben zwei Bereiche: apikal und basolateral. Deshalb sind sie polarisierte Zellen. Die Polarisierung wird durch die Aktivität eines gut geordneten Zytoskeletts und eines gut entwickelten vesikulären Verkehrs erzeugt, der Moleküle differenziert zwischen den beiden Bereichen verteilt. Tight Junctions verhindern die laterale Diffusion von Molekülen zwischen den beiden Domänen und tragen so zur Aufrechterhaltung der Polarität bei. Enterozyten weisen in der apikalen Domäne eine stark verpackte Mikrovilli auf, die die Membranoberfläche um das 100-fache vergrößern (Abbildung 3). In den apikalen Membranen befinden sich viele Transporter, die die Tore für die aus der Verdauung stammenden Moleküle sind, um in den Enterozyten zu gelangen. In den basolateralen Membranen gibt es andere Transporter, die dafür sorgen, dass diese Moleküle den Enterozyten verlassen und in die Blutgefäße gelangen. Diese segregierte Verteilung der Rezeptoren wird durch vesikulären Trafficking erzeugt.
Lebenszyklus
Das Darmlumen ist voller Moleküle, die für Enterozyten potenziell toxisch sind. Anstatt jede Verletzung zu reparieren, sterben geschädigte und alte Enterozyten durch Apoptose ab, werden dann aus der Epithelschicht ausgestoßen und kontinuierlich durch neue ersetzt. Die Dünndarmschleimhaut ist stark gefaltet und bildet viele Ausstülpungen oder Zotten und Einstülpungen oder Drüsen, die als Lieberkühn-Krypten bekannt sind. Im Dickdarm gibt es ebenfalls Lieberkühn-Krypten. Der Lebenszyklus der Enterozyten beginnt im unteren Teil der Lieberkühn-Drüsen und endet in den Zottenspitzen des Dünndarms oder in der Epitheloberfläche des Dickdarms. Das Leben eines Enterozyten ist etwa 2 bis 5 Tage lang. Beim Menschen wird das Darmepithel alle 4 bis 5 Tage erneuert.
Enterozyten differenzieren sich aus adulten Stammzellen, die sich im Boden der Lieberkühn-Drüsen befinden (Abbildung 4). Zunächst werden aus den adulten Stammzellen vorübergehend verstärkende Zellen (Vorläuferzellen), die sich etwas weiter von der Nische der adulten Stammzellen entfernt befinden. Transiente Amplifikationszellen teilen sich 4- bis 6-mal, um die Progenitorpopulation zu vergrößern, und differenzieren sich dann in die verschiedenen Zelltypen des Darmepithels. Die meisten von ihnen werden zu Enterozyten, aber auch zu Globettzellen, M-Zellen und anderen Zelltypen. Die neuen Enterozyten wandern nach und nach zu den Zottenspitzen oder zur luminalen Epitheloberfläche. Sobald sie diese Positionen erreicht haben, sterben sie ab und werden aus dem Epithel extrudiert. Zur Extrusion gehören sowohl mechanischer Druck als auch der Verlust der Adhäsionsverbindung mit den Nachbarzellen. Einige Zellen sterben durch Apoptose ab und werden dann aus dem Epithel ausgestoßen. Der Mechanismus für die Bewegung der Enterozyten von den Drüsen zur Epitheloberfläche ist nicht bekannt. Molekulare Komponenten der Basallamina unterscheiden sich entlang des Weges der Enterozyten, und es wird vermutet, dass sie zur Bewegung beitragen können. Es wird auch angenommen, dass die Ernährung an der Dynamik des Lebens der Enterozyten beteiligt ist.

Funktionen
Verdauung
Die Hauptfunktion der Enterozyten ist die Aufnahme von Nährstoffen nach der Magen- und enzymatischen Verdauung der Nahrung. Enterozyten können Glutamat und Glutamin, aber auch Fettsäuren und Glukose als Energiequelle nutzen. Das ist merkwürdig, weil alle Arten von Nährstoffen die Enterozyten durchlaufen. Sie helfen auch bei der Verdauung, indem sie Enzyme absondern, die Peptide und Disacaride abbauen. Die Glykokalyx der apikalen Domäne der Enterozyten bildet eine Schicht von etwa 400 bis 500 nm, manchmal sogar 1 µm Dicke. Einige Enzyme, die an der Verdauung beteiligt sind, sind in dieser Glykokalyx verankert. Die Enterozyten selektieren und fangen also nicht nur Stoffe aus der Verdauung ab, sondern verarbeiten auch einige von ihnen. Man sagt, dass es zwei Verdauungsphasen gibt, eine im Darmlumen, die von den Enzymen der Bauchspeicheldrüse durchgeführt wird, und eine andere an der Oberfläche der Enterozyten, die von anderen Verdauungsenzymen ausgeführt wird. Der größte Teil der Nährstoffaufnahme erfolgt durch die Enterozyten des Dünndarms, während die Enterozyten des Dickdarms hauptsächlich Wasser aufnehmen. Außerdem werden von den Spitzen der Mikrovilli kleine Bläschen freigesetzt, die Enzyme wie Phosphatasen enthalten, die möglicherweise eine Abwehrfunktion gegen Krankheitserreger haben.
Stoffe aus der Verdauung müssen das Darmepithel durchqueren, um in den Blutkreislauf zu gelangen. Dies kann auf verschiedenen Wegen geschehen: transzellulär, Endozytose/Transzytose und parazellulär.
Transzellulär. Die meisten Moleküle durchqueren die Epithelschicht des Darms, indem sie die Enterozyten passieren. Sie durchqueren zuerst die apikale und dann die basolaterale Membran. Die Moleküle können durch freie passive Diffusion, erleichterte passive Diffusion oder aktiven Transport bewegt werden. Bei der freien passiven Diffusion durchqueren die Moleküle die Membranen ohne jegliche Hilfe, während beim erleichterten und aktiven Transport die Moleküle von spezifischen Transportern, die in die Membranen eingebaut sind, erkannt werden müssen. Wasser, Ethanol und viele Lipide durchqueren Enterozyten durch freie passive Diffusion. Glucose, einige Lipide und Aminosäuren gelangen durch erleichterten passiven Transport oder durch aktiven Transport in die Enterozyten.
Der apikale Bereich der Zelle trägt eine Reihe von Proteinen für die Absorption von Substanzen, während die latero-basalen Membranen andere Transmembrantransporter für den Abtransport von Molekülen aus dem Enterozyten besitzen.
Die Absorptionsfähigkeit hängt vom Differenzierungsstadium des Enterozyten ab, was bedeutet, dass eine Reihe von Natriummembranpumpen vorhanden ist, die umso zahlreicher sind, je weiter sich die Enterozyten von der Tiefe der Krypten entfernen. So erfolgt die meiste Absorption von Zuckern und Aminosäuren im oberen Drittel der Dünndarmzotten und nahe der Oberfläche des Dickdarms. Die Hydrolaseaktivität nimmt zum Beispiel zu, wenn sich die Enterozyten von den Stammzellnischen (tiefe Teile der Krypten) entfernen.
Die Absorption von Glukose ist ein Beispiel für einen typischen Absorptionsmechanismus. Glukose durchquert die apikale Membran des Enterozyten durch Co-Transport, der an einen Natriumgradienten gekoppelt ist. Dieser Gradient wird durch Natrium-/Kaliumpumpen erzeugt und kann Glukose entgegen dem Glukosekonzentrationsgradienten in den Enterozyten transportieren. Der Natrium-Glukose-Transporter (SGLT) ermöglicht diesen Co-Transport. Andererseits befindet sich der GLUT2-Transporter in den laterobasalen Membranen, der Glukose aus dem Zytoplasma in den Interzellularraum verlagert. SGLT erhöht also die Glukosekonzentration im Zytoplasma der Enterozyten, während GLUT2 die Glukose in Richtung der Blutgefäße entweichen lässt. Die genaue Position der beiden Transporter bewirkt einen Glukosefluss durch die Enterozyten vom Darmlumen zu den Blutgefäßen.
Fett gehört zu den energiereichsten Stoffen und ist außerdem für die Zellmembranen notwendig. Der größte Teil des aus dem Darm aufgenommenen Nahrungsfetts liegt in Form von Triacylglycerin vor, aber auch andere Arten wie Cholesterin können aufgenommen werden. Zunächst bauen die Enzyme der Bauchspeicheldrüse das Nahrungsfett im Darmlumen ab, und die Triacylglycerine werden in Fettsäuren und Monoacylglycerine umgewandelt (Abbildung 5). Diese Moleküle bilden zusammen mit Cholesterin, fettlöslichen Vitaminen und Phospholipiden Mizellen, d. h. kleine Lipidtröpfchen, die dank der Gallensäuren wasserlöslich sind. Die Mizellen können die apikale Membran der Enterozyten ungehindert passieren. Die CD36- und FABP-Transporter (Fettsäurebindungsprotein) ermöglichen es einigen Fettsubstanzen, die apikale Membran des Enterozyten durch erleichterten passiven Transport zu passieren. Der Großteil des Fetttransports erfolgt in Form von Mizellen, während die Membrantransporter wie ein sensorisches System wirken, um langkettige Fettsäuren s 3im Darm zu erkennen. Cholesterin als einzelnes Molekül kann auch durch den NPC1L1 (Niemann-Pick C1-like 1)-Transporter transportiert werden, der Cholesterin aus dem Darmlumen in das Zytoplasma der Enterozyten überführt.

Im Enterozyten werden die Fette mit einigen Proteinen verbunden und zum endoplasmatischen Retikulum transportiert, wo die Triacylglycerine erneut synthetisiert werden. Sie werden mit einigen Proteinen verbunden, um Prä-Chlomikronen zu bilden. Das ApoB-Protein wird im endoplasmatischen Retikulum synthetisiert. ApoB bildet zusammen mit MTP (microsome tranfer protein) und Fettsäuren das Lipoprotein-Primordialpartikel. Im glatten endoplasmatischen Retikulum wird ApoB durch das Protein Apo A-IV ersetzt. Alle diese Komponenten bilden Prä-Chlomikronen, die in Vesikel eingeschlossen und zum Golgi-Apparat transportiert werden. Hier werden die Prä-Chlomikronen zu Chylomikronen zusammengefügt, die in exozytäre Vesikel eingeschlossen und in der laterobasalen Domäne des Enterozyten freigesetzt werden. Auf diese Weise können die Chylomikronen ins Blut und in die Lymphgefäße gelangen. Chylomikronen sind Lipoproteine mit einem Körper, der hauptsächlich aus Triacylglycerinen besteht, und einer Hülle aus Phospholipiden, Cholesterin und Apolipoproteinen. Sie spielen eine wichtige Rolle beim Transport von Triacylglycerinen und fettlöslichen Vitaminen.
Außerhalb des Enterozyten gelangen die Chylomikronen in die Lymphgefäße der Darmzotten und dann in die lymphatischen Plexus myentericus, von wo aus sie in die Blutgefäße gelangen. Neben den Chylomikronen ist das Fett auch in Lipoproteinen sehr geringer Dichte (VLDL) verpackt, die ebenfalls aus den Enterozyten exozytiert werden. Fett kann auch in den Lipidtropfen der Enterozyten gespeichert werden.
Die Enterozyten erhalten nach der Verdauung auch Eisen. Eisen ist wichtig für viele Proteine, wie z. B. Hämoglobin, und kann in der Nahrung als Teil von Hämoglobingruppen oder gebunden an Ferritin (in tierischem Fleisch) vorkommen (Abbildung 6). Eisen aus der Verdauung gelangt über den DMT1-Transporter (divalenter Metalltransporter 1) in den Körper, der sich in den apikalen Membranen der Enterozyten befindet. Transgene Mäuse, denen dieser Transporter fehlt, entwickeln eine schwere Anämie. DMT1 ist ein Co-Transporter, der an einen Protonengradienten gekoppelt ist. Der Protonengradient wird durch die Na+/K+-Pumpe erzeugt, die sich ebenfalls in der apikalen Membran der Enterozyten befindet. DMT1 transportiert Fe2+, aber das meiste Eisen aus dem Essen liegt in Form von Fe3+ vor. Die Eisenreduktion (Fe3+ zu Fe2+) erfolgt durch ein Reduktase-Enzym, das sich an der apikalen Oberfläche des Enterozyten befindet. Das an Hämogruppen gebundene Eisen wird offenbar durch rezeptorvermittelte Endozytose aufgenommen. Innerhalb des Enterozyten wird die Hämogruppe abgebaut, und das Eisen kann in das Zytosol gelangen.

Was auch immer der Eintrittsweg ist, sobald es im Zytosol ist, scheint die Bewegung des Eisens in Richtung der basolateralen Membranen durch Metallochaperon-Proteine vermittelt zu werden. In den basolateralen Membranen wird das Eisen durch den Ferroportin-Transporter in den extrazellulären Raum verlagert. Ferroportin nimmt die Fe2+-Form auf. Ferritin ist jedoch das Protein, das Eisen in das Pfortadersystem transportiert, und Eisen muss in der Fe3+-Form vorliegen. In den basolateralen Membranen des Enterozyten befinden sich Ferrooxidasen, die die Umwandlung von Fe2+ in Fe3+ ermöglichen. Eisen kann im Zytosol des Enterozyten an Ferritin gebunden gespeichert werden.
Endozytose/Transzytose. Moleküle wie Immunglobuline werden durch rezeptorvermittelte Endozytose endozytiert und durch Transzytose in andere Membrandomänen transportiert. An der Basis der Mikrovilli werden Vesikel gebildet, die später mit Endosomen verschmelzen. Die Immunglobuline werden dann in den in den Endosomen gebildeten Vesikeln eingeschlossen und zu den Membranen der basolateralen Domäne transportiert. Auf diese Weise entgehen die Immunglobuline dem lysosomalen Abbauweg.
Parazellulär. Wasser und Ionen durchqueren das Epithel über den parazellulären Weg.
Schutz
Enterozyten bilden eine Barriere, die Antigene, toxische Moleküle und Mikroorganismen abweist und gleichzeitig Nährstoffe durchlässt. Enterozyten sind mit vielen Mikroorganismen in Kontakt. Zum einen mit den Mikroorganismen, die im Darm ansässig sind, aber gefährlich werden können, wenn sie in das innere Gewebe gelangen, und zum anderen mit den nicht ansässigen Krankheitserregern, die mit der Nahrung aufgenommen werden. Die apikale Oberfläche der Enterozyten ist mit einer Schicht aus Schleimstoffen bedeckt, die von den Globettzellen abgegeben werden. Diese Schicht besteht aus Kohlenhydraten und hat eine dichte Viskosität, die die Diffusion von Molekülen ermöglicht, aber Zellen und die größten Moleküle zurückhält. Darüber hinaus weisen die Mikrovilli der Enterozyten an den apikalen Spitzen jedes Mikrovillus eine gut entwickelte Glykokalyx auf, die als physikalische und elektrische Barriere wirkt, da sie voller negativer Ladungen ist. Diese Mikrovilli erschweren einen direkten physischen Kontakt zwischen Mikroorganismen und Enterozytenmembran. Doch selbst wenn die Mikroorganismen diese beiden Barrieren passieren, sollten sie den Transportmechanismus der Mikrovilli überwinden.
Muzine sind hochglykosylierte Proteine, die in der apikalen Membran der Enterozyten vorkommen. Sie tragen zur gut ausgebildeten Glykokalyx bei. Mucine sind Transmembranproteine, die über ihre zytosolische Domäne mit dem Zytoskelett verbunden sind. MUC3, MUC12 und MUC17 sind die am häufigsten vorkommenden Mucine. Sie enthalten etwa 5000 Aminosäuren und ihre Kohlenhydratkomponente kann sich bis zu 1 µm von der Zelloberfläche erstrecken. Mucine bilden eine physische Barriere, die von Bakterien nur schwer überwunden werden kann.
Enterozyten sind in der Lage, Entzündungsprozesse auszulösen und zu regulieren, indem sie verschiedene Chimokine und Zytokine freisetzen. Sie verfügen auch über Rezeptoren für diese Moleküle. Enterozyten setzen pro-inflammatorische Moleküle frei, die die Immunzellen in der Darmschleimhaut beeinflussen.
Ein weiterer, weniger bekannter Schutzmechanismus ist die Freisetzung von Vesikeln von der apikalen Oberfläche der Enterozyten. Actin und Myosin, der motorische Apparat der Mikrovilli, erzeugen mechanische Kräfte, die die Membranen zur Spitze jeder Mikrovilli ziehen. Die Membranansammlung endet in Form von Vesikeln, die in das Darmlumen abgegeben werden. Diese Vesikel enthalten eine große Menge an alkalischer Phosphatase, die ein wirksames Mittel gegen Krankheitserreger ist, da sie die Toxizität von Lipopolysacharid und die Entzündung des Darms reduziert. Außerdem behindert sie die Anheftung von Bakterien an das Darmepithel und verringert die Vermehrung von Bakterien. Die von den Enterozyten freigesetzten Vesikel sind eine Möglichkeit, Anti-Mikroben-Moleküle in Bereiche zu senden, die weit vom Epithel entfernt sind.
Bibliographie
Barker N. 2014. Adulte intestinale Stammzellen: kritische Treiber der epithelialen Homöostase und Regeneration. Nature. 15: 19-33.
Giammanco A, Cefalù AB, Noto D, Averna MR. 2015. Die Pathophysiologie der intestinalen Lipoproteinproduktion. Frontiers in Physiology. 6: 61.
Knutson MD. 2014. Adulte intestinale Stammzellen: kritische Treiber der epithelialen Homöostase und Regeneration. Nature Review in Molecular Cell Biology. 15:19-33.
Knutson MD. 2017. Eisentransportproteine: Pforten der zellulären und systemischen Eisenhomöostase. Journal of biological chemistry Nature review in molecular cell biology. 292: 12735-12743.
Shifrin DA, McConell RE, Nambiar R, Higginbotham JN, Coffey RJ, Tyska MJ. 2012. Enterocyte microvillus-derived vesicles detoxify bacterial products and regulate epithelial-microbial interactions. Current biology. 22: 627-631.
Snoeck V, Goddeeries B, Cox E. 2005. Die Rolle der Enterozyten bei der intestinalen Barrierefunktion und Antigenaufnahme. Microbes and infection. 7: 997-1004.
Leave a Reply