Frontiers in Celland Developmental Biology
Background
Unitatea de bază a aparatului Golgi este de obicei considerată a fi o grămadă de cisterne care este foarte polarizată, cu fața cis care primește încărcătura de la ER și fața trans a stivei, TGN, asociată cu sortarea încărcăturii pentru exportul post-Golgi (Boncompain și Perez, 2013). Cu toate acestea, organizarea acestor mini-stack-uri în celulă variază între diferite organisme. La plante și nevertebrate, stivele Golgi individuale sunt împrăștiate independent în citoplasmă, în timp ce în majoritatea celulelor vertebrate, în timpul interfazei, stivele Golgi individuale sunt fuzionate împreună într-o structură compactă în formă de panglică situată în imediata apropiere a MTOC (Wei și Seemann, 2017). Structura panglicii Golgi în celulele mamiferelor este cel mai bine dezvăluită prin microscopie electronică (Rambourg și Clermont, 1997); microscopia optică de înaltă rezoluție care utilizează markeri cis și trans poate detecta, de asemenea, organizarea panglicii (Gosavi et al., 2018). O întrebare importantă care face obiectul unor investigații în domeniu este relevanța structurii panglicii Golgi și diferențele funcționale ale panglicii Golgi în comparație cu „mini-stackurile Golgi izolate” sau cu alte stări ale arhitecturii Golgi. Cu alte cuvinte, care este avantajul evolutiv al morfologiei mai complexe a panglicii mai complexe a aparatului Golgi în celulele vertebrate și ce funcții pot fi reglementate prin trecerea la o structură fără panglică?
Studiile din ultimii ani relevă faptul că membranele Golgi oferă o platformă pentru reglarea unei serii de procese celulare, inclusiv polarizarea celulară (Kupfer et al., 1983), migrația dirijată (Millarte și Farhan, 2012), stresul (Sasaki și Yoshida, 2015), repararea ADN-ului (Farber-Katz și colab., 2014), mitoza (Rabouille și Kondylis, 2007), metabolismul (Abdel Rahman și colab., 2015), răspunsurile pro-inflamatorii (Chen și Chen, 2018) și autofagia (Yamamoto și colab., 2012; Lamb și colab., 2013). Într-adevăr, în celulele mamiferelor există acum dovezi considerabile că Golgi, ca și alte organite intracelulare, poate acționa ca un senzor celular (Farhan și Rabouille, 2011; Mayinger, 2011; Millarte și Farhan, 2012; Sasaki și Yoshida, 2015; Luini și Parashuraman, 2016; Gosavi și Gleeson, 2017; Makhoul și colab., 2018). De asemenea, devine din ce în ce mai clar că morfologia precisă a Golgi este relevantă pentru reglarea unora dintre aceste procese celulare (Makhoul et al., 2018). Asocierea morfologiei Golgi cu semnalizarea a reieșit dintr-un screening al kinomului și al fosfatomului la nivelul întregului genom, care a identificat o cohortă mare de kinaze și fosfataze (20 % din totalul din genom) care au influențat morfologia Golgi (Chia et al., 2012). Modificările în morfologia Golgi au inclus fie fragmentarea Golgi (pierderea panglicii Golgi), fie formarea unui Golgi foarte compact și condensat în locația perinucleară. Relevanța actinei în reglarea morfologiei Golgi a fost evidențiată în acest studiu prin identificarea unui număr de kinaze, de exemplu ROCK1 și PAK1, care reglează dinamica actinei și modulează structura Golgi (Chia et al., 2012). Alte analize la nivelul întregului genom au evidențiat, de asemenea, probabilitatea ca Golgi să poată primi și transmite o mare varietate de semnale care ar putea influența, nu numai căile de transport membranar, ci și alte procese, apoptoza, mitoza, autofagia și răspunsurile la stres (Farhan et al., 2010; Millarte et al., 2015).
Structura panglicii Golgi este foarte dinamică și poate suferi remodelări foarte rapide în timpul unei serii de condiții diferite. De exemplu, în timpul mitozei, dezasamblarea panglicii Golgi este un eveniment timpuriu în tranziția G2/M și joacă un rol important ca punct de control al ciclului celular în promovarea intrării mitotice (Wei și Seemann, 2010; Corda et al., 2012). Reglarea dinamicii Golgi este mediată de interacțiunile dintre schelele moleculare situate pe membrana Golgi și citoschelet. Dinamica MT poate regla localizarea panglicii Golgi la centrosom și repoziționarea Golgi pentru a facilita traficul polarizat și secreția dirijată (Millarte și Farhan, 2012; Sanders și Kaverina, 2015). În plus, componentele membranare ale Golgi pot, de asemenea, nuclea și stabiliza microtubuli atât la cis- cât și la trans-Golgi și, prin urmare, Golgi însuși este, de asemenea, un MTOC (Efimov et al., 2007; Wu et al., 2016). Procesele mediate de actină contribuie, de asemenea, la forma și funcția Golgi și au fost identificate cel puțin nouă schelere moleculare localizate în Golgi care interacționează cu citoscheletul de actină . Intensificarea polimerizării actinei la nivelul Golgi duce la dispersarea panglicii, în timp ce inhibarea polimerizării actinei cu medicamente specifice, cum ar fi latrunculina A, duce la compactarea Golgi (Lazaro-Dieguez et al., 2006; Makhoul et al., 2018, 2019). Având în vedere aceste rețele de reglementare care modulează structura panglicii Golgi, considerăm că este foarte plauzibil faptul că echilibrul dintre panglica Golgi și mini-stackurile Golgi poate defini atât răspunsurile calitative, cât și cantitative ale căilor de semnalizare. Legătura dintre morfologia Golgi și semnalizare are, de asemenea, ramificații importante în ceea ce privește înțelegerea bazei moleculare a unui număr de boli care sunt asociate cu pierderea panglicii Golgi și apariția unui Golgi dispersat. De exemplu, s-a demonstrat că supraviețuirea unor celule canceroase este asociată cu un Golgi dispersat care reduce nivelul de apoptoză (Farber-Katz et al., 2014; Petrosyan, 2015).
Ce înseamnă fragmentarea Golgi?
Termenul „fragmentare Golgi” este utilizat în mod obișnuit pentru a descrie starea morfologică a unui Golgi dispersat în celulele mamiferelor, așa cum este detectată prin microscopie optică colorată cu markeri Golgi. Un Golgi dispersat este adesea observat în sistemele experimentale, de exemplu, atunci când celulele sunt tratate cu medicamente pentru a perturba citoscheletul, de exemplu, nocodazol (Wei și Seemann, 2010), atunci când fluxul membranar este perturbat sau atunci când componentele mașinăriei de transport Golgi sau ale sistemului de interacțiune cu citoscheletul sunt reduse, eliminate sau supraexprimate (Zappa et al., 2018). În diferite stări fiziologice, de exemplu, stresul (Serebrenik et al., 2018) și condiții patologice, în special cancerul și neurodegenerarea, Golgi și-a pierdut adesea locația juxtanucleară compactă tipică și este observat prin microscopie confocală ca structuri dispersate în întreaga citoplasmă . Există un număr tot mai mare de rapoarte care descriu fragmentarea Golgi în condiții fiziologice și patologice (Figura 1A). Cu toate acestea, o problemă legată de utilizarea termenului „fragmentat” este aceea că acesta implică faptul că integritatea structurală a Golgi este pierdută și că morfologia asociată cu structura „fragmentată” reprezintă un organit dezintegrat, anormal sau distrus. Într-o serie de cazuri, acest lucru este în mod clar înșelător, deoarece stivele Golgi individuale pot rămâne intacte și pot menține funcțiile clasice ale organitei, și anume glicozilarea și transportul membranar. Într-adevăr, în unele celule specializate, cum ar fi mioblaștii diferențiați (Lu et al., 2001), neuronii diferențiați care conțin stive Golgi individuale sau „avanposturi” de-a lungul dendritelor (Lasiecka și Winckler, 2011), celulele parietale gastrice (Gunn et al., 2011) și celulele uroepiteliale ale vezicii urinare (Kreft et al., 2010), apar mini-stackuri Golgi dispersate, fără o deficiență aparentă în ceea ce privește transportul membranar și glicozilarea. Mai degrabă, dispersia panglicii Golgi asociată cu condițiile experimentale și patologice poate reflecta o schimbare a echilibrului dinamic între morfologia compactă a panglicii și mini-stackurile Golgi individuale sau poate duce la perturbarea arhitecturii panglicii, precum și a integrității stivei Golgi. Aceasta este o chestiune relevantă, deoarece este foarte probabil ca starea morfologică precisă a Golgi să influențeze, în unele cazuri, eficiența transportului și a glicozilării (Puthenveedu et al., 2006), iar în alte cazuri, o varietate de rețele de semnalizare, dar nu neapărat transportul sau glicozilarea. Este important să se facă o diferență între mini-pilele Golgi intacte și pierderea integrității pilelor Golgi în definirea a ceea ce se înțelege prin Golgi „fragmentat”. Aici trecem în revistă diferitele morfologii Golgi care au fost detectate și caracterizate în cadru experimental, fiziologic și patologic.
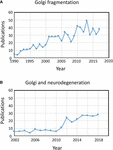
Figura 1. Publicații care identifică fragmentarea panglicii Golgi. (A) Numărul de publicații pe an cu termenul de fragmentare Golgi fie în titlu, fie în rezumat. (B) Numărul de publicații pe an în care Golgi a fost examinat în bolile neurodegenerative. Datele provin de la Alexandru Dan Corlățean. Tendința Medline: statistici anuale automatizate ale rezultatelor PubMed pentru orice interogare, 2004. Resursă web la URL: http://dan.corlan.net/medline-trend.html. Accesat: 2019-04-29.
Rethinking the Terminology of Golgi Morphological States
Structurile fragmentelor Golgi diferă în funcție de natura căii implicate pentru perturbarea sau modularea panglicii Golgi. Este important să avem o mai bună caracterizare ultrastructurală a „fragmentelor” Golgi în urma pierderii panglicii Golgi, deoarece este probabil ca rezultatul funcțional să fie foarte diferit în funcție de structurile Golgi precise. În afară de condițiile care au ca rezultat o panglică Golgi alungită, putem identifica din literatura de specialitate cel puțin 4 scenarii diferite asociate cu „fragmentarea” panglicii Golgi. Acestea sunt reprezentate în figura 2 și descrise după cum urmează:
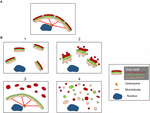
Figura 2. Model care prezintă diferite morfologii Golgi în urma „fragmentării” structurii panglicii Golgi. (A) Structura panglicii Golgi intactă și (B) diferite scenarii care arată pierderea panglicii Golgi. (1) Scenariul în care mini-stackurile Golgi intacte sunt dispersate în citoplasmă; (2) Scenariul în care integritatea stackurilor Golgi dispersate este compromisă, cu cisterne scurtate, umflarea cisternelor și creșterea numărului de tubuli și vezicule asociate Golgi; (3) Scenariul în care există o dispersie a unui compartiment Golgi. Aici TGN este dispersat în mod selectiv în citoplasmă, în timp ce restul stivei rămâne într-o structură de panglică; (4) Scenariul în care există o pierdere a panglicii și a stivei cu membrane Golgi dispersate predominant sub formă de tubuli și vezicule. Numerele se referă la clasificarea morfologiilor Golgi prezentate în text.
(1) Conversia panglicii Golgi în stive Golgi. Aici, pierderea (sau reducerea lungimii) panglicii Golgi este asociată cu mini-stack-uri Golgi dispersate, intacte. Această situație apare la o serie de tipuri de celule și, de asemenea, în sisteme model, cum ar fi tratamentul cu nocodazol sau modularea nivelurilor de golgin TGN GCC88. Transportul membranar pare a fi în mare parte neafectat în aceste condiții, cu excepția încărcăturii posibil mari (Ferraro et al., 2014; Lavieu et al., 2014), în timp ce semnalizarea mTOR este redusă și autofagia este îmbunătățită (Gosavi et al., 2018).
(2) Pierderea atât a panglicii Golgi, cât și a integrității stivei Golgi. În acest scenariu, structura panglicii este pierdută și, în plus, cisternele stivelor individuale sunt reduse în lungime și/sau număr și pot fi, de asemenea, asociate cu compartimente umflate, de exemplu, knock-out-ul GM130 (Liu et al., 2017) și mutațiile subunităților COG (Blackburn și Lupashin, 2016). Este probabil ca transportul membranar și glicozilarea să fie afectate în acest scenariu, împreună cu diverse rețele de semnalizare.
(3) Dispersia unui compartiment Golgi. În acest scenariu, doar un singur compartiment Golgi este dispersat, cum ar fi dispersia TGN recent raportată activarea inflammasomului NLRP3 (Chen și Chen, 2018). Restul stivei/ribonului rămâne neafectat. Identificarea acestor structuri Golgi necesită încorporarea microscopiei EM și optice și a unui număr de markeri Golgi de-a lungul stivei pentru a defini modificările precise ale morfologiei Golgi.
(4) Conversia panglicii Golgi în elemente tubulovesiculare. În acest scenariu, atât panglica cât și stivele Golgi sunt perturbate în mod extensiv, cu creșteri dramatice ale structurilor tubulovesiculare, așa cum se întâmplă în timpul mitozei (Wei și Seemann, 2017), a diferitelor medicamente și a tratamentului celulelor cu amiloid β (Joshi et al., 2014). Aici s-ar anticipa un impact asupra multora dintre funcțiile Golgi.
Nu deducem că Figura 2 reprezintă singurele morfologii ale „fragmentelor” Golgi și este posibil să se identifice scenarii suplimentare pe măsură ce structurile „fragmentelor” Golgi sunt investigate mai amănunțit.
Exemple de relație între morfologia Golgi și procesele celulare
Coordonarea dintre modificările morfologiei Golgi și diversele procese celulare a primit o atenție considerabilă. Pentru un rezumat mai detaliat al informațiilor de bază ale proceselor influențate de modificările morfologiei Golgi, cum ar fi traficul, glicozilarea, stresul, repararea ADN-ului, cititorul este invitat să consulte o serie de recenzii recente (Farhan și Rabouille, 2011; Millarte și Farhan, 2012; Sasaki și Yoshida, 2015; Gosavi și Gleeson, 2017; Makhoul et al., 2019). Mai jos sunt prezentate câteva exemple pentru a evidenția gama de procese celulare care sunt reglementate sau coordonate de diferite stări morfologice ale Golgi. Într-o serie de alte cazuri, cum ar fi unele cancere și răspunsuri la stres, panglica Golgi este dispersată sub formă de fragmente, însă morfologia acestor fragmente Golgi nu a fost bine caracterizată. Discuția de față se va concentra pe exemplele în care morfologia Golgi este bine definită.
DNA Repair and Cancer
Există o asociere intimă între morfologia Golgi și răspunsul la deteriorarea ADN (Farber-Katz et al., 2014). Legătura membranară Golgi, GOLPH3, este o oncogenă, iar supraexprimarea GOLPH3 are ca rezultat o supraviețuire celulară sporită în urma leziunilor ADN (Scott et al., 2009; Farber-Katz et al., 2014). În schimb, pierderea GOLPH3 împiedică dispersia panglicii Golgi, îmbunătățește panglica Golgi și promovează apoptoza după deteriorarea ADN. Răspunsul la deteriorarea ADN este mediat de kinaza DNA-PK, care fosforilează GOLPH3 și promovează „fragmentarea” Golgi prin creșterea polimerizării actinei la nivelul membranelor Golgi (Dippold et al., 2009). mTOR este modulat de modificările morfologiei Golgi mediate de GOLPH3 (Scott et al., 2009) și este probabil să contribuie la rezultatul răspunsului la ADN. Prin urmare, structura precisă a Golgi este legată de supraviețuirea și apoptoza celulară. Identitatea structurilor Golgi în urma dispersării panglicii Golgi de către fosfo-GOLPH3 rămâne să fie caracterizată. În mod clar, studiile viitoare care examinează relația dintre fragmentarea Golgi și semnalizarea mTOR în celulele canceroase vor fi binevenite.
Dezordini genetice asociate cu alterarea morfologiei Golgi
Multe boli au fost identificate cu tulburări monogenice cauzate de mutații moștenite fie ale componentelor asociate cu mașinăria de transport, fie ale enzimelor rezidente în Golgi. Multe dintre aceste boli sunt asociate cu fragmentarea panglicii Golgi, de exemplu, defecte ale complexului Golgi oligomeric conservat (COG) în tulburările congenitale de glicozilare (Miller și Ungar, 2012). În multe cazuri, tulburările sunt asociate cu patologii restrânse la un număr limitat de organe sau țesuturi. Baza pentru specificitatea tisulară este slab înțeleasă, dar probabil că se datorează deficiențelor în glicozilare și secreție și, de asemenea, alterărilor în rețelele de semnalizare asociate cu pierderea panglicii Golgi, cum ar fi răspunsurile Golgi la stres. În toate liniile celulare cu subunitatea COG knock-out, Golgi prezintă modificări moderate până la severe ale morfologiei caracterizate prin EM, asociate cu pierderea panglicii, cisterne dilatate și, în unele cazuri, cu întreruperea mini-stack-urilor. Aplicarea EM a fost fundamentală în definirea modificărilor morfologice (Blackburn și Lupashin, 2016).
Boli neurodegenerative
Statutul Golgi în bolile neurodegenerative a primit recent o atenție considerabilă (Figura 1B). Pierderea panglicii Golgi este o caracteristică comună a multor boli neurodegenerative, inclusiv a bolii Alzheimer, a bolii Huntington, a sclerozei laterale amiotrofice și a bolii Parkinson (Gonatas et al., 2006; Haase și Rabouille, 2015; Rabouille și Haase, 2015; Rabouille și Haase, 2015; Sundaramoorthy et al., 2015). Este foarte probabil ca perturbațiile în arhitectura Golgi în aceste boli să contribuie la procesele patologice. În majoritatea cazurilor, structura morfologică precisă a fragmentelor Golgi în aceste boli neurodegenerative nu a fost definită. Cu toate acestea, două sisteme experimentale au investigat recent în detaliu modificările structurii Golgi și degenerarea neuronală. În primul rând, s-a demonstrat că eliminarea condiționată a GM130, o golgin structurală care reglează panglica Golgi, în sistemul nervos central cauzează fragmentarea Golgi, atrofia dendritelor și degenerarea neuronală la șoareci (Liu et al., 2017). Analiza EM a celulelor Purkinje GM130 KO a arătat o reducere a lungimii cisternelor Golgi și a stivuirii și, în plus, avanposturile dendritelor Golgi tipice erau absente în aceste celule Purkinje GM130 -/- (Liu et al., 2017). Într-un al doilea studiu, neuronii hipocampali de la șoareci transgenici pentru mutația suedeză a proteinei precursoare amiloide (APP) și o subunitate mutantă de presenilină 1 a γ-secretazei, unde ambele mutații sunt asociate cu boala Alzheimer cu debut precoce, au dezvăluit o fragmentare extinsă a Golgi prin microscopie optică (Joshi et al., 2014). EM cantitativ al neuronilor la acești șoareci a arătat o reducere a numărului și a lungimii cisternelor din stive în comparație cu neuronii de la șoarecii de tip sălbatic. În plus, cisternele erau umflate. S-a demonstrat că modificările morfologiei Golgi în acești neuroni primari sunt direct asociate cu nivelul ridicat de producție de amiloid-β. Neuronii primari tratați cu amiloid-β sintetic au prezentat, de asemenea, o fragmentare similară a Golgi, precum și o creștere a structurilor tubulovesiculare asociate cu cisternele Golgi în comparație cu celulele netratate. Pierderea panglicii Golgi s-a datorat fosforilării GRASP65, o proteină structurală Golgi care joacă un rol-cheie în dezasamblarea panglicii Golgi și a stivei Golgi în mitoză (Joshi et al., 2014). Compararea acestor două studii de mai sus este informativă, deoarece căile care mediază modificările morfologiei Golgi diferă în fiecare caz, ceea ce duce la diferențe în morfologia „fragmentelor” Golgi. Trebuie să se ia în considerare modul în care aceste căi diferite care afectează morfologia Golgi influențează răspunsurile din aval.
mTOR Signaling
Laboratorul nostru a stabilit o abordare experimentală pentru a perturba echilibrul dintre panglica Golgi și mini-stackurile Golgi prin modularea dozei de GCC88, o golgin localizată la TGN. Această strategie a permis stabilirea unei linii celulare stabile, HeLa-B6, care nu are panglica Golgi. Am demonstrat că GCC88 reglează echilibrul dintre panglicile și mini-stackurile Golgi printr-un proces dependent de actină (Makhoul et al., 2019) și am identificat intersectina-1 (ITSN1), un factor de schimb de nucleotide de guanină pentru cdc42 (Hussain et al., 2001), ca interactor al GCC88 responsabil de pierderea panglicii Golgi (Makhoul et al., 2019). Analizele celulelor HeLa B6, cărora le lipsește panglica Golgi, au demonstrat o activitate mTOR redusă și o creștere asociată a biogenezei autofagozomilor (Gosavi et al., 2018). mTOR este una dintre principalele căi de semnalizare a celulelor eucariote și este cunoscută ca fiind un regulator negativ al autofagiei (Wullschleger et al., 2006). Prin urmare, echilibrul dintre grămezile Golgi și panglica Golgi are un efect direct asupra căii mTORC1. Utilizarea markerilor specifici compartimentelor cis- și trans- și a tomografiei EM a fost esențială în dezvăluirea modificărilor morfologice din panglica Golgi.
Inflammation
Inflammasomii sistemului imunitar înnăscut acționează ca un schelet pentru activarea dependentă de caspaza 1 a citokinelor proinflamatorii (Broz și Dixit, 2016). NLRP3 (nucleotide-binding domain, leucine-rich-containing family, pyrin domain-containing-3) este un inflammasom versatil care poate fi activat de o serie de stimuli microbieni și non-microbieni, având ca rezultat secreția de citokine proinflamatorii interleukina 1β (IL-1β) și interleukina 18 (IL-18) și moartea celulară programată prin piroptoză. Un studiu recent a demonstrat că activarea NLRP3 citosolic de către stimuli implică recrutarea NLRP3 la membranele TGN dispersate pentru a facilita asamblarea scheletului NLRP3 (Chen și Chen, 2018). TGN dispersat, dar nu și celelalte compartimente subiacente, recrutează în mod specific NLRP3, prin intermediul PI4P, pentru a asambla complexul adaptor ASC din aval, care suferă o polimerizare în regiunea peri-nucleară înainte de a recruta caspaza-1 pentru a activa calea de semnalizare din aval (Chen și Chen, 2018). Prin urmare, această descoperire importantă demonstrează că modularea arhitecturii TGN în mod selectiv, este esențială în activarea acestei căi. Utilizarea markerilor specifici compartimentului (TGN și cis-Golgi) împreună cu analiza optică și EM a fost esențială în dezvăluirea modificărilor morfologice din panglica Golgi.
Observații finale
Arhitectura precisă a morfologiei Golgi este definită de microscopia optică de înaltă rezoluție și de EM. Includerea acestor informații în viitoarele studii în domeniu va oferi o perspectivă considerabilă asupra dinamicii Golgi, a căilor de perturbare a structurii panglicii și a consecințelor funcționale asociate cu aceste căi diferite.
În rezumat, propunem că utilizarea termenului „Golgi fragmentat” este inadecvată pentru a descrie structurile Golgi asociate cu multe tratamente și afecțiuni, iar diferențele dintre aceste structuri Golgi sunt susceptibile de a fi relevante din punct de vedere fiziologic. Având în vedere natura dinamică a aparatului Golgi, este posibil să existe un echilibru între diferite stări morfologice ale Golgi la un moment dat, și anume mini-stack-uri și structuri de panglică. Înțelegerea echilibrului dinamic între diferitele morfologii Golgi în detaliu la nivel molecular este esențială pentru o apreciere completă a acestui organit în timpul proceselor celulare normale și, de asemenea, în condiții patologice. Va fi fascinant să vedem ce se va întâmpla pe măsură ce vom afla mai multe despre funcțiile de detecție celulară ale acestui organit complex și relația dintre aceste funcții și structurile Golgi.
Disponibilitatea datelor
Toate seturile de date analizate pentru acest studiu sunt incluse în manuscris și în fișierele suplimentare.
Contribuții ale autorilor
Toți autorii enumerați au avut o contribuție substanțială, directă și intelectuală la această lucrare și au aprobat-o pentru publicare.
Finanțare
Această lucrare a fost susținută prin finanțare din partea Consiliului Australian de Cercetare (DP160102394).
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Abbreviații
GM130, cis-Golgi matrix protein; GMAP210, Golgi microtubule associated protein; GOLPH3, Golgi phosphoprotein 3; GRASP, Golgi reassembly stacking protein; MTOC, microtubule organizing center; mTOR, mechanistic target of rapamycin; PI4P, phosphatidylinositol-4-phosphate; TGN, trans-Golgi network.
Abdel Rahman, A. M., Ryczko, M., Nakano, M., Pawling, J., Rodrigues, T., Johswich, A., et al. (2015). Golgi N-glican ramificat N-acetilglucosaminiltransferazele I, V și VI promovează absorbția și metabolismul nutrienților. Glycobiology 25, 225-240. doi: 10.1093/glycob/cwu105
PubMed Abstract | Full CrossRef Text | Google Scholar
Blackburn, J. B., și Lupashin, V. V. (2016). Crearea de knockout-uri ale subunităților conservate ale complexului golgi oligomeric oligomeric utilizând editarea genei mediată de CRISPR, asociată cu o strategie de selecție bazată pe defecte de glicozilare asociate cu afectarea funcției complexului COG. Metode Mol. Biol. 1496, 145-161. doi: 10.1007/978-1-4939-6463-5_12
PubMed Abstract | CrossRef Full Text | Google Scholar
Boncompain, G., și Perez, F. (2013). Numeroasele căi ale traficului dependent de Golgi. Histochem. Cell Biol. 140, 251-260. doi: 10.1007/s00418-013-1124-7
PubMed Abstract | Refef Full Text | Google Scholar
Broz, P., și Dixit, V. M. (2016). Inflammasomii: mecanism de asamblare, reglementare și semnalizare. Nat. Rev. Immunol. 16, 407-420. doi: 10.1038/nri.2016.58
PubMed Abstract | Textul integral | Google Scholar
Chen, J., și Chen, Z. J. (2018). PtdIns4P pe rețeaua trans-Golgi dispersată mediază activarea inflammasomului NLRP3. Nature 564, 71-76. doi: 10.1038/s41586-018-0761-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Chia, J., Goh, G., Racine, V., Ng, S., Kumar, P., și Bard, F. (2012). Screeningul RNAi dezvăluie o rețea mare de semnalizare care controlează aparatul Golgi în celulele umane. Mol. Syst. Biol. 8:629. doi: 10.1038/msb.2012.59
PubMed Abstract | Text integral | Google Scholar
Corda, D., Barretta, M. L., Cervigni, R. I., și Colanzi, A. (2012). Fragmentarea complexului Golgi în tranziția G2/M: un punct de control al ciclului celular bazat pe organite. IUBMB Life 64, 661-670. doi: 10.1002/iub.1054
PubMed Abstract | Text integral | Google Scholar
De Matteis, M. A., Mironov, A. A. A., și Beznoussenko, G. V. (2008). The Golgi Ribbon and the Function of the Golgins (Panglica Golgi și funcția Golgins). New York, NY: Springer-Verlag/Wein.
Google Scholar
Dippold, H. C., Ng, M. M., Farber-Katz, S. E., Lee, S. K., Kerr, M. L., Peterman, M. C., et al. (2009). GOLPH3 face legătura între fosfatidilinositol-4-fosfat și actomiozină pentru a întinde și modela Golgi pentru a promova înmugurirea. Cell 139, 337-351. doi: 10.1016/j.cell.2009.07.052
PubMed Abstract | Full CrossRef Text | Google Scholar
Efimov, A., Kharitonov, A., Efimova, N., Loncarek, J., Miller, P. M., Andreyeva, N., et al. (2007). Nuclearea asimetrică dependentă de CLASP a microtubulelor noncentrosomale la rețeaua trans-Golgi. Dev. Cell 12, 917-930. doi: 10.1016/j.devcel.2007.04.002
PubMed Abstract | Refef Full Text | Google Scholar
Farber-Katz, S. E., Dippold, H. C., Buschman, M. D., Peterman, M. C., Xing, M., Noakes, C. J., et al. (2014). Deteriorarea ADN declanșează dispersia Golgi prin intermediul DNA-PK și GOLPH3. Cell 156, 413-427. doi: 10.1016/j.cell.2013.12.023
PubMed Abstract | Refef Full Text | Google Scholar
Farhan, H., și Rabouille, C. (2011). Semnalizarea către și de la calea secretorie. J. Cell Sci. 124, 171-180. doi: 10.1242/jcs.076455
PubMed Abstract | Ref Full Text | Google Scholar
Farhan, H., Wendeler, M. W., Mitrovic, S., Fava, E., Silberberg, Y., Sharan, R., et al. (2010). Semnalizarea MAPK pentru calea secretorie timpurie dezvăluită prin screening funcțional de kinază / fosfatază. J. Cell Biol. 189, 997-1011. doi: 10.1083/jcb.200912082
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferraro, F., Kriston-Vizi, J., Metcalf, D. J., Martin-Martin, B., Freeman, J., Burden, J. J., et al. (2014). Un control al dimensiunii organitelor bazat pe două niveluri Golgi susține plasticitatea funcțională a celulelor endoteliale. Dev. Cell 29, 292-304. doi: 10.1016/j.devcel.2014.03.021
PubMed Abstract | Full CrossRef Text | Google Scholar
Gonatas, N. K., Stieber, A., și Gonatas, J. O. (2006). Fragmentarea aparatului Golgi în bolile neurodegenerative și moartea celulară. J. Neurol. Sci. 246, 21-30. doi: 10.1016/j.jns.2006.01.019
PubMed Abstract | Refef Full Text | Google Scholar
Gosavi, P., and Gleeson, P. A. (2017). Funcția structurii panglicii Golgi- Un mister de durată se desfășoară! Bioessays 39:1700063. doi: 10.1002/bies.201700063
PubMed Abstract | CrossRef Full Text | Google Scholar
Gosavi, P., Houghton, F. J., Mcmillan, P. J., Hanssen, E., și Gleeson, P. A. (2018). Panglica Golgi în celulele mamiferelor reglează negativ autofagia prin modularea activității mTOR. J. Cell Sci. 131:jcs211987. doi: 10.1242/jcs.211987
PubMed Abstract | Ref Full Text | Google Scholar
Gunn, P. A., Gliddon, B. L., Londrigan, S. L., Lew, A. M., Van Driel, I. R., și Gleeson, P. A. (2011). Aparatul Golgi din celulele parietale gastrice bogate în endomembrane există sub formă de mini-stack-uri stabile și funcționale dispersate în citoplasmă. Biol. Cell 103, 559-572. doi: 10.1042/BC20110074
PubMed Abstract | Full Text | Google Scholar
Haase, G., și Rabouille, C. (2015). Fragmentarea Golgi în neuronii motori ALS. Noi mecanisme care vizează microtubulii, legăturile și veziculele de transport. Front. Neurosci. 9:448. doi: 10.3389/fnins.2015.00448
PubMed Abstract | Text integral | Google Scholar
Hussain, N. K., Jenna, S., Glogauer, M., Quinn, C. C., Wasiak, S., Guipponi, M., et al. (2001). Proteina endocitică intersectin-l reglează asamblarea actinei prin Cdc42 și N-WASP. Nat. Cell Biol. 3, 927-932. doi: 10.1038/ncbb1001-927
PubMed Abstract | Text integral | Google Scholar
Joshi, G., Chi, Y., Chi, Y., Huang, Z., și Wang, Y. (2014). Fragmentarea Golgi indusă de Abeta în boala Alzheimer sporește producția de Abeta. Proc. Natl. acad. Sci. U.S.A. 111, E1230-E1239. doi: 10.1073/pnas.1320192111
PubMed Abstract | CrossRef Full Text | Google Scholar
Kreft, M. E., Di Giandomenico, D., Beznoussenko, G. V., Resnik, N., Mironov, A. A., și Jezernik, K. (2010). Fragmentarea aparatului Golgi ca mecanism responsabil pentru livrarea uniformă a uroplakinelor la membrana plasmatică apicală a celulelor uroepiteliale. Biol. Cell 102, 593-607. doi: 10.1042/bc20100024
PubMed Abstract | Full CrossRef Full Text | Google Scholar
Kupfer, A., Dennert, G., și Singer, S. J. (1983). Polarizarea aparatului Golgi și a centrului de organizare a microtubulilor în cadrul celulelor ucigașe naturale clonate legate de țintele lor. Proc. Natl. acad. Sci. U.S.A. 80, 7224-7228. doi: 10.1073/pnas.80.23.7224
PubMed Abstract | CrossRef Full Text | Google Scholar
Lamb, C. A., Yoshimori, T., și Tooze, S. A. (2013). Autofagosomul: origini necunoscute, biogeneză complexă. Nat. Rev. Mol. Cell Biol. 14, 759-774. doi: 10.1038/nrm3696
PubMed Abstract | Text integral | Google Scholar
Lasiecka, Z. M., și Winckler, B. (2011). Mecanisme de trafic polarizat al membranelor polarizate în neuroni – concentrându-se pe endosomi. Mol. Cell. Neurosci. 48, 278-287. doi: 10.1016/j.mcn.2011.06.013
PubMed Abstract | Full CrossRef Text | Google Scholar
Lavieu, G., Dunlop, M. H., Lerich, A., Zheng, H., Bottanelli, F., și Rothman, J. E. (2014). Structura panglicii Golgi facilitează transportul anterograd al încărcăturilor mari. Mol. Biol. Cell 25, 3028-3036. doi: 10.1091/mbc.E14-04-093
PubMed Abstract | Full CrossRef Text | Google Scholar
Lazaro-Dieguez, F., Jimenez, N., Barth, H., Koster, A. J., Renau-Piqueras, J., Llopis, J. L., et al. (2006). Filamentele Actin sunt implicate în menținerea morfologiei cisternei Golgi și a pH-ului intra-Golgi. Cell Motil. Cytoskeleton 63, 778-791. doi: 10.1002/cm.20161
PubMed Abstract | Full CrossRef Text | Google Scholar
Liu, C., Mei, M., Li, Q., Roboti, P., Pang, Q., Ying, Z., et al. (2017). Pierderea golginului GM130 cauzează întreruperea Golgi, pierderea neuronilor Purkinje și ataxia la șoareci. Proc. Natl. acad. Sci. U.S.A. 114, 346-351. doi: 10.1073/pnas.1608576114
PubMed Abstract | CrossRef Full Text | Google Scholar
Lu, Z., Joseph, D., Bugnard, E., Zaal, K. J., și Ralston, E. (2001). Reorganizarea complexului Golgi în timpul diferențierii musculare: vizualizare în celule vii și mecanism. Mol. Biol. Cell 12, 795-808. doi: 10.1091/mbc.12.4.795
PubMed Abstract | Refef Full Text | Google Scholar
Luini, A., și Parashuraman, S. (2016). Semnalizarea la Golgi: detectarea și controlul fluxurilor membranare. Curr. Opin. Cell Biol. 39, 37-42. doi: 10.1016/j.ceb.2016.01.014
PubMed Abstract |Ref Full Text | Google Scholar
Makhoul, C., Gosavi, P., Duffield, R., Delbridge, B., Williamson, N. A., și Gleeson, P. A. (2019). Intersectin-1 interacționează cu golginul GCC88 pentru a cupla rețeaua de actină și arhitectura Golgi. Mol. Biol. Cell 30, 370-386. doi: 10.1091/mbc.E18-05-0313
PubMed Abstract | Full CrossRef Text | Google Scholar
Makhoul, C., Gosavi, P., și Gleeson, P. A. (2018). Arhitectura Golgi și detecția celulară. Biochem. Soc. Trans. 46, 1063-1072. doi: 10.1042/BST20180323
PubMed Abstract | CrossRef Full Text | Google Scholar
Mayinger, P. (2011). Semnalizarea la Golgi. Cold Spring Harb. Perspect. Biol. 3:a005314.
Google Scholar
Millarte, V., Boncompain, G., Tillmann, K., Perez, F., Sztul, E., și Farhan, H. (2015). Fosfolipaza C gamma1 reglează traficul secretor timpuriu și migrația celulară prin interacțiunea cu p115. Mol. Biol. Cell 26, 2263-2278. doi: 10.1091/mbc.E15-03-0178
PubMed Abstract | Full CrossRef Text | Google Scholar
Millarte, V., și Farhan, H. (2012). Golgi în migrația celulară: reglarea prin transducția semnalului și implicațiile sale pentru metastaza celulelor canceroase. ScientificWorldJournal 2012:498278. doi: 10.1100/2012/498278
PubMed Abstract | Full CrossRef Text | Google Scholar
Miller, V. J., și Ungar, D. (2012). Re’COG’nition at the Golgi. Traffic 13, 891-897. doi: 10.1111/j.1600-0854.2012.01338.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Petrosyan, A. (2015). Onco-Golgi: este fragmentarea o poartă către progresia cancerului? Biochem. Mol. Biol. J. 1:16.
PubMed Abstract | Google Scholar
Puthenveedu, M. A., Bachert, C., Puri, S., Lanni, F., și Linstedt, A. D. (2006). Fuziunea cisternală laterală dependentă de GM130 și GRASP65 permite o distribuție uniformă a enzimelor Golgi. Nat. Cell Biol. 8, 238-248. doi: 10.1038/ncb1366
PubMed Abstract | Refef Full Text | Google Scholar
Rabouille, C., și Haase, G. (2015). Editorial: Patologia golgi în bolile neurodegenerative. Front. Neurosci. 9:489. doi: 10.3389/fnins.2015.00489
PubMed Abstract | Refef Full Text | Google Scholar
Rabouille, C., și Kondylis, V. (2007). Dezlegarea panglicii Golgi: un punct de control G2/M bazat pe organite. Cell Cycle 6, 2723-2729. doi: 10.4161/cc.6.22.4896
PubMed Abstract | Cross Full Text | Google Scholar
Rambourg, A., și Clermont, Y. (1997). Structura tridimensională a aparatului Golgi în celulele de mamifere. Basel: Birkhauser.
Google Scholar
Sanders, A. A., și Kaverina, I. (2015). Nuclearea și dinamica microtubulilor derivați din Golgi. Front. Neurosci. 9:431. doi: 10.3389/fnins.2015.00431
CrossRef Full Text | Google Scholar
Sasaki, K., și Yoshida, H. (2015). autoreglarea organellei-răspunsurile la stres în ER, Golgi, mitocondrii și lizozom. J. Biochem. 157, 185-195. doi: 10.1093/jb/mvvvv010
PubMed Abstract | Full CrossRef Text | Google Scholar
Scott, K. L., Kabbarah, O., Liang, M. C., Ivanova, E., Anagnostou, V., Wu, J., et al. (2009). GOLPH3 modulează semnalizarea mTOR și sensibilitatea la rapamicină în cancer. Nature 459, 1085-1090. doi: 10.1038/nature08109
PubMed Abstract | Text integral | Google Scholar
Serebrenik, Y. V., Hellerschmied, D., Toure, M., Lopez-Giraldez, F., Brookner, D., și Crews, C. M. (2018). Desfășurarea direcționată a proteinelor descoperă un răspuns de stres transcripțional specific Golgi. Mol. Biol. Cell 29, 1284-1298. doi: 10.1091/mbc.E17-11-0693
PubMed Abstract | Refef Full Text | Google Scholar
Sundaramoorthy, V., Sultana, J. M., și Atkin, J. D. (2015). Fragmentarea Golgi în scleroza laterală amiotrofică, o prezentare generală a posibililor factori declanșatori și consecințe. Front. Neurosci. 9:400. doi: 10.3389/fnins.2015.00400
PubMed Abstract | Full CrossRef Text | Google Scholar
Wei, J. H., și Seemann, J. (2010). Unraveling the Golgi ribbon. Traffic 11, 1391-1400. doi: 10.1111/j.1600-0854.2010.01114.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Wei, J. H., și Seemann, J. (2017). Dezasamblarea panglicii Golgi în timpul mitozei, diferențierii și progresiei bolii. Curr. Opin. Cell Biol. 47, 43-51. doi: 10.1016/j.ceb.2017.03.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, J., De Heus, C., Liu, Q., Bouchet, B. P., Noordstra, I., Jiang, K., et al. (2016). Calea moleculară a organizării microtubulilor la nivelul aparatului Golgi. Dev. Cell 39, 44-60. doi: 10.1016/j.devcel.2016.08.009
PubMed Abstract | Full CrossRef Text | Google Scholar
Wullschleger, S., Loewith, R., și Hall, M. N. (2006). Semnalizarea TOR în creștere și metabolism. Cell 124, 471-484.
Google Scholar
Yamamoto, H., Kakuta, S., Watanabe, T. M., Kitamura, A., Sekito, T., Kondo-Kakuta, C., et al. (2012). Veziculele Atg9 sunt o sursă importantă de membrană în timpul primelor etape de formare a autofagosomului. J. Cell Biol. 198, 219-233. doi: 10.1083/jcb.201202061
PubMed Abstract | CrossRef Full Text | Google Scholar
Zappa, F., Failli, M., și De Matteis, M. A. (2018). Complexul Golgi în boală și terapie. Curr. Opin. Cell Biol. 50, 102-116. doi: 10.1016/j.ceb.2018.03.005
PubMed Abstract | CrossRef Full Text | Google Scholar
.
Leave a Reply