Obszar badawczy
Większość komórek biorących udział w odporności ssaków wywodzi się z prekursorów w szpiku kostnym (lewa połowa ryciny 1) i krąży we krwi, dostając się do tkanek, a czasem je opuszczając w razie potrzeby. Bardzo rzadka komórka macierzysta utrzymuje się w szpiku kostnym u dorosłych (z częstością około 1 na 100 000 komórek) i zachowuje zdolność do różnicowania się we wszystkie typy komórek krwi. Hemopoeza była badana poprzez wstrzykiwanie małych ilości genetycznie oznaczonych komórek szpiku do myszy biorców i obserwowanie potomstwa, które one dają początek (klonowanie in vivo) lub poprzez hodowanie prekursorów szpiku kostnego w obecności odpowiednich czynników wzrostu (klonowanie in vitro). Proliferacja i różnicowanie wszystkich tych komórek odbywa się pod kontrolą rozpuszczalnych lub związanych z błoną komórkową czynników wzrostu wytwarzanych przez zrąb szpiku kostnego oraz przez siebie nawzajem. Wewnątrz komórki sygnały te włączają specyficzne czynniki transkrypcyjne, cząsteczki wiążące DNA, które działają jak główne przełączniki określające późniejszy program genetyczny, dając w konsekwencji początek rozwojowi różnych typów komórek (zwanych liniami). Co ciekawe, ostatnie badania wykazały, że możliwe jest przekształcenie jednego zróżnicowanego typu komórki w inny poprzez eksperymentalne wprowadzenie do komórki odpowiednich czynników transkrypcyjnych. Odkrycie to ma ważne implikacje terapeutyczne, np. w leczeniu genetycznych niedoborów odporności. Większość komórek hemopoetycznych przestaje się dzielić, gdy są już w pełni zróżnicowane. Jednakże, limfocyty dzielą się szybko i rozszerzają się po ekspozycji na antygen. Zwiększona liczba limfocytów specyficznych dla antygenu stanowi podstawę pamięci immunologicznej.
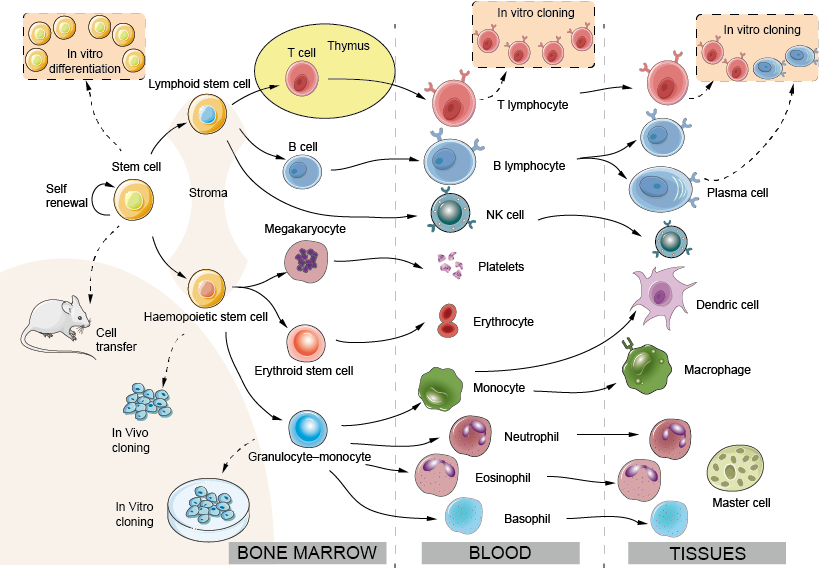
Rys. 1. Rozwój komórek odpornościowych: układ krwiotwórczy
Szpiku kostnego: W przeciwieństwie do większości innych tkanek czy narządów, układ krwiotwórczy stale się odnawia. U osoby dorosłej rozwój komórek hemopoetycznych zachodzi głównie w szpiku kostnym. U płodu, zanim rozwiną się kości, hemopoezy zachodzą najpierw w woreczku żółtkowym, a następnie w wątrobie.
Stroma: komórki nabłonkowe i śródbłonkowe, które zapewniają wsparcie i wydzielają czynniki wzrostu dla hemopoezy.
Komórka macierzysta: totipotencjalna i samoodnawiająca się komórka szpiku. Komórki macierzyste występują w niewielkiej liczbie zarówno we krwi, jak i w szpiku kostnym, a ich liczba może być zwiększona poprzez leczenie odpowiednimi czynnikami wzrostu (np. G-CSF), co znacznie ułatwia proces przeszczepiania szpiku kostnego.
Limfoidalna komórka macierzysta: przypuszczalnie zdolna do różnicowania się w limfocyty T lub B. Najnowsze dane sugerują, że rozróżnienie pomiędzy limfoidalnymi i mieloidalnymi komórkami macierzystymi może być w rzeczywistości bardziej złożone.
Hemopoetyczna komórka macierzysta: prekursor guzków śledziony i prawdopodobnie zdolna do różnicowania się we wszystkie drogi poza limfoidalną, tj. granulocyt, erytroid, monocyt, megakariocyt; często określana jako CFU-GEMM.
Erytroidalna komórka macierzysta: dająca początek erytrocytom. Erytropoetyna, hormon glikoproteinowy powstający w nerkach w odpowiedzi na niedotlenienie, przyspiesza różnicowanie prekursorów krwinek czerwonych i w ten sposób dostosowuje produkcję krwinek czerwonych do zapotrzebowania na ich zdolność przenoszenia tlenu, typowy przykład „ujemnego sprzężenia zwrotnego”.
Wspólny prekursor granulocytów-monocytów: względna proporcja tych dwóch typów komórek jest regulowana przez czynniki „stymulujące wzrost” lub „stymulujące kolonie”.
Klonowanie: Potencjał poszczególnych komórek macierzystych, aby dać początek jednemu lub więcej typom komórek hemopoetycznych został zbadany poprzez izolację pojedynczych komórek i umożliwienie im wielokrotnego podziału, a następnie obserwację, jakie typy komórek można znaleźć wśród potomstwa. Proces ten znany jest jako klonowanie (klon to zestaw komórek potomnych powstałych z jednej komórki macierzystej). Dowody sugerują, że w pewnych warunkach pojedyncza komórka macierzysta może dać początek wszystkim w pełni zróżnicowanym komórkom dorosłego układu hemopoetycznego.
Neutrofil (polimorf): Najczęstszy leukocyt we krwi człowieka, krótko żyjąca komórka fagocytująca, której ziarnistości zawierają liczne substancje bakteriobójcze. Neutrofile są pierwszymi komórkami, które opuszczają krew i wnikają do miejsc zakażenia lub zapalenia.
Eozynofil: leukocyt z dużymi refrakcyjnymi ziarnistościami, które zawierają szereg wysoce zasadowych lub „kationowych” białek, prawdopodobnie ważnych w zabijaniu większych pasożytów, w tym robaków.
Bazofil: leukocyt z dużymi bazofilnymi ziarnistościami, które zawierają heparynę i aminy wazoaktywne, ważne w odpowiedzi zapalnej. Powyższe trzy typy komórek są często określane zbiorczo jako „granulocyty”.
Megakariocyt: komórka macierzysta płytek krwi.
Płytki krwi: Małe komórki odpowiedzialne za uszczelnianie uszkodzonych naczyń krwionośnych („hemostaza”), ale także źródło wielu mediatorów stanu zapalnego.
Monocyt: Komórka prekursorowa we krwi rozwijająca się w makrofaga, gdy migruje do tkanek. Dodatkowe monocyty są przyciągane do miejsc zapalenia, stanowiąc rezerwuar makrofagów i być może również komórek dendrytycznych.
Makrofag: Główny fagocyt rezydenta tkanek i jam surowiczych, takich jak opłucna i otrzewna.
DC (komórka dendrytyczna): Komórki dendrytyczne występują we wszystkich tkankach organizmu (np. komórki Langerhansa w skórze), gdzie pobierają antygen, a następnie migrują do obszarów komórek T węzła chłonnego lub śledziony przez limfaty lub krew. Ich główną funkcją jest aktywacja odporności T-komórkowej, ale mogą być również zaangażowane w indukcję tolerancji. Drugi podzbiór plazmacytoidalnych DC (nazwa ta pochodzi od ich morfologicznego podobieństwa do komórek plazmatycznych) jest głównym producentem interferonów typu I, ważnej grupy białek przeciwwirusowych. Chociaż eksperymentalnie komórki dendrytyczne często wywodzą się z komórek mieloidalnych, linia rozwojowa komórek dendrytycznych w szpiku kostnym jest nadal przedmiotem debaty.
Komórka NK (natural killer): Komórka podobna do limfocytu, zdolna do zabijania niektórych komórek zakażonych wirusem i niektórych komórek nowotworowych, ale posiadająca złożone zestawy receptorów, które są całkiem odmienne od tych na prawdziwych limfocytach (więcej szczegółów patrz Ryc. 10). Komórki NK i limfocyty T mogą mieć wspólnego prekursora.
Limfocyty T i B: Limfocyty T (wywodzące się z grasicy) i B (wywodzące się ze szpiku kostnego lub, u ptaków, z bursy) są głównymi komórkowymi składnikami odporności adaptacyjnej. Limfocyty B są prekursorem komórek tworzących przeciwciała. W życiu płodowym rolę „bursy” może pełnić wątroba.
Komórka plazmatyczna: Komórka B w jej stanie wysokiego wydzielania przeciwciał. Pomimo swojej nazwy, komórki plazmatyczne są rzadko widoczne we krwi, ale znajdują się w śledzionie, węzłach chłonnych, itp. zawsze, gdy wytwarzane są przeciwciała. Komórki plazmatyczne nie dzielą się i nie mogą być utrzymywane przez dłuższy czas w warunkach in vitro. Jednakże, limfocyty B produkujące specyficzne przeciwciała mogą być łączone z komórką nowotworową w celu wytworzenia nieśmiertelnego klonu hybrydowego lub „hybridoma”, który nadal wydziela przeciwciała o określonej specyficzności. Takie przeciwciała monoklonalne okazały się niezwykle wartościowe jako specyficzne narzędzia w wielu gałęziach biologii, a kilka z nich jest obecnie rutynowo stosowanych w leczeniu chorób autoimmunologicznych i nowotworów.
Komórka tuczna: Duża komórka tkankowa wywodząca się z krążących bazofili. Komórki tuczne są szybko wyzwalane przez uszkodzenie tkanki w celu zainicjowania odpowiedzi zapalnej, która powoduje wiele form alergii.
Faktory wzrostu: Cząsteczki, które kontrolują proliferację i różnicowanie komórek hemopoetycznych, często są również zaangażowane w regulację odpowiedzi immunologicznych – interleukiny lub cytokiny. Niektóre z nich zostały po raz pierwszy odkryte przez hematologów i są nazywane „czynnikami stymulującymi kolonie” (CSF), ale różne nazwy nie mają większego znaczenia i rzeczywiście jedna z nich, IL-3, jest często znana jako „multi-CSF”. Czynniki wzrostu są stosowane w praktyce klinicznej w celu zwiększenia poszczególnych podgrup komórek krwi, a erytropoetyna była jednym z pierwszych z nowej generacji białek produkowanych przez „rekombinowaną” technologię, które były stosowane w klinice, a także przez sportowców chcących zwiększyć liczbę czerwonych krwinek.
.
Leave a Reply