Domaine de recherche
La grande majorité des cellules impliquées dans l’immunité des mammifères sont dérivées de précurseurs dans la moelle osseuse (moitié gauche de la figure 1) et circulent dans le sang, entrant et parfois sortant des tissus lorsque cela est nécessaire. Une cellule souche très rare persiste dans la moelle osseuse adulte (à une fréquence d’environ 1 sur 100 000 cellules), et conserve la capacité de se différencier en tous les types de cellules sanguines. L’hémopoïèse a été étudiée soit en injectant de petits nombres de cellules de moelle marquées génétiquement à des souris receveuses et en observant la descendance qu’elles donnent (clonage in vivo), soit en cultivant les précurseurs de la moelle osseuse en présence de facteurs de croissance appropriés (clonage in vitro). La prolifération et la différenciation de toutes ces cellules sont sous le contrôle de facteurs de croissance solubles ou membranaires produits par le stroma de la moelle osseuse et entre eux. À l’intérieur de la cellule, ces signaux activent des facteurs de transcription spécifiques, des molécules de liaison à l’ADN qui agissent comme des interrupteurs maîtres déterminant le programme génétique ultérieur, donnant lieu au développement des différents types de cellules (appelés lignées). Des études récentes ont montré qu’il est possible de transformer un type de cellule différencié en un autre en introduisant expérimentalement les bons facteurs de transcription dans la cellule. Cette découverte a des implications thérapeutiques importantes, par exemple pour guérir les immunodéficiences génétiques. La plupart des cellules hématopoïétiques cessent de se diviser une fois qu’elles sont complètement différenciées. Cependant, les lymphocytes se divisent rapidement et se développent après une exposition à un antigène. L’augmentation du nombre de lymphocytes spécifiques d’un antigène constitue la base de la mémoire immunologique.
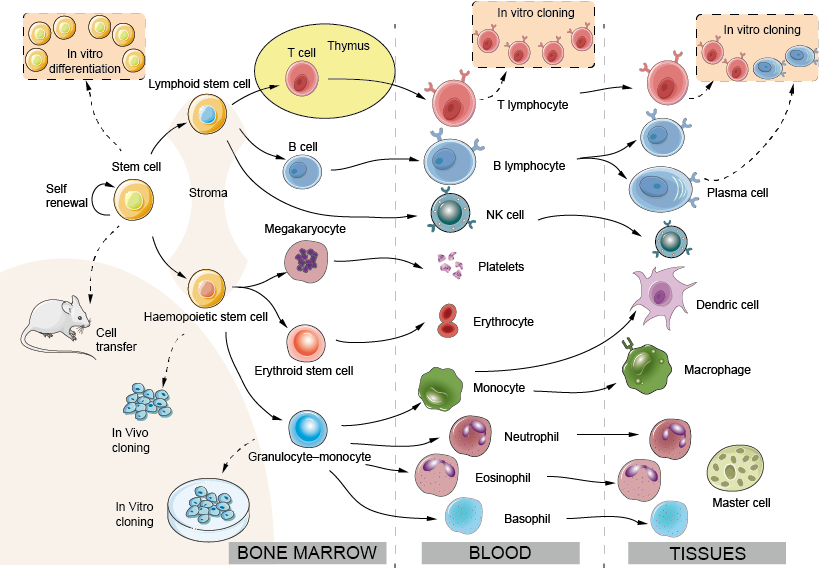
Figure 1. Développement des cellules immunitaires : le système hémopoïétique
Moelle osseuse : Contrairement à la plupart des autres tissus ou organes, le système hémopoïétique se renouvelle constamment. Chez l’adulte, le développement des cellules hémopoïétiques se fait principalement dans la moelle osseuse. Chez le fœtus, avant que les os ne se développent, l’hémopoïèse se produit d’abord dans le sac vitellin, puis dans le foie.
Stroma : cellules épithéliales et endothéliales qui fournissent un support et sécrètent des facteurs de croissance pour l’hémopoïèse.
Cellule souche : la cellule de moelle totipotente et auto-renouvelable. Les cellules souches se trouvent en faible nombre dans le sang ainsi que dans la moelle osseuse et leur nombre peut être stimulé par un traitement avec des facteurs de croissance appropriés (par exemple, le G-CSF), ce qui facilite grandement le processus de transplantation de moelle osseuse.
Cellule souche lymphoïde : présumée capable de se différencier en lymphocytes T ou B. Des données très récentes suggèrent que la distinction entre les cellules souches lymphoïdes et myéloïdes pourrait en fait être plus complexe.
Cellule souche hémopoïétique : précurseur des nodules de la rate et probablement capable de se différencier dans toutes les voies sauf la voie lymphoïde, c’est-à-dire granulocyte, érythroïde, monocyte, mégacaryocyte ; souvent appelée UFC-GEMM.
Cellule souche érythroïde : donnant naissance aux érythrocytes. L’érythropoïétine, une hormone glycoprotéique formée dans le rein en réponse à l’hypoxie, accélère la différenciation des précurseurs des globules rouges et ajuste ainsi la production de ces derniers à la demande de leur capacité de transport d’oxygène, un exemple typique de « rétroaction négative ».
Précurseur commun granulocyte-monocyte : la proportion relative de ces deux types de cellules est régulée par des facteurs de « croissance » ou de « stimulation des colonies ».
Clonage : Le potentiel des cellules souches individuelles à donner naissance à un ou plusieurs types de cellules hémopoïétiques a été exploré en isolant des cellules uniques et en leur permettant de se diviser de nombreuses fois, puis en observant quels types de cellules peuvent être trouvés parmi la progéniture. Ce processus est connu sous le nom de clonage (un clone étant un ensemble de cellules filles provenant toutes d’une seule cellule mère). Des données suggèrent que, dans certaines conditions, une seule cellule souche peut donner naissance à toutes les cellules entièrement différenciées d’un système hémopoïétique adulte.
Neutrophile (polymorphe) : Leucocyte le plus courant du sang humain, cellule phagocytaire de courte durée dont les granules contiennent de nombreuses substances bactéricides. Les neutrophiles sont les premières cellules à quitter le sang et à pénétrer dans les sites d’infection ou d’inflammation.
Eosinophile : Leucocyte doté de grands granules réfractiles qui contiennent un certain nombre de protéines hautement basiques ou « cationiques », peut-être importantes pour tuer les parasites plus grands, y compris les vers.
Basophile : Leucocyte doté de grands granules basophiles qui contiennent de l’héparine et des amines vasoactives, importantes dans la réponse inflammatoire. Les trois types de cellules ci-dessus sont souvent appelés collectivement « granulocytes ».
Mégacaryocyte : la cellule mère des plaquettes sanguines.
Plaquettes : Petites cellules responsables de l’étanchéité des vaisseaux sanguins endommagés (« hémostase ») mais aussi source de nombreux médiateurs inflammatoires.
Monocyte : Cellule précurseur du sang se développant en macrophage lorsqu’elle migre dans les tissus. Des monocytes supplémentaires sont attirés vers les sites d’inflammation, fournissant un réservoir de macrophages et peut-être aussi de cellules dendritiques.
Macrophage : Le principal phagocyte résident des tissus et des cavités séreuses telles que la plèvre et le péritoine.
DC (cellule dendritique) : Les cellules dendritiques sont présentes dans tous les tissus de l’organisme (par exemple les cellules de Langerhans de la peau) où elles absorbent l’antigène puis migrent vers les zones de cellules T du ganglion lymphatique ou de la rate via les lymphatiques ou le sang. Leur principale fonction est d’activer l’immunité des cellules T, mais elles peuvent également être impliquées dans l’induction de la tolérance. Un deuxième sous-ensemble de cellules dendritiques plasmacytoïdes (un nom qui provient de leur ressemblance morphologique avec les plasmocytes) sont les principaux producteurs d’interférons de type I, un groupe important de protéines antivirales. Bien qu’expérimentalement, les cellules dendritiques soient souvent dérivées des cellules myéloïdes, la lignée de développement des cellules dendritiques dans la moelle osseuse fait encore l’objet de débats.
Cellule NK (natural killer) : Cellule semblable à un lymphocyte, capable de tuer certaines cellules infectées par un virus et certaines cellules tumorales, mais dotée d’ensembles complexes de récepteurs bien distincts de ceux des vrais lymphocytes (pour plus de détails, voir la figure 10). Les cellules NK et les cellules T peuvent partager un précurseur commun.
Llymphocytes T et B : Les lymphocytes T (dérivés du thymus) et B (dérivés de la moelle osseuse ou, chez les oiseaux, de la bourse) sont les principaux composants cellulaires de l’immunité adaptative. Les lymphocytes B sont les précurseurs des cellules productrices d’anticorps. Dans la vie fœtale, le foie peut jouer le rôle de « bourse ».
Cellule plasmatique : Une cellule B dans son état de sécrétion d’anticorps à haut débit. Malgré leur nom, les plasmocytes sont rarement observés dans le sang, mais se trouvent dans la rate, les ganglions lymphatiques, etc, chaque fois que des anticorps sont fabriqués. Les plasmocytes ne se divisent pas et ne peuvent pas être maintenus pendant des périodes prolongées in vitro. Cependant, les lymphocytes B produisant des anticorps spécifiques peuvent être fusionnés avec une cellule tumorale pour produire un clone hybride immortel ou « hybridome », qui continue à sécréter des anticorps d’une spécificité prédéterminée. De tels anticorps monoclonaux se sont révélés d’une énorme valeur en tant qu’outils spécifiques dans de nombreuses branches de la biologie, et plusieurs d’entre eux sont maintenant utilisés en routine pour le traitement des maladies auto-immunes et du cancer.
Cellule mammaire : Une grande cellule tissulaire dérivée du basophile circulant. Les mastocytes sont rapidement déclenchés par des lésions tissulaires pour initier la réponse inflammatoire à l’origine de nombreuses formes d’allergie.
Facteurs de croissance : Les molécules qui contrôlent la prolifération et la différenciation des cellules hémopoïétiques sont souvent aussi impliquées dans la régulation des réponses immunitaires : les interleukines ou cytokines. Certaines d’entre elles ont été découvertes par des hématologues et sont appelées « facteurs de stimulation des colonies » (CSF), mais les différents noms n’ont pas de réelle signification, et l’une d’entre elles, l’IL-3, est souvent appelée « multi-CSF ». Les facteurs de croissance sont utilisés en pratique clinique pour stimuler des sous-ensembles particuliers de cellules sanguines, et l’érythropoïétine a été l’une des premières de la nouvelle génération de protéines produites par technologie « recombinante » à être utilisée en clinique, ainsi que par les athlètes souhaitant augmenter leur nombre de globules rouges.
Leave a Reply