Forskningsområde
De fleste celler, der er involveret i pattedyrs immunitet, stammer fra forstadier i knoglemarven (venstre halvdel af figur 1) og cirkulerer i blodet, hvor de kommer ind i og nogle gange forlader vævene, når det er nødvendigt. En meget sjælden stamcelle forbliver i den voksne knoglemarv (med en hyppighed på ca. 1 ud af 100 000 celler) og bevarer evnen til at differentiere sig til alle typer blodceller. Bloddannelsen er blevet undersøgt enten ved at injicere små mængder genetisk markerede marvceller i recipientmus og observere de afkom, de giver anledning til (in vivo-kloning) eller ved at dyrke knoglemarvsforløbere i nærværelse af passende vækstfaktorer (in vitro-kloning). Proliferation og differentiering af alle disse celler er under kontrol af opløselige eller membranbundne vækstfaktorer, der produceres af knoglemarvsstromaet og af hinanden. Inden for cellen aktiverer disse signaler specifikke transkriptionsfaktorer, DNA-bindende molekyler, der fungerer som hovedafbrydere, der bestemmer det efterfølgende genetiske program, hvilket igen giver anledning til udvikling af de forskellige celletyper (kaldet lineager). Bemærkelsesværdigt nok har nyere undersøgelser vist, at det er muligt at omdanne en differentieret celletype til en anden ved eksperimentelt at indføre de rigtige transkriptionsfaktorer i cellen. Denne opdagelse har vigtige terapeutiske konsekvenser, f.eks. i forbindelse med helbredelse af genetiske immundefekter. De fleste hæmopoietiske celler holder op med at dele sig, når de er fuldt differentieret. Men lymfocytter deler sig hurtigt og udvider sig, når de udsættes for antigen. Det øgede antal lymfocytter, der er specifikke for et antigen, danner grundlaget for immunologisk hukommelse.
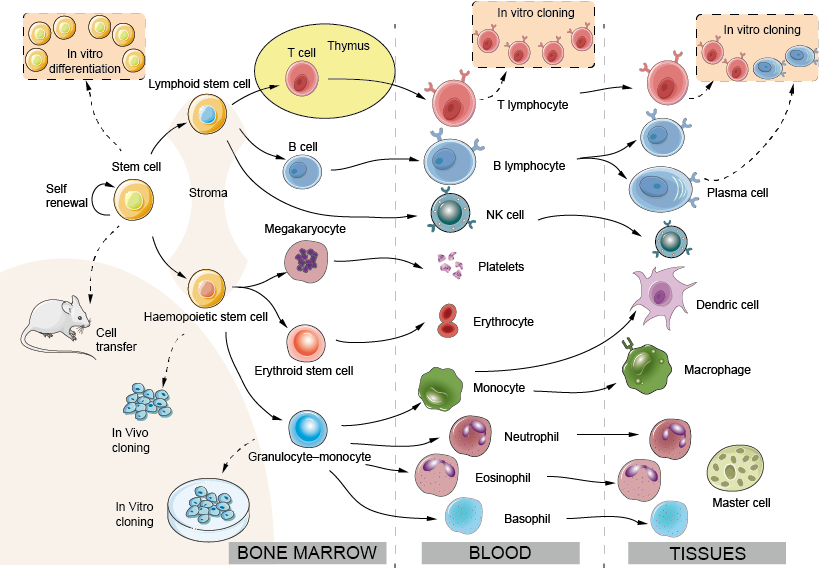
Figur 1. Udvikling af immunceller: det hæmopoietiske system
Benmarv: I modsætning til de fleste andre væv eller organer fornyer det hæmopoietiske system sig konstant. Hos den voksne sker udviklingen af hæmopoietiske celler fortrinsvis i knoglemarven. Hos fosteret, før knoglerne udvikles, sker hæmopoiese først i æggeblommesækken og derefter i leveren.
Stroma: Epithel- og endotelceller, der yder støtte og udskiller vækstfaktorer til hæmopoiese.
Stamcelle: Den totipotente og selvfornyende marvcelle. Stamceller findes i lavt antal i blod såvel som i knoglemarv, og antallet kan øges ved behandling med passende vækstfaktorer (f.eks. G-CSF), hvilket i høj grad letter knoglemarvstransplantationsprocessen.
Lymphoid stamcelle: formodes at være i stand til at differentiere sig til T- eller B-lymfocytter. Meget nyere data tyder på, at sondringen mellem lymfoide og myeloide stamceller i virkeligheden kan være mere kompleks.
Hemopoietisk stamcelle: forløberen for miltknuder og sandsynligvis i stand til at differentiere til alle andre end de lymfoide veje, dvs. granulocytter, erytroider, monocytter og megakaryocytter; ofte benævnt CFU-GEMM.
Erythroide stamcelle: giver anledning til erytrocytter. Erythropoietin, et glykoproteinhormon, der dannes i nyren som reaktion på hypoxi, fremskynder differentieringen af forstadier til røde blodlegemer og tilpasser således produktionen af røde blodlegemer til efterspørgslen efter deres ilttransporterende kapacitet, et typisk eksempel på ‘negativ feedback’.
Granulocyt-monocyt fælles forstadie: Den relative andel af disse to celletyper reguleres af ‘vækst-‘ eller ‘kolonistimulerende’ faktorer.
Kloning: Man har undersøgt de enkelte stamcellers potentiale til at give anledning til en eller flere typer af hæmopoetiske celler ved at isolere enkelte celler og lade dem dele sig mange gange og derefter observere, hvilke celletyper der kan findes blandt afkommet. Denne proces er kendt som kloning (en klon er et sæt datterceller, der alle stammer fra en enkelt modercelle). Der er tegn på, at en enkelt stamcelle under visse betingelser kan give anledning til alle de fuldt differentierede celler i et voksent hæmopoietisk system.
Neutrofil (polymorft): Den mest almindelige leukocyt i menneskets blod, en kortlivet fagocytisk celle, hvis granulat indeholder talrige bakteriedræbende stoffer. Neutrofile er de første celler, der forlader blodet og går ind på infektions- eller betændelsessteder.
Eosinofil: En leukocyt med store refraktile granula, der indeholder en række stærkt basiske eller “kationiske” proteiner, som muligvis er vigtige for at dræbe større parasitter, herunder orme.
Basofil: En leukocyt med store basofile granula, der indeholder heparin og vasoaktive aminer, som er vigtige i det inflammatoriske respons. Ovennævnte tre celletyper omtales ofte samlet som “granulocytter”.
Megakaryocyt: Modercelle for blodpladerne.
Blodpladerne: Små celler, der er ansvarlige for at forsegle beskadigede blodkar (‘hæmostase’), men som også er kilde til mange inflammatoriske mediatorer.
Monocyt: En forstadiecelle i blodet, der udvikler sig til en makrofag, når den vandrer ind i vævene. Yderligere monocytter tiltrækkes til betændelsessteder, hvilket giver et reservoir af makrofager og måske også dendritiske celler.
Makrofag: Den vigtigste residente fagocyt i væv og serøse hulrum, f.eks. i pleura og peritoneum.
DC (dendritisk celle): Dendritiske celler: Dendritiske celler findes i alle kroppens væv (f.eks. Langerhanscellerne i huden), hvor de optager antigen og derefter vandrer til T-celleområderne i lymfeknuderne eller milten via lymfeknuderne eller blodet. Deres vigtigste funktion er at aktivere T-celleimmunitet, men de kan også være involveret i toleranceinduktion. En anden undergruppe af plasmacytoide DC (et navn, der stammer fra deres morfologiske lighed med plasmaceller) er de vigtigste producenter af type I-interferoner, en vigtig gruppe af antivirale proteiner. Selv om dendritiske celler eksperimentelt set ofte er afledt af myeloide celler, er den dendritiske celles udviklingsmæssige afstamning i knoglemarven stadig genstand for debat.
NK (natural killer)-celle: En lymfocytlignende celle, der er i stand til at dræbe nogle virusinficerede celler og nogle tumorceller, men med komplekse sæt receptorer, der er helt forskellige fra dem på ægte lymfocytter (for flere detaljer se fig. 10). NK-celler og T-celler kan have en fælles forløber.
T- og B-lymfocytter: T-lymfocytter (fra thymus) og B-lymfocytter (fra knoglemarven eller, hos fugle, fra bursa) er de vigtigste cellulære komponenter i den adaptive immunitet. B-lymfocytter er forløberen for antistofdannende celler. I fosterlivet kan leveren spille rollen som “bursa”.
Plasmacelle: En B-celle i sin antistofudskillende tilstand med høj hastighed. På trods af deres navn ses plasmaceller sjældent i blodet, men findes i milt, lymfeknuder m.v., når der dannes antistoffer. Plasmaceller deler sig ikke og kan ikke opretholdes i længerevarende perioder in vitro. B-lymfocytter, der producerer specifikke antistoffer, kan imidlertid fusioneres med en tumorcelle for at frembringe en udødelig hybridklon eller “hybridom”, som fortsætter med at udskille antistoffer af en forudbestemt specificitet. Sådanne monoklonale antistoffer har vist sig at være af enorm værdi som specifikke redskaber inden for mange grene af biologien, og flere af dem anvendes nu rutinemæssigt til behandling af autoimmune sygdomme og kræft.
Mastcelle: En stor vævscelle, der stammer fra den cirkulerende basofil. Mastceller udløses hurtigt af vævsskader for at igangsætte det inflammatoriske respons, som forårsager mange former for allergi.
Vækstfaktorer: De molekyler, der styrer spredning og differentiering af hæmopoietiske celler, er ofte også involveret i reguleringen af immunreaktioner – interleukinerne eller cytokinerne. Nogle af dem blev først opdaget af hæmatologer og kaldes “koloni-stimulerende faktorer” (CSF), men de forskellige navne har ingen reel betydning, og faktisk er en af dem, IL-3, ofte kendt som “multi-CSF”. Vækstfaktorer anvendes i klinisk praksis til at øge bestemte undergrupper af blodceller, og erythropoietin var en af de første af den nye generation af proteiner fremstillet ved “rekombinant” teknologi, der blev anvendt i klinikken og også af sportsfolk, der ønsker at øge deres antal røde blodlegemer.
Leave a Reply