Frontiers in Celland Developmental Biology
Tło
Podstawowa jednostka aparatu Golgiego jest zwykle uważana za stos cystern, który jest silnie spolaryzowany, z cis-twarzą odbierającą ładunki z ER i trans-twarzą stosu, TGN, związaną z sortowaniem ładunków do eksportu post-Golgi (Boncompain i Perez, 2013). Organizacja tych mini-stosów w komórce jest jednak różna u różnych organizmów. U roślin i bezkręgowców poszczególne stosy Golgiego są rozproszone niezależnie w cytoplazmie, podczas gdy w większości komórek kręgowców podczas interfazy poszczególne stosy Golgiego zlepiają się ze sobą w zwartą strukturę wstęgową zlokalizowaną w bliskim sąsiedztwie MTOC (Wei i Seemann, 2017). Strukturę wstęgi Golgiego w komórkach ssaków najlepiej ujawnia mikroskopia elektronowa (Rambourg i Clermont, 1997); mikroskopia optyczna o wysokiej rozdzielczości z wykorzystaniem markerów cis i trans może również wykryć organizację wstęgi (Gosavi i in., 2018). Ważnym pytaniem badanym w tej dziedzinie jest znaczenie struktury wstęgi Golgiego i różnice funkcjonalne wstęgi Golgiego w porównaniu z „izolowanymi mini-stackami Golgiego” lub innymi stanami architektury Golgiego. Innymi słowy, co jest ewolucyjną zaletą bardziej złożonej morfologii wstążki aparatu Golgiego w komórkach kręgowców i jakie funkcje mogą być regulowane przez przejście do nie wstążkowej struktury?
Badania w ciągu ostatnich kilku lat ujawniają, że błony Golgiego stanowią platformę dla regulacji szeregu procesów komórkowych, w tym polaryzacji komórek (Kupfer i in., 1983), ukierunkowaną migrację (Millarte i Farhan, 2012), stres (Sasaki i Yoshida, 2015), naprawę DNA (Farber-Katz i in., 2014), mitozę (Rabouille i Kondylis, 2007), metabolizm (Abdel Rahman i in., 2015), odpowiedzi prozapalne (Chen i Chen, 2018) i autofagię (Yamamoto i in., 2012; Lamb i in., 2013). Rzeczywiście, w komórkach ssaków istnieją obecnie znaczące dowody na to, że Golgi, podobnie jak inne organelle wewnątrzkomórkowe, może działać jako czujnik komórkowy (Farhan i Rabouille, 2011; Mayinger, 2011; Millarte i Farhan, 2012; Sasaki i Yoshida, 2015; Luini i Parashuraman, 2016; Gosavi i Gleeson, 2017; Makhoul i in., 2018). Staje się również jasne, że dokładna morfologia Golgiego ma znaczenie dla regulacji wielu z tych procesów komórkowych (Makhoul i in., 2018). Związek morfologii Golgiego z sygnalizacją został potwierdzony przez badania kinomów i fosfatomów w całym genomie, które zidentyfikowały dużą kohortę kinaz i fosfataz (20% wszystkich w genomie) wpływających na morfologię Golgiego (Chia i in., 2012). Zmiany w morfologii Golgiego obejmowały albo fragmentację Golgiego (utrata wstęgi Golgiego) albo tworzenie bardzo zwartego i skondensowanego Golgiego w lokalizacji okołojądrowej. Znaczenie aktyny w regulacji morfologii Golgiego zostało podkreślone w tym badaniu poprzez identyfikację szeregu kinaz, na przykład ROCK1 i PAK1, które regulują dynamikę aktyny i modulują strukturę Golgiego (Chia i in., 2012). Inne analizy obejmujące cały genom również podkreśliły prawdopodobieństwo, że Golgi może odbierać i przekazywać wiele różnych sygnałów, które mogą wpływać nie tylko na szlaki transportu błonowego, ale także na inne procesy, apoptozę, mitozę, autofagię i odpowiedzi na stres (Farhan i in., 2010; Millarte i in., 2015).
Struktura wstęgi Golgiego jest wysoce dynamiczna i może ulegać bardzo szybkiej przebudowie podczas szeregu różnych warunków. Na przykład, podczas mitozy demontaż wstęgi Golgiego jest wczesnym wydarzeniem w przejściu G2/M i odgrywa ważną rolę jako punkt kontrolny cyklu komórkowego w promowaniu wejścia mitotycznego (Wei i Seemann, 2010; Corda i in., 2012). Regulacja dynamiki Golgiego odbywa się poprzez interakcje pomiędzy rusztowaniami molekularnymi zlokalizowanymi na błonie Golgiego a cytoszkieletem. Dynamika MT może regulować lokalizację wstęgi Golgiego przy centrosomie oraz repozycjonowanie Golgiego w celu ułatwienia spolaryzowanego traffikowania i ukierunkowanego wydzielania (Millarte i Farhan, 2012; Sanders i Kaverina, 2015). Ponadto, składniki błonowe Golgiego mogą również nukleować i stabilizować mikrotubule zarówno w cis- jak i trans-Golgi, a zatem samo Golgi jest również MTOC (Efimov i in., 2007; Wu i in., 2016). Procesy mediowane przez aktynę również przyczyniają się do formy i funkcji Golgiego i zidentyfikowano co najmniej dziewięć zlokalizowanych w Golgim rusztowań molekularnych, które oddziałują z cytoszkieletem aktynowym . Wzmocnienie polimeryzacji aktyny w Golgi powoduje rozproszenie wstęgi, podczas gdy hamowanie polimeryzacji aktyny za pomocą specyficznych leków, takich jak latrunculina A, powoduje zagęszczenie Golgi (Lazaro-Dieguez i in., 2006; Makhoul i in., 2018, 2019). Biorąc pod uwagę te sieci regulacyjne, które modulują strukturę wstęgi Golgiego, uważamy za bardzo prawdopodobne, że równowaga między wstęgą Golgiego a mini-stackami Golgiego może definiować zarówno jakościowe, jak i ilościowe odpowiedzi szlaków sygnalizacyjnych. Związek między morfologią Golgiego a sygnalizacją ma również ważne konsekwencje dla zrozumienia molekularnych podstaw wielu chorób, które są związane z utratą wstęgi Golgiego i pojawieniem się rozproszonego Golgiego. Na przykład, wykazano, że przeżywalność niektórych komórek nowotworowych jest związana z rozproszonym Golgim, które zmniejsza poziom apoptozy (Farber-Katz i in., 2014; Petrosyan, 2015).
What Does Golgi Fragmentation Mean?
Termin „fragmentacja Golgiego” jest powszechnie używany do opisania morfologicznego statusu rozproszonego Golgiego w komórkach ssaków, jak wykryto przez mikroskopię optyczną barwioną markerami Golgiego. Rozproszone Golgi jest często obserwowane w systemach eksperymentalnych, na przykład, gdy komórki są traktowane lekami perturbującymi cytoszkielet, np. nocodazolem (Wei i Seemann, 2010), gdy strumień błonowy jest perturbowany lub gdy komponenty maszynerii transportowej Golgi, lub systemu interakcji cytoszkieletowych, są znokautowane, znokautowane lub nadekspresjonowane (Zappa i in., 2018). W różnych stanach fizjologicznych, na przykład stresie (Serebrenik i in., 2018) i stanach patologicznych, w szczególności nowotworach i neurodegeneracji, Golgi często traci typową zwartą lokalizację juxtanuclear i jest obserwowana w mikroskopii konfokalnej jako rozproszone struktury w całej cytoplazmie . Istnieje coraz większa liczba doniesień opisujących fragmentację Golgiego w warunkach fizjologicznych i patologicznych (Rysunek 1A). Jednak problem z użyciem terminu „pofragmentowany” polega na tym, że sugeruje on, że integralność strukturalna Golgiego jest utracona i że morfologia związana z „pofragmentowaną” strukturą reprezentuje zdezintegrowaną, nieprawidłową lub zniszczoną organellę. W wielu przypadkach jest to wyraźnie mylące, ponieważ poszczególne stosy Golgiego mogą pozostać nienaruszone i mogą zachować klasyczne funkcje organelli, a mianowicie glikozylację i transport błonowy. Rzeczywiście, rozproszone mini-stosunki Golgiego występują w niektórych wyspecjalizowanych komórkach, takich jak zróżnicowane mioblasty (Lu i in., 2001), zróżnicowane neurony, które zawierają pojedyncze stosy Golgiego lub „placówki” wzdłuż dendrytów (Lasiecka i Winckler, 2011), komórki okładzinowe żołądka (Gunn i in., 2011) i komórki uroepitelialne pęcherza moczowego (Kreft i in., 2010), bez widocznego niedoboru w transporcie błonowym i glikozylacji. Rozproszenie wstęgi Golgiego związane z warunkami doświadczalnymi i patologicznymi może raczej odzwierciedlać przesunięcie dynamicznej równowagi pomiędzy morfologią zwartej wstęgi a poszczególnymi mini-stosami Golgiego lub może skutkować zaburzeniem architektury wstęgi, jak również integralności stosu Golgiego. Jest to istotna kwestia, ponieważ dokładny status morfologiczny Golgiego będzie bardzo prawdopodobnie wpływał, w niektórych przypadkach, na wydajność transportu i glikozylacji (Puthenveedu i in., 2006), a w innych przypadkach na różne sieci sygnalizacyjne, ale niekoniecznie na transport czy glikozylację. Ważne jest, aby odróżnić nienaruszone mini-stosy Golgiego od utraty integralności stosów Golgiego w definiowaniu tego, co jest rozumiane jako „pofragmentowany” Golgi. Tutaj dokonujemy przeglądu różnych morfologii Golgiego, które zostały wykryte i scharakteryzowane w eksperymentalnym, fizjologicznym i patologicznym ustawieniu.
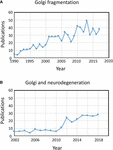
Figura 1. Publikacje identyfikujące fragmentację wstęgi Golgiego. (A) Liczba publikacji w ciągu roku z terminem fragmentacja Golgiego w tytule lub abstrakcie. (B) Liczba publikacji na rok, w których Golgiego zostało zbadane w chorobach neurodegeneracyjnych. Dane pochodzą od Alexandru Dan Corlan. Medline trend: zautomatyzowane roczne statystyki wyników PubMed dla dowolnego zapytania, 2004. Zasób internetowy pod adresem URL: http://dan.corlan.net/medline-trend.html. Dostęp: 2019-04-29.
Rethinking the Terminology of Golgi Morphological States
Struktury fragmentów Golgiego różnią się w zależności od charakteru ścieżki zaangażowanej w perturbację lub modulację wstęgi Golgiego. Ważne jest, aby mieć lepszą ultrastrukturalną charakterystykę „fragmentów” Golgiego po utracie wstęgi Golgiego, ponieważ wynik funkcjonalny prawdopodobnie będzie bardzo różny w zależności od dokładnych struktur Golgiego. Oprócz warunków, które skutkują wydłużoną wstęgą Golgiego, możemy zidentyfikować z literatury co najmniej 4 różne scenariusze związane z „fragmentacją” wstęgi Golgiego. Zostały one przedstawione na Rysunku 2 i opisane w następujący sposób:
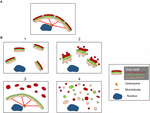
Rysunek 2. Model pokazujący różne morfologie Golgiego po „fragmentacji” struktury wstęgi Golgiego. (A) Nienaruszona struktura wstęgi Golgiego i (B) różne scenariusze pokazujące utratę wstęgi Golgiego. (1) Scenariusz, w którym nienaruszone mini-stosunki Golgiego są rozproszone w cytoplazmie; (2) Scenariusz, w którym integralność rozproszonych stosów Golgiego jest naruszona ze skróconymi cysternami, obrzękiem cystern i wzrostem powiązanych z Golgim kanalików i pęcherzyków; (3) Scenariusz, w którym następuje rozproszenie jednego przedziału Golgiego. Tutaj TGN jest selektywnie rozproszony w cytoplazmie, podczas gdy reszta stosu pozostaje w strukturze wstążki; (4) Scenariusz, w którym następuje utrata wstążki i stosów z błonami Golgiego rozproszonymi głównie jako kanaliki i pęcherzyki. Numery odnoszą się do klasyfikacji morfologii Golgiego podanej w tekście.
(1) Konwersja wstęgi Golgiego do stosów Golgiego. Tutaj utrata (lub zmniejszenie długości) wstęgi Golgiego wiąże się z rozproszonymi, nienaruszonymi mini-stosami Golgiego. Sytuacja ta występuje w wielu typach komórek, a także w systemach modelowych, takich jak traktowanie nocodazolem lub modulacja poziomów TGN golginy GCC88. Transport membranowy wydaje się być w tych warunkach w dużej mierze niezakłócony, z wyjątkiem ewentualnie dużych ładunków (Ferraro i in., 2014; Lavieu i in., 2014), podczas gdy sygnalizacja mTOR jest zmniejszona, a autofagia wzmocniona (Gosavi i in., 2018).
(2) Utrata zarówno wstęgi Golgiego, jak i integralności stosów Golgiego. W tym scenariuszu dochodzi do utraty struktury wstęgi, a ponadto cysterny poszczególnych stosów mają zmniejszoną długość i/lub liczbę i mogą być również związane z obrzękiem kompartmentu, na przykład nokaut GM130 (Liu i in., 2017) i mutacje podjednostek COG (Blackburn i Lupashin, 2016). Transport membranowy i glikozylacja są prawdopodobnie dotknięte w tym scenariuszu wraz z różnymi sieciami sygnalizacyjnymi.
(3) Rozproszenie jednego przedziału Golgiego. W tym scenariuszu tylko jeden przedział Golgiego jest rozproszony, taki jak rozproszenie TGN ostatnio zgłoszone aktywacja inflammasomu NLRP3 (Chen i Chen, 2018). Pozostała część stosu / wstęgi pozostaje nienaruszona. Identyfikacja tych struktur Golgiego wymaga włączenia mikroskopii EM i optycznej oraz szeregu markerów Golgiego w całym stosie, aby określić dokładne zmiany w morfologii Golgiego.
(4) Konwersja wstęgi Golgiego do elementów tubulovesicular. W tym scenariuszu zarówno wstęga Golgiego, jak i stosy ulegają rozległym perturbacjom z dramatycznym wzrostem struktur tubulovesicularnych, jak w przypadku podczas mitozy (Wei i Seemann, 2017), różnych leków i leczenia komórek amyloidem β (Joshi i in., 2014). Tutaj można by przewidywać wpływ na wiele funkcji Golgiego.
Nie wnioskujemy, że Rysunek 2 przedstawia jedyne morfologie „fragmentów” Golgiego i możliwe jest, że dodatkowe scenariusze zostaną zidentyfikowane w miarę szerszego badania struktur „fragmentów” Golgiego.
Examples of a Relationship Between Golgi Morphology and Cell Process
Koordynacja zmian w morfologii Golgiego i różnych procesów komórkowych otrzymała znaczną uwagę. W celu bardziej szczegółowego podsumowania informacji o tle procesów, na które wpływają zmiany w morfologii Golgiego, takich jak trafficking, glikozylacja, stres, naprawa DNA, czytelnik jest odsyłany do szeregu ostatnich przeglądów (Farhan i Rabouille, 2011; Millarte i Farhan, 2012; Sasaki i Yoshida, 2015; Gosavi i Gleeson, 2017; Makhoul i in., 2019). Poniżej przedstawiono kilka przykładów, aby podkreślić zakres procesów komórkowych, które są regulowane lub koordynowane przez różne stany morfologiczne Golgiego. W wielu innych przypadkach, takich jak niektóre nowotwory i reakcje na stres, wstęga Golgiego jest rozproszona jako fragmenty, jednak morfologia tych fragmentów Golgiego nie została dobrze scharakteryzowana. Dyskusja tutaj będzie skupiona na przykładach, w których morfologia Golgiego jest dobrze określona.
DNA Repair and Cancer
Istnieje intymny związek między morfologią Golgiego a odpowiedzią na uszkodzenia DNA (Farber-Katz et al., 2014). Więźba błonowa Golgiego, GOLPH3, jest onkogenem, a nadekspresja GOLPH3 skutkuje zwiększonym przeżyciem komórek po uszkodzeniach DNA (Scott i in., 2009; Farber-Katz i in., 2014). I odwrotnie, utrata GOLPH3 zapobiega rozproszeniu wstęgi Golgiego, wzmacnia wstęgę Golgiego i promuje apoptozę po uszkodzeniach DNA. W odpowiedzi na uszkodzenia DNA pośredniczy kinaza DNA-PK, która fosforyluje GOLPH3 i promuje „fragmentację” Golgiego poprzez zwiększenie polimeryzacji aktyny przy błonach Golgiego (Dippold i in., 2009). mTOR jest modulowany przez zmiany w morfologii Golgiego mediowane przez GOLPH3 (Scott i in., 2009) i prawdopodobnie przyczynia się do wyniku odpowiedzi na uszkodzenia DNA. Stąd, dokładna struktura Golgiego jest związana z przeżyciem i apoptozą komórek. Tożsamość struktur Golgiego po rozproszeniu wstęgi Golgiego przez fosfo-GOLPH3 pozostaje do scharakteryzowania. Przyszłe badania nad związkiem pomiędzy fragmentacją Golgiego a sygnalizacją mTOR w komórkach nowotworowych będą z pewnością warte uwagi.
Zaburzenia genetyczne związane ze zmienioną morfologią Golgiego
Wiele chorób zostało zidentyfikowanych jako zaburzenia monogenowe spowodowane dziedziczonymi mutacjami składników związanych z mechanizmami transportowymi lub enzymami rezydującymi w Golgim. Wiele z tych chorób jest związanych z fragmentacją wstęgi Golgiego, na przykład defekty w konserwowanym oligomerycznym kompleksie Golgiego (COG) we wrodzonych zaburzeniach glikozylacji (Miller i Ungar, 2012). W wielu przypadkach zaburzenia te wiążą się z patologiami ograniczonymi do ograniczonej liczby narządów lub tkanek. Podstawa specyficzności tkankowej jest słabo poznana, ale prawdopodobnie wynika z niedoborów w glikozylacji i sekrecji, a także zmian w sieciach sygnalizacyjnych związanych z utratą wstęgi Golgiego, takich jak reakcje stresowe Golgiego. Golgiego we wszystkich liniach komórkowych, w których znokautowano podjednostkę COG, wykazują umiarkowane do poważnych zmiany morfologii, jak scharakteryzowano w EM, związane z utratą wstęgi, poszerzonymi cysternami, a w niektórych przypadkach z przerwaniem mini-stacków. Zastosowanie EM miało fundamentalne znaczenie w definiowaniu zmian morfologicznych (Blackburn i Lupashin, 2016).
Choroby neurodegeneracyjne
Stan Golgiego w chorobach neurodegeneracyjnych otrzymał ostatnio znaczną uwagę (Figura 1B). Utrata wstęgi Golgiego jest wspólną cechą wielu chorób neurodegeneracyjnych, w tym choroby Alzheimera, choroby Huntingtona, stwardnienia zanikowego bocznego i choroby Parkinsona (Gonatas i in., 2006; Haase i Rabouille, 2015; Rabouille i Haase, 2015; Sundaramoorthy i in., 2015). Jest bardzo prawdopodobne, że perturbacje w architekturze Golgiego w tych chorobach przyczyniają się do procesów patologicznych. W większości przypadków dokładna struktura morfologiczna fragmentów Golgiego w tych chorobach neurodegeneracyjnych nie została zdefiniowana. Jednakże, dwa systemy eksperymentalne badały ostatnio zmiany w strukturze Golgiego i degeneracji neuronów w sposób dość szczegółowy. Po pierwsze, wykazano, że warunkowy knock out GM130, strukturalnej golginy, która reguluje wstęgę Golgiego, w ośrodkowym układzie nerwowym powoduje fragmentację Golgiego, zanik dendrytów i degenerację neuronów u myszy (Liu i in., 2017). Analiza EM komórek Purkinjego GM130 KO wykazała redukcję długości cystern Golgiego i układania ich w stosy, a ponadto typowe wypustki dendrytów Golgiego były nieobecne w tych komórkach Purkinjego GM130 -/- (Liu i in., 2017). W drugim badaniu, neurony hipokampa z myszy transgenicznych dla szwedzkiej mutacji białka prekursorowego amyloidu (APP) i zmutowanej preseniliny 1 podjednostki γ-sekretazy, gdzie obie mutacje są związane z chorobą Alzheimera o wczesnym początku, ujawniły rozległą fragmentację Golgiego za pomocą mikroskopii optycznej (Joshi i in., 2014). Ilościowa EM neuronów u tych myszy wykazała redukcję liczby i długości cystern w stosach w porównaniu z neuronami pochodzącymi od myszy typu dzikiego. Ponadto, cysterny były obrzęknięte. Wykazano, że zmiany w morfologii Golgiego w tych neuronach pierwotnych były bezpośrednio związane z podwyższonym poziomem produkcji amyloidu-β. Neurony pierwotne poddane działaniu syntetycznego amyloidu-β również wykazywały podobną fragmentację Golgiego, jak również wzrost struktur tubulovesularnych związanych z cysternami Golgiego w porównaniu z komórkami nieleczonymi. Utrata wstęgi Golgiego była spowodowana fosforylacją GRASP65, białka strukturalnego Golgiego, które odgrywa kluczową rolę w demontażu wstęgi Golgiego i stosów w mitozie (Joshi i in., 2014). Porównanie tych dwóch powyższych badań jest pouczające, ponieważ szlaki pośredniczące w zmianach morfologii Golgiego różnią się w każdym przypadku, prowadząc do różnic w morfologii „fragmentów” Golgiego. Należy rozważyć, w jaki sposób te różne szlaki wpływające na morfologię Golgiego wpływają na odpowiedzi downstream.
mTOR Signaling
Nasze laboratorium ustaliło podejście eksperymentalne do perturbacji równowagi między wstęgą Golgiego a mini-stackami Golgiego poprzez modulację dawki GCC88, golginy zlokalizowanej w TGN. Ta strategia pozwoliła na stworzenie stabilnej linii komórkowej HeLa-B6, która nie posiada wstęgi Golgiego. Wykazaliśmy, że GCC88 reguluje równowagę pomiędzy wstęgami Golgiego i mini-stackami poprzez proces zależny od aktyny (Makhoul i in., 2019) i zidentyfikowaliśmy intersektynę-1 (ITSN1), czynnik wymiany nukleotydów guaninowych dla cdc42 (Hussain i in., 2001), jako interaktora GCC88 odpowiedzialnego za utratę wstęgi Golgiego (Makhoul i in., 2019). Analizy komórek HeLa B6, w których brakuje wstęgi Golgiego, wykazały zmniejszoną aktywność mTOR i związany z tym wzrost biogenezy autofagosomów (Gosavi i in., 2018). mTOR jest jednym z głównych szlaków sygnałowych komórek eukariotycznych i wiadomo, że jest negatywnym regulatorem autofagii (Wullschleger i in., 2006). Dlatego też równowaga pomiędzy stosami Golgiego a wstęgą Golgiego ma bezpośredni wpływ na szlak mTORC1. Zastosowanie cis- i trans- specyficznych markerów przedziałowych, oraz tomografii EM, było krytyczne w ujawnieniu zmian morfologicznych we wstędze Golgiego.
Zapalenie
Inflammasomy wrodzonego układu odpornościowego działają jako rusztowanie dla zależnej od kaspazy 1 aktywacji cytokin prozapalnych (Broz i Dixit, 2016). NLRP3 (nucleotide-binding domain, leucine-rich-containing family, pyrin domain-containing-3) jest wszechstronnym inflammasomem, który może być aktywowany przez szereg bodźców mikrobiologicznych i niemikrobiologicznych, co skutkuje wydzielaniem cytokin prozapalnych interleukiny 1β (IL-1β) i interleukiny 18 (IL-18) oraz programowaną śmiercią komórki poprzez piroptozę. Ostatnie badanie wykazało, że aktywacja cytozolowej NLRP3 przez bodźce wiąże się z rekrutacją NLRP3 do rozproszonych błon TGN, aby ułatwić składanie rusztowania NLRP3 (Chen i Chen, 2018). Rozproszona TGN, ale nie leżąca u podstaw innych przedziałów, specjalnie rekrutuje NLRP3, za pośrednictwem PI4P, do złożenia kompleksu adaptorowego ASC, który ulega polimeryzacji w regionie okołojądrowym przed rekrutacją kaspazy-1 w celu aktywacji ścieżki sygnałowej downstream (Chen i Chen, 2018). Stąd to ważne odkrycie pokazuje, że modulacja architektury TGN selektywnie, jest krytyczna w aktywacji tego szlaku. Zastosowanie markerów specyficznych dla przedziału (TGN i cis-Golgi) wraz z analizą optyczną i EM było krytyczne w ujawnieniu zmian morfologicznych w wstędze Golgiego.
Concluding Remarks
Precyzyjna architektura morfologii Golgiego jest określona przez mikroskopię optyczną o wysokiej rozdzielczości i przez EM. Włączenie tej informacji w przyszłych badaniach w terenie zapewni znaczący wgląd w dynamikę Golgiego, ścieżki perturbacji struktury wstęgi i funkcjonalne konsekwencje związane z tymi różnymi ścieżkami.
Podsumowując, proponujemy, że użycie terminu „fragmentaryczny Golgi” jest nieadekwatne do opisu struktur Golgiego związanych z wieloma zabiegami i warunkami, a różnice w tych strukturach Golgiego są prawdopodobnie istotne fizjologicznie. Biorąc pod uwagę dynamiczną naturę aparatu Golgiego, możliwe jest, że może istnieć równowaga pomiędzy różnymi stanami morfologicznymi Golgiego w danym czasie, tj. mini-stackami i strukturami wstęgowymi. Zrozumienie dynamicznej równowagi pomiędzy różnymi morfologiami Golgiego w szczegółach molekularnych jest krytyczne dla pełnego zrozumienia tej organelli podczas normalnych procesów komórkowych, a także w warunkach patologicznych. Fascynujące będzie zobaczyć, co rozwinie się, gdy dowiemy się więcej o funkcjach wyczuwania komórki przez tę złożoną organellę i związku między tymi funkcjami a strukturami Golgiego.
Dostępność danych
Wszystkie zestawy danych analizowane w tym badaniu są zawarte w manuskrypcie i plikach uzupełniających.
Author Contributions
Wszyscy wymienieni autorzy wnieśli istotny, bezpośredni i intelektualny wkład w pracę i zatwierdzili ją do publikacji.
Funding
Ta praca była wspierana przez finansowanie z Australian Research Council (DP160102394).
Oświadczenie o konflikcie interesów
Autorzy deklarują, że badania zostały przeprowadzone przy braku jakichkolwiek komercyjnych lub finansowych relacji, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Abbreviations
GM130, cis-Golgi matrix protein; GMAP210, Golgi microtubule associated protein; GOLPH3, Golgi phosphoprotein 3; GRASP, Golgi reassembly stacking protein; MTOC, microtubule organizing center; mTOR, mechanistic target of rapamycin; PI4P, phosphatidylinositol-4-phosphate; TGN, trans-Golgi network.
Abdel Rahman, A. M., Ryczko, M., Nakano, M., Pawling, J., Rodrigues, T., Johswich, A., et al. (2015). Golgi N-glikan branching N-acetylglucosaminyltransferases I, V i VI promote nutrient uptake and metabolism. Glycobiology 25, 225-240. doi: 10.1093/glycob/cwu105
PubMed Abstract | CrossRef Full Text | Google Scholar
Blackburn, J. B., and Lupashin, V. V. (2016). Tworzenie knockoutów konserwowanych podjednostek oligomerycznego kompleksu golgiego za pomocą edycji genów z wykorzystaniem CRISPR sparowanej ze strategią selekcji opartą na defektach glikozylacji związanych z upośledzoną funkcją kompleksu COG. Methods Mol. Biol. 1496, 145-161. doi: 10.1007/978-1-4939-6463-5_12
PubMed Abstract | CrossRef Full Text | Google Scholar
Boncompain, G., and Perez, F. (2013). The many routes of Golgi-dependent trafficking. Histochem. Cell Biol. 140, 251-260. doi: 10.1007/s00418-013-1124-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Broz, P., and Dixit, V. M. (2016). Inflammasomes: mechanizm składania, regulacji i sygnalizacji. Nat. Rev. Immunol. 16, 407-420. doi: 10.1038/nri.2016.58
PubMed Abstract | CrossRef Full Text | Google Scholar
Chen, J., and Chen, Z. J. (2018). PtdIns4P na rozproszonej sieci trans-Golgi pośredniczy w aktywacji inflammasomu NLRP3. Nature 564, 71-76. doi: 10.1038/s41586-018-0761-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Chia, J., Goh, G., Racine, V., Ng, S., Kumar, P., and Bard, F. (2012). RNAi screening reveals a large signaling network controlling the Golgi apparatus in human cells. Mol. Syst. Biol. 8:629. doi: 10.1038/msb.2012.59
PubMed Abstract | CrossRef Full Text | Google Scholar
Corda, D., Barretta, M. L., Cervigni, R. I., and Colanzi, A. (2012). Golgi complex fragmentation in G2/M transition: an organelle-based cell-cycle checkpoint. IUBMB Life 64, 661-670. doi: 10.1002/iub.1054
PubMed Abstract | CrossRef Full Text | Google Scholar
De Matteis, M. A., Mironov, A. A., and Beznoussenko, G. V. (2008). The Golgi Ribbon and the Function of the Golgins. New York, NY: Springer-Verlag/Wein.
Google Scholar
Dippold, H. C., Ng, M. M., Farber-Katz, S. E., Lee, S. K., Kerr, M. L., Peterman, M. C., et al. (2009). GOLPH3 łączy fosfatydyloinozytol-4-fosforan i aktomiozynę, aby rozciągnąć i ukształtować Golgiego w celu promowania pączkowania. Cell 139, 337-351. doi: 10.1016/j.cell.2009.07.052
PubMed Abstract | CrossRef Full Text | Google Scholar
Efimov, A., Kharitonov, A., Efimova, N., Loncarek, J., Miller, P. M., Andreyeva, N., et al. (2007). Asymmetric CLASP-dependent nucleation of noncentrosomal microtubules at the trans-Golgi network. Dev. Cell 12, 917-930. doi: 10.1016/j.devcel.2007.04.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Farber-Katz, S. E., Dippold, H. C., Buschman, M. D., Peterman, M. C., Xing, M., Noakes, C. J., et al. (2014). Uszkodzenia DNA wyzwalają dyspersję Golgiego poprzez DNA-PK i GOLPH3. Cell 156, 413-427. doi: 10.1016/j.cell.2013.12.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Farhan, H., and Rabouille, C. (2011). Signalling to and from the secretory pathway. J. Cell Sci. 124, 171-180. doi: 10.1242/jcs.076455
PubMed Abstract | CrossRef Full Text | Google Scholar
Farhan, H., Wendeler, M. W., Mitrovic, S., Fava, E., Silberberg, Y., Sharan, R., et al. (2010). MAPK signaling to the early secretory pathway revealed by kinase/phosphatase functional screening. J. Cell Biol. 189, 997-1011. doi: 10.1083/jcb.200912082
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferraro, F., Kriston-Vizi, J., Metcalf, D. J., Martin-Martin, B., Freeman, J., Burden, J. J., et al. (2014). A two-tier Golgi-based control of organelle size underpins the functional plasticity of endothelial cells. Dev. Cell 29, 292-304. doi: 10.1016/j.devcel.2014.03.021
PubMed Abstract | CrossRef Full Text | Google Scholar
Gonatas, N. K., Stieber, A., and Gonatas, J. O. (2006). Fragmentacja aparatu Golgiego w chorobach neurodegeneracyjnych i śmierci komórki. J. Neurol. Sci. 246, 21-30. doi: 10.1016/j.jns.2006.01.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Gosavi, P., and Gleeson, P. A. (2017). The function of the Golgi ribbon structure- An enduring mytery unfolds! Bioessays 39:1700063. doi: 10.1002/bies.201700063
PubMed Abstract | CrossRef Full Text | Google Scholar
Gosavi, P., Houghton, F. J., Mcmillan, P. J., Hanssen, E., and Gleeson, P. A. (2018). Wstęga Golgiego w komórkach ssaków negatywnie reguluje autofagię poprzez modulację aktywności mTOR. J. Cell Sci. 131:jcs211987. doi: 10.1242/jcs.211987
PubMed Abstract | CrossRef Full Text | Google Scholar
Gunn, P. A., Gliddon, B. L., Londrigan, S. L., Lew, A. M., Van Driel, I. R., and Gleeson, P. A. (2011). The Golgi apparatus in the endomembrane-rich gastric parietal cells exist as functional stable mini-stacks dispersed throughout the cytoplasm. Biol. Cell 103, 559-572. doi: 10.1042/BC20110074
PubMed Abstract | CrossRef Full Text | Google Scholar
Haase, G., and Rabouille, C. (2015). Fragmentacja Golgiego w neuronach ruchowych ALS. New mechanisms targeting microtubules, tethers, and transport vesicles. Front. Neurosci. 9:448. doi: 10.3389/fnins.2015.00448
PubMed Abstract | CrossRef Full Text | Google Scholar
Hussain, N. K., Jenna, S., Glogauer, M., Quinn, C. C., Wasiak, S., Guipponi, M., et al. (2001). Endocytic protein intersectin-l regulates actin assembly via Cdc42 and N-WASP. Nat. Cell Biol. 3, 927-932. doi: 10.1038/ncb1001-927
PubMed Abstract | CrossRef Full Text | Google Scholar
Joshi, G., Chi, Y., Huang, Z., and Wang, Y. (2014). Wywołana przez Abeta fragmentacja Golgiego w chorobie Alzheimera zwiększa produkcję Abeta. Proc. Natl. Acad. Sci. U.S.A. 111, E1230-E1239. doi: 10.1073/pnas.1320192111
PubMed Abstract | CrossRef Full Text | Google Scholar
Kreft, M. E., Di Giandomenico, D., Beznoussenko, G. V., Resnik, N., Mironov, A. A., and Jezernik, K. (2010). Fragmentacja aparatu Golgiego jako mechanizm odpowiedzialny za równomierne dostarczanie uroplakin do apikalnej błony plazmatycznej komórek uroepitelialnych. Biol. Cell 102, 593-607. doi: 10.1042/bc20100024
PubMed Abstract | CrossRef Full Text | Google Scholar
Kupfer, A., Dennert, G., and Singer, S. J. (1983). Polarization of the Golgi apparatus and the microtubule-organizing center within cloned natural killer cells bound to their targets. Proc. Natl. Acad. Sci. U.S.A. 80, 7224-7228. doi: 10.1073/pnas.80.23.7224
PubMed Abstract | CrossRef Full Text | Google Scholar
Lamb, C. A., Yoshimori, T., and Tooze, S. A. (2013). The autophagosome: origins unknown, biogenesis complex. Nat. Rev. Mol. Cell Biol. 14, 759-774. doi: 10.1038/nrm3696
PubMed Abstract | CrossRef Full Text | Google Scholar
Lasiecka, Z. M., and Winckler, B. (2011). Mechanisms of polarized membrane trafficking in neurons – focusing in on endosomes. Mol. Cell. Neurosci. 48, 278-287. doi: 10.1016/j.mcn.2011.06.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Lavieu, G., Dunlop, M. H., Lerich, A., Zheng, H., Bottanelli, F., and Rothman, J. E. (2014). The Golgi ribbon structure facilitates anterograde transport of large cargoes. Mol. Biol. Cell 25, 3028-3036. doi: 10.1091/mbc.E14-04-093
PubMed Abstract | CrossRef Full Text | Google Scholar
Lazaro-Dieguez, F., Jimenez, N., Barth, H., Koster, A. J., Renau-Piqueras, J., Llopis, J. L., et al. (2006). Actin filaments are involved in the maintenance of Golgi cisternae morphology and intra-Golgi pH. Cell Motil. Cytoskeleton 63, 778-791. doi: 10.1002/cm.20161
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, C., Mei, M., Li, Q., Roboti, P., Pang, Q., Ying, Z., et al. (2017). Loss of the golgin GM130 causes Golgi disruption, Purkinje neuron loss, and ataxia in mice. Proc. Natl. Acad. Sci. U.S.A. 114, 346-351. doi: 10.1073/pnas.1608576114
PubMed Abstract | CrossRef Full Text | Google Scholar
Lu, Z., Joseph, D., Bugnard, E., Zaal, K. J., and Ralston, E. (2001). Reorganizacja kompleksu Golgiego podczas różnicowania mięśni: wizualizacja w żywych komórkach i mechanizm. Mol. Biol. Cell 12, 795-808. doi: 10.1091/mbc.12.4.795
PubMed Abstract | CrossRef Full Text | Google Scholar
Luini, A., and Parashuraman, S. (2016). Signaling at the Golgi: sensing and controlling the membrane fluxes. Curr. Opin. Cell Biol. 39, 37-42. doi: 10.1016/j.ceb.2016.01.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Makhoul, C., Gosavi, P., Duffield, R., Delbridge, B., Williamson, N. A., and Gleeson, P. A. (2019). Intersektyna-1 oddziałuje z golginą GCC88 w celu sprzężenia sieci aktynowej i architektury Golgiego. Mol. Biol. Cell 30, 370-386. doi: 10.1091/mbc.E18-05-0313
PubMed Abstract | CrossRef Full Text | Google Scholar
Makhoul, C., Gosavi, P., and Gleeson, P. A. (2018). Architektura Golgiego i wyczuwanie komórki. Biochem. Soc. Trans. 46, 1063-1072. doi: 10.1042/BST20180323
PubMed Abstract | CrossRef Full Text | Google Scholar
Mayinger, P. (2011). Signaling at the Golgi. Cold Spring Harb. Perspect. Biol. 3:a005314.
Google Scholar
Millarte, V., Boncompain, G., Tillmann, K., Perez, F., Sztul, E., and Farhan, H. (2015). Phospholipase C gamma1 reguluje wczesną trafficking sekrecyjną i migrację komórek poprzez interakcję z p115. Mol. Biol. Cell 26, 2263-2278. doi: 10.1091/mbc.E15-03-0178
PubMed Abstract | CrossRef Full Text | Google Scholar
Millarte, V., and Farhan, H. (2012). The Golgi in cell migration: regulation by signal transduction and its implications for cancer cell metastasis. ScientificWorldJournal 2012:498278. doi: 10.1100/2012/498278
PubMed Abstract | CrossRef Full Text | Google Scholar
Miller, V. J., and Ungar, D. (2012). Re’COG’nition at the Golgi. Traffic 13, 891-897. doi: 10.1111/j.1600-0854.2012.01338.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Petrosyan, A. (2015). Onko-Golgi: czy fragmentacja jest bramą do progresji nowotworu? Biochem. Mol. Biol. J. 1:16.
PubMed Abstract | Google Scholar
Puthenveedu, M. A., Bachert, C., Puri, S., Lanni, F., and Linstedt, A. D. (2006). GM130 and GRASP65-dependent lateral cisternal fusion allows uniform Golgi-enzyme distribution. Nat. Cell Biol. 8, 238-248. doi: 10.1038/ncb1366
PubMed Abstract | CrossRef Full Text | Google Scholar
Rabouille, C., and Haase, G. (2015). Editorial: golgi pathology in neurodegenerative diseases. Front. Neurosci. 9:489. doi: 10.3389/fnins.2015.00489
PubMed Abstract | CrossRef Full Text | Google Scholar
Rabouille, C., and Kondylis, V. (2007). Golgi ribbon unlinking: an organelle-based G2/M checkpoint. Cell Cycle 6, 2723-2729. doi: 10.4161/cc.6.22.4896
PubMed Abstract | CrossRef Full Text | Google Scholar
Rambourg, A., and Clermont, Y. (1997). Three-Dimensional Structure of the Golgi Apparatus in Mammalian Cells. Basel: Birkhauser.
Google Scholar
Sanders, A. A., and Kaverina, I. (2015). Nucleation and dynamics of Golgi-derived microtubules. Front. Neurosci. 9:431. doi: 10.3389/fnins.2015.00431
CrossRef Full Text | Google Scholar
Sasaki, K., and Yoshida, H. (2015). Organelle autoregulation-stress responses in the ER, Golgi, mitochondria and lysosome. J. Biochem. 157, 185-195. doi: 10.1093/jb/mvv010
PubMed Abstract | CrossRef Full Text | Google Scholar
Scott, K. L., Kabbarah, O., Liang, M. C., Ivanova, E., Anagnostou, V., Wu, J., et al. (2009). GOLPH3 moduluje sygnalizację mTOR i wrażliwość na rapamycynę w nowotworach. Nature 459, 1085-1090. doi: 10.1038/nature08109
PubMed Abstract | CrossRef Full Text | Google Scholar
Serebrenik, Y. V., Hellerschmied, D., Toure, M., Lopez-Giraldez, F., Brookner, D., and Crews, C. M. (2018). Targeted protein unfolding uncovers a Golgi-specific transcriptional stress response. Mol. Biol. Cell 29, 1284-1298. doi: 10.1091/mbc.E17-11-0693
PubMed Abstract | CrossRef Full Text | Google Scholar
Sundaramoorthy, V., Sultana, J. M., and Atkin, J. D. (2015). Golgi fragmentation in amyotrophic lateral sclerosis, an overview of possible triggers and consequences. Front. Neurosci. 9:400. doi: 10.3389/fnins.2015.00400
PubMed Abstract | CrossRef Full Text | Google Scholar
Wei, J. H., and Seemann, J. (2010). Unraveling the Golgi ribbon. Traffic 11, 1391-1400. doi: 10.1111/j.1600-0854.2010.01114.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Wei, J. H., and Seemann, J. (2017). Golgi ribbon disassembly during mitosis, differentiation and disease progression. Curr. Opin. Cell Biol. 47, 43-51. doi: 10.1016/j.ceb.2017.03.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, J., De Heus, C., Liu, Q., Bouchet, B. P., Noordstra, I., Jiang, K., et al. (2016). Molekularny szlak organizacji mikrotubul w aparacie Golgiego. Dev. Cell 39, 44-60. doi: 10.1016/j.devcel.2016.08.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Wullschleger, S., Loewith, R., and Hall, M. N. (2006). TOR signaling in growth and metabolism. Cell 124, 471-484.
Google Scholar
Yamamoto, H., Kakuta, S., Watanabe, T. M., Kitamura, A., Sekito, T., Kondo-Kakuta, C., et al. (2012). Atg9 vesicles are an important membrane source during early steps of autophagosome formation. J. Cell Biol. 198, 219-233. doi: 10.1083/jcb.201202061
PubMed Abstract | CrossRef Full Text | Google Scholar
Zappa, F., Failli, M., and De Matteis, M. A. (2018). Kompleks Golgiego w chorobie i terapii. Curr. Opin. Cell Biol. 50, 102-116. doi: 10.1016/j.ceb.2018.03.005
PubMed Abstract | CrossRef Full Text | Google Scholar
.
Leave a Reply