Frontiers in Marine Science
Introduction
Les coraux des profondeurs constituent un groupe d’organismes marins très diversifié, et la région de la Nouvelle-Zélande est un point chaud pour les coraux des profondeurs (Sánchez et Rowden, 2006 ; Cairns et al., 2009). Plusieurs études ont examiné les effets du chalutage de fond sur les assemblages de macro-invertébrés d’eau profonde (y compris les coraux) dans la région du Pacifique Sud (Althaus et al., 2009 ; Clark et Rowden, 2009 ; Clark et al., 2010, 2019 ; Williams et al., 2010 ; Anderson et al., 2014). Ces études ont démontré que le chalutage de fond avait un impact considérable sur les colonies et les communautés coralliennes d’eaux profondes, fragiles et à croissance lente, et que leur capacité de récupération était faible, voire nulle. Les impacts environnementaux prévus par le changement climatique, tels que le réchauffement et l’acidification des océans, devraient également menacer la santé des coraux d’eau profonde, certains habitats devenant trop chauds pour qu’ils puissent se développer (Anthony et Marshall, 2009), ou réduits en pH et en ions carbonate, ce qui aura probablement un impact sur les coraux d’eau profonde dont le squelette est à base de carbonate (Gammon et al., 2018). Pour mieux informer les futures évaluations des risques et la gestion des ressources marines, une compréhension de l’âge et de la croissance des coraux d’eau profonde est essentielle pour déterminer les temps de régénération des coraux et leur capacité de récupération après des perturbations anthropiques ou d’autres dommages naturels.
Un travail considérable a été entrepris dans la région de la Nouvelle-Zélande sur la taxonomie des coraux d’eau profonde, et la distribution des différentes espèces et leurs préférences environnementales, ainsi que l’importance du corail d’eau profonde pour les écosystèmes benthiques. Un examen de notre compréhension et de nos connaissances des coraux d’eau profonde dans la région de la Nouvelle-Zélande a récemment été publié (Tracey et Hjorvarsdottir, 2019). Cet examen a également souligné les principales lacunes dans notre compréhension des coraux d’eau profonde, y compris les données limitées sur l’âge et la croissance pour de nombreux genres et espèces. Dans cette étude, nous évaluons l’âge et le taux de croissance du corail noir des profondeurs protégé Antipatharian Bathypathes patula. L’âge et le taux de croissance de ce corail n’ont pas été étudiés précédemment dans cette région. La sélection de cette espèce a été basée sur la liste des priorités de l’évaluation des risques (Clark et al., 2014) et sur l’analyse de la littérature (Tracey et al., 2018), couplée à la disponibilité des échantillons (emplacement et nombre total), et à d’autres recherches complémentaires sur le corail noir entreprises en Nouvelle-Zélande (Hitt et al., 2020).
Tracey et al. (2018) ont décrit les méthodes actuelles utilisées pour déterminer l’âge des espèces de corail d’eau profonde. Les avantages et les inconvénients de chaque méthode ont été discutés. Les principales méthodes qui ont été appliquées avec succès pour mesurer l’âge et la croissance des coraux d’eau profonde sont (1) l’observation directe, comme les mesures in situ ou les expériences en aquarium de la croissance linéaire ou des extensions de surface ; le taux d’ajout de polypes ; l’estimation des taux de calcification (par ex, à l’aide de la technique du poids flottant), (2) l’énumération des zones ou des bandes de croissance du squelette (sclérochronologie), et (3) les analyses radiométriques.
Les observations directes et les mesures in situ ou en aquarium sont très difficiles à entreprendre pour les coraux d’eau profonde, car il est difficile d’obtenir des spécimens viables vivants et de les garder en vie, car ils prennent beaucoup de temps à se développer (Gammon et al., 2018 ; Tracey et al., 2018). L’énumération des zones de croissance, la sclérochronologie, est idéale pour les espèces de coraux d’eau profonde qui présentent un fort contraste entre les schémas de croissance en forme de zones observés dans les coupes transversales du squelette. Il est toutefois essentiel d’utiliser une méthode de validation indépendante pour vérifier la validité chronologique des comptages des zones de croissance observées (Andrews et al., 2002). La méthode permettant d’obtenir des comptages de zones de croissance visibles dans la structure du squelette a été appliquée avec succès pour déterminer les données relatives à l’âge et au taux de croissance des octocoraux gorgones, notamment les coraux bambous Keratoisis sp. vieux de 400 ans, et le corail bambou Lepidisis sp. âgé de 60 ans (Thresher et al., 2004, 2007 ; Mortensen et Buhl-Mortensen, 2005 ; Sherwood et al., 2005 ; Tracey et al., 2007 ; Sherwood et Edinger, 2009). Les coraux noirs ont également été vieillis avec succès en utilisant les zones de croissance ou les comptages, avec des âges de 150 ans à 480 ans pour Antipathes dendrochristos et Leiopathes glaberrima, respectivement (Love et al., 2007 ; Williams et al., 2007). Dans une étude du corail noir Stauropathes arctica, des comptes de zones de 55-58 ont été obtenus (Sherwood et Edinger, 2009), les auteurs notant que la datation au radiocarbone a limité ces âges à 55 et 82 ans. Les taux de croissance des coraux noirs via l’énumération des zones de croissance révèlent une faible croissance radiale de 8 à 140 μm/an (Love et al., 2007 ; Prouty et al., 2011).
La méthode d’énumération des zones de croissance présente des limites potentielles (voir le résumé dans Tracey et al., 2018). De nombreux coraux ne présentent pas de structure de zone régulière claire sur l’ensemble de leur squelette, ou la structure de zone claire peut n’être apparente que dans certaines parties du squelette. Même lorsqu’elle est présente, la structure des zones peut être variable ou présenter des possibilités d’interprétation différentes. Par exemple, le nombre de bases et de pointes des espèces d’octocoraux de bambou Keratoisis sp. et Lepidisis sp. était plus élevé que les âges estimés par la méthode radiométrique au plomb 210 (210Pb) (Tracey et al., 2007). On a émis l’hypothèse que les zones observées au microscope optique ont une périodicité bi-annuelle et que les zones observées au MEB à la jonction nodale peuvent représenter un événement environnemental, tel que la périodicité lunaire. Les cycles lunaires peuvent être associés à de forts événements de marée, qui pourraient augmenter la disponibilité de la nourriture pour les organismes sessiles filtreurs, entraînant des impulsions de croissance somatique. Les coraux gorgones bubblegum (par exemple, Paragorgia spp.) et les coraux précieux rouges (par exemple, Corallium sp.) n’ont pas été vieillis avec succès en utilisant des comptages de zones en raison de motifs de bandes intrinsèquement complexes ou mal définis (Griffin et Druffel, 1989 ; Andrews et al, 2005).
La méthode radiométrique la plus couramment utilisée pour les coraux d’eau profonde est la datation par l’isotope du radiocarbone (14C) (Druffel et al., 1995 ; Sherwood et al., 2005 ; Tracey et al., 2018). Cette méthode repose sur le fait qu’une très faible quantité de carbone naturel présent dans l’atmosphère est radioactive sous forme de 14C et est incorporée au squelette du corail lorsqu’il forme son carbonate de calcium ou ses protéines et sa chitine (Adkins et al., 2002 ; Tracey et al., 2003 ; Consalvey et al., 2006). La demi-vie du radiocarbone étant connue pour être de 5 730 ans, cette méthode, bien que coûteuse, peut être utilisée pour déterminer de manière fiable l’âge de spécimens datant de moins de 50 000 ans ; au-delà, l’activité du 14C devient trop faible pour être détectée (Coleman, 1991). Au cours des années 1950-60, il y a eu une augmentation rapide du 14C atmosphérique résultant des essais de dispositifs nucléaires ; ce « carbone de bombe » peut également être utilisé comme un outil pour calibrer les âges, fournissant un point de référence pour les échantillons plus récents (Coleman, 1991 ; Druffel et al., 1995 ; Tracey et al., 2003 ; Roark et al, 2009 ; Sherwood et Edinger, 2009).
La datation au radiocarbone a été utilisée avec succès sur plusieurs espèces de coraux, notamment les coraux pierreux, les coraux noirs et les octocoraux gorgones (Druffel et al., 1990 ; Roark et al., 2006 ; Carreiro-Silva et al., 2013 ; Prouty et al., 2016 ; Hitt et al., 2020). Cependant, cette méthode présente également des limites. En raison de la circulation océanique, l’âge radiocarbone de l’eau des océans est nettement plus ancien que celui de l’atmosphère, ce que l’on appelle « l’âge réservoir marin » (Tracey et al., 2003 ; Consalvey et al., 2006 ; Roark et al., 2006 ; Noé et al., 2008). Les erreurs dans l’âge du réservoir peuvent avoir des effets significatifs sur les estimations de l’âge des coraux. La correction des âges des réservoirs nécessite la connaissance des eaux environnantes et suppose des ratios constants de radiocarbone dans l’eau ; cependant, ces niveaux peuvent être modifiés par le mélange au sein de l’océan, les événements de remontée d’eau localisés et les efflorescences de productivité, qui peuvent tous modifier les transformations du cycle du carbone et la composition du squelette corallien en 14C (Tracey et al, 2018).
Sur la base de l’examen de Tracey et al. (2018), nous avons choisi d’utiliser deux méthodes de vieillissement pour B. patula ; les comptages des bandes de croissance du squelette et la méthode radiométrique de datation au radiocarbone (14C). L’application de ces méthodes permet d’établir des comparaisons avec d’autres études antérieures sur le vieillissement des coraux, tant en Nouvelle-Zélande que dans le monde. La sélection des échantillons, le micro-fraisage du matériel et les méthodes de sectionnement, ainsi que l’interprétation du nombre de zones et de la datation au radiocarbone sont présentés. Les caractéristiques d’âge et de croissance du corail noir B. patula et d’une colonie de Bathypathes cf. conferta (initialement supposée être B. patula) sont fournies.
Matériaux et méthodes
Sélection des échantillons
Les échantillons utilisés dans cette étude proviennent de spécimens conservés logés dans la National Institute of Water and Atmospheric Research (NIWA) de Nouvelle-Zélande, National Invertebrate Collection (NIC).
Les échantillons ont été sélectionnés dans deux régions ; la baie de Plenty (nord-est de l’île du Nord de la Nouvelle-Zélande) et Chatham Rise (est de la Nouvelle-Zélande), afin de comparer les résultats et d’évaluer la variabilité des taux de croissance entre les différentes zones, et également avec d’autres genres de coraux noirs d’eau profonde, spécifiquement Antipathella, Leiopathes et Antipathes, provenant des mêmes régions (Hitt et al, 2020).
Les courants océanographiques influencent les coraux d’eau profonde en fournissant un flux régulier de nourriture et en dispersant les larves. Par conséquent, ces courants influencent également la disponibilité des proies et la distribution des coraux profonds. Si les coraux d’eau profonde sont les plus affectés par les courants de fond qui les traversent et influencent la distribution des sédiments, ils sont également affectés par les courants de surface qui influencent la productivité primaire et donc l’approvisionnement en nourriture qui tombe sur les coraux d’eau profonde au fond de la mer. La masse continentale de la Nouvelle-Zélande se trouve à la croisée des chemins entre les eaux de surface chaudes, pauvres en nutriments et subtropicales qui arrivent du nord, et les eaux de surface froides, riches en nutriments et subantarctiques qui arrivent du sud. La compréhension actuelle des masses d’eau et des courants océaniques dans la région, à la surface, dans la thermocline, dans les eaux intermédiaires et dans les eaux profondes, a été récemment examinée par Chiswell et al. (2015). Le cadre océanographique pour les coraux de cette étude est le suivant.
La baie de Plenty est baignée par des eaux de surface chaudes, peu nutritives et subtropicales qui proviennent du courant est-australien et qui affluent de l’ouest et forment le courant est-aucklandais. Le Chatham Rise est le point de rencontre entre les eaux subtropicales chaudes et peu nutritives (STW) et les eaux subantarctiques froides et très nutritives (SAW) provenant de l’océan Austral, le front subtropical (STF). Le mélange des masses d’eau STW et SAW au niveau du STF fait du Chatham Rise une zone de très forte productivité primaire, fournissant une source de nourriture importante et donc un apport de carbone pour ces coraux. Les concentrations de chlorophylle a varient entre 0,3 et 0,48 mg/m3 dans le Chatham Rise et la Bay of Plenty, contre 0,03-0,3 mg/m3 dans le Pacifique central (Pinkerton, 2016). À des profondeurs de 500-1500 m, les eaux intermédiaires antarctiques (AAIW), fraîches (3,5-10°C), de faible salinité (34,4-34,6) et riches en oxygène (200-250 μmol/kg) et en nutriments (nitrate 15-36 μmol/kg), s’écoulent dans cette région depuis le nord et le sud (Chiswell et al, 2015).
Les coraux du Chatham Rise ont été choisis car il existe des données modernes sur l’âge du réservoir de 14C dans cette zone (Sikes et al., 2008). Connaître l’âge réservoir local de 14C permet une estimation plus précise de l’âge radiocarbone des coraux.
Les échantillons ont été sélectionnés parmi les spécimens existants collectés par Fisheries New Zealand (FNZ), les observateurs du ministère des industries primaires (MPI) et les chercheurs du NIWA et sont conservés dans le (NIC). Un graphique des données de distribution de B. patula a aidé à la décision sur la sélection du site de la colonie et le nombre d’échantillons (Figure 1). Deux spécimens de la baie de Plenty (NIWA24190 et NIWA85940) ont été sélectionnés pour la datation au radiocarbone et les sections minces pour le comptage des zones. Le reste des spécimens a été sélectionné dans le Chatham Rise.
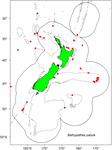
Figure 1. Emplacements où Bathypathes patula a été échantillonné dans la région de la Nouvelle-Zélande. Les points rouges dénotent les emplacements des sources d’échantillons individuels de coraux pour les spécimens de B. patula conservés dans la National Invertebrate Collection of New Zealand (NIC). Les lignes grises indiquent le contour de la profondeur de l’eau à 200 mètres. La ligne noire dénote l’étendue de la zone économique exclusive (ZEE) de la Nouvelle-Zélande.
Fin 2018, un spécialiste invité en taxonomie du corail noir (Jeremy Horowitz, Université James Cook) a examiné les identifications de plusieurs échantillons de la NIC. Au cours de ce processus, l’une des colonies de corail noir sélectionnées pour cette recherche d’estimation de l’âge et supposée être Bathypathes patula, a reçu une identification révisée. Le corail noir NIWA24190 a maintenant été identifié comme étant Bathypathes cf. conferta. L’échantillon a été désigné comme Bathypathes cf. conferta tout au long de cet article (Figure 2), l’identification la plus probablement correcte. Un examen taxonomique plus approfondi de ce spécimen est en cours (Opresko pers comm). La carte de distribution (Figure 1) peut inclure des exemples supplémentaires de B. cf. conferta.

Figure 2. Bathypathes cf. conferta. NIWA24190. Spécimen montrant où les échantillons ont été extraits pour l’analyse. (A) est l’extrémité en croissance, (B) la section basale. Spécimen provenant de Bay of Plenty, Nouvelle-Zélande. La barre d’échelle est une règle de 35 cm.
Préparation du matériel
Une fois que des échantillons appropriés ont été identifiés, de petites sections (moins de 10 mm) ont été excisées des extrémités en croissance et de la partie basale de la tige principale des coraux. Comme de nombreux échantillons avaient été brisés au cours du processus de collecte, des sections supplémentaires ont été prélevées le long de la tige principale afin de pouvoir générer des estimations fiables du taux de croissance linéaire (Figures 2-5). Les échantillons des extrémités en croissance ont ensuite été divisés en deux fragments, l’un pour la datation au radiocarbone, l’autre pour la préparation de sections minces afin d’obtenir des comptages de zones.

Figure 3. Bathypathes patula NIWA85940. Spécimen montrant où les échantillons ont été extraits pour l’analyse. (A) est l’extrémité en croissance, (C) la section basale, et (B) est un site d’échantillonnage intermédiaire car le spécimen a été brisé lors de la collecte et des longueurs inconnues de la tige de la branche principale peuvent manquer au-dessus de ce site. Spécimen de la baie de Plenty, Nouvelle-Zélande. La barre d’échelle est une règle de 35 cm.

Figure 4. Bathypathes patula NIWA49468. Spécimen montrant où les échantillons ont été extraits pour l’analyse. (A) est l’extrémité en croissance, (D) la section basale, et (B,C) sont des sites d’échantillonnage intermédiaires car le spécimen était cassé lors de la collecte et une longueur inconnue de la tige de la branche principale peut manquer entre ces deux sites. Spécimen provenant de Chatham Rise, Nouvelle-Zélande. La barre d’échelle est une règle de 35 cm.

Figure 5. Bathypathes patula NIWA47911. Spécimen montrant où les échantillons ont été extraits pour l’analyse. (A) est l’extrémité en croissance, (F) la section basale et, (B-E) sont des sites d’échantillons intermédiaires pris pour rechercher le signal de la bombe à radiocarbone. Spécimen provenant de Chatham Rise, Nouvelle-Zélande. La barre d’échelle est une règle de 35 cm.
Micro-fraisage du matériau
Dans des travaux antérieurs, il avait été noté que les sections de corail noir sont enclines à aspirer la résine vers le haut à travers leur matrice poreuse par action capillaire et donc les sections dans cette étude ne pouvaient pas être liées avec de la résine à une plaque de base pour le fraisage. Au lieu de cela, un mandrin a été fabriqué pour maintenir la section pendant le processus de fraisage, éliminant ainsi le risque de contamination des échantillons de radiocarbone par la résine.
Des échantillons de radiocarbone en poudre ont été extraits du bord et du cœur des sections basales, centrales et de pointe à l’aide d’une micro-fraise New WaveTM avec une fraise Brassler H2.11.006 de 0,5 mm au NIWA. Les échantillons de bord étaient constitués de matériel provenant des 250 microns extérieurs de la section, les échantillons de cœur étaient obtenus à partir de matériel situé dans un rayon de 750 microns autour du primordium. Nous avons essayé d’extraire au moins 1,5 mg de matériel par échantillon. Les échantillons ont ensuite été pesés et analysés pour le radiocarbone au laboratoire de radiocarbone de l’Université nationale australienne (ANU).
Méthode de sectionnement fin et protocoles de comptage des zones
Les sections de tiges de corail ont été noyées dans de la résine époxy claire en deux parties et sectionnées avec une scie à diamant au NIWA. Les sections ont été polies d’un côté et montées côté poli vers le bas sur une lame de verre pour microscopie, puis meulées et polies jusqu’à ce qu’elles aient une épaisseur optimale pour visualiser la structure de la zone de croissance en lumière transmise. L’épaisseur optimale pour les sections de cette espèce était d’environ 250-300 μm et suit la procédure standard de préparation des sections minces (Andrews et al., 2002 ; Mortensen et Buhl-Mortensen, 2005 ; Tracey et al., 2007). Le comptage des bandes de croissance périodiques ou des incréments, supposés se former annuellement, a eu lieu après la préparation des sections minces au NIWA.
Pour générer les comptes de zones, les préparations de sections minces des sections de branches principales ont été observées sous un microscope composé à lumière transmise. Pour faciliter l’interprétation des zones, les sections ont également été examinées à l’aide d’une lumière ultraviolette selon la méthodologie de Sherwood et Edinger (2009). Ici, les comptages de zones ont été effectués à l’aide d’un éclairage transmis en champ clair et l’éclairage ultra-violet a été une aide utile pour aider à définir davantage la structure de la zone observée.
Méthode de datation au radiocarbone
Avant les analyses, les échantillons ont été nettoyés (par exemple, par lixiviation à l’acide) des croûtes noires et de l’activité endolithique pour éliminer tout contaminant 14C plus jeune potentiel qui pourrait altérer les résultats (Adkins et al., 2002). Les échantillons de corail en poudre ont été traités avec <1 ml de HCL 0,1 M. L’acide a ensuite été éliminé à la pipette. L’acide a ensuite été éliminé à la pipette et les échantillons ont ensuite été lavés trois fois avec de l’eau milliQ. L’échantillon a ensuite été congelé avec de la glace sèche et lyophilisé. Environ 1mg d’échantillon de corail nettoyé a été pesé dans un tube de quartz de 6 mm de diamètre extérieur, ∼60 mg de CuO et une coupe d’argent ont été ajoutés. Les tubes ont été évacués à <3e-3 torr (<0,4 Pa) et scellés avec un chalumeau. Les tubes ont ensuite été cuits à 900°C pendant 6 h pour générer du CO2. Le CO2 résultant a été purifié et converti en graphite en présence d’hydrogène avec du Fe sous tension comme catalyseur. Le graphite a ensuite été mesuré sur le spectromètre de masse à accélérateur à un étage de l’ANU (Fallon et al., 2010). Toutes les données ont été corrigées en utilisant le δ13C de l’AMS en ligne, normalisées à l’acide oxalique I et soustraites du fond en utilisant du charbon sans 14C traité de la même manière que les échantillons de corail. Les données sont présentées selon les recommandations de Stuiver et Polach (1977).
Résultats
Sections minces pour les comptages de zones
Les modèles structurels de zones observés sur les sections de squelettes pour ces espèces sont très complexes et peuvent être interprétés de plusieurs façons. Pour les comptages de croissance radiale, les sections préparées ont été soigneusement observées et l’axe qui présentait le mieux une structure de zone claire du primordium au bord extérieur a ensuite été utilisé pour obtenir des comptages de zones. La croissance radiale des branches de B. patula était raisonnablement régulière, il n’y avait pas de biais marqué dans le dépôt de zones formant des zones plus épaisses sur un côté particulier de la branche, ce qui a été précédemment observé chez d’autres espèces de corail noir. Les rayons utilisés pour les calculs de taux de croissance étaient une moyenne des rayons minimum et maximum observés dans les sections préparées, ce qui signifie que les taux de croissance radiale rapportés seront un taux de croissance radiale moyen pour le corail.
Sur le squelette du corail, il y a un motif initial de bandes grossières largement défini par l’alternance de zones plus sombres et plus claires (Figure 6) lorsqu’il est observé sous une puissance inférieure (10-20×). Lors d’un examen plus approfondi sous une puissance plus élevée (100-200×), un motif de bandes à échelle fine raisonnablement régulier est également apparent (Figure 7). Nous avons appliqué ici deux protocoles de lecture – en comptant à la fois les zones larges grossièrement formées et les zones fines finement formées (Tableau 1). Les comptages de zones présentés ici ont tous été effectués par un seul lecteur (Marriott). Au cours du processus de développement des protocoles d’interprétation des zones, de nombreuses lectures ont été effectuées en appliquant les différentes itérations des protocoles en cours de développement. Les comptages de zones des deux protocoles présentés ici ont chacun été dérivés de comptages multiples à travers la section.

Figure 6. Section basale du corail NIWA47911 montrant l’interprétation en bandes de couleur grossière de la structure des zones observées. Le spécimen présente 54 zones marquées par des points rouges. Le rectangle pointillé en médaillon montre la partie centrale de la section basale imagée dans la figure 7.

Figure 7. Partie centrale de la section basale du corail NIWA47911 montrant le protocole d’interprétation à échelle fine de la structure des zones observées. Le spécimen montre 42 zones marquées de points noirs à travers cette région interne de la section ; la section entière a montré 211 zones.

Tableau 1. Comptage des zones à partir de coupes minces.
Pour la partie la plus jeune des spécimens étudiés, la région de l’extrémité, ou proche de l’extrémité, les comptages variaient de 4 à 7 (comptages de zones grossières) et de 10 à 19 (comptages de zones fines). Dans la région médiane de la branche principale, les comptes variaient de 55 à 60 (comptes de la zone grossière) et de 370 à 374 (comptes de la zone fine). Dans la région de la base de la colonie, les comptes variaient de 37 à 193 (comptes de zones grossières) et de 78 à 481 (comptes de zones fines). La complexité des modèles de zonation a mis en évidence la nécessité d’une validation.
Analyse du radiocarbone
Les échantillons broyés énumérés dans le tableau 2 ont été envoyés à l’ANU pour une datation au radiocarbone. Les résultats des 17 échantillons de coraux sont présentés dans les résultats de radiocarbone (tableau 3). Trois échantillons (échantillons 47911-F2 ; 24190-B1 ; 85940-B1) ont échoué au laboratoire, le matériel restant étant insuffisant pour tenter un duplicata. Les résultats du radiocarbone des coraux restants ont été calibrés à un âge calendaire en utilisant OxCal4.3 (Bronk Ramsey, 2001), la courbe Marine13 et un deltaR (décalage du réservoir de radiocarbone) local de Nouvelle-Zélande de -18 ± 36 (Reimer et Reimer, 2001). Les distributions des tranches d’âge des échantillons de coraux pré-bombés sont présentées dans le tableau 3. Tous les spécimens de coraux utilisés dans cette étude étaient vivants au moment de la capture, donc toutes les estimations d’âge données sont l’âge au moment de la capture et non la durée de vie du spécimen. Les durées de vie prévues pour cette espèce seront supérieures aux estimations d’âge présentées ici. Le corail 85940 avait environ 380 ± 50 ans, le corail 49468 environ 310 ± 70 ans et le corail 47911 environ 120 ± 50 ans (tableau 3). Tous les échantillons de bord extérieur et de pointe de corail contenaient des valeurs de radiocarbone F14C >1 (tableau 3), à l’exception de 85940-B2 et 85940-C2, ce qui indique que ces coraux étaient vivants et incorporaient du carbone de l’eau de surface au moment du prélèvement. Les coraux 85940-B2 et 85940-C2 présentaient sur leur bord extérieur des valeurs de radiocarbone F14C <1 (Tableau 3), ce qui indique qu’une partie du squelette n’ajoutait pas activement de matière. Cela a été observé précédemment lorsque la partie basale de la colonie corallienne cesse de croître, cependant, la section supérieure continue de croître (Komugabe-Dixson et al., 2016).
Tableau 2. Échantillons extraits pour la datation radiocarbone.

Tableau 3. Résultats du radiocarbone.
Estimations du taux de croissance
Les estimations du taux de croissance ont été basées sur les résultats du radiocarbone, car les comptages de zones étaient problématiques et se sont avérés non validés, de sorte qu’ils ne pouvaient pas être utilisés pour générer des estimations fiables du taux de croissance (voir la section « Estimations de l’âge et de la croissance de Bathypathes patula » pour une discussion plus approfondie sur le comptage de zones). Les taux de croissance ont été dérivés des distances physiques entre les points d’échantillonnage et des âges au radiocarbone calibrés sur le site d’échantillonnage concerné. En raison de l’échec de certains échantillons lors de l’analyse radiocarbone, seul un ensemble limité d’estimations de taux de croissance a pu être généré. Les taux de croissance radiale, c’est-à-dire la vitesse à laquelle la branche de la colonie s’épaissit radialement au fil du temps, ont été estimés en divisant les années civiles calibrées de croissance entre la carotte et le bord du site d’échantillonnage par le rayon moyen du segment de branche. La croissance radiale variait de 11,1 à 35,7 μm/an. Les taux de croissance linéaire, c’est-à-dire la vitesse à laquelle la branche de la colonie s’allonge longitudinalement au fil du temps, ont été estimés en divisant la différence entre les âges calendaires calibrés des échantillons de carottes par la distance linéaire entre deux sites d’échantillonnage. Deux taux de croissance linéaire ont été obtenus, 5,2 et 9,6 mm/an (tableau 4).

Tableau 4. Estimations du taux de croissance de Bathypathes patula.
Discussion
Estimations de l’âge et de la croissance de Bathypathes patula
Les résultats du radiocarbone de ce travail montrent que B. patula est une espèce à longue durée de vie, avec des âges supérieurs à 385 ans. De lents taux de croissance linéaire (5,2-9,6 mm/an) et radiale (11,1-35,7 μm/an) ont été obtenus à partir des données d’âge radiocarbone.
Aucun des protocoles de comptage de zones n’a été corrélé de manière fiable avec les estimations indépendantes d’âge radiocarbone. Le protocole de comptage de zones à échelle fine a montré la corrélation la plus étroite avec les données d’âge au 14C, fournissant un certain soutien global pour la longévité lors de la comparaison des comptages de zones avec les dates au 14C. Les estimations d’âge entre les données d’âge radiocarbone et les données de comptage de zones à échelle fine ont régulièrement montré une disparité de plus de cent ans dans les sections de branche avec des âges radiocarbone calibrés de 112-385 ans (tableaux 1, 3). Les différences entre les âges estimés d’échantillons comparables à l’aide des deux méthodes étaient négatives et positives ; il n’y avait pas de sous-âge ou de sur-âge proportionnel à l’aide des comptages de zones (tableau 1). Cela signifie que la structure de zone observée ne présente pas de périodicité annuelle, ni aucun autre schéma chronologique régulier, et que nos protocoles de comptage de zones ne peuvent pas être utilisés pour générer de manière fiable des estimations d’âge pour B. patula.
Les résultats du radiocarbone de bord du spécimen NIWA-85940 suggèrent que la section basale (C2) de la tige principale a cessé de déposer du matériel squelettique sur sa surface extérieure 293 ans avant la récolte, et que la section médiane (B2) a cessé de déposer du matériel squelettique 88 ans avant la récolte. Ceci malgré l’observation que ces sections de la tige principale étaient immédiatement adjacentes aux pinnules latérales avec des polypes vivants. L’aspect optique de ces sections ne donnait aucune indication que le dépôt de zones avait cessé sur leur marge extérieure. La surface de la branche corallienne semblait encore relativement vierge, elle ne présentait aucun signe d’érosion superficielle ou de décoloration, comme on pourrait s’y attendre dans une branche corallienne qui n’accrétait plus de nouveau matériel squelettique sur sa surface externe. Cela suggère que si les tiges des branches peuvent cesser d’accréter des couches squelettiques, alors que les extrémités des branches continuent de croître, alors les protocoles de la méthode de comptage de zones ne peuvent pas être utilisés de manière fiable pour la génération d’estimations d’âge à partir de sections basales pour cette espèce de corail.
Dans le spécimen NIWA47911, cinq échantillons ont été extraits de l’extrémité en croissance de la branche axiale principale vers la base du corail. Ces échantillons ont été espacés de 25 mm. Il s’agissait de tenter de localiser l’apparition du radiocarbone de la bombe dans le squelette du corail. Cela permettrait d’évaluer avec précision le taux de croissance linéaire des extrémités les plus récentes des branches de la colonie. Si la montée du radiocarbone de la bombe pouvait être localisée avec précision, cela donnerait également un point d’ancrage exact pour définir la correction du 14C à appliquer aux échantillons de radiocarbone d’avant la bombe pour cette colonie et pour d’autres colonies de la même masse d’eau. Malheureusement, tous ces échantillons se sont avérés être postérieurs à la bombe et ce processus n’a pas pu être mené à bien. Il serait utile de procéder à de futurs échantillonnages plus en amont de cette branche pour établir ce point de rattachement et le taux de croissance linéaire contemporain. Notre travail a mesuré des taux de croissance linéaires globaux de 5,2-9,6 mm/an, en supposant le taux de croissance le plus rapide, vous auriez besoin d’échantillonner 700 mm en arrière le long de la tige de branche principale à partir de l’extrémité de croissance pour être sûr d’observer la montée du radiocarbone de la bombe dans le squelette.
Les recherches de Love et al. (2007) sur l’espèce de corail noir Antipathes dendrochristos ont également rapporté deux interprétations de la structure de la zone similaires aux protocoles grossiers et fins décrits ici. Cependant, ces auteurs ont constaté que la structure de bandes de couleur plus grossière était en corrélation avec leurs résultats de radiocarbone et de 210Pb indiquant une bande annuelle (Love et al., 2007).
Les mesures de radiocarbone du travail actuel présentaient F14C >1 dans les échantillons provenant des extrémités des branches en croissance et de la surface de la branche principale, indiquant que ces échantillons présentaient des niveaux de radiocarbone post-bombe modernes. La présence de carbone post-bombe sous la couche mixte de l’océan indique que les coraux noirs B. patula utilisent le POC récemment exporté de l’eau de surface. À ces profondeurs, le POC est la seule source de carbone marquée au 14C de la bombe. Le carbone inorganique dissous (DIC) de l’eau ambiante dans laquelle vivent les coraux présente des valeurs de 14C beaucoup plus faibles (Matsumoto, 2007 ; Alves et al., 2018). La détection de la bombe 14C chez des coraux qui se développent dans des eaux qui n’ont pas connu de bombe 14C (c’est-à-dire par la ventilation de l’océan) renforce le fait que les coraux noirs tirent leur carbone du POC dérivé de la surface (Roark et al., 2009 ; Sherwood et Edinger, 2009 ; Williams et Grottoli, 2010 ; Prouty et al., 2011). Cela signifie également que nous n’avons pas besoin de modéliser pour un effet de réservoir en eau profonde, comme c’est le cas pour les coraux pierreux, qui dérivent leur carbone squelettique du DIC dans les eaux intermédiaires qui les baignent.
Comparaisons avec les données récentes sur l’âge des coraux noirs néo-zélandais et mondiaux
Les estimations d’âge et les taux de croissance dérivés du radiocarbone de ce projet sont similaires aux résultats d’un certain nombre d’autres études sur l’âge et la croissance qui ont été récemment entreprises pour les coraux noirs clés d’eau profonde (Antipatharia) dans la région de la Nouvelle-Zélande (tableau 5). Ces estimations d’âge et de croissance pour B. patula sont similaires à d’autres genres de coraux, tels que les colonies Leiopathes, Antipathes et Antipathella, qui vivent jusqu’à 2600 ans et croissent de l’ordre de 1-143 μm/an (Hitt et al., 2020). Nos résultats apportent un soutien supplémentaire au fait que les coraux noirs de Nouvelle-Zélande sont parmi les animaux marins à croissance la plus lente de la région, certaines espèces présentant une longévité extrême.

Tableau 5. Études d’estimation de l’âge au radiocarbone des coraux noirs de Nouvelle-Zélande (Antipatharia).
Les résultats de B. patula et d’autres coraux noirs qui ont été vieillis en Nouvelle-Zélande ne montrent pas de tendances claires dans les taux de croissance ou la longévité par rapport aux masses d’eau et aux profondeurs où ces coraux résident. Les échantillons de Chatham Rise et de Bay of Plenty provenaient pour la plupart de profondeurs d’eau raisonnablement similaires, entre 750 et <1269 m. Le spécimen de B. patula de Chatham Rise, plus profond, provenait de quelque part entre 1120 et 1269 m (Tableaux 1, 5). Le taux de croissance radiale de nos échantillons de Chatham Rise (NIWA-49468 et NIWA47911), de 20-36 μm/an, était plus élevé que celui du spécimen de Bay of Plenty (NIWA-85940), de 11 μm/an. Comme seuls trois taux de croissance ont été obtenus avec succès pour les échantillons de B. patula de ces deux régions, aucune hypothèse sur les différences régionales des taux de croissance ne peut être faite. Le spectre des données de taux de croissance pour les coraux noirs de Chatham Rise montre qu’un échantillon d’Antipathes sp. avait le taux de croissance observé le plus rapide à ce jour, 91-143 μm/an, ainsi qu’un des plus lents, 5-15 μm/an pour un spécimen de Leiopathes secunda. Les spécimens de corail noir de la baie de Plenty Bathypathes patula, Leiopathes secunda, et Leiopathes sp. présentent des taux de croissance radiale moyens à faibles, 5-40 μm/an. En revanche, le corail noir Antipathella fiordensis des eaux peu profondes du Fiordland a un taux de croissance radiale relativement élevé (50-57 μm/an), mais on ne sait pas si cela est une fonction de l’espèce ou des conditions environnementales du fiord, ou un mélange des deux.
Cette recherche concorde également avec des études mondiales qui ont montré que les coraux noirs sont parmi les coraux d’eau profonde à croissance la plus lente. Sherwood et Edinger (2009) donnent des estimations d’âge pour le corail noir Stauropathes arctica jusqu’à 82 années civiles. Prouty et al. (2011) ont utilisé le radiocarbone pour générer des estimations de l’âge des colonies de Leiopathes sp. vivant en capture jusqu’à 2100 ans. Carreiro-Silva et al. (2013) ont estimé l’âge d’une colonie de Leiopathes sp. des Açores à 2320 ans. Un spécimen de Leiopathes annosahas d’Hawaï présentait le potentiel d’atteindre une durée de vie supérieure à 4000 ans (Roark et al., 2009).
Ces nouveaux taux d’âge et de croissance pour le délicat corail noir des profondeurs B. patula soulignent qu’il s’agit d’une espèce à longue durée de vie, montrée dans cette étude pour atteindre des âges supérieurs à 385 ans, et qui présente des taux de croissance linéaire et radiale lents. Les résultats indiquent une faible résilience probable et un temps de récupération lent après une perturbation ou un retrait. Cette recherche sera utilisée pour informer les futures évaluations des risques et les stratégies de gestion dans le cadre de la Nouvelle-Zélande pour la gestion des coraux (Freeman et Cryer, 2019). La croissance lente et la longévité extrême soulignent en outre que ces coraux seront très vulnérables aux perturbations sous-marines, telles que la pêche et l’exploitation minière, et peuvent prendre des siècles pour se remettre des impacts anthropiques (Hitt et al…, 2020).
Conclusion
L’âge et le taux de croissance des échantillons de corail noir d’eau profonde B. patula provenant de deux régions de Nouvelle-Zélande, Bay of Plenty et Chatham Rise, ont été déterminés à l’aide de deux méthodes différentes ; le comptage des anneaux de croissance (sclérochronologie) et la datation au radiocarbone. Deux protocoles différents ont été utilisés pour compter les anneaux de croissance, en utilisant des couches de croissance sombres et claires. Ces méthodes ont donné des résultats variables, qui étaient également incompatibles avec les âges au radiocarbone de plusieurs de ces coraux. Les âges radiocarbone de B. patula indiquent que cette espèce de corail vit longtemps, avec des âges de plus de 385 ans, avec des taux de croissance linéaires (5,2-9,6 mm/an) et radiaux (11,1-35,7 μm/an) lents. Ces résultats sont comparables aux âges et aux taux de croissance d’autres genres de coraux noirs provenant des mêmes régions de Nouvelle-Zélande et du monde entier. L’âge et les taux de croissance des espèces d’eau profonde sont essentiels pour déterminer le risque potentiel de ces organismes face aux perturbations anthropiques. Ces résultats seront utilisés pour informer les futures évaluations des risques et les stratégies de gestion dans le cadre de la Nouvelle-Zélande pour la gestion des coraux.
Data Availability Statement
Tous les ensembles de données générés pour cette étude sont inclus dans l’article/matériel supplémentaire.
Contributions des auteurs
PM, DT, HB et NH ont contribué à la conception et à la conception de l’étude. PM a effectué toute la préparation des échantillons, l’analyse des images de sectionnement, l’élaboration du protocole de coupe mince et le comptage des zones, ainsi que le micro-fraisage des échantillons de radiocarbone. NH a analysé les échantillons de radiocarbone. SF a produit des estimations d’âge corrigées à partir des données brutes de radiocarbone et a rédigé des sections du manuscrit. PM et DT ont rédigé la première version du manuscrit. Tous les auteurs ont contribué à la révision du manuscrit.
Funding
Cette recherche a été financée par la deuxième année du programme de services de conservation (CSP), projet POP2017-07 du ministère de la Conservation (DOC) Objectif : « Développer une méthodologie pour déterminer l’âge et les caractéristiques de croissance des principales espèces de corail à haut risque en eaux profondes (eaux froides) de Nouvelle-Zélande. » Le financement des frais de publication de ce journal a été fourni par le NIWA, Nouvelle-Zélande.
Conflit d’intérêt
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Nous remercions le groupe du programme des services de conservation, le département de la conservation de la Nouvelle-Zélande, en particulier Ian Angus, Kris Ramm, et aussi Freydis Hjorvarsdottir (précédemment du CSP maintenant du ministère des industries primaires de la Nouvelle-Zélande) pour leur soutien au travail. Nous remercions Helen Neil (NIWA) et Dan Sinclair (VUW), pour leur soutien à la fourniture de leurs données préliminaires. Nous remercions le personnel du NIWA, Sadie Mills et Diana Macpherson, pour leur contribution à la sélection de l’échantillon, Owen Anderson pour la production de la figure 1, Peter Horn pour sa révision interne approfondie, et Rosemary Hurst pour ses commentaires et conseils utiles sur le manuscrit. Nous remercions Jeremy Horowitz (James Cook University, Australie) pour l’identification des échantillons, et Dennis Opresko (Emeritus Smithsonian Institute) pour ses commentaires sur les révisions de la taxonomie du corail noir. Enfin, nous remercions les trois réviseurs, ce document a grandement bénéficié de leur évaluation détaillée et constructive.
Adkins, J. F., Griffin, S., Kashgarian, M., Cheng, H., Druffel, E. R. M., Boyle, E. A., et al. (2002). Radiocarbon dating of deep-sea corals. Radiocarbon 44, 567-580. doi : 10.1017/s0033822200031921
CrossRef Full Text | Google Scholar
Althaus, F., Williams, A., Schlacher, T. A., Kloser, R. J., Green, M. A., Barker, B. A., et al. (2009). Impacts of bottom trawling on deep-coral ecosystems of seamounts are long-lasting. Mar. Ecol. Prog. Ser. 397, 279-294. doi : 10.3354/meps08248
CrossRef Full Text | Google Scholar
Alves, E. Q., Macario, K., Ascough, P., et Bronk Ramsey, C. (2018). L’effet de réservoir mondial de radiocarbone marin : définitions, mécanismes et perspectives. Rev. Geophys. 56, 278-305. doi : 10.1002/2017RG000588
CrossRef Full Text | Google Scholar
Anderson, O., Tracey, D., Bostock, H., Williams, M., et Clark, M. (2014). Modélisation affinée de la convenance de l’habitat pour les espèces coralliennes protégées dans la ZEE de la Nouvelle-Zélande. Rapport du client NIWA préparé pour le ministère de la Conservation. WLG2014-69No. 46. Auckland : NIWA.
Google Scholar
Andrews, A. H., Cailliet, G. M., Kerr, L. A., Coale, K. H., Lundstrom, C., et DeVogelaere, A. P. (2005). « Investigations of age and growth for three deep-sea corals from the Davidson Seamount off central California, » in Cold-Water Corals and Ecosystems, eds A. Freiwald and J. M. Roberts (Berlin : Springer-Verlag), 1021-1038. doi : 10.1007/3-540-27673-4_51
CrossRef Full Text | Google Scholar
Andrews, A. H., Cordes, E. E., Mahoney, M. M., Munk, K., Coale, K. H., Cailliet, G. M., et al. (2002). Age, growth and radiometric age validation of a deep-sea, habitat-forming gorgonian (Primnoa resedaeformis) from the Gulf of Alaska. Hydrobiologia 471, 101-110.
Google Scholar
Anthony, K. R. N., et Marshall, P. A. (2009). Coral Reefs and Climate Change. Bilan des impacts et de l’adaptation au changement climatique marin pour l’Australie 2009. Gland : UICN.
Google Scholar
Bronk Ramsey, C. (2001). Développement du programme d’étalonnage du radiocarbone OxCal. Radiocarbon 43, 355-363. doi : 10.1017/s0033822200038212
CrossRef Full Text | Google Scholar
Cairns, S., Gershwin, L., Brook, F., Pugh, P., Dawson, E., Ocanþa, O., et al. (2009). « Phylum cnidaria : corals, medusae, hydroids myxozo-ans, » in New Zealand Inventory of Biodiversity, Volume 1 : Kingdom Animalia, ed. D. P. Gordon (Nouvelle-Zélande : Canterbury University Press), 59-101.
Google Scholar
Carreiro-Silva, M., Andrews, A. H., Braga-Henriques, A., de Matos, V., Porteiro, F. M., et Santos, R. S. (2013). Variabilité des taux de croissance du corail noir Leiopathes sp. des Açores. Mar. Ecol. Progr. Ser. 473, 189-199. doi : 10.3354/meps10052
CrossRef Full Text | Google Scholar
Chiswell, S. M., Bostock, H. C., Sutton, P. J. H., et Williams, M. J. M. (2015). L’océanographie physique des mers profondes autour de la Nouvelle-Zélande : une revue, New Zealand. J. Mar. Freshw. Res. 49, 1-32. doi : 10.1080/00288330.2014.992918
CrossRef Full Text | Google Scholar
Clark, M., Bowden, D., Baird, S., et Stewart, R. (2010). Effets de la pêche sur la biodiversité benthique des monts sous-marins du complexe « Graveyard », nord de Chatham Rise. New Zeal. Aqu. Environ. Biodivers. Rep. 46:40.
Google Scholar
Clark, M., et Rowden, A. (2009). Effets du chalutage en eau profonde sur les assemblages de macro-invertébrés des monts sous-marins de la Chatham Rise, Nouvelle-Zélande. Deep Sea Res. I 56, 1540-1554. doi : 10.1016/j.dsr.2009.04.015
CrossRef Full Text | Google Scholar
Clark, M., Tracey, D., Anderson, O., et Parker, S. (2014). Évaluation pilote des risques écologiques pour les coraux protégés. Wellington : Institut national de recherche sur l’eau et l’atmosphère, 32.
Google Scholar
Clark, M. R., Bowden, D. A., Rowden, A. A., et Stewart, R. (2019). Peu de preuves de la résilience des communautés benthiques au chalutage de fond sur les monts sous-marins après 15 ans. Front. Mar. Sci. 6:63. doi : 10.3389/fmars.2019.00063
CrossRef Full Text | Google Scholar
Coleman, D. C. (1991). Techniques de l’isotope du carbone. Cambridge, MA : Academic Press.
Google Scholar
Consalvey, M., MacKay, K., et Tracey, D. (2006). Examen des informations sur les espèces de coraux d’eau profonde protégées dans la région de la Nouvelle-Zélande. Rapport du client NIWA. WLG2006-85. 60. Auckland : NIWA.
Google Scholar
Druffel, E. R. M., Griffin, S., Witter, A., Nelson, E., Southon, J., Kashgarian, M., et al. (1995). Gerardia : pin de bristlecone de la mer profonde ? Geochim. Cosmochim. Acta 59, 5031-5036. doi : 10.1016/0016-7037(95)00373-8
CrossRef Full Text | Google Scholar
Druffel, E. R. M., King, L. L., Belastock, R. A., and Buesseller, K. O. (1990). Growth rate of a deep-sea coral using 210Pb and other isotopes. Geochim. Cosmochim. Acta 54, 1493-1500.
Google Scholar
Fallon, S. J., Fifield, L. K., et Chappell, J. M. (2010). Le prochain chapitre de la datation au radiocarbone à l’Université nationale australienne : rapport d’étape sur l’AMS à un seul étage. Nuclear Instr. Methods Phys. Res. Sec. B 268, 898-901. doi : 10.1016/j.nimb.2009.10.059
CrossRef Full Text | Google Scholar
Freeman, D., et Cryer, M. (2019). » Current management measures and threats « , in The State of Knowledge of Deep-Sea Corals in the New Zealand Region, Chap. 9, eds D. M. Tracey and F. Hjorvarsdottir (Auckland : NIWA Science and Technology Series).
Google Scholar
Gammon, M. J., Tracey, D. M., Marriott, P. M., Cummings, V. J., et Davy, S. K. (2018). La réponse physiologique du corail des profondeurs Solenosmilia variabilis à l’acidification des océans. PEERJ 6:e5236. doi : 10.7717/peerj.5236
PubMed Abstract | CrossRef Full Text | Google Scholar
Griffin, S., et Druffel, E. M. (1989). Sources de carbone pour les coraux d’eau profonde. Radiocarbon 31, 533-543. doi : 10.1017/s0033822200012121
CrossRef Full Text | Google Scholar
Hitt, N. T., Sinclair, D. J., Fallon, S. J., Neil, H. L., Tracey, D. M., Komugabe-Dixson, A., et al. (2020). Croissance et longévité des coraux noirs de Nouvelle-Zélande. Deep Sea Res. I 2020:103298. doi : 10.1016/j.dsr.2020.103298
CrossRef Full Text | Google Scholar
Komugabe, A. F., Fallon, S. J., Thresher, R. E., and Eggins, S. M. (2014). Les âges du réservoir de surface de la mer de Tasman moderne à partir des coraux noirs d’eau profonde. Deep-Sea Res. 99, 207-212. doi : 10.1016/j.dsr2.2013.05.024
CrossRef Full Text | Google Scholar
Komugabe-Dixson, A. F., Fallon, S. J., Eggins, S. M., et Thresher, R. E. (2016). Preuve radiocarbone pour les changements du milieu de l’Holocène tardif dans la circulation de l’océan Pacifique sud-ouest. Paleoceanography 31, 971-985. doi : 10.1002/2016PA002929
CrossRef Full Text | Google Scholar
Love, M. S., Yoklavich, M. M., Black, B. A., and Andrews, A. H. (2007). Âge des colonies de corail noir (Antipathes dendrochristos), avec des notes sur les espèces invertébrées associées. Bull. Mar. Sci. 80, 391-400.
Google Scholar
Matsumoto, K. (2007). Âge de circulation des océans mondiaux basé sur le radiocarbone. J. Geophys. Res. 112:C09004. doi : 10.1029/2007JC004095
CrossRef Full Text | Google Scholar
Mortensen, P. B., and Buhl-Mortensen, L. (2005). Morphologie et croissance des gorgones d’eau profonde Primnoa resedaeformis et Paragorgia arborea. Mar. Biol. 147, 775-788. doi : 10.1007/s00227-005-1604-y
CrossRef Full Text | Google Scholar
Noé, S. U., Lembke-Jene, L., and Chr Dullo, W. (2008). Taux de croissance variables chez les coraux bambous : sclérochronologie et datation radiocarbone d’un squelette de gorgone d’eau profonde du milieu de l’Holocène (Keratosis sp… : Octocorallia) de Chatham Rise (Nouvelle-Zélande). Facies 54, 151-166. doi : 10.1007/s10347-007-0129-x
CrossRef Full Text | Google Scholar
Pinkerton, M. H. (2016). Observations par satellite de la couleur de l’océan du phytoplancton dans la ZEE de la Nouvelle-Zélande, 1997-2016. Ministère de l’environnement. Wellington : NIWA.
Google Scholar
Prouty, N. G., Fisher, C. R., Demopoulous, A. W. J., et Druffel, E. R. M. (2016). Taux de croissance et âges des coraux dee-sea impactés par la marée noire de Deepwater Horizon. Deep-Sea Res. II 129, 196-212. doi : 10.1016/j.dsr2.2014.10.021
CrossRef Full Text | Google Scholar
Prouty, N. G., Roark, E. B., Buster, N. A., et Ross, S. W. (2011). Taux de croissance et répartition par âge des coraux noirs d’eau profonde dans le golfe du Mexique. Mar. Ecol. Prog. Ser. 423, 101-115. doi : 10.3354/meps08953
CrossRef Full Text | Google Scholar
Reimer, P. J., Bard, E., Bayliss, A., Beck, J. W., Blackwell, P. G., Bronk Ramsey, C., et al. (2013). Courbes d’étalonnage des âges radiocarbone IntCal13 et Marine13 0-50 000 ans cal BP. Radiocarbon 55, 1869-1887. doi : 10.2458/azu_js_rc.55.16947
PubMed Abstract | CrossRef Full Text | Google Scholar
Reimer, P. J., et Reimer, R. W. (2001). Une base de données de correction des réservoirs marins et une interface en ligne. Radiocarbon 43, 461-463. doi : 10.1017/s0033822200038339
CrossRef Full Text | Google Scholar
Roark, E. B., Guilderson, T. P., Dunbar, R. B., Fallon, S. J., and Mucclarone, D. A. (2009). Extreme longevity in proteinaceous deep-sea corals. Proc. Natl. Acad. Sci. U.S.A. 106, 5204-5208. doi : 10.1073/pnas.0810875106
PubMed Abstract | CrossRef Full Text | Google Scholar
Roark, E. B., Guilderson, T. P., Dunbar, R. B., and Ingram, B. L. (2006). Radiocarbon based ages and growth rates : Hawaiian deepsea corals. Mar. Ecol. Progr. Ser. 327, 1-37.
Google Scholar
Sánchez, J., et Rowden, A. (2006). « Octocoral diversity on New Zealand Seamounts », in Proceedings of the Presented at the 10th International Coral Reef Symposium, Okinawa.
Google Scholar
Sherwood, O. A., and Edinger, E. N. (2009). Ages and growth rates of some deep-sea gorgonian and antipatharian corals of Newfoundland and Labrador. Can. J. Fish. Aquatic Sci. 66, 142-152. doi : 10.1139/f08-195
CrossRef Full Text | Google Scholar
Sherwood, O. A., Scott, D. B., Risk, M. J., and Guilderson, T. P. (2005). Radiocarbon evidence for annual growth rings in the deep-sea octocoral Primnoa resedaeformis. Mar. Ecol. Prog. Ser. 301, 129-134. doi : 10.3354/meps301129
CrossRef Full Text | Google Scholar
Sikes, E., Burgess, S., Grandpre, R., and Guilderson, T. (2008). Évaluation des âges modernes d’eau profonde dans la région de la Nouvelle-Zélande en utilisant des coraux d’eau profonde. Deep Sea Res. I 55, 38-49. doi : 10.1016/j.dsr.2007.10.004
CrossRef Full Text | Google Scholar
Stuiver, M., et Polach, H. A. (1977). Rapport de discussion sur les données 14C. Radiocarbon 19, 355-363. doi : 10.1017/S0033822200003672
CrossRef Full Text | Google Scholar
Thresher, R., Rintoul, S. R., Koslow, J. A., Weidman, C., Adkins, J., and Proctor, C. (2004). Oceanic evidence of climate change in southern Australia over the last three centuries. Geophys. Res. Lett. 31:l07212.
Google Scholar
Thresher, R. E., MacRae, C. M., Wilson, N. C., and Gurney, R. (2007). Effets environnementaux sur la composition du squelette des gorgones d’eau profonde (Keratoisis spp. ; Isididae). Bull. Mar. Sci. 8, 409-422.
Google Scholar
Tracey, D., Bostock, H., et Shaffer, M. (2018). Méthodes de vieillissement des coraux protégés des grands fonds : Un examen et une recommandation pour une étude de vieillissement. Contrat DOC 4527 GMC – Âge et croissance du corail (POP2017-07). Rapport du client NIWA WN2018035. Auckland : NIWA, 40.
Google Scholar
Tracey, D., Neil, H., Gordon, D., et O’Shea, S. (2003). Chroniques des profondeurs : vieillissement des coraux d’eau profonde dans les eaux néo-zélandaises. NIWA Water Atmosph. 11, 22-24.
Google Scholar
Tracey, D. M., et Hjorvarsdottir, F. (eds) (2019). « The state of knowledge of deep-sea corals in the new zealand region », dans NIWA Science and Technology Series Number 84, (Auckland : NIWA),140.
Google Scholar
Tracey, D. M., Neil, H., Marriott, P., Andrews, A. H., Cailliet, G. M., et Sanchez, J. A. (2007). Age and growth of two genera of deep-sea bamboo corals (family Isididae) in New Zealand waters. Bull. Mar. Sci. 81, 393-408.
Google Scholar
Williams, A., Schlacher, T. A., Rowden, A. A., Althaus, F., Clark, M. R., Bowden, D. A., et al. (2010). Seamount megabenthic assemblages fail to recover from trawling impacts. Mar. Ecol. 31, 183-199. doi : 10.1111/j.1439-0485.2010.00385.x
CrossRef Full Text | Google Scholar
Williams, B., and Grottoli, A. G. (2010). Variabilité des isotopes stables de l’azote et du carbone (δ15N et δ13C) dans les taxons de coraux mous et de coraux noirs du Pacifique tropical peu profond et implications pour les reconstructions paléocéanographiques. Geochim. Cosmochim. Acta 74, 5280-5288. doi : 10.1016/j.gca.2010.06.026
CrossRef Full Text | Google Scholar
Williams, B., Risk, M. J., Ross, S. W., and Sulak, K. J. (2007). Les données d’isotopes stables des antipathaires d’eau profonde : 400-year records from the southeastern coast of the United States of America. Bull. Mar. Sci. 81, 437-447.
Google Scholar
.
Leave a Reply