Menu
ABOVE: © ISTOCK.COM, bodym
Cu puțin peste 10 ani în urmă, când neurobiologul Richard Smeyne lucra la St. Jude Children’s Research Hospital din Memphis, a văzut o înregistrare video cu o rață care se comporta ciudat. Pasărea cu pene albe și cioc portocaliu stătea ușor separată de stolul său, la o fermă din Laos. Se plimba în cerc și își ridica o aripă, apoi și-a pierdut echilibrul și a căzut. S-a ridicat, a încercat să dea din ambele aripi și a căzut din nou.
Smeyne a văzut înregistrarea video în timp ce participa la un seminar ținut de David Boltz, pe atunci postdoctorand, și de consilierul lui Boltz, un „vânător de gripă” pe nume Robert Webster, care conducea programul de cercetare a gripei la spital. Rața, au explicat Boltz și Webster, era infectată cu virusul H5N1 al gripei aviare care îmbolnăvise mii de păsări și omorâse sute de oameni în 2006 și 2007. Smeyne, care studiase neurobiologia bolii Parkinson la șoareci, a recunoscut problemele motorii ale animalului. Acea rață are Parkinson, s-a gândit el.
El i-a spus acest lucru lui Webster după seminar, iar Webster a râs, își amintește Smeyne. „A spus: „Ei bine, este o pasăre bolnavă”.” Dar Smeyne era curios în legătură cu mecanismele neuronale care stau la baza comportamentului anormal al raței. El s-a întrebat dacă rațele sănătoase infectate cu H5N1 în laborator ar prezenta o neurodegenerare asemănătoare cu cea a bolii Parkinson. În laboratorul de nivel 3 de biosecuritate de la St. Jude, el și colegii săi au infectat rațele cu virusul, apoi au sacrificat păsările și le-au scos creierele, depozitându-le în formaldehidă timp de trei săptămâni pentru a ucide virusul activ.
Când Smeyne a început să disece creierele rațelor odată infectate, s-a concentrat pe o regiune numită substantia nigra, care este adesea afectată la pacienții cu Parkinson. „Când l-am deschis, când am tăiat creierul, substantia nigra era devastată. Toți neuronii dispăruseră complet”, spune Smeyne. El s-a întors la Webster, își amintește el, și a spus: „Nu m-am înșelat. Rățușca dvs. chiar are boala Parkinson.”
Inducerea inflamației și a morții în părțile creierului pe care le vedem degenerând în boala Parkinson.
-Richard Smeyne,
Thomas Jefferson University
Pentru că pasărea avusese gripă, Smeyne s-a întrebat dacă nu cumva există o legătură între infecția virală și neurodegenerarea extinsă pe care a observat-o. El l-a întrebat pe Webster despre simptomele experimentate de persoanele infectate cu H5N1. Răspunsul lui Webster – inflamarea creierului care duce la tremurături și alte disfuncții motorii – nu părea a fi „boala Parkinson în toată regula”, spune Smeyne, „dar era parkinsonism”, un subansamblu de simptome ale bolii.
Cercând în literatura de specialitate, Smeyne a găsit mai multe indicii ale capacității gripei de a afecta creierul. Una dintre primele legături între gripă și disfuncțiile neuronale a fost o corelație între gripa spaniolă din 1918, cauzată de un subtip numit H1N1, și o epidemie de Parkinson câteva decenii mai târziu. În anii 1940 și la începutul anilor 1950, diagnosticele de boală neurodegenerativă au părut să crească brusc, de la 1-2% din populația SUA la 2,5-3%, apoi au scăzut înapoi la 1-2%, spune Smeyne. „Practic, cu 50 la sută mai mulți oameni în acei ani au avut Parkinson.”
Dovezile care să sugereze că infecția gripală a cauzat tulburarea neurodegenerativă au fost cel puțin slabe, dar corelația a fost suficientă pentru ca Smeyne să investigheze mai departe. Împreună cu colegii săi, el a injectat doze neletale de H5N1 sau H1N1 în nasul unor șoareci de șase până la opt săptămâni, apoi a urmărit modul în care virusurile s-au răspândit prin sistemul nervos al animalelor. Rezultatele au fost surprinzătoare, spune el: unii viruși nu au fost blocați să intre în creier de bariera hemato-encefalică – un strat semipermeabil de celule care separă sistemul nervos central de circulația corpului. H5N1, de exemplu, se putea infiltra cu ușurință în celulele nervoase din creier și le putea ucide, și se pare că viza în special neuronii producători de dopamină din substantia nigra.1 Și, deși tulpina de gripă H1N1 nu a putut traversa bariera hemato-encefalică, aceasta a făcut ca celulele imunitare ale sistemului nervos central, numite microglia, să pătrundă în substantia nigra și în hipocampus, provocând inflamație și moarte celulară în această zonă.2
„Așadar, acestea au fost două gripe diferite, două mecanisme diferite, dar același efect într-un anumit sens”, spune Smeyne, care s-a mutat la Universitatea Thomas Jefferson din Philadelphia în 2016. „Ele induceau inflamația și moartea în părțile creierului pe care le vedem degenerând în boala Parkinson.”
Experimentele lui Smeyne nu sunt singurele care sugerează că infecțiile virale pot contribui la tulburările neurodegenerative, iar legătura nu se limitează la gripă. Mai multe virusuri diferite, inclusiv rujeola și herpesul, pot da naștere la simptome de scleroză multiplă (SM) la rozătoare, de exemplu.3 Iar nivelurile de herpesvirus sunt mai ridicate în creierele persoanelor care au murit din cauza bolii Alzheimer decât în cele care nu au această boală,4 în timp ce unii pacienți cu HIV dezvoltă demență care pare să fie asociată cu infecția.
„Virușii sunt adesea ignorați în legătură cu bolile neurodegenerative”, a declarat pentru The Scientist neurobiologul Anthony van den Pol de la Universitatea Yale. „Acest lucru se datorează în parte faptului că nu există niciun semn clar că un virus provoacă o boală neurodegenerativă. Dar s-ar putea.”
Invadând creierul
Încă din 1385, medicii din Europa au înregistrat conexiuni între infecția gripală și psihoză. Această legătură între gripă și creier a devenit mult mai evidentă în timpul și după epidemia de gripă spaniolă din 1918. Dovezi mai directe ale legăturii dintre virus și creier au apărut în anii 1970, când cercetătorii conduși de Eugenia Gamboa, pe atunci neurolog la Universitatea Columbia, și colegii săi au găsit antigeni virali în creierul unor persoane decedate care fuseseră afectate de o afecțiune cunoscută sub numele de encefalită letargică.5 Având simptome precum febră, dureri de cap și vedere dublă, encefalita letargică a fost asociată cu – și, după părerea unora, cauzată de – gripa spaniolă din 1918, iar cercetătorii au speculat că această afecțiune ar putea fi un precursor al simptomelor bolii Parkinson. Apoi, în 1997, o echipă de oameni de știință a raportat că șobolanii expuși la virusul encefalitei japoneze au dezvoltat o boală cu simptome similare cu boala Parkinson la om.6
Dar legătura dintre infecția virală și bolile cerebrale a fost puternic contestată. Iar atunci când cercetătorii de la Institutul de Patologie al Forțelor Armate din Washington, DC, au folosit PCR pentru a căuta fragmente din genomul H1N1 în țesutul cerebral conservat al victimelor encefalitei letargice la începutul anilor 2000, nu au găsit niciun semn al virusului.7
Asta era stadiul cercetărilor atunci când Smeyne a descoperit leziunile cerebrale severe asemănătoare cu Parkinson la rațele infectate cu H5N1. Nimeni nu testase în mod direct capacitatea virusului de a provoca boala Parkinson până când a infectat șoarecii cu H5N1 și a documentat leziuni grave la nivelul substantia nigra. Rezultatele sale au dezvăluit, de asemenea, o posibilă cale prin care virusul se poate răspândi din organism în creier. Potrivit lui Smeyne, substantia nigra nu a fost ținta inițială a virusului; acesta a infectat mai întâi neuronii din intestin. „Apoi, virusul a intrat în nervul vag și, practic, a folosit nervul vag ca o ușă din spate în creier.”
Rute de trecere
Câteva virusuri pot intra în organism prin nas și gură și se pot deplasa spre creier prin replicare și răspândire prin bulbii olfactivi; nervul lingual, care coboară pe linia maxilarului și ajunge în limbă; sau nervul vag, care se deplasează prin gât și torace până la stomac.

Planul este izbitor de asemănător cu modul în care boala Parkinson pare să își croiască drum prin corpul uman, spune Smeyne. Conform unei ipoteze acceptate pe scară largă, propusă pentru prima dată de neuropatologul german Heiko Braak în 2003, boala Parkinson începe în intestin, manifestându-se prin probleme digestive, și apoi se mută în creier. „Progresia bolii de la intestin la creierul anterior, care are loc poate pe parcursul a 25 sau 30 de ani la un om”, spune Smeyne. Dar șoarecii trăiesc vieți mult mai scurte. La rozătoare, virusul gripal poate parcurge același traseu și poate crea semne de Parkinson în câteva săptămâni, notează el. Și, așa cum au descoperit Smeyne și colegii săi în cazul șoarecilor infectați cu H1N1, virușii care nu reușesc să ajungă în creier pot juca totuși un rol în neurodegenerare, prin declanșarea unei inflamații severe.
Câteva cercetări nu au reușit să găsească o legătură între infecția virală și afectarea creierului, totuși. De exemplu, atunci când cercetătorii de la US Centers for Disease Control and Prevention din Atlanta, Georgia, au studiat efectele tulpinii de gripă care a provocat epidemia de gripă spaniolă din 1918, nu au observat niciun semn de inflamație în creierul șoarecilor infectați.8 „Este nevoie de mai multă muncă pentru a căuta o legătură între infecția virală și bolile neurodegenerative”, spune microbiologul Terrence Tumpey, coautor al acelui studiu.
Smeyne suspectează că legătura dintre viruși și bolile centrate pe creier ar putea fi mai subtilă. Pentru a explora în continuare relația dintre H1N1 și Parkinson, el și colegii săi au administrat o toxină numită MPTP unor șoareci care se refăcuseră după infecția cu virusul. Substanța chimică a fost un produs secundar al unui lot prost de heroină sintetică preparată în anii 1970, care i-a determinat pe consumatori să dezvolte boala Parkinson. Șoarecii tratați cu MPTP care fuseseră infectați cu H1N1 au dezvoltat semne ale bolii și au pierdut cu 25% mai mulți neuroni în substantia nigra decât șoarecii neinfectați tratați cu toxina sau șoarecii infectați cu virusul, dar neexpuși la MPTP.9
„Acest lucru ne-a sugerat”, spune Smeyne, „că, deși infecția H1N1 în sine nu a cauzat Parkinson, ea a pregătit sistemul nervos să fie sensibil la alte lucruri care ar putea-o face.”
O legătură mai largă între viruși și neurodegenerare
Legătura dintre gripă și Parkinson nu este singura legătură pe care cercetătorii au făcut-o între viruși și problemele neurologice. La sfârșitul anilor 1980 și începutul anilor 1990, cercetătorii au descoperit că șoarecii infectați cu viruși precum rujeola și herpesul au suferit același tip de afectare a oligodendrocitelor lor – celule din sistemul nervos central care produc mielina, învelișul gras izolator înfășurat în jurul axonilor neuronilor – ca și pacienții cu SM. Nu este clar dacă virușii au invadat direct oligodendrocitele sau pur și simplu au provocat sistemul imunitar al șoarecilor să atace celulele, dar rezultatul final a fost demielinizarea neuronilor, spune van den Pol, la fel ca ceea ce se observă la pacienții cu SM.

Una dintre tulpinile de virus care a indus simptome de SM la șoareci a fost herpesvirusul 6, care a fost, de asemenea, asociat cu dezvoltarea bolii Alzheimer. Legături timide între infecțiile virale și Alzheimer au fost documentate în ultimele câteva decenii, dar posibilitatea a reapărut anul trecut, când Joel Dudley de la Școala de Medicină Icahn de la Mount Sinai și colegii săi, analizând datele din băncile de creiere și din studiile publicate, au descoperit că pacienții cu boala Alzheimer aveau niveluri ridicate de virusuri, cum ar fi herpesvirusul uman 6 și herpesvirusul uman 7, în patru regiuni cheie ale creierului. Pe baza datelor genetice și proteomice, cercetătorii au descoperit, de asemenea, că herpesvirusul uman 6 poate induce expresia genelor care stimulează dezvoltarea proteinei amiloid β, care formează plăcile caracteristice bolii Alzheimer.4
Vezi „Microbii declanșează boala Alzheimer?”
O astfel de corelație nu dovedește că virușii cauzează boala, dar sugerează că agenții patogeni ar putea juca, până la urmă, un rol în bolile neurodegenerative, spune Dudley. „Un lucru care este diferit astăzi în comparație cu meditațiile anterioare privind ipoteza agenților patogeni este faptul că avem metode de secvențiere mult mai puternice care pot arunca o privire mai imparțială asupra peisajului ADN/ARN microbian al țesutului cerebral”, spune el. „Probabil că vom avea o privire și mai bună asupra acestei întrebări pe măsură ce vom aplica tehnologia de secvențiere cu citire lungă și tehnologia de secvențiere cu o singură celulă la eșantioanele de țesut cerebral.”
HIV este un alt virus pe care cercetătorii îl suspectează că ar putea provoca leziuni cerebrale asemănătoare cu Alzheimer sau Parkinson. În anii 1990, oamenii de știință au arătat că HIV ar putea traversa bariera hemato-encefalică, iar studiile ulterioare au dezvăluit că, atunci când virusul se infiltrează în creier, acesta stimulează moartea neuronală și pierderea conexiunilor sinaptice.10 Mai recent, medicii au început să raporteze despre pacienți cu HIV care dezvoltă demență și o pierdere de materie cerebrală care reflectă ceea ce se observă la pacienții cu Alzheimer, explică Sara Salinas, patolog și virusolog la Universitatea din Montpellier, Franța, și colegii săi într-un articol de analiză din 2018 în Frontiers in Cellular Neuroscience.11 Studii mai recente arată că pacienții cu HIV dezvoltă plăci de amiloid β. Și, spune Smeyne, pacienții cu HIV pot dezvolta, de asemenea, încetineală în mișcare și tremurături.
Traversarea barierei hemato-encefalice
Când interacționează cu sistemul nervos, particulele virale pot traversa bariera hemato-encefalică direct sau prin infectarea celulelor endoteliale (mai jos, stânga), sau pot folosi o abordare de cal troian (centru), infectând monocitele care traversează bariera înainte de a se replica și de a izbucni din celulele albe din sânge odată intrate în creier. Alternativ, unii viruși nu traversează bariera hemato-encefalică, dar invocă un răspuns imunitar care poate stimula citokine sau chemokine pentru a sparge bariera (dreapta).

O privire mai atentă la modurile de comunicare neuronală ar putea oferi unele indicii privind dezvoltarea bolilor neurodegenerative. La începutul acestui an, două grupuri de oameni de știință au raportat că, pe lângă faptul că folosesc semnale electrice și chimice pentru a comunica între ei, neuronii folosesc vezicule extracelulare care transportă ARN-uri mesageriale.12,13 Structura acestor vezicule amintește de modul în care HIV și alte retrovirusuri construiesc învelișuri protectoare numite capside care transportă materialul genetic al virusului de la o celulă la alta, spune Jason Shepherd, cercetător în neuroștiințe la Universitatea din Utah și coautor al unuia dintre studii. Genele care codifică veziculele ar putea fi rămășițe de la infecții anterioare, sugerează el, iar aceste capside care imită virusul ar putea adăposti proteine toxice, cum ar fi amiloidul β, și le-ar putea răspândi în tot creierul.
„În mod clar, virușii influențează creierul”, spune Shepherd, dar natura acestei relații rămâne neclară.
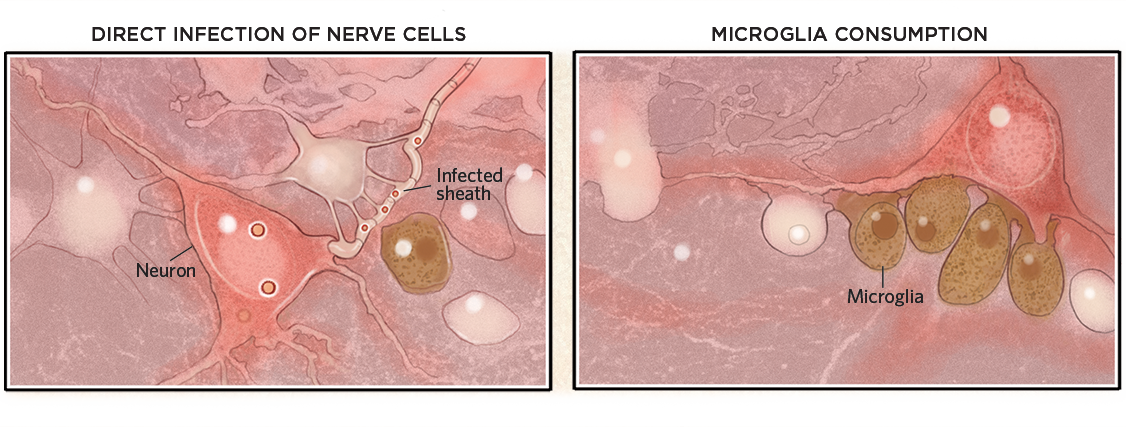
Deteriorarea creierului
După ce se află în interiorul creierului, virușii pot infecta celulele sau învelișurile lor de mielină și le pot ucide (mai jos, stânga). Totuși, virușii nu trebuie neapărat să intre în creier pentru a provoca daune. Ele pot, de asemenea, să declanșeze un răspuns imunitar care activează microglia, care apoi consumă neuronii altfel sănătoși (dreapta).
Urmeneala persistă
O provocare în înțelegerea modului în care creierul răspunde la o infecție virală este că efectele pot persista mult timp după ce sistemul nostru imunitar a eliminat infecția din corpul nostru. La începutul acestui an, de exemplu, Martin Korte de la Technische Universität Braunschweig din Germania și colegii săi au raportat că creierul șoarecilor infectați cu anumite tulpini ale virusului gripal a suferit deficite de memorie chiar și după ce, aparent, și-au revenit. S-a dovedit că creierele lor erau pline de microglia chiar și la 30 până la 60 de zile după ce infecția s-a instalat pentru prima dată.14 Nivelurile de microglie pot începe să revină la normal în jurul a 60 de zile după infecție, neuronii din șoarecii tineri recuperându-se complet, împreună cu performanțele de memorie ale animalelor. Cu toate acestea, numărul microgliilor poate rămâne ridicat până la 120 de zile, spune Korte pentru The Scientist; acest lucru este echivalent cu mai mult de 10 ani la om.
Van den Pol spune că un astfel de decalaj este exact motivul pentru care oamenii de știință au probleme în a accepta faptul că virușii ar putea provoca boli neurodegenerative. „În știință ne gândim adesea la faptul că unele cauze și efecte sunt de multe ori milisecunde”, spune el. „Aici, este vorba de decenii. Virusul intră și apoi, poate că zeci de ani mai târziu, poate provoca o neurodegenerare potențial gravă” – o astfel de legătură pe termen lung este greu de demonstrat.
În știință ne gândim adesea că unele cauze și efecte sunt adesea milisecunde. Aici, este vorba de decenii.
-Anthony van den Pol,
Yale University
Dacă legătura dintre infecțiile virale și problemele neurologice poate fi stabilită mai concret, cercetătorii ar putea fi capabili să dezvolte modalități de atenuare a efectelor neurologice, spune van den Pol. Înțelegerea modului în care infecțiile declanșează sistemul imunitar, de exemplu, ar putea duce la modalități de a reduce inflamația determinată de glia în speranța de a preveni daunele pe termen lung, sugerează el.
Între timp, Smeyne notează că vaccinarea împotriva gripei – sau cel puțin administrarea de Tamiflu în cazul în care o persoană se infectează – ar putea ajuta la prevenirea complicațiilor neurologice ale infecției gripale. El și colegii săi au testat această abordare pe șoareci după ce rezultatele lor au dezvăluit legătura dintre gripă, toxina MPTP și boala Parkinson. Echipa a administrat unui grup de șoareci un vaccin H1N1 cu 30 de zile înainte de a infecta animalele cu virusul. Un alt grup de șoareci a fost tratat cu Tamiflu timp de o săptămână după ce au fost infectați. Ambele grupuri de șoareci au fost lăsate să se recupereze înainte de a li se administra o doză mică de MPTP. În timp ce șoarecii de control care nu au primit nici vaccinul, nici tratamentul antigripal au dezvoltat simptome asemănătoare cu cele ale bolii Parkinson, șoarecii tratați nu au dezvoltat efecte neurodegenerative. „Ne-am protejat împotriva doar prin tratament timpuriu sau tratament profilactic cu vaccinul”, spune Smeyne.
Este o dovadă în plus pentru a susține ideea că infecțiile virale pot afecta creierul, spune Smeyne, dar încă nu există un studiu categoric care să demonstreze că un virus poate cauza Parkinson, sau Alzheimer, sau orice alt număr de tulburări neurologice. „Îmi place ideea că virușii pot provoca o mulțime de boli diferite ale creierului ca ipoteză”, spune van den Pol. „Dar respect, de asemenea, faptul că este într-adevăr o ipoteză.”
- H. Jang et al., „Highly pathogenic H5N1 influenza virus can enter the central nervous system and induce neuroinflammation and neurodegeneration,” PNAS, 106:14063-68, 2009.
- S. Sadasivan și alții, „Inducerea activării microgliei după infecția cu virusul gripal A/CA/04/2009 H1N1 non-neurotropic”, PLOS ONE, 10:e0124047, 2015.
- U.G. Liebert, V. ter Meulen. „Aspecte virologice ale encefalomielitei induse de virusul rujeolei la șobolanii Lewis și BN”, J Gen Virol, 68:1715-22, 1987.
- B. Readhead et al., „Multiscale analysis of independent Alzheimer’s cohorts finds disruption of molecular, genetic, and clinical networks by human herpesvirus,” Neuron, 99:64-82.e7, 2018.
- E.T. Gamboa et al., „Influenza virus antigen in postencephalitic parkinsonism brain. Detection by immunofluorescence,” Arch Neurol, 31:228-32, 1974.
- A. Ogata et al., „A rat model of Parkinson’s disease induced by Japanese encephalitis virus,” J Neurovirol, 3:141-47, 1997.
- S. McCall et al., „Influenza RNA not detected in archival brain tissues from acute encephalitis lethargica cases or in postencephalitic Parkinson cases,” J Neuropathol Exp Neurol, 60:696-704, 2001.
- J.C. Kash et al., „Genomic analysis of increased host immune and cell death responses induced by 1918 influenza virus,” Nature, 443:578-81, 2006.
- S. Sadasivan et al., „Efectele sinergice ale gripei și ale 1-metil-4-fenil-1,2,3,6-tetrahidropiridinei (MPTP) pot fi eliminate prin utilizarea terapiei gripale: Experimental evidence for the multi-hit hypothesis”, NPJ Parkinsons Dis, 3:18, 2017.
- S. Peudenier et al., „HIV receptors within the brain: a study of CD4 and MHC-II on human neurons, astrocytes and microglial cells”, Res Virol, 142:145-49, 1991.
- G. Canet et al., „HIV neuroinfection and Alzheimer’s disease: Similitudini și legături potențiale?” Front Cell Neurosci, 12:307, 2018.
- E.D. Pastuzyn et al., „The neuronal gene Arc encodes a repurposed retrotransposon gag protein that mediates intercellular RNA transfer,” Cell, 172:P275-88.E18, 2018.
- J. Ashley și colab., „Retrovirus-like gag protein Arc1 binds RNA and traffics across synaptic boutons”, Cell, 172:P262-74.E11, 2018.
- S. Hosseini et al., „Long-term neuroinflammation induced by influenza A virus infection and the impact on hippocampal neuron morphology and function,” J Neurosci, 38:3060-80, 2018.
.
Leave a Reply