Menú
ABOVE: © ISTOCK.COM, bodym
Hace poco más de 10 años, cuando el neurobiólogo Richard Smeyne trabajaba en el Hospital de Investigación Infantil St. Jude de Memphis, vio un vídeo de un pato que actuaba de forma extraña. El pájaro de plumas blancas y pico anaranjado se encontraba ligeramente apartado de su bandada en una granja de Laos. Caminó en círculos y levantó un ala, luego perdió el equilibrio y se cayó. Se levantó, intentó batir ambas alas y volvió a caer.
Smeyne vio el vídeo mientras asistía a un seminario impartido por el entonces postdoctorado David Boltz y el asesor de Boltz, un «cazador de gripe» llamado Robert Webster, que dirigía el programa de investigación de la gripe en el hospital. El pato, explicaron Boltz y Webster, estaba infectado con el virus H5N1 de la gripe aviar que había enfermado a miles de aves y matado a cientos de personas en 2006 y 2007. Smeyne, que había estado estudiando la neurobiología de la enfermedad de Parkinson en ratones, reconoció los problemas motores del animal. Ese pato tiene Parkinson, pensó.
Se lo contó a Webster después del seminario, y éste se rió, recuerda Smeyne. «Dijo: ‘Bueno, es un pájaro enfermo'». Pero Smeyne sentía curiosidad por los mecanismos neuronales que subyacen al comportamiento anormal del pato. Se preguntó si los patos sanos infectados con el H5N1 en el laboratorio mostrarían una neurodegeneración similar a la del Parkinson. En el laboratorio de nivel 3 de bioseguridad del St. Jude, él y sus colegas infectaron a los patos con el virus, luego sacrificaron a las aves y extrajeron sus cerebros, almacenándolos en formaldehído durante tres semanas para matar el virus activo.
Cuando Smeyne comenzó a diseccionar los cerebros de los patos una vez infectados, se centró en una región llamada sustancia negra, que a menudo está dañada en los pacientes de Parkinson. «Cuando lo abrí, al cortar el cerebro, la sustancia negra estaba devastada. Todas las neuronas habían desaparecido por completo», dice Smeyne. Volvió a Webster, recuerda, y le dijo: «No estaba equivocado. Su pato tiene la enfermedad de Parkinson»
Estaban induciendo la inflamación y la muerte en las partes del cerebro que vemos degenerar en la enfermedad de Parkinson.
-Richard Smeyne,
Universidad Thomas Jefferson
Dado que el ave había tenido la gripe, Smeyne se preguntó si había una conexión entre la infección viral y la extensa neurodegeneración que observó. Preguntó a Webster sobre los síntomas que experimentaban las personas infectadas por el H5N1. La respuesta de Webster -inflamación del cerebro que conduce a temblores y otras disfunciones motoras- no sonaba como «la enfermedad de Parkinson en toda regla», dice Smeyne, «pero era parkinsonismo», un subconjunto de síntomas de la enfermedad.
Buscando en la literatura, Smeyne encontró más indicios de la capacidad de la gripe para dañar el cerebro. Uno de los primeros vínculos entre la gripe y la disfunción neuronal fue la correlación entre la gripe española de 1918, causada por un subtipo llamado H1N1, y una epidemia de Parkinson unas décadas después. En los años 40 y principios de los 50, los diagnósticos de esta enfermedad neurodegenerativa parecieron aumentar bruscamente, pasando del 1-2 por ciento de la población estadounidense al 2,5-3 por ciento, para luego volver a descender al 1-2 por ciento, afirma Smeyne. «Básicamente, un 50 por ciento más de personas en esos años contrajeron Parkinson».
La evidencia que sugería que la infección de la gripe causaba el trastorno neurodegenerativo era tenue, por decir lo menos, pero la correlación fue suficiente para que Smeyne investigara más. Junto con sus colegas, inyectó dosis no letales de H5N1 o H1N1 en las narices de ratones de entre seis y ocho semanas, y luego siguió la propagación de los virus por el sistema nervioso de los animales. Los resultados fueron sorprendentes: la barrera hematoencefálica, una capa semipermeable de células que separa el sistema nervioso central de la circulación del cuerpo, no impedía que algunos virus entraran en el cerebro. El H5N1, por ejemplo, podía infiltrarse fácilmente en las células nerviosas del cerebro y matarlas, y parecía dirigirse especialmente a las neuronas productoras de dopamina de la sustancia negra.1 Y aunque la cepa de la gripe H1N1 no podía cruzar la barrera hematoencefálica, seguía provocando que las células inmunitarias del sistema nervioso central, llamadas microglías, fluyeran hacia la sustancia negra y el hipocampo, causando inflamación y muerte celular en la zona.2
«Así que se trataba de dos gripes diferentes, dos mecanismos distintos, pero el mismo efecto en cierto sentido», dice Smeyne, que se trasladó a la Universidad Thomas Jefferson de Filadelfia en 2016. «Estaban induciendo la inflamación y la muerte en las partes del cerebro que vemos degenerar en la enfermedad de Parkinson.»
Los experimentos de Smeyne no son los únicos que sugieren que las infecciones virales pueden contribuir a los trastornos neurodegenerativos, y la conexión no se limita a la gripe. Varios virus diferentes, incluidos el sarampión y el herpes, pueden dar lugar a síntomas de esclerosis múltiple (EM) en roedores, por ejemplo.3 Y los niveles del virus del herpes son más altos en los cerebros de las personas que murieron de Alzheimer que en las que no padecen la enfermedad,4 mientras que algunos pacientes con VIH desarrollan una demencia que parece estar asociada a la infección.
«A menudo se ignoran los virus en relación con las enfermedades neurodegenerativas», dice a The Scientist el neurobiólogo de la Universidad de Yale Anthony van den Pol. «Eso se debe, en parte, a que no hay ninguna señal clara de que un virus cause una enfermedad neurodegenerativa. Pero podría.»
Invadir el cerebro
Ya en 1385, los médicos de Europa registraron conexiones entre la infección de la gripe y la psicosis. Ese vínculo entre la gripe y el cerebro se hizo mucho más evidente durante y después de la epidemia de gripe española de 1918. Una prueba más directa de la relación entre el virus y el cerebro se produjo en la década de 1970, cuando los investigadores dirigidos por Eugenia Gamboa, entonces neuróloga de la Universidad de Columbia, y sus colegas encontraron antígenos virales en los cerebros de personas fallecidas que habían padecido una enfermedad conocida como encefalitis letárgica.5 Con síntomas como fiebre, dolor de cabeza y visión doble, la encefalitis letárgica se asoció a la gripe española de 1918 -y algunos pensaron que había sido causada por ella-, y los investigadores especularon con que la enfermedad podría ser un precursor de los síntomas del Parkinson. Luego, en 1997, un equipo de científicos informó que las ratas expuestas al virus de la encefalitis japonesa desarrollaron una enfermedad con síntomas similares a los de la enfermedad de Parkinson en humanos.6
Pero la conexión entre la infección viral y la enfermedad cerebral ha sido muy discutida. Y cuando los investigadores del Instituto de Patología de las Fuerzas Armadas en Washington, DC, utilizaron la PCR para buscar fragmentos del genoma del H1N1 en el tejido cerebral conservado de las víctimas de la encefalitis letárgica a principios de la década de 2000, no encontraron signos del virus.7
Tal era el estado de la investigación cuando Smeyne descubrió el grave daño cerebral similar al Parkinson en los patos infectados por el H5N1. Nadie había comprobado directamente la capacidad del virus para causar la enfermedad de Parkinson hasta que él infectó ratones con el H5N1 y documentó graves daños en la sustancia negra. Sus resultados también revelaron una posible vía de propagación del virus desde el cuerpo hasta el cerebro. Según Smeyne, la sustancia negra no fue el objetivo inicial del virus, sino que primero infectó las neuronas del intestino. «Luego, el virus se dirigió al nervio vago y, básicamente, utilizó el nervio vago como una puerta trasera hacia el cerebro.»
Rutas de paso
Algunos virus pueden entrar en el cuerpo a través de la nariz y la boca y trasladarse al cerebro replicándose y propagándose a través de los bulbos olfatorios; el nervio lingual, que baja por la mandíbula y llega a la lengua; o el nervio vago, que viaja por el cuello y el tórax hasta el estómago.

El patrón es sorprendentemente similar a la forma en que la enfermedad de Parkinson parece abrirse camino a través del cuerpo humano, dice Smeyne. Según una hipótesis ampliamente aceptada, propuesta por primera vez por el neuropatólogo alemán Heiko Braak en 2003, la enfermedad de Parkinson comienza en el intestino, manifestándose como problemas digestivos, y luego pasa al cerebro. «La progresión de la enfermedad desde el intestino hasta el cerebro anterior tiene lugar a lo largo de unos 25 o 30 años en un ser humano», dice Smeyne. Pero los ratones viven mucho menos tiempo. En los roedores, el virus de la gripe puede recorrer el mismo camino y crear signos de Parkinson en unas pocas semanas, señala. Y, como descubrieron Smeyne y sus colegas con ratones infectados por el virus H1N1, los virus que no consiguen llegar al cerebro pueden seguir desempeñando un papel en la neurodegeneración, al desencadenar una inflamación grave.
Sin embargo, algunas investigaciones no han logrado encontrar una relación entre la infección viral y el daño al cerebro. Por ejemplo, cuando los investigadores de los Centros para el Control y la Prevención de Enfermedades de EE.UU. en Atlanta, Georgia, estudiaron los efectos de la cepa de gripe que causó la epidemia de gripe española de 1918, no observaron ningún signo de inflamación en los cerebros de los ratones infectados.8 «Hay que seguir trabajando para buscar una relación entre la infección viral y las enfermedades neurodegenerativas», afirma el microbiólogo Terrence Tumpey, coautor de ese estudio.
Smeyne sospecha que la relación entre los virus y las enfermedades centradas en el cerebro podría ser más sutil. Para explorar más la relación entre el H1N1 y el Parkinson, él y sus colegas dieron una toxina llamada MPTP a ratones que se habían recuperado de la infección con el virus. La sustancia química era un subproducto de un lote malo de heroína sintética cocinado en la década de 1970 que llevó a los usuarios a desarrollar la enfermedad de Parkinson. Los ratones tratados con MPTP que habían sido infectados con el H1N1 desarrollaron signos de la enfermedad y perdieron un 25 por ciento más de neuronas en la sustancia negra que los ratones no infectados tratados con la toxina o los ratones infectados con el virus pero no expuestos al MPTP.9
«Eso nos sugirió», dice Smeyne, «que si bien la infección por el H1N1 por sí sola no causó el Parkinson, preparó al sistema nervioso para ser sensible a otras cosas que sí lo harían».
Un vínculo más amplio entre los virus y la neurodegeneración
La conexión entre la gripe y el Parkinson no es el único vínculo que los investigadores han hecho entre los virus y los problemas neurológicos. A finales de los años ochenta y principios de los noventa, los investigadores descubrieron que los ratones infectados con virus como el sarampión y el herpes sufrían el mismo tipo de daño en sus oligodendrocitos -células del sistema nervioso central que producen mielina, la vaina grasa aislante que envuelve los axones de las neuronas- que los pacientes con EM. No está claro si los virus invadieron los oligodendrocitos directamente, o simplemente provocaron que el sistema inmunitario de los ratones atacara las células, pero el resultado final fue la desmielinización de las neuronas, dice van den Pol, al igual que lo que se observa en los pacientes con EM.

Una de las cepas de virus que indujeron síntomas de EM en ratones fue el herpesvirus 6, que también se ha asociado con el desarrollo de la enfermedad de Alzheimer. En las últimas décadas se han documentado vínculos tentativos entre las infecciones virales y el Alzheimer, pero la posibilidad resurgió el año pasado cuando Joel Dudley, de la Escuela de Medicina Icahn del Monte Sinaí, y sus colegas, al revisar los datos de los bancos de cerebros y los estudios publicados, descubrieron que los pacientes con la enfermedad de Alzheimer tenían niveles elevados de virus, como el herpesvirus humano 6 y el herpesvirus humano 7, en cuatro regiones clave del cerebro. Basándose en datos genéticos y proteómicos, los investigadores también descubrieron que el herpesvirus humano 6 puede inducir la expresión de genes que estimulan el desarrollo de la proteína β amiloide, que forma las placas características de la enfermedad de Alzheimer.4
Ver «¿Desencadenan los microbios la enfermedad de Alzheimer?»
Tal correlación no prueba que los virus causen la enfermedad, pero sí sugiere que los patógenos pueden desempeñar un papel en las enfermedades neurodegenerativas después de todo, dice Dudley. «Una cosa que es diferente hoy en día en comparación con las reflexiones anteriores sobre la hipótesis de los patógenos es que tenemos métodos de secuenciación mucho más potentes que pueden echar un vistazo más imparcial al paisaje del ADN/ARN microbiano del tejido cerebral», dice. «Es probable que obtengamos una visión aún mejor de esta cuestión a medida que apliquemos la tecnología de secuenciación de lectura larga y la tecnología de secuenciación unicelular a las muestras de tejido cerebral».
El VIH es otro virus que los investigadores sospechan que podría causar daños cerebrales similares a los del Alzheimer o el Parkinson. En la década de 1990, los científicos demostraron que el VIH podía atravesar la barrera hematoencefálica, y estudios posteriores revelaron que cuando el virus se infiltra en el cerebro, estimula la muerte neuronal y la pérdida de conexiones sinápticas.10 Más recientemente, los médicos han comenzado a informar sobre pacientes con VIH que desarrollan demencia y una pérdida de materia cerebral que refleja lo que se observa en los pacientes con Alzheimer, explican Sara Salinas, patóloga y viróloga de la Universidad de Montpellier en Francia, y sus colegas en un artículo de revisión de 2018 en Frontiers in Cellular Neuroscience.11 Estudios más recientes muestran que los pacientes con VIH desarrollan placas de β amiloide. Y, según Smeyne, los pacientes con VIH también pueden desarrollar lentitud de movimientos y temblores.
Cruzar la barrera hematoencefálica
Cuando interactúan con el sistema nervioso, las partículas víricas pueden cruzar la barrera hematoencefálica directamente o a través de la infección de las células endoteliales (abajo, a la izquierda), o pueden utilizar un enfoque de caballo de Troya (en el centro), infectando a los monocitos que cruzan la barrera antes de replicarse y salir de los glóbulos blancos una vez dentro del cerebro. Por otra parte, algunos virus no atraviesan la barrera hematoencefálica, pero invocan una respuesta inmunitaria que puede estimular a las citocinas o quimiocinas para que rompan la barrera (derecha).

Una mirada más atenta a los modos de comunicación neuronal podría dar algunas pistas sobre el desarrollo de las enfermedades neurodegenerativas. A principios de este año, dos grupos de científicos informaron de que, además de utilizar señales eléctricas y químicas para comunicarse entre sí, las neuronas emplean vesículas extracelulares que transportan ARN mensajeros.12,13 La estructura de estas vesículas recuerda a la forma en que el VIH y otros retrovirus construyen caparazones protectores llamados cápsides que transportan el material genético del virus de una célula a otra, dice Jason Shepherd, neurocientífico de la Universidad de Utah y coautor de uno de los estudios. Los genes que codifican las vesículas podrían ser restos de infecciones pasadas, sugiere, y estas cápsides que imitan a los virus podrían albergar proteínas tóxicas, como el amiloide β, y propagarlas por el cerebro.
«Está claro que los virus influyen en el cerebro», afirma Shepherd, pero la naturaleza de esa relación sigue sin estar clara.
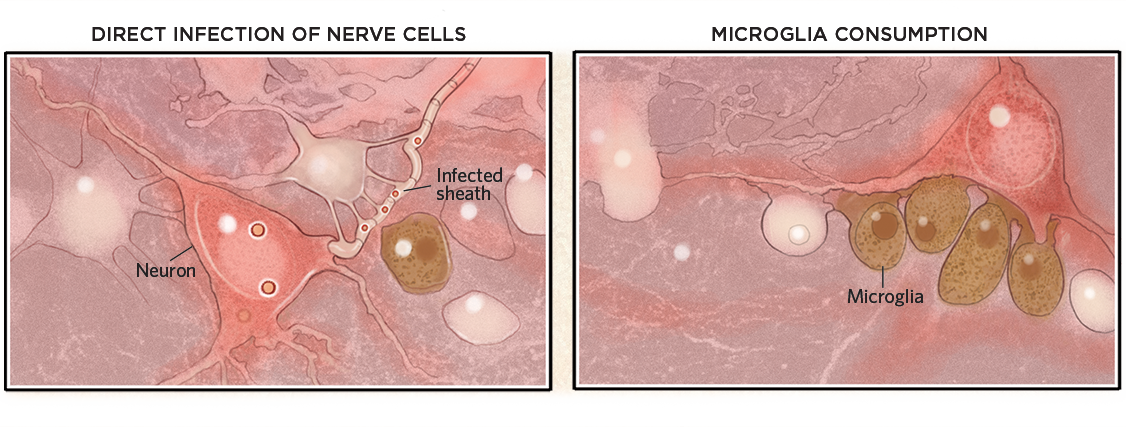
Daños cerebrales
Una vez dentro del cerebro, los virus pueden infectar las células o sus vainas de mielina y matarlas (abajo, izquierda). Sin embargo, los virus no tienen que entrar necesariamente en el cerebro para causar daños. También pueden desencadenar una respuesta inmunitaria que active la microglía, la cual consume neuronas que de otro modo estarían sanas (derecha).
El olvido persiste
Una de las dificultades para entender cómo responde el cerebro a una infección vírica es que sus efectos pueden persistir mucho tiempo después de que nuestro sistema inmunitario haya eliminado la infección de nuestro organismo. A principios de este año, por ejemplo, Martin Korte, de la Universidad Técnica de Braunschweig (Alemania), y sus colegas informaron de que los cerebros de los ratones infectados con ciertas cepas del virus de la gripe sufrían déficits de memoria incluso después de haberse recuperado aparentemente. Resultó que sus cerebros estaban llenos de microglía incluso entre 30 y 60 días después de que se produjera la infección.14 Los niveles de microglía pueden empezar a volver a la normalidad alrededor de 60 días después de la infección, y las neuronas de los ratones jóvenes se recuperan por completo, junto con el rendimiento de la memoria de los animales. Sin embargo, el número de microglías puede permanecer elevado hasta 120 días, dice Korte a The Scientist; eso equivale a más de 10 años en tiempo humano.
Van den Pol dice que ese retraso es exactamente la razón por la que los científicos tienen problemas para aceptar que los virus puedan causar enfermedades neurodegenerativas. «En la ciencia solemos pensar que la causa y el efecto son a menudo milisegundos», dice. «Aquí se habla de décadas. El virus entra y luego tal vez décadas más tarde puede causar algún tipo de neurodegeneración potencialmente grave» – tal vínculo a largo plazo es difícil de demostrar.
En la ciencia a menudo pensamos que alguna causa y efecto son a menudo milisegundos. Aquí se habla de décadas.
-Anthony van den Pol,
Universidad de Yale
Si se puede establecer de forma más concreta la conexión entre las infecciones víricas y los problemas neurológicos, los investigadores podrían desarrollar formas de mitigar los efectos neurológicos, afirma van den Pol. Entender cómo las infecciones desencadenan el sistema inmunitario, por ejemplo, podría conducir a formas de reducir la inflamación impulsada por la glía con la esperanza de prevenir daños a largo plazo, sugiere.
Mientras tanto, Smeyne señala que la vacunación contra la gripe -o al menos, tomar Tamiflu si una persona se infecta- podría ayudar a prevenir las complicaciones neurológicas de la infección por gripe. Él y sus colegas probaron este enfoque en ratones después de que sus resultados revelaran la relación entre la gripe, la toxina MPTP y la enfermedad de Parkinson. El equipo dio a un grupo de ratones una vacuna contra el H1N1 30 días antes de infectar a los animales con el virus. Otro grupo de ratones fue tratado con Tamiflu durante la semana posterior a la infección. Se dejó que ambos grupos de ratones se recuperaran antes de administrarles una dosis baja de MPTP. Mientras que los ratones de control que no recibieron ni la vacuna ni el tratamiento contra la gripe desarrollaron síntomas similares a los del Parkinson, los ratones tratados no desarrollaron efectos neurodegenerativos. «Habíamos protegido sólo con el tratamiento temprano o el tratamiento profiláctico con la vacuna», dice Smeyne.
Es una prueba más para apoyar la idea de que las infecciones virales pueden dañar el cerebro, dice Smeyne, pero todavía no hay un estudio contundente que demuestre que un virus puede causar Parkinson, o Alzheimer, o cualquier número de otros trastornos neurológicos. «Me gusta la idea de que los virus pueden causar muchas enfermedades cerebrales diferentes como hipótesis», dice van den Pol. «Pero también respeto el hecho de que realmente se trata de una hipótesis».
- H. Jang et al., «Highly pathogenic H5N1 influenza virus can enter the central nervous system and induce neuroinflammation and neurodegeneration», PNAS, 106:14063-68, 2009.
- S. Sadasivan et al., «Induction of microglia activation after infection with the non-neurotropic A/CA/04/2009 H1N1 influenza virus,» PLOS ONE, 10:e0124047, 2015.
- U.G. Liebert, V. ter Meulen. «Aspectos virológicos de la encefalomielitis inducida por el virus del sarampión en ratas Lewis y BN», J Gen Virol, 68:1715-22, 1987.
- B. Readhead et al., «Multiscale analysis of independent Alzheimer’s cohorts finds disruption of molecular, genetic, and clinical networks by human herpesvirus», Neuron, 99:64-82.e7, 2018.
- E.T. Gamboa et al., «Influenza virus antigen in postencephalitic parkinsonism brain. Detección por inmunofluorescencia», Arch Neurol, 31:228-32, 1974.
- A. Ogata et al., «A rat model of Parkinson’s disease induced by Japanese encephalitis virus,» J Neurovirol, 3:141-47, 1997.
- S. McCall et al., «Influenza RNA not detected in archival brain tissues from acute encephalitis lethargica cases or in postencephalitic Parkinson cases,» J Neuropathol Exp Neurol, 60:696-704, 2001.
- J.C. Kash et al., «Genomic analysis of increased host immune and cell death responses induced by 1918 influenza virus,» Nature, 443:578-81, 2006.
- S. Sadasivan et al., «Synergistic effects of influenza and 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP) can be eliminated by the use of influenza therapeutics: Evidencia experimental para la hipótesis del multigolpe», NPJ Parkinsons Dis, 3:18, 2017.
- S. Peudenier et al., «HIV receptors within the brain: a study of CD4 and MHC-II on human neurons, astrocytes and microglial cells», Res Virol, 142:145-49, 1991.
- G. Canet et al., «HIV neuroinfection and Alzheimer’s disease: ¿Similitudes y vínculos potenciales?». Front Cell Neurosci, 12:307, 2018.
- E.D. Pastuzyn et al., «The neuronal gene Arc encodes a repurposed retrotransposon gag protein that mediates intercellular RNA transfer,» Cell, 172:P275-88.E18, 2018.
- J. Ashley et al., «La proteína gag similar a un retrotransposón Arc1 se une al ARN y trafica a través de las boutons sinápticas», Cell, 172:P262-74.E11, 2018.
- S. Hosseini et al., «Neuroinflamación a largo plazo inducida por la infección del virus de la gripe A y el impacto en la morfología y la función de las neuronas del hipocampo», J Neurosci, 38:3060-80, 2018.
.
Leave a Reply