Menu
ABOVE: © ISTOCK.COM, bodym
Poco più di 10 anni fa, quando il neurobiologo Richard Smeyne lavorava al St. Jude Children’s Research Hospital di Memphis, vide un video di un’anatra che si comportava in modo strano. L’uccello dalle piume bianche e dal becco arancione era in piedi leggermente separato dal suo stormo in una fattoria del Laos. Ha camminato in cerchio e ha alzato un’ala, poi ha perso l’equilibrio ed è caduta. Si alzò, cercò di sbattere entrambe le ali e cadde di nuovo.
Smeyne vide il video mentre assisteva a un seminario tenuto dall’allora postdoc David Boltz e dal consulente di Boltz, un “cacciatore di influenza” di nome Robert Webster, che dirigeva il programma di ricerca sull’influenza all’ospedale. L’anatra, hanno spiegato Boltz e Webster, era stata infettata dal virus dell’influenza aviaria H5N1 che aveva ammalato migliaia di uccelli e ucciso centinaia di persone nel 2006 e 2007. Smeyne, che aveva studiato la neurobiologia del morbo di Parkinson nei topi, ha riconosciuto i problemi motori dell’animale. Quell’anatra ha il Parkinson, pensò.
Lo disse a Webster dopo il seminario, e Webster rise, ricorda Smeyne. “Ha detto: ‘Beh, è un uccello malato'”. Ma Smeyne era curioso di conoscere i meccanismi neurali alla base del comportamento anormale dell’anatra. Si chiese se le anatre sane infettate con H5N1 in laboratorio avrebbero mostrato una neurodegenerazione simile al Parkinson. Nel laboratorio di biosicurezza 3 del St. Jude, lui e i suoi colleghi hanno infettato le anatre con il virus, poi hanno sacrificato gli uccelli e rimosso i loro cervelli, conservandoli in formaldeide per tre settimane per uccidere il virus attivo.
Quando Smeyne ha iniziato a sezionare il cervello delle anatre infettate, si è concentrato su una regione chiamata substantia nigra, che è spesso danneggiata nei pazienti di Parkinson. “Quando l’ho aperto, quando ho tagliato il cervello, la substantia nigra era devastata. Tutti i neuroni erano completamente andati”, dice Smeyne. Tornò da Webster, ricorda, e disse: “Non mi sbagliavo. La tua anatra ha il morbo di Parkinson.”
Stavano inducendo infiammazione e morte nelle parti del cervello che vediamo degenerare nel morbo di Parkinson.
-Richard Smeyne,
Thomas Jefferson University
Perché l’uccello aveva avuto l’influenza, Smeyne si chiese se ci fosse una connessione tra l’infezione virale e la vasta neurodegenerazione che aveva osservato. Ha chiesto a Webster i sintomi sperimentati dalle persone infettate da H5N1. La risposta di Webster – un’infiammazione del cervello che porta a tremori e altri malfunzionamenti motori – non suonava come “una vera e propria malattia di Parkinson”, dice Smeyne, “ma era parkinsonismo”, un sottoinsieme dei sintomi della malattia.
Guardando nella letteratura, Smeyne ha trovato altri indizi della capacità dell’influenza di danneggiare il cervello. Uno dei primi collegamenti tra influenza e disfunzioni neurali è stata una correlazione tra l’influenza spagnola del 1918, causata da un sottotipo chiamato H1N1, e un’epidemia di Parkinson pochi decenni dopo. Negli anni ’40 e nei primi anni ’50, le diagnosi della malattia neurodegenerativa sembrarono aumentare bruscamente, dall’1-2 per cento della popolazione statunitense al 2,5-3 per cento, per poi ridiscendere all’1-2 per cento, dice Smeyne. “Fondamentalmente, 50 per cento più persone in quegli anni hanno avuto il Parkinson.”
Le prove per suggerire che l’infezione da influenza ha causato il disturbo neurodegenerativo era tenue, per non dire altro, ma la correlazione era sufficiente per Smeyne per indagare ulteriormente. Con i suoi colleghi, ha sparato dosi non letali di H5N1 o H1N1 nel naso di topi di sei-otto settimane, poi ha seguito come i virus si sono diffusi attraverso il sistema nervoso degli animali. I risultati sono stati sorprendenti, dice: alcuni virus non sono stati bloccati dall’entrare nel cervello dalla barriera emato-encefalica, uno strato semipermeabile di cellule che separa il sistema nervoso centrale dalla circolazione del corpo. H5N1, per esempio, potrebbe facilmente infiltrarsi nelle cellule nervose del cervello e ucciderle, e sembra prendere di mira soprattutto i neuroni produttori di dopamina nella substantia nigra.1 E mentre il ceppo dell’influenza H1N1 non poteva attraversare la barriera emato-encefalica, ha ancora causato cellule immunitarie del sistema nervoso centrale chiamate microglia per fluire nella substantia nigra e nell’ippocampo, causando infiammazione e morte cellulare nella zona.2
“Così questi erano due diverse vampate, due meccanismi diversi, ma lo stesso effetto in un certo senso”, dice Smeyne, che si è trasferito alla Thomas Jefferson University di Philadelphia nel 2016. “Stavano inducendo l’infiammazione e la morte nelle parti del cervello che vediamo degenerare nella malattia di Parkinson.”
Gli esperimenti di Smeyne non sono gli unici a suggerire che le infezioni virali possono contribuire ai disturbi neurodegenerativi, e la connessione non è limitata all’influenza. Diversi virus diversi, tra cui il morbillo e l’herpes, possono dare origine ai sintomi della sclerosi multipla (SM) nei roditori, per esempio.3 E i livelli di herpesvirus sono più alti nel cervello delle persone morte di Alzheimer che in quelle senza la malattia,4 mentre alcuni pazienti con HIV sviluppano una demenza che sembra essere associata all’infezione.
“I virus sono spesso ignorati in relazione alle malattie neurodegenerative”, dice a The Scientist il neurobiologo della Yale University Anthony van den Pol. “Questo è in parte perché non c’è un chiaro segno che un virus causi una malattia neurodegenerativa. Ma potrebbe.”
Invadendo il cervello
Già nel 1385, i medici in Europa registrarono connessioni tra l’infezione influenzale e la psicosi. Questo legame tra l’influenza e il cervello è diventato molto più evidente durante e dopo l’epidemia di influenza spagnola del 1918. Prove più dirette del legame virus-cervello sono arrivate negli anni ’70, quando i ricercatori guidati da Eugenia Gamboa, allora neurologa alla Columbia University, e colleghi hanno trovato antigeni virali nel cervello di persone decedute che erano state afflitte da una condizione nota come encefalite letargica.5 Avendo sintomi come febbre, mal di testa e visione doppia, l’encefalite letargica era associata all’influenza spagnola del 1918 e, secondo alcuni, causata da essa, e i ricercatori hanno ipotizzato che la condizione potesse essere un precursore dei sintomi del Parkinson. Poi, nel 1997, un team di scienziati ha riferito che i ratti esposti al virus dell’encefalite giapponese hanno sviluppato una malattia con sintomi simili al morbo di Parkinson umano.6
Ma la connessione tra infezione virale e malattia del cervello è stata fortemente contestata. E quando i ricercatori dell’Armed Forces Institute of Pathology di Washington, DC, hanno usato la PCR per cercare frammenti del genoma H1N1 nel tessuto cerebrale conservato delle vittime di encefalite letargica nei primi anni 2000, non hanno trovato alcun segno del virus.7
Questo era lo stato della ricerca quando Smeyne ha scoperto il grave danno cerebrale simile al Parkinson nelle anatre infettate dal virus H5N1. Nessuno aveva testato direttamente la capacità del virus di causare il morbo di Parkinson fino a quando ha infettato i topi con H5N1 e documentato gravi danni alla substantia nigra. I suoi risultati hanno anche rivelato una possibile via di diffusione del virus dal corpo al cervello. La substantia nigra, dice Smeyne, non era l’obiettivo iniziale del virus; prima ha infettato i neuroni nell’intestino. “Poi, il virus è andato nel nervo vago e fondamentalmente ha usato il nervo vago come una porta sul retro del cervello.”
Via di passaggio
Alcuni virus possono entrare nel corpo attraverso il naso e la bocca e passare al cervello replicandosi e diffondendosi attraverso i bulbi olfattivi; il nervo linguale, che corre lungo la mascella e nella lingua; o il nervo vago, che viaggia attraverso il collo e il torace fino allo stomaco.

Il modello è sorprendentemente simile a come la malattia di Parkinson sembra farsi strada attraverso il corpo umano, dice Smeyne. Secondo un’ipotesi ampiamente accettata proposta per la prima volta dal neuropatologo tedesco Heiko Braak nel 2003, la malattia di Parkinson inizia nell’intestino, manifestandosi come problemi digestivi, e poi si sposta nel cervello. “La progressione della malattia dall’intestino al prosencefalo avviene forse nell’arco di 25 o 30 anni in un uomo”, dice Smeyne. Ma i topi vivono una vita molto più breve. Nei roditori, il virus dell’influenza può percorrere lo stesso percorso e creare segni di Parkinson in poche settimane, nota. E come Smeyne e i suoi colleghi hanno scoperto con i topi infettati dall’H1N1, i virus incapaci di arrivare al cervello possono ancora giocare un ruolo nella neurodegenerazione, innescando una grave infiammazione.
Alcune ricerche non hanno trovato un legame tra l’infezione virale e i danni al cervello, tuttavia. Per esempio, quando i ricercatori del Centers for Disease Control and Prevention degli Stati Uniti ad Atlanta, Georgia, hanno studiato gli effetti del ceppo influenzale che ha causato l’epidemia di influenza spagnola del 1918, non hanno visto alcun segno di infiammazione nel cervello dei topi infetti.8 “È necessario altro lavoro per cercare un legame tra l’infezione virale e le malattie neurodegenerative”, dice il microbiologo Terrence Tumpey, coautore di quello studio.
Smeyne sospetta che il legame tra virus e malattie incentrate sul cervello potrebbe essere più sottile. Per esplorare ulteriormente la relazione tra H1N1 e Parkinson, lui e i suoi colleghi hanno dato una tossina chiamata MPTP ai topi che avevano recuperato dall’infezione con il virus. La sostanza chimica era un sottoprodotto di una cattiva partita di eroina sintetica cucinata negli anni ’70 che ha portato i consumatori a sviluppare il morbo di Parkinson. I topi trattati con MPTP che erano stati infettati con H1N1 hanno sviluppato i segni della malattia e hanno perso il 25 per cento più neuroni nella substantia nigra rispetto ai topi non infetti trattati con la tossina o topi infettati con il virus ma non esposti a MPTP.9
“Questo ci ha suggerito”, dice Smeyne, “che mentre l’infezione H1N1 da sola non ha causato il Parkinson, ha innescato il sistema nervoso per essere sensibile ad altre cose che lo farebbero.”
Un collegamento più ampio tra virus e neurodegenerazione
La connessione influenza-Parkinson non è l’unico collegamento che i ricercatori hanno fatto tra virus e problemi neurologici. Alla fine degli anni ’80 e all’inizio degli anni ’90, i ricercatori hanno scoperto che i topi infettati da virus come il morbillo e l’herpes hanno subito lo stesso tipo di danno ai loro oligodendrociti – le cellule del sistema nervoso centrale che producono mielina, la guaina grassa isolante avvolta intorno agli assoni dei neuroni – come fanno i pazienti con SM. Non è chiaro se i virus hanno invaso gli oligodendrociti direttamente, o semplicemente provocato il sistema immunitario dei topi per attaccare le cellule, ma il risultato finale è stato demielinizzazione dei neuroni, van den Pol dice, proprio come quello che si vede nei pazienti con SM.

Uno dei ceppi di virus che ha indotto i sintomi della SM nei topi era l’herpesvirus 6, che è stato anche associato allo sviluppo del morbo di Alzheimer. collegamenti timidi tra infezioni virali e Alzheimer sono stati documentati negli ultimi decenni, ma la possibilità riemerse l’anno scorso quando Joel Dudley della Icahn School of Medicine al Monte Sinai e colleghi, rivedendo i dati da banche del cervello e studi pubblicati, ha trovato che i pazienti con malattia di Alzheimer avevano elevati livelli di virus, come herpesvirus umano 6 e herpesvirus umano 7, in quattro regioni chiave del cervello. Sulla base di dati genetici e proteomici, i ricercatori hanno anche scoperto che l’herpesvirus umano 6 può indurre l’espressione genica che stimola lo sviluppo della proteina amiloide β, che forma placche che sono segni distintivi della malattia di Alzheimer.4
Vedi “Do Microbes Trigger Alzheimer’s Disease?”
Tale correlazione non dimostra che i virus causano la malattia, ma suggerisce che gli agenti patogeni possono avere un ruolo nelle malattie neurodegenerative dopo tutto, dice Dudley. “Una cosa che è diversa oggi rispetto alle precedenti riflessioni sull’ipotesi del patogeno è che abbiamo metodi di sequenziamento molto più potenti che possono dare uno sguardo più imparziale al paesaggio DNA/RNA microbico del tessuto cerebrale”, dice. “È probabile che riusciremo a dare uno sguardo ancora migliore a questa domanda quando applicheremo la tecnologia di sequenziamento a lettura lunga e la tecnologia di sequenziamento a singola cellula ai campioni di tessuto cerebrale”.
HIV è un altro virus che i ricercatori sospettano possa causare danni cerebrali simili all’Alzheimer o al Parkinson. Negli anni ’90, gli scienziati hanno dimostrato che l’HIV potrebbe attraversare la barriera emato-encefalica, e studi successivi hanno rivelato che quando il virus si infiltra nel cervello, stimola la morte neuronale e la perdita di connessioni sinaptiche.10 Più di recente, i medici hanno iniziato a riferire di pazienti con HIV che sviluppano demenza e una perdita di materia cerebrale che rispecchia ciò che si vede nei pazienti di Alzheimer, spiega Sara Salinas, patologa e virologa dell’Università di Montpellier in Francia, e colleghi in un articolo di revisione del 2018 su Frontiers in Cellular Neuroscience.11 Studi più recenti mostrano che i pazienti con HIV sviluppano placche di amiloide β. E, dice Smeyne, i pazienti con HIV possono anche sviluppare lentezza nei movimenti e tremori.
Crossing blood-brain barrier
Quando interagiscono con il sistema nervoso, le particelle virali possono attraversare la barriera emato-encefalica direttamente o attraverso l’infezione delle cellule endoteliali (sotto, a sinistra), o possono usare un approccio da cavallo di Troia (centro), infettando i monociti che attraversano la barriera prima di replicarsi e scoppiare dai globuli bianchi una volta all’interno del cervello. In alternativa, alcuni virus non attraversano la barriera emato-encefalica ma invocano una risposta immunitaria che può spingere le citochine o le chemochine a rompere la barriera (destra).

Uno sguardo più attento alle modalità di comunicazione neuronale può dare alcuni indizi sullo sviluppo delle malattie neurodegenerative. All’inizio di quest’anno, due gruppi di scienziati hanno riferito che, oltre a usare segnali elettrici e chimici per parlare tra loro, i neuroni impiegano vescicole extracellulari che trasportano RNA messaggero.12,13 La struttura di queste vescicole ricorda il modo in cui l’HIV e altri retrovirus costruiscono gusci protettivi chiamati capside che trasportano il materiale genetico del virus da cellula a cellula, dice Jason Shepherd, un neuroscienziato dell’Università dello Utah e coautore di uno degli studi. I geni che codificano le vescicole potrebbero essere residui di infezioni passate, suggerisce, e questi capidi che imitano i virus potrebbero ospitare proteine tossiche, come l’amiloide β, e diffonderle nel cervello.
“Chiaramente, i virus influenzano il cervello”, dice Shepherd, ma la natura di questa relazione rimane poco chiara.
Danni al cervello
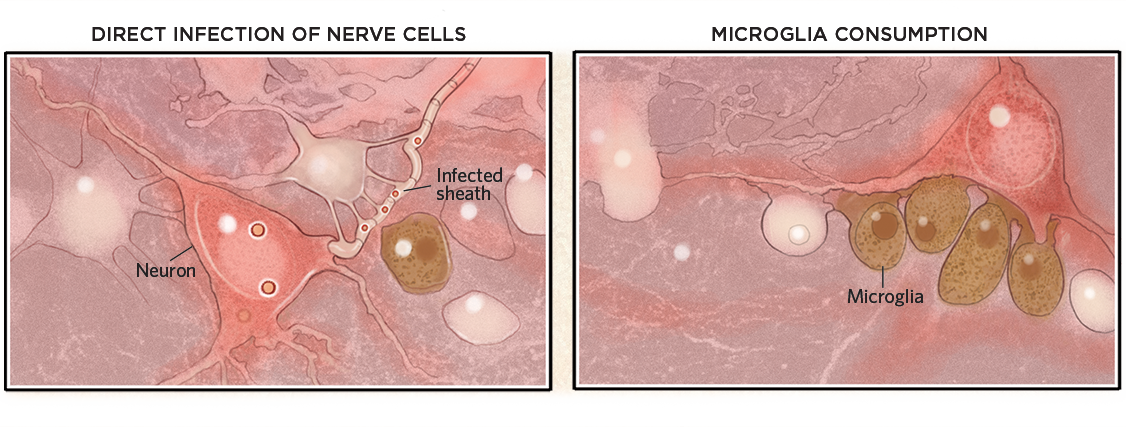
Una volta dentro il cervello, i virus possono infettare le cellule o le loro guaine mieliniche e ucciderle (sotto, a sinistra). I virus non devono necessariamente entrare nel cervello per causare danni, però. Possono anche innescare una risposta immunitaria che attiva la microglia, che poi consuma neuroni altrimenti sani (a destra).
L’oblio permane
Una sfida nella comprensione di come il cervello risponde alle infezioni virali è che gli effetti possono persistere a lungo dopo che il nostro sistema immunitario ha eliminato l’infezione dal nostro corpo. All’inizio di quest’anno, per esempio, Martin Korte della Technische Universität Braunschweig in Germania e colleghi hanno riferito che il cervello dei topi infettati con alcuni ceppi del virus dell’influenza ha subito deficit di memoria anche dopo che avevano apparentemente recuperato. Si è scoperto che i loro cervelli erano pieni di microglia anche da 30 a 60 giorni dopo che l’infezione aveva preso piede.14 I livelli di microglia possono iniziare a tornare alla normalità intorno ai 60 giorni dopo l’infezione, con i neuroni nei giovani topi che si riprendono completamente, insieme alle prestazioni di memoria degli animali. Tuttavia, il numero di microglia può rimanere elevato fino a 120 giorni, dice Korte a The Scientist; che è equivalente a più di 10 anni nel tempo umano.
Van den Pol dice che un tale ritardo è esattamente il motivo per cui gli scienziati hanno difficoltà ad accettare che i virus possano causare malattie neurodegenerative. “Nella scienza spesso pensiamo che causa ed effetto siano spesso millisecondi”, dice. “Qui si parla di decenni. Il virus entra e poi forse decenni più tardi può causare qualche neurodegenerazione potenzialmente grave”- un tale legame a lungo termine è difficile da dimostrare.
Nella scienza spesso pensiamo di qualche causa ed effetto essendo spesso millisecondi. Qui, stai parlando di decenni.
-Anthony van den Pol,
Yale University
Se il collegamento tra infezioni virali e problemi neurologici può essere più concretamente stabilito, i ricercatori possono essere in grado di sviluppare modi per mitigare gli effetti neurologici, van den Pol dice. Capire come le infezioni innescano il sistema immunitario, per esempio, potrebbe portare a modi per downregolare l’infiammazione guidata dalla glia nella speranza di prevenire danni a lungo termine, suggerisce.
Nel frattempo, Smeyne nota che la vaccinazione per l’influenza – o per lo meno, prendendo Tamiflu se una persona viene infettata – potrebbe aiutare a prevenire le complicazioni neurologiche di infezione influenzale. Lui e i suoi colleghi hanno testato questo approccio nei topi dopo che i loro risultati hanno rivelato il legame tra l’influenza, la tossina MPTP e la malattia di Parkinson. Il team ha dato a un gruppo di topi un vaccino H1N1 30 giorni prima di infettare gli animali con il virus. Un altro gruppo di topi è stato trattato con Tamiflu per la settimana dopo l’infezione. Entrambi i gruppi di topi sono stati autorizzati a recuperare prima di ricevere una bassa dose di MPTP. Mentre i topi di controllo che non hanno ricevuto né il vaccino né il trattamento dell’influenza hanno sviluppato sintomi simili al Parkinson, i topi trattati non hanno sviluppato effetti neurodegenerativi. “Avevamo protetto dal solo trattamento precoce o profilattico con il vaccino”, dice Smeyne.
È un’ulteriore prova a sostegno dell’idea che le infezioni virali possono danneggiare il cervello, dice Smeyne, ma non c’è ancora uno studio schiacciante che dimostri che un virus può causare il Parkinson, o l’Alzheimer, o qualsiasi numero di altri disturbi neurologici. “Mi piace l’idea che i virus possano causare un sacco di diverse malattie del cervello come ipotesi”, dice van den Pol. “Ma rispetto anche il fatto che sia davvero un’ipotesi”.
- H. Jang et al., “Il virus dell’influenza H5N1 altamente patogeno può entrare nel sistema nervoso centrale e indurre neuroinfiammazione e neurodegenerazione”, PNAS, 106:14063-68, 2009.
- S. Sadasivan et al., “Induzione dell’attivazione della microglia dopo l’infezione con il virus influenzale non-neurotropico A/CA/04/2009 H1N1,” PLOS ONE, 10:e0124047, 2015.
- U.G. Liebert, V. ter Meulen. “Virological aspects of measles virus-induced encephalomyelitis in Lewis and BN rats,” J Gen Virol, 68:1715-22, 1987.
- B. Readhead et al., “Multiscale analysis of independent Alzheimer’s cohorts finds disruption of molecular, genetic, and clinical networks by human herpesvirus,” Neuron, 99:64-82.e7, 2018.
- E.T. Gamboa et al., “Influenza virus antigen in postencephalitic parkinsonism brain. Detection by immunofluorescence,” Arch Neurol, 31:228-32, 1974.
- A. Ogata et al., “Un modello di ratto del morbo di Parkinson indotto dal virus dell’encefalite giapponese”, J Neurovirol, 3:141-47, 1997.
- S. McCall et al., “RNA dell’influenza non rilevato in tessuti cerebrali d’archivio da casi di encefalite letargica acuta o in casi di Parkinson postencefalitici”, J Neuropathol Exp Neurol, 60:696-704, 2001.
- J.C. Kash et al., “Analisi genomica dell’aumento delle risposte immunitarie e di morte cellulare dell’ospite indotte dal virus dell’influenza del 1918”, Nature, 443:578-81, 2006.
- S. Sadasivan et al., “Gli effetti sinergici dell’influenza e della 1-metil-4-fenil-1,2,3,6-tetraidropiridina (MPTP) possono essere eliminati dall’uso di terapie influenzali: Prove sperimentali per l’ipotesi multi-hit”, NPJ Parkinsons Dis, 3:18, 2017.
- S. Peudenier et al., “Recettori HIV all’interno del cervello: uno studio di CD4 e MHC-II su neuroni umani, astrociti e cellule microgliali,” Res Virol, 142:145-49, 1991.
- G. Canet et al., “HIV neuroinfezione e malattia di Alzheimer: Somiglianze e potenziali legami?” Front Cell Neurosci, 12:307, 2018.
- E.D. Pastuzyn et al., “The neuronal gene Arc encodes a repurposed retrotransposon gag protein that mediates intercellular RNA transfer,” Cell, 172:P275-88.E18, 2018.
- J. Ashley et al., “Retrovirus-like gag protein Arc1 binds RNA and traffics across synaptic boutons,” Cell, 172:P262-74.E11, 2018.
- S. Hosseini et al., “La neuroinfiammazione a lungo termine indotta dall’infezione da virus dell’influenza A e l’impatto sulla morfologia e la funzione dei neuroni ippocampali”, J Neurosci, 38:3060-80, 2018.
Leave a Reply