Menu
ABOVE: © ISTOCK.COM, bodym
Toen neurobioloog Richard Smeyne iets meer dan tien jaar geleden in het St. Jude Children’s Research Hospital in Memphis werkte, zag hij een video van een eend die zich vreemd gedroeg. De witgevederde vogel met oranje snavel stond een beetje apart van zijn kudde op een boerderij in Laos. Hij liep rondjes en sloeg een vleugel op, verloor toen zijn evenwicht en viel om. Het stond op, probeerde met beide vleugels te flapperen, en viel weer om.
Smeyne zag de video terwijl hij een seminar bijwoonde dat werd gegeven door de toenmalige postdoc David Boltz en Boltz’ adviseur, een “griepjager” genaamd Robert Webster, die aan het hoofd stond van het grieponderzoeksprogramma in het ziekenhuis. De eend, legden Boltz en Webster uit, was besmet met het H5N1 vogelgriepvirus dat duizenden vogels ziek had gemaakt en honderden mensen had gedood in 2006 en 2007. Smeyne, die de neurobiologie van de ziekte van Parkinson bij muizen had bestudeerd, herkende de motorische problemen van het dier. Die eend heeft Parkinson, dacht hij.
Hij vertelde dit na het seminar aan Webster, en Webster lachte, herinnert Smeyne zich. “Hij zei: ‘Nou, het is een zieke vogel.'” Maar Smeyne was nieuwsgierig naar de neurale mechanismen die ten grondslag liggen aan het abnormale gedrag van de eend. Hij vroeg zich af of gezonde eenden, besmet met H5N1 in het lab, Parkinson-achtige neurodegeneratie zouden vertonen. In het biosafety level 3-lab van St. Jude infecteerden hij en zijn collega’s eenden met het virus, waarna de vogels werden opgeofferd en hun hersenen werden verwijderd, waarna ze drie weken in formaldehyde werden bewaard om het actieve virus te doden.
Toen Smeyne de eenmaal geïnfecteerde eendenhersenen begon te ontleden, richtte hij zich op een gebied genaamd de substantia nigra, dat vaak beschadigd is bij Parkinson-patiënten. “Toen ik de hersenen openmaakte, was de substantia nigra verwoest. Alle neuronen waren volledig verdwenen,” zegt Smeyne. Hij ging terug naar Webster, herinnert hij zich, en zei: “Ik had het niet mis. Uw eend heeft wel degelijk de ziekte van Parkinson.”
Ze veroorzaakten ontsteking en dood in de delen van de hersenen die we bij de ziekte van Parkinson zien degenereren.
-Richard Smeyne,
Thomas Jefferson University
Omdat de vogel griep had gehad, vroeg Smeyne zich af of er een verband was tussen de virale infectie en de uitgebreide neurodegeneratie die hij waarnam. Hij vroeg Webster naar de symptomen van mensen die besmet waren met H5N1. Websters antwoord – ontsteking van de hersenen die leidt tot tremoren en andere motorische stoornissen – klonk niet als een “volwaardige ziekte van Parkinson”, aldus Smeyne, “maar het was wel parkinsonisme”, een subset van symptomen van de ziekte.
In de literatuur vond Smeyne meer aanwijzingen voor het vermogen van influenza om de hersenen te beschadigen. Een van de eerste verbanden tussen influenza en neurale disfunctie was een verband tussen de Spaanse griep van 1918, veroorzaakt door een subtype dat H1N1 werd genoemd, en een epidemie van Parkinson enkele decennia later. In de jaren ’40 en begin jaren ’50 leek de diagnose van de neurodegeneratieve ziekte abrupt toe te nemen, van 1-2 procent van de Amerikaanse bevolking tot 2,5-3 procent, om vervolgens weer te dalen tot 1-2 procent, aldus Smeyne. “In feite kregen 50 procent meer mensen in die jaren Parkinson.”
Het bewijs om te suggereren dat influenza-infectie de neurodegeneratieve aandoening veroorzaakte, was op zijn zachtst gezegd zwak, maar de correlatie was voor Smeyne genoeg om verder te onderzoeken. Samen met zijn collega’s schoot hij niet-dodelijke doses H5N1 of H1N1 in de neuzen van muizen van zes tot acht weken oud, en volgde vervolgens hoe de virussen zich door het zenuwstelsel van de dieren verspreidden. De resultaten waren verbluffend, zegt hij: sommige virussen werden er niet van weerhouden de hersenen binnen te dringen door de bloed-hersenbarrière – een semipermeabele laag cellen die het centrale zenuwstelsel scheidt van de bloedsomloop van het lichaam. H5N1, bijvoorbeeld, kon gemakkelijk infiltreren in zenuwcellen in de hersenen en ze doden, en het bleek vooral de dopamine-producerende neuronen in de substantia nigra aan te vallen.1 En hoewel de H1N1-griepstam de bloed-hersenbarrière niet kon passeren, zorgde het er toch voor dat immuuncellen van het centrale zenuwstelsel, microglia genaamd, naar de substantia nigra en de hippocampus stroomden, wat ontsteking en celdood in het gebied veroorzaakte.2
“Dus dit waren twee verschillende flus, twee verschillende mechanismen, maar in zekere zin hetzelfde effect,” zegt Smeyne, die in 2016 naar de Thomas Jefferson University in Philadelphia verhuisde. “Ze veroorzaakten ontsteking en dood in de delen van de hersenen die we zien degenereren bij de ziekte van Parkinson.”
Smeyne’s experimenten zijn niet de enigen die suggereren dat virale infecties kunnen bijdragen aan neurodegeneratieve aandoeningen, en het verband is niet beperkt tot influenza. Verschillende virussen, waaronder mazelen en herpes, kunnen bijvoorbeeld symptomen van multiple sclerose (MS) veroorzaken bij knaagdieren.3 En niveaus van herpesvirus zijn hoger in de hersenen van mensen die aan Alzheimer zijn overleden dan in die zonder de ziekte,4 terwijl sommige HIV-patiënten dementie ontwikkelen die in verband lijkt te staan met de infectie.
“Virussen worden vaak genegeerd in relatie tot neurodegeneratieve ziekten,” vertelt Yale University neurobioloog Anthony van den Pol aan The Scientist. “Dat komt deels omdat er geen duidelijk teken is dat een virus een neurodegeneratieve ziekte veroorzaakt. Maar het zou kunnen.”
Invasie in de hersenen
Al in 1385 registreerden artsen in Europa verbanden tussen griepinfectie en psychose. Dat verband tussen griep en de hersenen werd veel duidelijker tijdens en na de Spaanse griepepidemie van 1918. Meer direct bewijs voor het verband tussen het virus en de hersenen kwam er in de jaren 1970, toen onderzoekers onder leiding van Eugenia Gamboa, toen een neuroloog aan de Columbia University, en collega’s virusantigenen vonden in de hersenen van overleden mensen die waren getroffen door een aandoening die bekend staat als encefalitis lethargica.5 Met symptomen als koorts, hoofdpijn en dubbel zicht werd encefalitis lethargica in verband gebracht met – en sommigen dachten dat het veroorzaakt was door – de Spaanse griep van 1918, en onderzoekers speculeerden dat de aandoening een voorloper zou kunnen zijn van de symptomen van Parkinson. Vervolgens, in 1997, meldde een team van wetenschappers dat ratten die waren blootgesteld aan het Japanse encefalitisvirus een ziekte ontwikkelden met symptomen die leken op de ziekte van Parkinson bij de mens.6
Maar het verband tussen virale infectie en hersenaandoeningen is fel betwist. En toen onderzoekers van het Armed Forces Institute of Pathology in Washington, DC, PCR gebruikten om te zoeken naar fragmenten van het H1N1-genoom in het geconserveerde hersenweefsel van slachtoffers van encefalitis lethargica in de vroege jaren 2000, vonden ze geen tekenen van het virus.7
Dat was de stand van het onderzoek toen Smeyne de ernstige Parkinson-achtige hersenbeschadiging bij de met H5N1 besmette eenden ontdekte. Niemand had rechtstreeks getest of het virus de ziekte van Parkinson kon veroorzaken totdat hij muizen met H5N1 infecteerde en ernstige schade aan de substantia nigra documenteerde. Zijn resultaten onthulden ook een mogelijke route voor het virus om zich van het lichaam naar de hersenen te verspreiden. De substantia nigra, zegt Smeyne, was niet het eerste doelwit van het virus; het infecteerde eerst neuronen in de darm. “Daarna ging het virus naar de nervus vagus en gebruikte de nervus vagus als een achterdeur naar de hersenen.”
Routes van doorgang
Sommige virussen kunnen het lichaam binnendringen via de neus en mond en naar de hersenen gaan door zich te vermenigvuldigen en te verspreiden via de reukbollen; de tongzenuw, die langs de kaaklijn en in de tong loopt; of de nervus vagus, die via de nek en borstkas naar de maag gaat.

Het patroon lijkt opvallend veel op de manier waarop de ziekte van Parkinson zich door het menselijk lichaam lijkt te werken, aldus Smeyne. Volgens een algemeen aanvaarde hypothese, die in 2003 voor het eerst werd voorgesteld door de Duitse neuropatholoog Heiko Braak, begint de ziekte van Parkinson in de darm, manifesteert zich als spijsverteringsproblemen, en verplaatst zich dan naar de hersenen. “De progressie van de ziekte van de darm naar de voorhersenen, dat duurt bij een mens misschien 25 of 30 jaar,” zegt Smeyne. Maar muizen leven veel korter. Bij de knaagdieren kan het griepvirus hetzelfde traject afleggen en binnen een paar weken tekenen van Parkinson veroorzaken, merkt hij op. En zoals Smeyne en zijn collega’s ontdekten met H1N1-geïnfecteerde muizen, kunnen virussen die niet in de hersenen kunnen doordringen toch een rol spelen bij neurodegeneratie, door ernstige ontstekingen te veroorzaken.
Sommig onderzoek heeft echter geen verband gevonden tussen virale infectie en schade aan de hersenen. Toen onderzoekers van de Amerikaanse Centers for Disease Control and Prevention in Atlanta, Georgia, bijvoorbeeld de effecten bestudeerden van de griepstam die de Spaanse griepepidemie van 1918 veroorzaakte, zagen zij geen tekenen van ontsteking in de hersenen van besmette muizen.8 “Er is meer werk nodig om te zoeken naar een verband tussen virale infectie en neurodegeneratieve ziekten,” zegt microbioloog Terrence Tumpey, die medeauteur was van die studie.
Smeyne vermoedt dat het verband tussen virussen en hersenaandoeningen subtieler zou kunnen zijn. Om het verband tussen H1N1 en Parkinson verder te onderzoeken, gaven hij en zijn collega’s een toxine genaamd MPTP aan muizen die waren hersteld van infectie met het virus. De chemische stof was een bijproduct van een slechte partij synthetische heroïne die in de jaren 1970 werd gekookt en waardoor gebruikers de ziekte van Parkinson ontwikkelden. De met MPTP behandelde muizen die waren geïnfecteerd met H1N1 ontwikkelden tekenen van de ziekte en verloren 25 procent meer neuronen in de substantia nigra dan niet-geïnfecteerde muizen die werden behandeld met het toxine of muizen die waren geïnfecteerd met het virus maar niet waren blootgesteld aan MPTP.9
“Dat suggereerde ons,” zegt Smeyne, “dat hoewel de H1N1-infectie op zichzelf geen Parkinson veroorzaakte, het het zenuwstelsel primeerde om gevoelig te zijn voor andere dingen die dat wel zouden doen.”
Een breder verband tussen virussen en neurodegeneratie
De griep-Parkinson-verbinding is niet het enige verband dat onderzoekers hebben gelegd tussen virussen en neurologische problemen. Eind jaren tachtig en begin jaren negentig ontdekten onderzoekers dat muizen die waren geïnfecteerd met virussen zoals mazelen en herpes, dezelfde soort schade opliepen aan hun oligodendrocyten-cellen in het centrale zenuwstelsel die myeline produceren, de isolerende vettige schede die rond de axonen van neuronen is gewikkeld-als patiënten met MS doen. Het is niet duidelijk of de virussen de oligodendrocyten rechtstreeks zijn binnengedrongen, of dat ze gewoon het immuunsysteem van de muizen hebben uitgelokt om de cellen aan te vallen, maar het eindresultaat was volgens Van den Pol demyelinisatie van de neuronen, net zoals bij MS-patiënten.

Een van de virusstammen die MS-symptomen in muizen veroorzaakte, was herpesvirus 6, dat ook in verband is gebracht met de ontwikkeling van de ziekte van Alzheimer. In de afgelopen decennia zijn voorzichtige verbanden tussen virale infecties en de ziekte van Alzheimer gedocumenteerd, maar de mogelijkheid dook vorig jaar weer op toen Joel Dudley van de Icahn School of Medicine van Mount Sinai en collega’s, die gegevens van hersenbanken en gepubliceerde studies bekeken, ontdekten dat patiënten met de ziekte van Alzheimer verhoogde niveaus van virussen hadden, zoals het humaan herpesvirus 6 en humaan herpesvirus 7, in vier belangrijke hersengebieden. Op basis van genetische en proteomische gegevens ontdekten de onderzoekers ook dat humaan herpesvirus 6 genexpressie kan induceren die de ontwikkeling stimuleert van het eiwit amyloïde β, dat plaques vormt die kenmerkend zijn voor de ziekte van Alzheimer.4
Zie “Do Microbes Trigger Alzheimer’s Disease?”
Zo’n correlatie bewijst niet dat virussen de ziekte veroorzaken, maar het suggereert wel dat ziekteverwekkers toch een rol kunnen spelen bij neurodegeneratieve ziekten, zegt Dudley. “Eén ding dat vandaag anders is dan eerdere overpeinzingen over de pathogeen-hypothese is dat we veel krachtiger sequentiemethodes hebben die een meer onbevooroordeelde blik kunnen werpen op het microbiële DNA/RNA-landschap van hersenweefsel,” zegt hij. “We zullen waarschijnlijk een nog betere kijk op deze vraag krijgen als we long-read sequencing-technologie en single-cell sequencing-technologie toepassen op hersenweefselmonsters.”
HIV is een ander virus waarvan onderzoekers vermoeden dat het Alzheimer-achtige of Parkinson-achtige hersenschade kan veroorzaken. In de jaren negentig toonden wetenschappers aan dat hiv de bloed-hersenbarrière kon passeren, en latere studies toonden aan dat wanneer het virus de hersenen infiltreert, het neuronale sterfte en een verlies van synaptische verbindingen stimuleert.10 Meer recentelijk zijn artsen begonnen met het rapporteren over patiënten met hiv die dementie ontwikkelen en een verlies van hersenmaterie die weerspiegelt wat wordt gezien bij Alzheimer-patiënten, Sara Salinas, een patholoog en viroloog aan de Universiteit van Montpellier in Frankrijk, en collega’s leggen uit in een overzichtsartikel in 2018 in Frontiers in Cellular Neuroscience.11 Recentere studies tonen aan dat HIV-patiënten plaques van amyloïde β ontwikkelen. En, zegt Smeyne, HIV-patiënten kunnen ook traagheid in beweging en tremoren ontwikkelen.
Doorkruisen bloed-hersenbarrière
Bij interactie met het zenuwstelsel kunnen virale deeltjes de bloed-hersenbarrière direct of via infectie van endotheelcellen (linksonder) doorkruisen, of ze kunnen een Trojaans paard-benadering gebruiken (midden), waarbij monocyten worden geïnfecteerd die de barrière passeren voordat ze repliceren en uit de witte bloedcellen barsten zodra ze zich in de hersenen bevinden. Een andere mogelijkheid is dat sommige virussen de bloed-hersenbarrière niet passeren, maar een immuunrespons oproepen die cytokinen of chemokinen kan aanwakkeren om de barrière te doorbreken (rechts).

Een nadere beschouwing van de wijze waarop neuronen met elkaar communiceren, kan een aantal aanwijzingen geven over de ontwikkeling van neurodegeneratieve ziekten. Eerder dit jaar meldden twee groepen wetenschappers dat neuronen, naast het gebruik van elektrische en chemische signalen om met elkaar te praten, gebruik maken van extracellulaire blaasjes met boodschapper-RNA’s.12,13 De structuur van deze blaasjes doet denken aan de manier waarop HIV en andere retrovirussen beschermende omhulsels bouwen die capsiden worden genoemd en die het genetisch materiaal van het virus van cel naar cel vervoeren, zegt Jason Shepherd, een neurowetenschapper aan de Universiteit van Utah en medeauteur van een van de studies. De genen die coderen voor de blaasjes zouden mogelijk overblijfselen kunnen zijn van infecties uit het verleden, suggereert hij, en deze virus-imiterende capsiden zouden toxische eiwitten, zoals amyloïde β, kunnen herbergen en deze door de hersenen kunnen verspreiden.
“Het is duidelijk dat virussen de hersenen beïnvloeden,” zegt Shepherd, maar de aard van die relatie blijft onduidelijk.
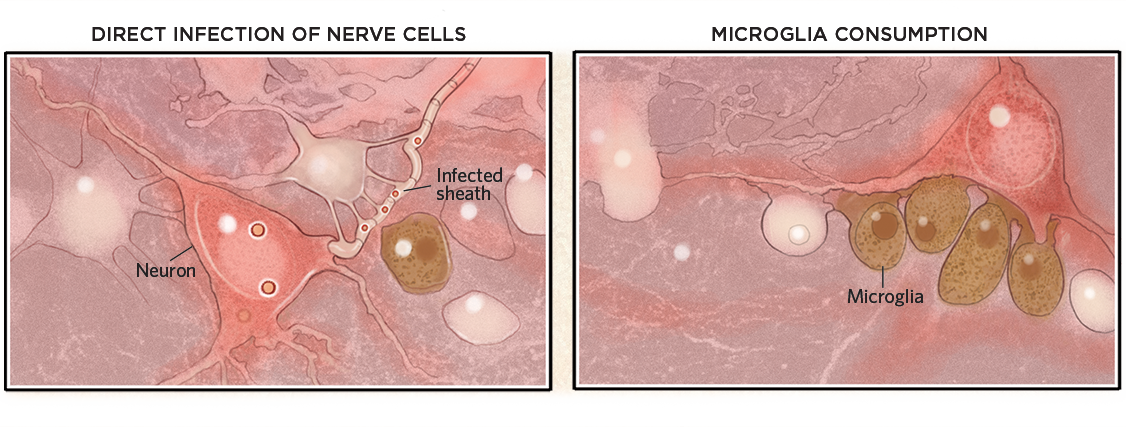
Hersenschade
Eenmaal in de hersenen, kunnen virussen cellen of hun myelinescheden infecteren en ze doden (linksonder). Virussen hoeven echter niet per se de hersenen binnen te dringen om schade te veroorzaken. Ze kunnen ook een immuunrespons uitlokken die microglia activeert, die vervolgens gezonde neuronen consumeren (rechts).
Vergetelheid blijft
Een van de uitdagingen bij het begrijpen van de manier waarop de hersenen reageren op een virusinfectie, is dat de effecten kunnen blijven hangen lang nadat ons immuunsysteem de infectie uit ons lichaam heeft verwijderd. Eerder dit jaar, bijvoorbeeld, meldden Martin Korte van de Technische Universität Braunschweig in Duitsland en collega’s dat de hersenen van muizen die waren geïnfecteerd met bepaalde stammen van het griepvirus geheugenstoornissen vertoonden, zelfs nadat ze schijnbaar waren hersteld. Het bleek dat hun hersenen vol microglia zaten, zelfs 30 tot 60 dagen nadat de infectie voor het eerst had plaatsgevonden.14 De microglia-niveaus kunnen rond 60 dagen na de infectie beginnen terug te keren naar het normale bereik, waarbij de neuronen in de jonge muizen zich volledig herstellen, samen met de geheugenprestaties van de dieren. Toch kunnen de aantallen microglia tot 120 dagen verhoogd blijven, vertelt Korte aan The Scientist; dat komt overeen met meer dan 10 jaar in menselijke tijd.
Van den Pol zegt dat zo’n vertraging precies de reden is waarom wetenschappers moeite hebben om te accepteren dat virussen neurodegeneratieve ziekten kunnen veroorzaken. “In de wetenschap denken we vaak dat oorzaak en gevolg vaak milliseconden zijn,” zegt hij. “Hier heb je het over tientallen jaren. Het virus gaat naar binnen en dan misschien tientallen jaren later kan het een potentieel ernstige neurodegeneratie veroorzaken”- zo’n lange termijn verband is moeilijk aan te tonen.
In de wetenschap denken we vaak dat een oorzaak en gevolg vaak milliseconden zijn. Hier heb je het over tientallen jaren.
-Anthony van den Pol,
Yale University
Als het verband tussen virale infecties en neurologische problemen concreter kan worden vastgesteld, kunnen onderzoekers misschien manieren ontwikkelen om de neurologische effecten te verzachten, aldus Van den Pol. Inzicht in de manier waarop infecties het immuunsysteem activeren, zou bijvoorbeeld kunnen leiden tot manieren om glia-gedreven ontsteking te remmen in de hoop langdurige schade te voorkomen, suggereert hij.
In de tussentijd merkt Smeyne op dat vaccinatie tegen de griep – of op zijn minst het nemen van Tamiflu als een persoon geïnfecteerd raakt – neurologische complicaties van een griepinfectie zou kunnen helpen voorkomen. Hij en zijn collega’s hebben deze aanpak getest bij muizen nadat hun resultaten het verband hadden aangetoond tussen griep, het MPTP-toxine en de ziekte van Parkinson. Het team gaf een groep muizen een H1N1-vaccin 30 dagen voordat de dieren met het virus werden geïnfecteerd. Een andere groep muizen werd behandeld met Tamiflu gedurende de week nadat ze waren besmet. Beide groepen muizen mochten herstellen voordat ze een lage dosis MPTP toegediend kregen. Terwijl de controlemuizen die noch het vaccin noch de griepbehandeling kregen Parkinson-achtige symptomen ontwikkelden, ontwikkelden de behandelde muizen geen neurodegeneratieve effecten. “We hadden beschermd tegen alleen door vroege behandeling of profylactische behandeling met het vaccin,” zegt Smeyne.
Het is verder bewijs om het idee te ondersteunen dat virale infecties de hersenen kunnen beschadigen, zegt Smeyne, maar er is nog steeds geen slam-dunk studie die aantoont dat een virus Parkinson kan veroorzaken, of Alzheimer, of een aantal andere neurologische aandoeningen. “Ik vind het idee dat virussen veel verschillende hersenziekten kunnen veroorzaken een goede hypothese,” zegt Van den Pol. “Maar ik respecteer ook het feit dat het echt een hypothese is.”
- H. Jang e.a., “Hoog pathogeen H5N1 influenzavirus kan het centrale zenuwstelsel binnendringen en neuroinflammatie en neurodegeneratie induceren,” PNAS, 106:14063-68, 2009.
- S. Sadasivan et al., “Inductie van microglia-activatie na infectie met het niet-neurotropische A/CA/04/2009 H1N1 influenzavirus,” PLOS ONE, 10:e0124047, 2015.
- U.G. Liebert, V. ter Meulen. “Virological aspects of measles virus-induced encephalomyelitis in Lewis and BN rats,” J Gen Virol, 68:1715-22, 1987.
- B. Readhead e.a., “Multiscale analyse van onafhankelijke Alzheimer cohorten vindt verstoring van moleculaire, genetische en klinische netwerken door humaan herpesvirus,” Neuron, 99:64-82.e7, 2018.
- E.T. Gamboa e.a., “Influenza virus antigen in postencefalitisch parkinsonisme brein. Detection by immunofluorescence,” Arch Neurol, 31:228-32, 1974.
- A. Ogata et al., “A rat model of Parkinson’s disease induced by Japanese encephalitis virus,” J Neurovirol, 3:141-47, 1997.
- S. McCall et al., “Influenza RNA not detected in archival brain tissues from acute encephalitis lethargica cases or in postencephalitic Parkinson cases,” J Neuropathol Exp Neurol, 60:696-704, 2001.
- J.C. Kash et al., “Genomic analysis of increased host immune and cell death responses induced by 1918 influenza virus,” Nature, 443:578-81, 2006.
- S. Sadasivan et al., “Synergistische effecten van influenza en 1-methyl-4-fenyl-1,2,3,6-tetrahydropyridine (MPTP) kunnen worden geëlimineerd door het gebruik van influenza-therapeutica: Experimental evidence for the multi-hit hypothesis,” NPJ Parkinsons Dis, 3:18, 2017.
- S. Peudenier e.a., “HIV-receptoren in de hersenen: een studie van CD4 en MHC-II op menselijke neuronen, astrocyten en microgliacellen,” Res Virol, 142:145-49, 1991.
- G. Canet e.a., “HIV-neuroinfectie en de ziekte van Alzheimer: Similarities and potential links?” Front Cell Neurosci, 12:307, 2018.
- E.D. Pastuzyn et al., “The neuronal gene Arc encodes a repurposed retrotransposon gag protein that mediates intercellular RNA transfer,” Cell, 172:P275-88.E18, 2018.
- J. Ashley et al., “Retrovirus-like gag protein Arc1 binds RNA and traffics across synaptic boutons,” Cell, 172:P262-74.E11, 2018.
- S. Hosseini et al., “Long-term neuroinflammation induced by influenza A virus infection and the impact on hippocampal neuron morphology and function,” J Neurosci, 38:3060-80, 2018.
Leave a Reply