Menu
ABOVE: © ISTOCK.COM, bodym
Vor etwas mehr als 10 Jahren, als der Neurobiologe Richard Smeyne am St. Jude Children’s Research Hospital in Memphis arbeitete, sah er ein Video von einer Ente, die sich seltsam verhielt. Der weißgefiederte Vogel mit dem orangefarbenen Schnabel stand etwas abseits von seiner Herde auf einer Farm in Laos. Er drehte sich im Kreis und schlug einen Flügel hoch, verlor dann das Gleichgewicht und fiel um. Er stand auf, versuchte mit beiden Flügeln zu schlagen und fiel wieder um.
Smeyne sah das Video, als er an einem Seminar teilnahm, das der damalige Postdoktorand David Boltz und Boltz‘ Berater, ein „Grippejäger“ namens Robert Webster, der das Influenza-Forschungsprogramm des Krankenhauses leitete, gaben. Die Ente, so erklärten Boltz und Webster, war mit dem Vogelgrippevirus H5N1 infiziert, an dem 2006 und 2007 Tausende von Vögeln erkrankt und Hunderte von Menschen gestorben waren. Smeyne, der die Neurobiologie der Parkinson-Krankheit bei Mäusen untersucht hatte, erkannte die motorischen Probleme des Tieres. Diese Ente hat Parkinson, dachte er.
Er erzählte Webster dies nach dem Seminar, und Webster lachte, erinnert sich Smeyne. „Er sagte: ‚Nun, es ist ein kranker Vogel.'“ Aber Smeyne war neugierig auf die neuronalen Mechanismen, die dem abnormen Verhalten der Ente zugrunde lagen. Er fragte sich, ob gesunde Enten, die im Labor mit H5N1 infiziert wurden, eine Parkinson-ähnliche Neurodegeneration zeigen würden. Im St. Jude-Labor der Biosicherheitsstufe 3 infizierten er und seine Kollegen Enten mit dem Virus, schlachteten die Vögel, entfernten ihre Gehirne und lagerten sie drei Wochen lang in Formaldehyd, um das aktive Virus abzutöten.
Als Smeyne begann, die einmal infizierten Entengehirne zu sezieren, konzentrierte er sich auf eine Region namens Substantia nigra, die bei Parkinson-Patienten häufig geschädigt ist. „Als ich das Gehirn öffnete und aufschnitt, war die Substantia nigra völlig zerstört. Alle Neuronen waren komplett verschwunden“, sagt Smeyne. Er ging zurück zu Webster, erinnert er sich, und sagte: „Ich habe mich nicht geirrt. Ihre Ente hat Parkinson.“
Sie lösten Entzündungen und Tod in den Teilen des Gehirns aus, die bei Parkinson degenerieren.
-Richard Smeyne,
Thomas Jefferson University
Da der Vogel die Grippe gehabt hatte, fragte sich Smeyne, ob es einen Zusammenhang zwischen der Virusinfektion und der von ihm beobachteten umfassenden Neurodegeneration gab. Er fragte Webster nach den Symptomen, die bei Menschen auftreten, die mit H5N1 infiziert sind. Websters Antwort – eine Entzündung des Gehirns, die zu Zittern und anderen motorischen Fehlfunktionen führt – klang nicht wie eine „ausgewachsene Parkinson-Krankheit“, sagt Smeyne, „aber es war Parkinsonismus“, eine Untergruppe der Krankheitssymptome.
Bei einem Blick in die Literatur fand Smeyne weitere Hinweise auf die Fähigkeit der Grippe, das Gehirn zu schädigen. Eine der frühesten Verbindungen zwischen Influenza und neuronaler Dysfunktion war ein Zusammenhang zwischen der Spanischen Grippe von 1918, die durch einen Subtyp namens H1N1 verursacht wurde, und einer Epidemie von Parkinson einige Jahrzehnte später. In den 1940er und frühen 1950er Jahren schienen die Diagnosen der neurodegenerativen Krankheit abrupt anzusteigen, von 1 bis 2 Prozent der US-Bevölkerung auf 2,5 bis 3 Prozent, und fielen dann wieder auf 1 bis 2 Prozent zurück, sagt Smeyne. „Im Grunde erkrankten in diesen Jahren 50 Prozent mehr Menschen an Parkinson.“
Die Beweise dafür, dass eine Grippeinfektion die neurodegenerative Erkrankung verursacht, waren gelinde gesagt dürftig, aber der Zusammenhang war für Smeyne ausreichend, um weiter zu forschen. Zusammen mit seinen Kollegen schoss er sechs bis acht Wochen alten Mäusen nicht-tödliche Dosen von H5N1 oder H1N1 in die Nase und verfolgte dann, wie sich die Viren im Nervensystem der Tiere ausbreiteten. Die Ergebnisse waren verblüffend: Einige Viren wurden nicht durch die Blut-Hirn-Schranke – eine halbdurchlässige Zellschicht, die das zentrale Nervensystem vom Körperkreislauf trennt – am Eindringen in das Gehirn gehindert. H5N1 zum Beispiel konnte leicht in Nervenzellen im Gehirn eindringen und sie abtöten, und es schien besonders auf die Dopamin-produzierenden Neuronen in der Substantia nigra abzuzielen.1 Und obwohl der H1N1-Grippestamm die Blut-Hirn-Schranke nicht überwinden konnte, verursachte er dennoch, dass Immunzellen des Zentralnervensystems, die so genannten Mikroglia, in die Substantia nigra und den Hippocampus strömten, was zu Entzündungen und Zelltod in diesem Bereich führte.2
„Es handelte sich also um zwei verschiedene Erreger, zwei verschiedene Mechanismen, aber in gewisser Weise um dieselbe Wirkung“, sagt Smeyne, der 2016 an die Thomas Jefferson University in Philadelphia wechselte. „
Smeynes Experimente sind nicht die einzigen, die darauf hindeuten, dass Virusinfektionen zu neurodegenerativen Störungen beitragen können, und die Verbindung ist nicht auf die Grippe beschränkt. Mehrere verschiedene Viren, darunter Masern und Herpes, können beispielsweise bei Nagetieren Symptome der Multiplen Sklerose (MS) hervorrufen.3 Und in den Gehirnen von Menschen, die an Alzheimer gestorben sind, ist die Konzentration von Herpesviren höher als bei Menschen ohne diese Krankheit,4 während einige HIV-Patienten eine Demenz entwickeln, die mit der Infektion in Zusammenhang zu stehen scheint.
„Viren werden im Zusammenhang mit neurodegenerativen Erkrankungen oft ignoriert“, erklärt der Neurobiologe Anthony van den Pol von der Universität Yale gegenüber The Scientist. „Das liegt zum Teil daran, dass es keine eindeutigen Anzeichen dafür gibt, dass ein Virus eine neurodegenerative Krankheit verursacht. Aber es könnte sein.“
Invasion des Gehirns
Bereits im Jahr 1385 haben Ärzte in Europa einen Zusammenhang zwischen einer Grippeinfektion und einer Psychose festgestellt. Dieser Zusammenhang zwischen der Grippe und dem Gehirn wurde während und nach der Spanischen Grippeepidemie von 1918 sehr viel deutlicher. Ein direkterer Beweis für die Verbindung zwischen Virus und Gehirn wurde in den 1970er Jahren erbracht, als Forscher unter der Leitung von Eugenia Gamboa, damals Neurologin an der Columbia University, und Kollegen virale Antigene in den Gehirnen verstorbener Menschen fanden, die an einer als Encephalitis lethargica bekannten Erkrankung gelitten hatten.5 Mit Symptomen wie Fieber, Kopfschmerzen und Doppeltsehen wurde die Encephalitis lethargica mit der Spanischen Grippe von 1918 in Verbindung gebracht – und, wie einige glaubten, von ihr verursacht -, und die Forscher spekulierten, dass die Erkrankung ein Vorläufer der Parkinson-Symptome sein könnte. 1997 berichtete ein Team von Wissenschaftlern, dass Ratten, die dem Japanischen Enzephalitis-Virus ausgesetzt waren, eine Krankheit entwickelten, die ähnliche Symptome wie die Parkinson-Krankheit beim Menschen aufwies.6
Der Zusammenhang zwischen Virusinfektion und Gehirnerkrankung ist jedoch heftig umstritten. Und als Forscher des Armed Forces Institute of Pathology in Washington, DC, Anfang der 2000er Jahre mit PCR nach Fragmenten des H1N1-Genoms im konservierten Hirngewebe von Opfern der Encephalitis lethargica suchten, fanden sie keine Anzeichen des Virus.7
So war der Stand der Forschung, als Smeyne die schweren Parkinson-ähnlichen Hirnschäden bei den H5N1-infizierten Enten entdeckte. Niemand hatte die Fähigkeit des Virus, die Parkinson-Krankheit zu verursachen, direkt getestet, bis er Mäuse mit H5N1 infizierte und schwere Schäden an der Substantia nigra dokumentierte. Seine Ergebnisse zeigten auch einen möglichen Weg auf, wie sich das Virus vom Körper ins Gehirn ausbreiten kann. Die Substantia nigra, so Smeyne, war nicht das ursprüngliche Ziel des Virus; es infizierte zunächst Neuronen im Darm. „Dann ist das Virus in den Vagusnerv eingedrungen und hat den Vagusnerv im Grunde als Hintertür ins Gehirn benutzt.“
Passagewege
Einige Viren können durch Nase und Mund in den Körper eindringen und zum Gehirn gelangen, indem sie sich replizieren und über die Riechkolben, den Zungennerv, der am Kiefer entlang bis zur Zunge verläuft, oder den Vagusnerv, der durch den Hals und den Brustkorb bis zum Magen wandert, verbreiten.

Das Muster ähnelt verblüffend der Art und Weise, wie sich die Parkinson-Krankheit durch den menschlichen Körper zu arbeiten scheint, sagt Smeyne. Nach einer weithin akzeptierten Hypothese, die erstmals 2003 von dem deutschen Neuropathologen Heiko Braak aufgestellt wurde, beginnt die Parkinson-Krankheit im Darm, wo sie sich in Form von Verdauungsproblemen äußert, und greift dann auf das Gehirn über. „Das Fortschreiten der Krankheit vom Darm zum Vorderhirn dauert beim Menschen vielleicht 25 oder 30 Jahre“, sagt Smeyne. Aber Mäuse leben viel kürzer. Bei den Nagern kann das Grippevirus die gleiche Strecke zurücklegen und innerhalb weniger Wochen Anzeichen von Parkinson hervorrufen, stellt er fest. Und wie Smeyne und seine Kollegen bei H1N1-infizierten Mäusen feststellten, können Viren, die es nicht ins Gehirn schaffen, dennoch eine Rolle bei der Neurodegeneration spielen, indem sie schwere Entzündungen auslösen.
Einige Forschungsarbeiten haben jedoch keinen Zusammenhang zwischen Virusinfektion und Schädigung des Gehirns gefunden. Als beispielsweise Forscher der US-amerikanischen Centers for Disease Control and Prevention in Atlanta, Georgia, die Auswirkungen des Grippestamms untersuchten, der die Spanische Grippe-Epidemie von 1918 auslöste, konnten sie in den Gehirnen infizierter Mäuse keine Anzeichen einer Entzündung feststellen.8 „Es sind weitere Untersuchungen erforderlich, um einen Zusammenhang zwischen Virusinfektionen und neurodegenerativen Erkrankungen zu finden“, sagt der Mikrobiologe Terrence Tumpey, der diese Studie mitverfasst hat.
Smeyne vermutet, dass der Zusammenhang zwischen Viren und gehirnbedingten Erkrankungen subtiler sein könnte. Um den Zusammenhang zwischen H1N1 und Parkinson weiter zu erforschen, verabreichten er und seine Kollegen Mäusen, die sich von der Infektion mit dem Virus erholt hatten, ein Toxin namens MPTP. Die Chemikalie war ein Nebenprodukt einer schlechten Charge von synthetischem Heroin, das in den 1970er Jahren hergestellt wurde und bei den Konsumenten zur Entwicklung der Parkinson-Krankheit führte. Die mit MPTP behandelten Mäuse, die mit H1N1 infiziert worden waren, entwickelten Anzeichen der Krankheit und verloren 25 Prozent mehr Neuronen in der Substantia nigra als nicht infizierte Mäuse, die mit dem Toxin behandelt wurden, oder Mäuse, die mit dem Virus infiziert, aber nicht mit MPTP behandelt wurden.9
„Das deutet für uns darauf hin“, sagt Smeyne, „dass die H1N1-Infektion allein zwar nicht Parkinson verursacht, aber das Nervensystem so präpariert, dass es auf andere Dinge empfindlich reagiert.“
Ein breiterer Zusammenhang zwischen Viren und Neurodegeneration
Die Verbindung zwischen Grippe und Parkinson ist nicht die einzige Verbindung, die Forscher zwischen Viren und neurologischen Problemen hergestellt haben. In den späten 1980er und frühen 1990er Jahren fanden Forscher heraus, dass Mäuse, die mit Viren wie Masern und Herpes infiziert waren, die gleiche Art von Schäden an ihren Oligodendrozyten – Zellen im Zentralnervensystem, die Myelin, die isolierende Fetthülle, die sich um die Axone der Neuronen wickelt, produzieren – erlitten wie Patienten mit MS. Es ist nicht klar, ob die Viren direkt in die Oligodendrozyten eingedrungen sind oder einfach nur das Immunsystem der Mäuse dazu veranlasst haben, die Zellen anzugreifen, aber das Endergebnis war eine Demyelinisierung der Neuronen, sagt van den Pol, genau wie bei MS-Patienten.

Einer der Virusstämme, die bei Mäusen MS-Symptome auslösten, war das Herpesvirus 6, das auch mit der Entwicklung der Alzheimer-Krankheit in Verbindung gebracht wurde. Hinweise auf einen Zusammenhang zwischen Virusinfektionen und Alzheimer wurden in den letzten Jahrzehnten dokumentiert, aber diese Möglichkeit tauchte im letzten Jahr wieder auf, als Joel Dudley von der Icahn School of Medicine am Mount Sinai und Kollegen bei der Auswertung von Daten aus Hirnbanken und veröffentlichten Studien feststellten, dass Patienten mit Alzheimer in vier Schlüsselregionen des Gehirns erhöhte Werte von Viren wie dem menschlichen Herpesvirus 6 und dem menschlichen Herpesvirus 7 aufwiesen. Auf der Grundlage genetischer und proteomischer Daten fanden die Forscher außerdem heraus, dass das humane Herpesvirus 6 eine Genexpression auslösen kann, die die Entwicklung des Proteins Amyloid β fördert, das Plaques bildet, die ein Kennzeichen der Alzheimer-Krankheit sind.4
Siehe „Do Microbes Trigger Alzheimer’s Disease?“
Eine solche Korrelation beweist nicht, dass Viren die Krankheit verursachen, aber sie deutet darauf hin, dass Krankheitserreger bei neurodegenerativen Erkrankungen doch eine Rolle spielen könnten, sagt Dudley. „Ein Unterschied zu früheren Überlegungen zur Pathogenhypothese besteht darin, dass wir heute über viel leistungsfähigere Sequenzierungsmethoden verfügen, die einen unvoreingenommeneren Blick auf die mikrobielle DNA/RNA-Landschaft des Hirngewebes werfen können“, sagt er. „Wir werden wahrscheinlich einen noch besseren Blick auf diese Frage bekommen, wenn wir die Long-Read-Sequenzierungstechnologie und die Einzelzell-Sequenzierungstechnologie auf Hirngewebeproben anwenden.“
HIV ist ein weiteres Virus, von dem Forscher vermuten, dass es Alzheimer- oder Parkinson-ähnliche Hirnschäden verursachen könnte. In den 1990er Jahren wiesen Wissenschaftler nach, dass HIV die Blut-Hirn-Schranke überwinden kann, und spätere Studien zeigten, dass das Virus, wenn es in das Gehirn eindringt, das Absterben von Nervenzellen und den Verlust synaptischer Verbindungen auslöst.10 In jüngerer Zeit haben Ärzte begonnen, über Patienten mit HIV zu berichten, die Demenz und einen Verlust von Hirnsubstanz entwickeln, der dem ähnelt, was bei Alzheimer-Patienten zu beobachten ist, erklären Sara Salinas, eine Pathologin und Virologin an der Universität Montpellier in Frankreich, und Kollegen in einem Übersichtsartikel von 2018 in Frontiers in Cellular Neuroscience.11 Neuere Studien zeigen, dass HIV-Patienten Plaques aus Amyloid β entwickeln. Und, so Smeyne, HIV-Patienten können auch eine Verlangsamung der Bewegungen und Zittern entwickeln.
Überwindung der Blut-Hirn-Schranke
Wenn sie mit dem Nervensystem interagieren, können Viruspartikel die Blut-Hirn-Schranke direkt oder durch Infektion von Endothelzellen überwinden (unten links), oder sie können einen Ansatz des trojanischen Pferdes verwenden (Mitte), indem sie Monozyten infizieren, die die Schranke überqueren, bevor sie sich replizieren und aus den weißen Blutkörperchen ausbrechen, sobald sie im Gehirn sind. Alternativ dazu überqueren einige Viren die Blut-Hirn-Schranke nicht, sondern rufen eine Immunreaktion hervor, die Zytokine oder Chemokine dazu anregen kann, die Schranke zu durchbrechen (rechts).

Ein genauerer Blick auf die Art und Weise der neuronalen Kommunikation könnte einige Hinweise auf die Entstehung neurodegenerativer Erkrankungen geben. Anfang dieses Jahres berichteten zwei Wissenschaftlergruppen, dass Neuronen nicht nur elektrische und chemische Signale verwenden, um miteinander zu kommunizieren, sondern auch extrazelluläre Vesikel, die Boten-RNAs tragen.12,13 Die Struktur dieser Vesikel erinnert an die Art und Weise, wie HIV und andere Retroviren schützende Hüllen, so genannte Kapsiden, bauen, die das genetische Material des Virus von Zelle zu Zelle transportieren, sagt Jason Shepherd, ein Neurowissenschaftler an der Universität von Utah und Mitautor einer der Studien. Die Gene, die für die Vesikel kodieren, könnten möglicherweise Überbleibsel früherer Infektionen sein, meint er, und diese virusähnlichen Kapsiden könnten toxische Proteine wie Amyloid β beherbergen und sie im Gehirn verbreiten.
„Es ist klar, dass Viren das Gehirn beeinflussen“, sagt Shepherd, aber die Art dieser Beziehung bleibt unklar.
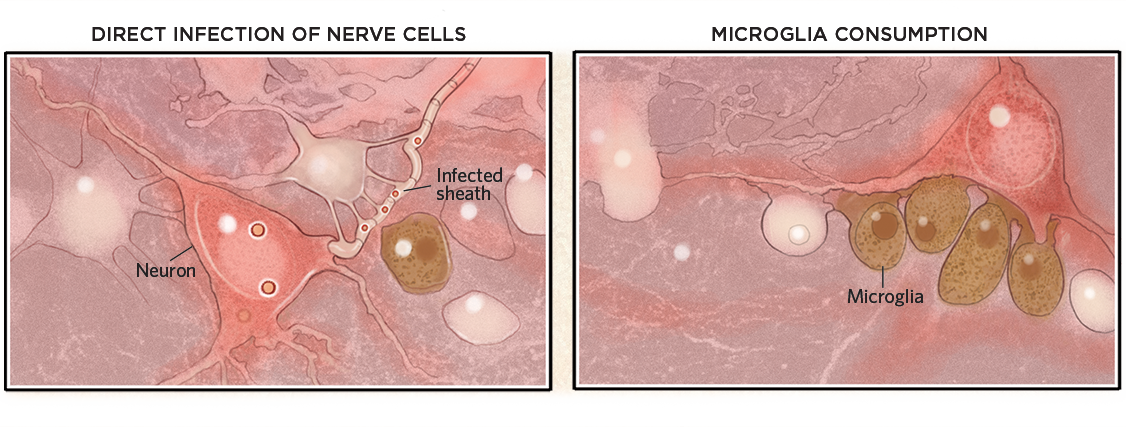
Gehirnschäden
Wenn sie einmal im Gehirn sind, können Viren Zellen oder ihre Myelinscheiden infizieren und abtöten (unten, links). Viren müssen jedoch nicht unbedingt in das Gehirn eindringen, um Schäden zu verursachen. Sie können auch eine Immunreaktion auslösen, die Mikroglia aktiviert, die dann ansonsten gesunde Neuronen verzehren (rechts).
Vergessenheit bleibt
Eine Herausforderung beim Verständnis der Reaktion des Gehirns auf eine Virusinfektion besteht darin, dass die Auswirkungen noch lange anhalten können, nachdem unser Immunsystem die Infektion aus unserem Körper entfernt hat. Anfang dieses Jahres berichteten Martin Korte von der Technischen Universität Braunschweig und Kollegen, dass die Gehirne von Mäusen, die mit bestimmten Stämmen des Grippevirus infiziert waren, Gedächtnislücken aufwiesen, selbst nachdem sie sich scheinbar erholt hatten. Es stellte sich heraus, dass ihre Gehirne auch 30 bis 60 Tage nach der Infektion noch voller Mikroglia waren.14 Etwa 60 Tage nach der Infektion können die Mikroglia-Werte wieder in den Normalbereich zurückkehren, und die Neuronen in den jungen Mäusen erholen sich vollständig, ebenso wie die Gedächtnisleistung der Tiere. Dennoch kann die Zahl der Mikroglia bis zu 120 Tage lang erhöht bleiben, erklärt Korte gegenüber The Scientist; das entspricht beim Menschen mehr als 10 Jahren.
Van den Pol sagt, dass eine solche Verzögerung genau der Grund ist, warum Wissenschaftler Schwierigkeiten haben zu akzeptieren, dass Viren neurodegenerative Krankheiten verursachen könnten. „In der Wissenschaft denken wir oft, dass Ursache und Wirkung oft nur Millisekunden dauern“, sagt er. „Hier geht es um Jahrzehnte. Das Virus dringt ein und kann dann vielleicht Jahrzehnte später eine potenziell schwerwiegende Neurodegeneration verursachen.“
In der Wissenschaft denken wir oft, dass Ursache und Wirkung oft nur Millisekunden dauern. Hier geht es um Jahrzehnte.
-Anthony van den Pol,
Yale University
Wenn der Zusammenhang zwischen Virusinfektionen und neurologischen Problemen konkreter nachgewiesen werden kann, können Forscher vielleicht Wege entwickeln, um die neurologischen Auswirkungen zu mildern, sagt van den Pol. Wenn man versteht, wie Infektionen das Immunsystem auslösen, könnte man zum Beispiel Wege finden, die durch Glia ausgelöste Entzündung herunterzuregulieren, in der Hoffnung, langfristige Schäden zu verhindern, schlägt er vor.
In der Zwischenzeit stellt Smeyne fest, dass eine Grippeimpfung – oder zumindest die Einnahme von Tamiflu im Falle einer Infektion – helfen könnte, neurologische Komplikationen einer Grippeinfektion zu verhindern. Er und seine Kollegen testeten diesen Ansatz an Mäusen, nachdem ihre Ergebnisse den Zusammenhang zwischen Grippe, dem MPTP-Toxin und der Parkinson-Krankheit aufgezeigt hatten. Das Team verabreichte einer Gruppe von Mäusen einen H1N1-Impfstoff, 30 Tage bevor die Tiere mit dem Virus infiziert wurden. Eine andere Gruppe von Mäusen wurde eine Woche lang nach der Infektion mit Tamiflu behandelt. Beide Mäusegruppen durften sich erholen, bevor ihnen eine niedrige Dosis MPTP verabreicht wurde. Während die Kontrollmäuse, die weder den Impfstoff noch die Grippebehandlung erhielten, Parkinson-ähnliche Symptome entwickelten, traten bei den behandelten Mäusen keine neurodegenerativen Auswirkungen auf. „
Dies ist ein weiterer Beweis für die Idee, dass Virusinfektionen das Gehirn schädigen können, sagt Smeyne, aber es gibt immer noch keine eindeutige Studie, die beweist, dass ein Virus Parkinson, Alzheimer oder andere neurologische Störungen verursachen kann. „Mir gefällt die Idee, dass Viren viele verschiedene Hirnerkrankungen verursachen können, als Hypothese“, sagt van den Pol. „Aber ich respektiere auch die Tatsache, dass es wirklich eine Hypothese ist.“
- H. Jang et al. „Hochpathogenes H5N1-Influenzavirus kann in das zentrale Nervensystem eindringen und Neuroinflammation und Neurodegeneration induzieren“, PNAS, 106:14063-68, 2009.
- S. Sadasivan et al. „Induction of microglia activation after infection with the non-neurotropic A/CA/04/2009 H1N1 influenza virus,“ PLOS ONE, 10:e0124047, 2015.
- U.G. Liebert, V. ter Meulen. „Virological aspects of measles virus-induced encephalomyelitis in Lewis and BN rats,“ J Gen Virol, 68:1715-22, 1987.
- B. Readhead et al., „Multiscale analysis of independent Alzheimer’s cohorts finds disruption of molecular, genetic, and clinical networks by human herpesvirus,“ Neuron, 99:64-82.e7, 2018.
- E.T. Gamboa et al., „Influenza virus antigen in postencephalitic parkinsonism brain. Detection by immunofluorescence,“ Arch Neurol, 31:228-32, 1974.
- A. Ogata et al. „A rat model of Parkinson’s disease induced by Japanese encephalitis virus“, J Neurovirol, 3:141-47, 1997.
- S. McCall et al., „Influenza RNA not detected in archival brain tissues from acute encephalitis lethargica cases or in postencephalitic Parkinson cases,“ J Neuropathol Exp Neurol, 60:696-704, 2001.
- J.C. Kash et al., „Genomic analysis of increased host immune and cell death responses induced by 1918 influenza virus,“ Nature, 443:578-81, 2006.
- S. Sadasivan et al. „Synergistische Effekte von Influenza und 1-Methyl-4-Phenyl-1,2,3,6-Tetrahydropyridin (MPTP) können durch den Einsatz von Influenza-Therapeutika eliminiert werden: Experimental evidence for the multi-hit hypothesis,“ NPJ Parkinsons Dis, 3:18, 2017.
- S. Peudenier et al., „HIV receptors within the brain: a study of CD4 and MHC-II on human neurons, astrocytes and microglial cells,“ Res Virol, 142:145-49, 1991.
- G. Canet et al., „HIV neuroinfection and Alzheimer’s disease: Similarities and potential links?“ Front Cell Neurosci, 12:307, 2018.
- E.D. Pastuzyn et al., „The neuronal gene Arc encodes a repurposed retrotransposon gag protein that mediates intercellular RNA transfer,“ Cell, 172:P275-88.E18, 2018.
- J. Ashley et al. „Retrovirus-like gag protein Arc1 binds RNA and traffics across synaptic boutons“, Cell, 172:P262-74.E11, 2018.
- S. Hosseini et al. „Long-term neuroinflammation induced by influenza A virus infection and the impact on hippocampal neuron morphology and function,“ J Neurosci, 38:3060-80, 2018.
Leave a Reply