内分泌障害 がん治療の新たな代償
免疫チェックポイント阻害剤(ICI)は、チェックポイント、すなわち細胞傷害性Tリンパ球抗原4(CTLA-4)、プログラム細胞死タンパク質1(PD-1)、プログラム細胞死タンパク質リガンド1(PD-L1)をブロックし、細胞傷害性T細胞の機能抑制を解除して抗腫瘍免疫反応を増強するモノクロナル抗体である(図1参照)。

図1. 免疫チェックポイント阻害剤のメカニズム
2011年、米国食品医薬品局は、最初のICIであるイピリムマブをメラノーマに使用することを承認しました。 その後、PD-1阻害剤(ペムブロリズマブ、ニボルマブ)、PD-L1阻害剤(アテゾリズマブ、アベルマブ、デュルバルマブ)を含む5つのICIが臨床で承認されています。
ICIは、下垂体、甲状腺、内分泌膵臓、(まれに)副腎、副甲状腺に影響を及ぼす内分泌免疫関連有害事象(IRAE)の新しい原因として浮上した。 これらの内分泌異常症の根本的なメカニズムは、主にT細胞による免疫介在性であると考えられています。しかし、その具体的なメカニズムはまだ解明されておらず、最近および現在進行中の研究の対象になっています。
さまざまな悪性腫瘍に非常に有効なICIの使用が増えることで、これらの内分泌異常症の人口負担が増加する可能性があります。 それゆえ、臨床医はそれらを特定し、管理を開始できることが不可欠である。
内分泌障害のモニタリング
ICIの開始前に、患者は血清TSH、血清フリーチロキシン、血清8AMコルチゾール、血清ACTH、空腹時血糖などの臨床検査を受けておく必要がある。 これらの検査のいずれかに異常がある場合、さらなる検査とモニタリングが実施され得る。
臨床医は、患者に自己免疫の個人歴または家族歴がある場合、あるいは他のIRAEを発症している場合は、内分泌障害の検査に対する閾値を低くする必要がある。
CTLA-4阻害剤イピリムマブに関連する最も一般的な内分泌疾患は下垂体炎で、患者の8~11%に発生する。 PD-1阻害剤、PD-L1阻害剤では0%~5%と頻度が低い。 ICIの投与開始後、通常6~12週間で下垂体炎が発生しますが、治療期間が長期化した場合の症例も報告されています。
提示と管理
下垂体炎は下垂体肥大による腫瘤性を呈し、頭痛、複視、視野欠損を伴うことがある。 腫瘤の有無にかかわらず、すべての症例で下垂体ホルモン不足-最も一般的には二次性副腎機能不全-があり、”副腎クリーゼ “という緊急事態として現れることがある。 また、中枢性甲状腺機能低下症や、時に二次性腺機能低下症も引き起こすことがあります。
疲労、脱力、吐き気、混乱、記憶喪失、性欲減退、食欲不振、幻覚、温度不耐性、発熱や悪寒の自覚症状などの症状が現れることがあります。 これらの症状はしばしば非特異的であり、がんに関連した体質的症状と重複することがある。
したがって、臨床医は、特に副腎機能不全を伴う場合は、速やかに認識し管理しなければ生命を脅かす可能性があるため、物理的下部炎を評価する際に強く疑ってかかる必要がある。 下垂体後葉はほとんど侵されないため、ICI使用時に中枢性糖尿病はまれである。
診断検査には脳MRI(図2)および下垂体と標的腺で産生されるホルモンを検査する必要がある
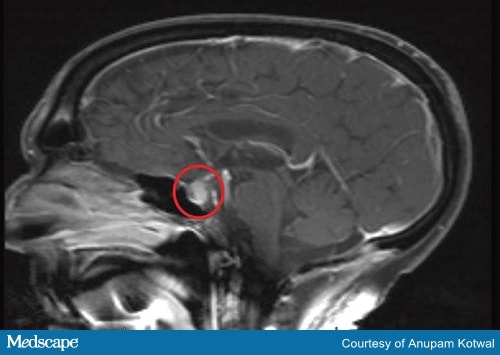
図2a. 頭部のMRI、下垂体の肥大と増強、茎の肥厚を示す
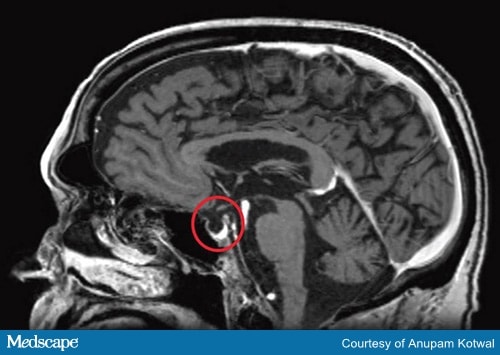
図2b。 頭部のMRI、下垂体の破壊を示し、空の鞍のように見える。
ホルモン異常に加えて、コルチゾールおよびチロキシンの欠乏により、低ナトリウム血症および低血糖などの電解質異常が起こることがある。
患者が頭痛や視覚異常などの大量作用を呈する場合、入院を検討する必要がある。 高用量のグルココルチコイド(例えば、プレドニゾン/メチルプレドニゾロン1mg/kg/日またはデキサメタゾン4mg 6時間ごと)は、物理膜下炎による腫瘤効果の懸念があるとすぐに投与すべきである。
低血圧、混乱、低血糖を呈する患者は副腎危機にある場合があるが、ストレス量グルココルチコイドと水分蘇生で管理することが必要である。 副腎クリーゼと腫瘤の影響が治まれば、または患者がホルモン欠乏の軽度から中等度の症状しか示さない場合は、ホルモン補充が管理の主軸となる。 下垂体機能低下症を発症した患者のほとんどは、生涯にわたるホルモン補充を必要とする。
甲状腺炎
甲状腺機能障害は、PD-1およびPD-L1阻害剤に関連する最も一般的な内分泌障害です(6%~21%)。 CTLA-4阻害剤であるイピリムマブでは発生頻度が低くなります。 イピリムマブとPD-1阻害剤の併用療法では、甲状腺機能障害の発生率が最も高く、通常ICI開始後8~10週で発生するが、最大2年遅れることもあることが実証されている。
症状と管理
甲状腺炎は、甲状腺ホルモンが分泌される甲状腺中毒期が先行することもあり、原発性甲状腺機能低下症を呈することがある。 橋本甲状腺炎の既往のある患者では、甲状腺ホルモン補充量の増加により、甲状腺機能低下症の悪化が示唆されることがある。
ICI誘発甲状腺炎では、無痛性甲状腺炎に比べて永久的な甲状腺機能低下症に進行するリスクが高いようで、これは特に甲状腺ペルオキシダーゼ抗体(TPO)が上昇している場合に顕著である。 バセドウ病のような持続性甲状腺機能亢進症は、CTLA-4阻害剤の使用でまれに報告されています。
甲状腺ホルモン機能障害が急性あるいは軽度であるため、多くの患者は無症状であり、ICI注入前の甲状腺ホルモンレベルのモニタリングの重要性が強調されている。 顕性甲状腺機能低下症になった患者や進行した患者の多くは、長期的な甲状腺ホルモン補充が必要である。
診断は甲状腺機能検査で簡単に確定できる。 TSH-受容体抗体は甲状腺機能亢進症が8週間以上持続している場合にのみ検査する必要があり、その場合はTSH-受容体抗体検査が陽性であればバセドウ病を示唆している。
画像診断は通常ICIによる甲状腺炎の診断に必要ではない。 場合によっては、甲状腺超音波検査が甲状腺炎の診断を確定するのに役立ち、甲状腺が不均質で血管が少なく見える(図3)
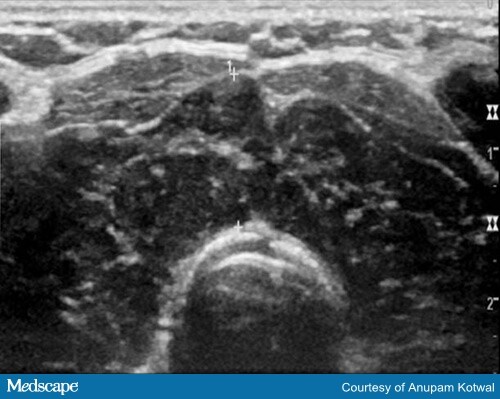
図3. 不均質で低エコーの甲状腺実質を示す超音波画像で、血管も少ない。
悪性腫瘍のワークアップまたはモニタリングの一部として行われたFDG-PETスキャンは通常、甲状腺炎と一致する甲状腺のFDGアップテイクがびまん性に増加することを示す(図4)。

図4. FDG-PETスキャンで甲状腺のFDG取り込みのびまん性増加を示す。
管理は診断が下された甲状腺炎の段階によって異なる。 一過性の甲状腺中毒症は、通常β遮断薬で対症療法的に管理することができる。
明らかな甲状腺機能低下症や症状のある潜在性甲状腺機能低下症に対しては、レボチロキシンによるT4補充療法を開始し、その量はTSHに基づいて漸増されるべきである。
インスリン依存性糖尿病
CTLA-4阻害剤の臨床試験では糖尿病の新規発症は報告されておらず、PD-1阻害剤の試験では<1%の患者に報告されています。 しかし、最近、CTLA-4阻害剤とPD-1阻害剤の併用により、最大1.5%の割合で報告されています。
PD-L1阻害剤は、インスリン依存性糖尿病を新たに発症させるだけでなく、既存の糖尿病を悪化させることが示されている。 頻繁に遭遇する1型糖尿病関連抗体の高力価は、免疫プロセスに沿ったものです。
新規発症のインスリン依存性糖尿病は、通常PD-1阻害剤治療開始後20週間で発症しますが、早ければ2週間、遅くとも治療開始後3~4年後に報告されることが分かっています。
症状と管理
インスリン不足の重症度により、糖尿病性ケトアシドーシスによる緊急事態が発生することがあり、かなり頻繁に報告されている。
高血糖を呈するICI患者には、ヘモグロビンA1c(高血糖の急性期のため、通常は極端に上昇しない)、Cペプチド(通常は低い)、血糖の併用、1型糖尿病抗体を検査することが勧められる。 糖尿病性ケトアシドーシスの懸念がある場合は、血清重炭酸塩、アニオンギャップ、β-ヒドロキシ酪酸、尿ケトンを検査する必要がある。
最初の高血糖が治まれば、そして抗体が陰性でC-ペプチド値が適切なインスリン分泌を示唆すれば、特に食前高血糖がなければ、治療の慎重な漸減が考えられるが、患者はインスリン不足の「ハネムーン期」にあるかもしれないから非常に厳密に監視されなければならない。
ICI誘発糖尿病患者のほとんどは、経過観察中に基礎ボーラス療法またはインスリンポンプによる集中的なインスリン療法を必要とし、寛解の可能性は低いことが示唆されている。 このことは、すでに癌を患っている患者の病的状態を著しく悪化させることになる。 副腎炎と副甲状腺機能低下症
原発性副腎不全を示唆する臨床症状がいくつかの症例報告に記載されているが、通常、低体温症や慢性グルココルチコイド使用(がんや他のIRAEの管理)による二次性副腎不全との鑑別が困難である。
最近、PD-1阻害剤の使用により、免疫介在性副甲状腺機能低下症を示唆する低カルシウム血症と副甲状腺ホルモン低下症の2例が報告されており、うち1例はカルシウム感受性受容体に対する抗体を示している。
Facebook、Twitter、Instagram、YouTubeでMedscapeをフォローする
Leave a Reply