Frontiers in Neuroscienze
Introduzione
C’è evidenza di un dimorfismo sessuale del cervello (es, Coffey et al., 1998; Sacher et al., 2013) e nuove teorie mediche sottolineano l’importanza della medicina specifica di genere in termini di fattori di rischio, epidemiologia e risultati del trattamento (ad esempio, Mielke et al., 2014). Al fine di estrarre informazioni essenziali e complete da studi di imaging comportamentale e funzionale, includendo il genere, come un fattore essenziale è di grande interesse (Sacher et al., 2013). Questa revisione evidenzia questa importanza per la scienza chemiosensoriale in cui i chemosegnali sono noti per evocare essi stessi un effetto specifico di genere.
Il termine “feromoni” (i cosiddetti chemosegnali) è stato coniato nel 1959 da Peter Karlson e Martin Lüscher, che li ha definiti come “sostanze che vengono secrete all’esterno da un individuo e ricevute da un secondo individuo della stessa specie, in cui rilasciano una reazione specifica, per esempio un comportamento definito o un processo di sviluppo” (Karlson e Lüscher, 1959). La ricerca di questi semiochimici è ancora un obiettivo elusivo dell’ecologia chimica e degli studi sulla comunicazione. Oggi, è chiaro che i segnali chimici giocano un ruolo significativo nell’interazione sociale e nella comunicazione in varie specie. È noto che gli animali sono in grado di comunicare stati affettivi, come stress, allarme, paura, ansia o interesse sessuale, manipolando i segnali chimici prodotti dalla loro pelle (Kiyokawa, 2004; Kiyokawa et al., 2006). Negli animali, questi segnali sono elaborati congiuntamente dall’organo vomeronasale (VNO) e dai sistemi olfattivi accessori, oltre che dal sistema olfattivo principale (Chamero et al., 2012; Petrulis, 2013). L’ampia letteratura che si occupa del VNO fornisce poco consenso sulla presenza del VNO negli esseri umani (per una revisione, vedi Meredith, 2001). Mentre una struttura simile al VNO degli animali è stata trovata in utero negli esseri umani (Knecht et al., 2003), la stessa struttura non è continuamente evidente negli adulti (Trotier et al., 2000; Trotier, 2011). Ad oggi, non è chiaro se esista un VNO umano e se abbia un ruolo nella percezione dei segnali chimici (Frasnelli et al., 2011).
Diverse aree del corpo umano – come i piedi, la bocca o, in particolare, le regioni ascellari – sono note per produrre odori che agiscono come segnali chimici (Pausa, 2012). Recentemente, Gelstein et al. (2011) hanno scoperto che le lacrime trasmettono segnali chimici, e anche il cerume è stato proposto per essere in grado di trasportare informazioni chemosensoriali (Prokop-Prigge et al., 2014). Tuttavia, il sudore umano è il conduttore di segnali chimici più studiato (Porter e Moore, 1981; Lundström et al., 2008; Zhou e Chen, 2008; Zernecke et al., 2010; Albrecht et al., 2011).
Anche se il cocktail di odore del corpo umano può contenere ben oltre 200 componenti individuali (Zeng et al., 1996), il componente più studiato è lo steroide 4,16-androstadien-3-one (AND). La struttura chimica della molecola AND è molto simile all’androstenone, un noto feromone animale (Melrose et al., 1971). Le caratteristiche trasversali specifiche dell’AND e il suo impatto sul comportamento umano e sugli eventi psicofisiologici, in particolare, hanno attirato molta attenzione nella ricerca recente.
Le seguenti sezioni si concentreranno sulla ricerca che affronta gli effetti comportamentali e psicofisiologici così come l’elaborazione neuronale dell’AND, sottolineando le sue caratteristiche specifiche di genere e trasversali.
Effetti comportamentali e psicofisiologici dell’AND
L’AND è una delle sostanze note per modulare gli stati psicologici e fisiologici, così come il comportamento umano in modo non conscio (Lundström e Olsson, 2005). È noto che l’AND è associata a specifiche caratteristiche intersessuali e recentemente ha attirato molta attenzione, in particolare per quanto riguarda il suo effetto sulla psicofisiologia delle donne (Jacob e McClintock, 2000; Jacob et al., 2001, 2002; Lundström e Olsson, 2005; Wyart et al., 2007). Tuttavia, ci sono prove che l’AND influenza anche la psicofisiologia e il comportamento degli uomini (Bensafi et al., 2003, 2004). Questi effetti genere-specifici non solo rendono l’AND particolarmente interessante, ma inducono anche una distorsione interpretativa di certi risultati a causa di gruppi di studio misti e di una descrizione non esaustiva dello studio. La tabella 1 fornisce una panoramica degli studi e dei risultati specifici di genere.
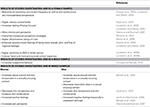
Tabella 1. Risultati comportamentali e psicofisiologici indotti da AND.
I dati dei precedenti studi comportamentali e psicofisiologici sono forniti nelle seguenti sezioni categorizzati secondo il genere del campione.
Studi che indagano AND in un campione femminile
Sono state riportate manifestazioni psicofisiologiche legate all’esposizione ad AND in soggetti femminili, basate su AND rilevate nei livelli di cortisolo salivare (Wyart et al., 2007) e i livelli di fisiologia autonoma hanno mostrato una riduzione significativa della frequenza respiratoria e cardiaca, così come la conduttanza cutanea e l’aumento della temperatura corporea (Grosser et al., 2000). Oltre a ciò, Lundström e colleghi hanno suggerito che l’AND ha migliorato la sensazione delle donne di essere concentrate (Lundström et al., 2003) e ha indotto una maggiore attenzione, anche al di fuori della rilevazione cosciente dell’AND (Lundström e Olsson, 2005). Inoltre, le analisi delle registrazioni ERP (event-related potential) chemiosensoriali hanno rivelato che AND viene elaborato tra il 13 e il 20 per cento più velocemente di odoranti simili nelle valutazioni edonistiche e di intensità (Lundström et al., 2006b). Per quanto riguarda il ruolo generalmente proposto di AND nel comportamento riproduttivo, due studi (Thorne et al., 2002; Saxton et al, 2008) indicano che le valutazioni degli uomini sull’attrattiva femminile sono modulate da questo speciale chemosegnale con valutazioni più alte delle donne nella condizione AND, mentre un altro esperimento (Lundström e Olsson, 2005) non è stato in grado di confermare questo effetto.
Saxton et al. (2008), che hanno valutato l’effetto di AND in un evento di speed-dating, hanno sostenuto che la suggerita dipendenza dal contesto di AND può verificarsi solo in presenza di una persona maschile (Jacob et al., 2001; Lundström e Olsson, 2005). Inoltre, la letteratura recente suggerisce che AND rafforza le strategie di competizione intrasessuale nelle donne (Parma et al., 2012).
Il ruolo di AND come modulatore-chemosegnale è stato discusso anche nel contesto di servire come collegamento tra lo stato ormonale e questo speciale steroide: Mentre le donne che assumono contraccettivi orali sono più sensibili agli odori ambientali, le donne fertili hanno mostrato una maggiore sensibilità ai chemosegnali con rilevanza riproduttiva, come l’androstadienone (Lundström et al., 2006a). Per quanto riguarda l’influenza dell’AND sull’umore, l’AND è stato trovato per migliorare l’umore positivo nelle donne, con sensazioni di essere più rilassate, calme e libere da sentimenti negativi (Grosser et al., 2000; Preti et al., 2003). Un altro studio ha riportato che l’impostazione, il modo e chi ha condotto l’esperimento giocano un ruolo nella percezione. Lundström e Olsson (2005) hanno sottolineato l’impatto delle condizioni socio-sperimentali nelle donne che hanno mostrato cambiamenti nell’umore auto-riferito solo quando le interazioni sperimentali erano completate da uno sperimentatore maschio, quindi, ancora una volta, proponendo un effetto dipendente dal contesto per AND.
Studi che indagano AND in un campione maschile
Gli studi che usano campioni maschili sono rari. L’unico studio che indaga l’effetto di AND negli uomini è uscito di recente, e ha dimostrato che AND ha influenzato direttamente il comportamento cooperativo degli uomini aumentando tale comportamento (Huoviala e Rantala, 2013).
Studi che indagano AND in campioni misti
Abbiamo definito gli studi con campioni misti come quelli in cui il disegno dello studio include uomini e donne.
Per quanto riguarda gli effetti di attivazione nel sistema nervoso simpatico, uno studio di Jacob et al. (2001) è stato in grado di confermare i suggeriti effetti calmanti di AND sulla fisiologia delle donne, come già suggerito da uno studio usando il campione femminile presentato nella sezione precedente (vedi Sezione “Studi che indagano AND in un campione femminile”; Grosser et al, 2000). Mentre la somministrazione di AND ha portato ad un aumento della temperatura della pelle negli uomini e ad un abbassamento della temperatura nelle donne, AND ha aumentato la conduttanza della pelle in entrambi i sessi, con un effetto significativamente maggiore osservato nelle donne, indicando che l’effetto eccitante era più prevalente nelle donne che negli uomini (Jacob et al., 2001). È interessante notare che gli effetti di attivazione di AND dipendevano dal contesto socio-sperimentale, poiché le reazioni delle donne sono state osservate solo nelle sessioni somministrate da uno sperimentatore maschio. Alcuni altri risultati hanno sottolineato la dipendenza dal contesto di AND in modo simile. Mentre l’AND somministrato in un contesto neutro, o in un contesto con poca interazione sociale, non ha influenzato le funzioni del sistema nervoso autonomo, ha permesso un aumento dell’eccitazione sessuale in un contesto sessualmente eccitante in modo indipendente dal sesso (Bensafi et al., 2004; Hummer e McClintock, 2009). Durante lo stesso contesto sessualmente eccitante, i tassi di respirazione, soprattutto negli uomini, sono diminuiti, mentre la temperatura della pelle in entrambi i sessi è aumentata (Bensafi et al., 2004).
Per quanto riguarda le variabili psicologiche, è stato riportato che AND ha effetti divergenti negli uomini e nelle donne, come mostrato per gli stati psicofisiologici; mentre la somministrazione di AND ha portato ad un aumento delle emozioni negative negli uomini (Jacob e McClintock, 2000), soprattutto in ambienti spiacevoli (Bensafi et al., 2004), nessun effetto negativo è stato evocato nelle donne. Concentrandosi sulla dipendenza dal contesto di AND, i sentimenti positivi nelle donne sono stati trovati sostenuti durante un periodo triste (Bensafi et al., 2004) e sono stati aumentati in un contesto neutro (Jacob e McClintock, 2000).
Inoltre, un altro studio che ha analizzato l’effetto di AND sull’umore e la percezione del dolore ha concluso che l’esposizione a questo steroide ha portato a un miglioramento dello stato d’animo solo nelle donne (Villemure e Bushnell, 2007). Sulla base di questa scoperta, gli autori hanno inoltre ipotizzato che le donne avrebbero mostrato una minore sensazione di dolore quando esposte all’AND. Tuttavia, questa ipotesi non è stata confermata, in quanto le donne, curiosamente, hanno mostrato un aumento del dolore percepito (Villemure e Bushnell, 2007).
Un effetto del sesso degli sperimentatori sulla risposta di base in un esperimento AND è stato recentemente osservato anche nei roditori (Sorge et al., 2014). Per quanto riguarda la ricerca futura, dovrebbero essere considerati i risultati preliminari sugli effetti sesso-divergenti di AND su variabili psicofisiologiche e psicologiche, in particolare la dipendenza dal contesto di AND. Questa dipendenza dal contesto dovrebbe essere implicitamente notato quando si pianificano gli esperimenti, così come l’interpretazione dei risultati per evitare un bias di interpretazione.
Correlati neuronali di AND
Negli ultimi anni, un gran numero di studi di neuroimaging hanno fornito informazioni sull’elaborazione neuronale di odori comuni dal percorso olfattivo (per una revisione, vedi Lundström et al., 2011). Mentre gli odori comuni normalmente attivano la giunzione temporo-frontale, la cosiddetta corteccia piriforme, l’amigdala, l’insula e la corteccia orbitofrontale, gli odori corporei sono comunemente trovati per attivare una rete situata al di fuori del sistema olfattivo principale, compresa la corteccia cingolata posteriore, il giro occipitale, il giro angolare e la corteccia cingolata anteriore (per una revisione, vedi Lundström e Olsson, 2010). La seguente sezione ha lo scopo di fornire al lettore una panoramica sull’elaborazione neuronale del segnale chimico AND.
Gli studi di neuroimaging hanno illustrato un risultato specifico di genere, ma un altro risultato significativo dovrebbe essere specificamente notato: l’effetto di orientamento sessuale. Di conseguenza, le seguenti sezioni saranno segmentate in elaborazione neuronale specifica per genere e impatto dell’orientamento sessuale.
Per illustrare più chiaramente i risultati discussi nei paragrafi successivi, forniamo al lettore una panoramica dei modelli di attivazione neurale indotti da AND, classificati per genere e orientamento sessuale (vedi Figura 1).
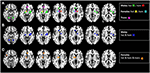
Figura 1. Immagini anatomiche medie assiali sovrapposte all’attivazione neurale indotta da AND, risultanti da diversi studi di imaging funzionale (vedi Tabella 2). Per migliorare la comparabilità, abbiamo incluso tutti gli studi di tomografia a emissione di positroni (PET) utilizzando lo stesso tracciante, con lo speciale composto simile al feromone che ha indotto l’attivazione neuronale (vedi Tabella 2). Poiché i risultati di alcuni gruppi di soggetti sono stati riutilizzati come controlli in tutti questi studi, queste attivazioni sono illustrate una volta sola. I voxel sono stati evidenziati con una sfera di 10 mm. Per illustrare l’impatto dell’orientamento sessuale, le attivazioni negli uomini eterosessuali (verde) e omosessuali (rosso), nelle donne eterosessuali (giallo) e omosessuali (ciano), così come nei transessuali maschio-femmina non omosessuali, sono mappati separatamente (A). Le differenze sesso-specifiche nei modelli di attivazione sono mostrate in (B) (maschi etero e omosessuali; blu) e (C) (femmine etero e omosessuali, così come transessuali maschio-femmina; arancione).

Tabella 2. Panoramica degli studi inclusi nel disegno grafico.
L’elaborazione neuronale specifica del genere di AND
I primi studi di tomografia a emissione di positroni (PET) che esplorano i correlati neurali della percezione di AND hanno suggerito la presenza di un’attivazione neurale specifica del genere in cui la via ipotalamica era significativamente attivata nelle donne eterosessuali, ma gli uomini eterosessuali non avevano questa attivazione ipotalamica, e aree della corteccia olfattiva erano invece attivate (Savic et al., 2001, 2005, 2009; Berglund et al., 2006, 2008; Hillert et al., 2007; Ciumas et al., 2009). Tuttavia, contrariamente a questi studi PET, un recente studio fMRI ha trovato un’attivazione ipotalamica non specifica per il sesso (Burke et al., 2012). Quando gli autori hanno applicato varie concentrazioni di AND, è stata dimostrata un’attivazione ipotalamica significativamente più alta nelle donne che negli uomini quando è stata usata una concentrazione più alta (10 mM). Questo corrisponde a studi precedenti. Tuttavia, quando i partecipanti sono stati esposti a concentrazioni medie (0,1 mM), gli uomini hanno dimostrato una risposta ipotalamica significativamente più forte rispetto alle donne partecipanti (Burke et al., 2012). Questi risultati hanno portato gli autori a concludere che l’AND evoca risposte ipotalamiche in entrambi i sessi in modo dipendente dalla concentrazione dello stimolo. Tuttavia, quando si confrontano questi risultati con la serie di studi di Savic e collaboratori (Savic et al., 2001, 2005, 2009; Berglund et al., 2006, 2008; Hillert et al., 2007; Ciumas et al., 2009), va notato che Burke et al. (2012) hanno utilizzato altri metodi di consegna dell’odore, concentrazioni di composti, nonché un’altra tecnica di imaging, che insieme hanno influenzato la nostra capacità di confrontare direttamente i risultati.
Impatto dell’orientamento sessuale sull’elaborazione neuronale di AND
L’ultimo decennio di ricerche di imaging cerebrale ha rivelato che la stimolazione di AND produce effetti di gruppo significativi e localizzati che sono apparentemente dipendenti dall’orientamento sessuale. Ci sono diversi studi di neuroimaging funzionale, che affrontano le risposte corticali ai feromoni che sembrano essere dipendenti dall’orientamento sessuale; gli uomini omosessuali e i transessuali maschio-femmina sono stati trovati a mostrare la stessa via di attivazione delle donne eterosessuali, cioè dimostrando risposte ipotalamiche all’esposizione all’AND (Savic et al., 2005; Berglund et al., 2008).
Al contrario, Berglund e colleghi hanno concluso che le donne omosessuali elaborano l’AND in modo simile agli uomini eterosessuali, cioè da parti della corteccia olfattiva (Berglund et al., 2006). Questi risultati (Savic et al., 2005; Berglund et al., 2006, 2008), sono di grande importanza al fine di sottolineare le prove esistenti degli effetti dell’orientamento sessuale sull’elaborazione neurale anche in altre aree di ricerca. Recentemente, i risultati comportamentali e di neuroimaging di Perry et al. (2013) hanno mostrato che l’empatia è legata al genere, così come la preferenza sessuale. Inoltre, uno studio volto a caratterizzare l’omogeneità regionale e la connettività funzionale durante il riposo ha trovato differenze significative tra uomini omo ed eterosessuali (Hu et al., 2013). Quindi, sarebbe presuntuoso non considerare la possibilità di utilizzare questa variabile come un fattore modulante per ottenere gruppi di soggetti omogenei.
Inconsistenza AND-EST
Come notato in precedenza, AND viene elaborato in modo specifico per il genere; tuttavia, finora, pochi studi hanno affrontato gli aspetti funzionali oltre l’attività neurale. La maggior parte degli studi pubblicati che indagano l’effetto dell’AND sui processi neurali hanno incluso anche un altro potenziale feromone umano, ovvero l’estra-1,3,5(10),16-tetraen-3-olo (EST) (Savic et al., 2001, 2005, 2009; Berglund et al., 2006, 2008; Hillert et al., 2007; Ciumas et al., 2009). L’EST è stato, tra l’altro, rilevato come componente naturale dell’urina nelle donne in gravidanza (Thysen et al., 1968). È interessante notare che la somministrazione di questo steroide simile agli estrogeni provoca un effetto complementare all’AND. Mentre l’applicazione di AND ha causato un’attivazione ipotalamica nelle donne e l’attivazione di aree olfattive comuni negli uomini, EST viene elaborato in modo diametralmente opposto, cioè attraverso la via ipotalamica negli uomini eterosessuali e parti della corteccia olfattiva nelle donne eterosessuali (Savic et al., 2001, 2005, 2009; Berglund et al., 2006, 2008; Hillert et al., 2007; Ciumas et al., 2009). Questa relazione complementare sembra essere di grande rilevanza fisiologica.
Rispetto all’AND, le misure psicofisiologiche specifiche dell’EST sono in gran parte sconosciute. Tuttavia, mentre i risultati di Bensafi et al. (2003) non hanno rivelato alcun effetto dell’EST sull’eccitazione fisiologica, gli stessi autori hanno scoperto che l’EST influenza l’eccitazione fisiologica in modo dipendente dal contenuto (Bensafi et al., 2004). Esplorando la percezione cosciente degli odori di AND ed EST in un modello animale, un effetto specifico di genere è stato ottenuto da Laska et al. (2006), che hanno rilevato la sensibilità olfattiva all’AND nelle scimmie ragno femmine, ma non nei maschi, mentre le risposte alle più alte concentrazioni di EST sono state trovate nei maschi, ma non nelle femmine. Questi dati evidenziano anche l’elaborazione genere-specifica di questi due composti simili ai feromoni in modelli animali non umani. Infine, questi risultati indicano che c’è un notevole bisogno di ricerca sugli effetti psicofisiologici dell’EST.
Osservazioni finali
Come mostrato, l’applicazione non cosciente di AND media il comportamento umano, la psicofisiologia, così come l’elaborazione corticale, con risposte e attivazioni diverse negli uomini e nelle donne. Per quanto riguarda i risultati precedenti, l’influenza suggerita della condizione contestuale dovrebbe essere considerata in ogni ulteriore pianificazione di uno studio, così come nell’interpretazione e nella segnalazione dei risultati. Inoltre, le discrepanze nei risultati tra i vari studi sottolineano ulteriormente la necessità di ulteriori ricerche in questo settore, soprattutto nel campo dell’applicazione sotto e sopra soglia di AND per escludere potenziali effetti dipendenti dalla concentrazione. Inoltre, l’avvento dell’imaging chemiosensoriale tramite fMRI permette un’indagine più rigorosa e temporalmente dettagliata dell’elaborazione neurale di AND. Infine, come dimostrato dai risultati di neuroimaging presentati sopra, legati all’orientamento sessuale, bisogna fare attenzione a includere gruppi di soggetti omogenei o a controllare attentamente le caratteristiche demografiche. I meccanismi di mediazione di questi effetti specifici del sesso e delle preferenze sessuali sull’elaborazione comportamentale, psicofisiologica e neurale dell’AND dovrebbero costituire la base di ulteriori ricerche.
Dichiarazione di conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
Questa ricerca è stata sostenuta dalla FWF (Veronika Schöpf, Karl-Heinz Nenning, Kathrin Kollndorfer, Jacqueline Krajnik: P23205-B09; Jacqueline Krajnik: KLI 252; Karl-Heinz Nenning: P22578-B19) e dall’UE (Karl-Heinz Nenning: FP7-ICT-2009-5/257528). Johan N. Lundström è finanziato dalla Fondazione Knut e Alice Wallenberg (KAW 2012.0141).
Albrecht, J., Demmel, M., Schöpf, V., Kleemann, A. M., Kopietz, R., May, J., et al. (2011). Annusare i segnali chemiosensoriali dei maschi in condizione ansiosa rispetto a non ansiosa aumenta l’ansia di stato dei soggetti femminili. Chem. Senses 36, 19-27. doi: 10.1093/chemse/bjq087
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Bensafi, M., Brown, W. M., Khan, R., Levenson, B., e Sobel, N. (2004). Annusare composti derivati da steroidi sessuali umani modula l’umore, la memoria e la funzione del sistema nervoso autonomo in specifici contesti comportamentali. Behav. Brain Res. 152, 11-22. doi: 10.1016/j.bbr.2003.09.009
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Bensafi, M., Brown, W. M., Tsutsui, T., Mainland, J. D., Johnson, B. N., Bremner, E. A., et al. Composti derivati da steroidi sessuali inducono effetti sesso-specifici sulla funzione del sistema nervoso autonomo negli esseri umani. Behav. Neurosci. 117, 1125-1134. doi: 10.1037/0735-7044.117.6.1125
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Berglund, H., Lindström, P., Dhejne-Helmy, C., e Savic, I. (2008). Maschio a femmina transessuali mostrano sesso atipico attivazione ipotalamo quando odore di steroidi odorosi. Cereb. Cortex 18, 1900-1908. doi: 10.1093/cercor/bhm216
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Berglund, H., Lindström, P., e Savic, I. (2006). Risposta del cervello ai feromoni putativi in donne lesbiche. Proc. Natl. Acad. Sci. U.S.A. 103, 8269-8274. doi: 10.1073/pnas.0600331103
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Burke, S. M., Veltman, D. J., Gerber, J., Hummel, T., and Bakker, J. (2012). Uomini e donne eterosessuali mostrano una risposta ipotalamica al chemio-segnale androstadienone. PLoS ONE 7:e40993. doi: 10.1371/journal.pone.0040993
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Chamero, P., Leinders-Zufall, T., and Zufall, F. (2012). Dai geni alla comunicazione sociale: il rilevamento molecolare dell’organo vomeronasale. Trends Neurosci. 35, 597-606. doi: 10.1016/j.tins.2012.04.011
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ciumas, C., Lindén Hirschberg, A., e Savic, I. (2009). Alto testosterone fetale e reti cerebrali sessualmente dimorfici nelle femmine. Cereb. Cortex 19, 1167-1174. doi: 10.1093/cercor/bhn160
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Coffey, C. E., Lucke, J. F., Saxton, J. A., Ratcliff, G., Unitas, L. J., Billig, B., et al. Differenze di sesso nell’invecchiamento del cervello: uno studio quantitativo di risonanza magnetica. Arch. Neurol. 55, 169-179. doi: 10.1001/archneur.55.2.169
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Frasnelli, J., Lundström, J. N., Boyle, J. A., Katsarkas, A., and Jones-Gotman, M. (2011). L’organo vomeronasale non è coinvolto nella percezione di odori endogeni. Hum. Cervello Mapp. 32, 450-460. doi: 10.1002/hbm.21035
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Gelstein, S., Yeshurun, Y., Rozenkrantz, L., Shushan, S., Frumin, I., Roth, Y., et al. Lacrime umane contengono un chemosegnale. Scienza 331, 226-230. doi: 10.1126/science.1198331
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Grosser, B. I., Monti-Bloch, L., Jennings-White, C., e Berliner, D. L. (2000). Effetti comportamentali ed elettrofisiologici di androstadienone, un feromone umano. Psychoneuroendocrinology 25, 289-299. doi: 10.1016/S0306-4530(99)00056-6
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Hillert, L., Musabasic, V., Berglund, H., Ciumas, C., and Savic, I. (2007). Elaborazione degli odori nella sensibilità chimica multipla. Hum. Cervello Mapp. 28, 172-182. doi: 10.1002/hbm.20266
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Hu, S., Xu, D., Peterson, B. S., Peterson, B., Wang, Q., He, X., et al. Associazione di reti cerebrali in stato di riposo con la preferenza sessuale di uomini omosessuali: uno studio di omogeneità regionale e connettività funzionale. PLoS ONE 8:e59426. doi: 10.1371/journal.pone.0059426
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Hummer, T. A., e McClintock, M. K. (2009). Putative feromone umano androstadienone sintonizza la mente specificamente alle informazioni emotive. Horm. Behav. 55, 548-559. doi: 10.1016/j.yhbeh.2009.01.002
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Huoviala, P., and Rantala, M. J. (2013). Un feromone umano putativo, androstadienone, aumenta la cooperazione tra gli uomini. PLoS ONE 8:e62499. doi: 10.1371/journal.pone.0062499
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Jacob, S., Garcia, S., Hayreh, D., and McClintock, M. K. (2002). Effetti psicologici dei composti muschiati: confronto di androstadienone con androstenolo e muscone. Horm. Behav. 42, 274-283. doi: 10.1006/hbeh.2002.1826
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Jacob, S., Hayreh, D. J., e McClintock, M. K. (2001). Contesto-dipendente effetti di steroidi chemosignals sulla fisiologia umana e l’umore. Physiol. comportamento. 74, 15-27. doi: 10.1016/S0031-9384(01)00537-6
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Jacob, S., and McClintock, M. K. (2000). Stato psicologico e gli effetti sull’umore di chemiosegnali steroidei in donne e uomini. Horm. Behav. 37, 57-78. doi: 10.1006/hbeh.1999.1559
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Karlson, P., and Lüscher, M. (1959). Feromoni: un nuovo termine per una classe di sostanze biologicamente attive. Nature 183, 55-56. doi: 10.1038/183055a0
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kiyokawa, Y. (2004). Feromoni di allarme con diverse funzioni sono rilasciati da diverse regioni della superficie corporea dei ratti maschi. Chem. Senses 29, 35-40. doi: 10.1093/chemse/bjh004
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kiyokawa, Y., Shimozuru, M., Kikusui, T., Takeuchi, Y., e Mori, Y. (2006). Feromone di allarme aumenta comportamenti difensivi e di valutazione del rischio nei ratti maschi. Physiol. comportamento. 87, 383-387. doi: 10.1016/j.physbeh.2005.11.003
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Knecht, M., Witt, M., Abolmaali, N., Hüttenbrink, K. B., and Hummel, T. (2003). L’organo vomeronasale umano. Nervenarzt 74, 858-862. doi: 10.1007/s00115-003-1573-7
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Laska, M., Wieser, A., and Salazar, L. T. H. (2006). Differenze sesso-specifiche nella sensibilità olfattiva per feromoni putativi umani nei primati non umani. J. Comp. Psychol. 120, 106-112. doi: 10.1037/0735-7036.120.2.106
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lundström, J. N., Boesveldt, S., and Albrecht, J. (2011). Elaborazione centrale dei sensi chimici: una panoramica. ACS Chem. Neurosci. 2, 5-16. doi: 10.1021/cn1000843
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lundström, J. N., Boyle, J. A., Zatorre, R. J., e Jones-Gotman, M. (2008). Elaborazione funzionale neuronale di odori del corpo differisce da quella di simili odori comuni. Cereb. Cortex 18, 1466-1474. doi: 10.1093/cercor/bhm178
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lundström, J. N., Goncalves, M., Esteves, F., and Olsson, M. J. (2003). Effetti psicologici dell’esposizione sottosoglia al feromone umano putativo 4,16-androstadien-3-one. Horm. Behav. 44, 395-401. doi: 10.1016/j.yhbeh.2003.06.004
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lundström, J. N., McClintock, M. K., and Olsson, M. J. (2006a). Effetti dello stato riproduttivo sulla sensibilità olfattiva suggerire odore specificità. Biol. Psychol. 71, 244-247. doi: 10.1016/j.biopsycho.2005.07.001
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lundström, J. N., and Olsson, M. J. (2005). Quantità sottosoglia di odorante sociale influenzano l’umore, ma non il comportamento, in donne eterosessuali quando testato da un maschio, ma non una femmina, sperimentatore. Biol. Psychol. 70, 197-204. doi: 10.1016/j.biopsycho.2005.01.008
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lundström, J. N., and Olsson, M. J. (2010). Elaborazione neuronale funzionale degli odori del corpo umano. Vitam. Horm. 83, 1-23. doi: 10.1016/S0083-6729(10)83001-8
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lundström, J. N., Olsson, M. J., Schaal, B., and Hummel, T. (2006b). Un chemosignal putativo sociale suscita risposte corticali più veloci di odoranti percettivamente simili. Neuroimage 30, 1340-1346. doi: 10.1016/j.neuroimage.2005.10.040
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Melrose, D. R., Reed, H. C., and Patterson, R. L. (1971). Steroidi androgeni associati all’odore del cinghiale come aiuto per il rilevamento dell’estro nell’inseminazione artificiale del maiale. Br. Vet. J. 127, 497-502.
Pubmed Abstract | Pubmed Full Text
Meredith, M. (2001). Funzione dell’organo vomeronasale umano: una revisione critica dei casi migliori e peggiori. Chem. Senses 26, 433-445. doi: 10.1093/chemse/26.4.433
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Mielke, M. M., Vemuri, P., and Rocca, W. A. (2014). Epidemiologia clinica della malattia di Alzheimer: valutare le differenze di sesso e di genere. Clin. Epidemiol. 6, 37-48. doi: 10.2147/CLEP.S37929
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Parma, V., Tirindelli, R., Bisazza, A., Massaccesi, S., and Castiello, U. (2012). Gli odori percepiti subliminalmente modulano la competizione intrasessuale femminile: uno studio sui movimenti oculari. PLoS ONE 7:e30645. doi: 10.1371/journal.pone.0030645
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Pause, B. M. (2012). Elaborazione dei segnali di odore del corpo da parte del cervello umano. Chemosens. Percept. 5, 55-63. doi: 10.1007/s12078-011-9108-2
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Perry, D., Walder, K., Hendler, T., and Shamay-Tsoory, S. G. (2013). Il genere che sei e il genere che ti piace: preferenze sessuali e risposte neurali empatiche. Brain Res. 1534, 66-75. doi: 10.1016/j.brainres.2013.08.040
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Petrulis, A. (2013). Chemosegnali, ormoni e riproduzione dei mammiferi. Horm. Behav. 63, 723-741. doi: 10.1016/j.yhbeh.2013.03.011
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Porter, R. H., and Moore, J. D. (1981). Riconoscimento umano dei parenti tramite spunti olfattivi. Physiol. Behav. 27, 493-495. doi: 10.1016/0031-9384(81)90337-1
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Preti, G., Wysocki, C. J., Barnhart, K. T., Sondheimer, S. J., and Leyden, J. J. (2003). Estratti ascellari maschili contengono feromoni che influenzano la secrezione pulsatile dell’ormone luteinizzante e l’umore nelle donne destinatarie. Biol. Reprod. 68, 2107-2113. doi: 10.1095/biolreprod.102.008268
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Prokop-Prigge, K. A., Thaler, E., Wysocki, C. J., and Preti, G. (2014). Identificazione di composti organici volatili nel cerume umano. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 953-954. doi: 10.1016/j.jchromb.2014.01.043
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Sacher, J., Neumann, J., Okon-Singer, H., Gotowiec, S., e Villringer, A. (2013). Dimorfismo sessuale nel cervello umano: prove di neuroimaging. Magn. Reson. Imaging 31, 366-375. doi: 10.1016/j.mri.2012.06.007
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Savic, I., Berglund, H., Gulyas, B., and Roland, P. (2001). L’odore di composti odorosi simili agli ormoni sessuali causa attivazioni ipotalamiche differenziate per sesso negli esseri umani. Neuron 31, 661-668. doi: 10.1016/S0896-6273(01)00390-7
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Savic, I., Berglund, H., and Lindström, P. (2005). Risposta del cervello ai feromoni putativi negli uomini omosessuali. Proc. Natl. Acad. Sci. U.S.A. 102, 7356-7361. doi: 10.1073/pnas.0407998102
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Savic, I., Hedén-Blomqvist, E., and Berglund, H. (2009). Trasduzione del segnale dei feromoni nell’uomo: cosa si può imparare dalla perdita olfattiva. Hum. Brain Mapp. 30, 3057-3065. doi: 10.1002/hbm.20727
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Saxton, T. K., Lyndon, A., Little, A. C., and Roberts, S. C. (2008). La prova che androstadienone, un chemosegnale umano putativo, modula le attribuzioni delle donne di attrattiva degli uomini. Horm. Behav. 54, 597-601. doi: 10.1016/j.yhbeh.2008.06.001
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Sorge, R. E., Martin, L. J., Isbester, K. A., Sotocinal, S. G., Rosen, S., Tuttle, A. H., et al. (2014). L’esposizione olfattiva ai maschi, compresi gli uomini, provoca stress e analgesia correlata nei roditori. Nat. Methods 11, 629-632. doi: 10.1038/nmeth.2935
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Thorne, F., Neave, N., Scholey, A., Moss, M., e Fink, B. (2002). Effetti dei feromoni maschili putativi sulle valutazioni femminili di attrattiva maschile: influenza dei contraccettivi orali e il ciclo mestruale. Neuro Endocrinol. Lett. 23, 291-297.
Pubmed Abstract | Pubmed Full Text
Thysen, B., Elliott, W. H., e Katzman, P. A. (1968). Identificazione di estra-1,3,5(10),16-tetraen-3-olo (estratetraenolo) dalle urine di donne incinte (1). Steroidi 11, 73-87. doi: 10.1016/S0039-128X(68)80052-2
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Trotier, D. (2011). Organo vomeronasale e feromoni umani. Eur. Ann. Otorhinolaryngol. Head Neck Dis. 128, 184-190. doi: 10.1016/j.anorl.2010.11.008
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Trotier, D., Eloit, C., Wassef, M., Talmain, G., Bensimon, J. L., Døving, K. B., et al. (2000). La cavità vomeronasale negli esseri umani adulti. Chem. Senses 25, 369-380. doi: 10.1093/chemse/25.4.369
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Villemure, C., and Bushnell, M. C. (2007). Gli effetti dello steroide androstadienone e degli odori piacevoli sull’umore e sulla percezione del dolore di uomini e donne. Eur. J. Pain 11, 181-191. doi: 10.1016/j.ejpain.2006.02.005
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Wyart, C., Webster, W. W., Chen, J. H., Wilson, S. R., McClary, A., Khan, R. M., et al. (2007). Annusare un singolo componente del sudore maschile altera i livelli di cortisolo nelle donne. J. Neurosci. 27, 1261-1265. doi: 10.1523/JNEUROSCI.4430-06.2007
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Zeng, X. N., Leyden, J. J., Spielman, A. I., e Preti, G. (1996). Analisi degli odori ascellari femminili caratteristici: confronto qualitativo con i maschi. J. Chem. Ecol. 22, 237-257. doi: 10.1007/BF02055096
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Zernecke, R., Kleemann, A. M., Haegler, K., Albrecht, J., Vollmer, B., Linn, J., et al. Proprietà chemiosensoriali del sudore umano. Chem. Senses 35, 101-108. doi: 10.1093/chemse/bjp087
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Zhou, W., e Chen, D. (2008). Codifica di spunti chemosensoriali sessuali umani nella corteccia orbitofrontale e fusiforme. J. Neurosci. 28, 14416-14421. doi: 10.1523/JNEUROSCI.3148-08.2008
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Leave a Reply