Menu
ABOVE: © ISTOCK.COM, bodym
Kicsivel több mint 10 évvel ezelőtt, amikor Richard Smeyne neurobiológus a memphisi St. Jude Gyermekkutató Kórházban dolgozott, látott egy videót egy furcsán viselkedő kacsáról. A fehér tollú, narancssárga csőrű madár egy laoszi farmon állt kissé elkülönülve a nyájától. Körbe-körbe járkált és felcsapta az egyik szárnyát, majd elvesztette az egyensúlyát és leesett. Felállt, megpróbált mindkét szárnyával csapkodni, és újra elesett.
Smeyne akkor látta a videót, amikor részt vett egy szemináriumon, amelyet az akkori posztdoktor David Boltz és Boltz tanácsadója, egy Robert Webster nevű “influenzavadász” tartott, aki a kórház influenza-kutatási programját vezette. Boltz és Webster elmagyarázta, hogy a kacsa a H5N1 madárinfluenza vírusával volt fertőzött, amely 2006-ban és 2007-ben madarak ezreit betegítette meg és emberek százait ölte meg. Smeyne, aki a Parkinson-kór neurobiológiáját tanulmányozta egereken, felismerte az állat mozgásszervi problémáit. Ez a kacsa Parkinson-kóros, gondolta.
Ezt elmondta Websternek a szeminárium után, és Webster nevetett, emlékszik vissza Smeyne. “Azt mondta: ‘Hát, ez egy beteg madár'”. Smeyne azonban kíváncsi volt a kacsa abnormális viselkedésének hátterében álló idegi mechanizmusokra. Kíváncsi volt, hogy a laboratóriumban H5N1 vírussal megfertőzött egészséges kacsák is Parkinson-kórhoz hasonló neurodegenerációt mutatnának-e. A St. Jude 3-as biológiai biztonsági szintű laboratóriumában ő és kollégái kacsákat fertőztek meg a vírussal, majd feláldozták a madarakat, eltávolították az agyukat, és három hétig formaldehidben tárolták, hogy az aktív vírus elpusztuljon.
Amikor Smeyne elkezdte boncolni az egyszer már fertőzött kacsaagyakat, a substantia nigra nevű régióra összpontosított, amely gyakran károsodik a Parkinson-kóros betegeknél. “Amikor felnyitottam, amikor felvágtam az agyat, a substantia nigra elpusztult. Az összes neuron teljesen eltűnt” – mondja Smeyne. Visszament Websterhez, emlékszik vissza, és azt mondta: “Nem tévedtem. A kacsája valóban Parkinson-kóros.”
Az agynak azokban a részeiben idézett elő gyulladást és elhalást, amelyek a Parkinson-kórban degenerálódnak.
-Richard Smeyne,
Thomas Jefferson Egyetem
Mivel a madár influenzás volt, Smeyne azon tűnődött, hogy van-e kapcsolat a vírusfertőzés és a megfigyelt kiterjedt neurodegeneráció között. Megkérdezte Webstert a H5N1 vírussal fertőzött embereknél tapasztalt tünetekről. Webster válasza – az agy gyulladása, amely remegéshez és más motoros működési zavarokhoz vezet – nem hangzott “kifejlett Parkinson-kórnak”, mondja Smeyne, “de parkinsonizmus volt”, a betegség tüneteinek egy alcsoportja.
A szakirodalomban kutatva Smeyne további utalásokat talált az influenza agykárosító képességére. Az egyik legkorábbi kapcsolat az influenza és az idegi diszfunkció között az 1918-as spanyolnátha – amelyet egy H1N1 nevű altípus okozott – és a néhány évtizeddel későbbi Parkinson-járvány közötti összefüggés volt. Az 1940-es években és az 1950-es évek elején a neurodegeneratív betegség diagnózisa hirtelen növekedni látszott, az amerikai lakosság 1-2 százalékáról 2,5-3 százalékra, majd visszaesett 1-2 százalékra – mondja Smeyne. “Alapvetően azokban az években 50 százalékkal több ember kapott Parkinson-kórt.”
A bizonyíték arra, hogy az influenzafertőzés okozta a neurodegeneratív betegséget, enyhén szólva gyenge volt, de az összefüggés elég volt Smeyne számára ahhoz, hogy tovább vizsgálódjon. Kollégáival nem halálos dózisú H5N1 vagy H1N1 vírust lőtt fel hat-nyolc hetes egerek orrába, majd nyomon követte, hogyan terjednek a vírusok az állatok idegrendszerében. Az eredmények megdöbbentőek voltak, mondja: egyes vírusokat nem akadályozta meg a vér-agy gát – a központi idegrendszert a test keringésétől elválasztó félig áteresztő sejtréteg – az agyba való bejutást. A H5N1 például könnyen beszivároghatott az agy idegsejtjeibe és elpusztíthatta azokat, és úgy tűnt, hogy különösen a substantia nigra dopamin-termelő neuronjait veszi célba.1 És bár a H1N1 influenzatörzs nem tudott átjutni a vér-agy gáton, mégis a központi idegrendszer mikroglia nevű immunsejtjeit beáramoltatta a substantia nigrába és a hippokampuszba, gyulladást és sejthalált okozva a területen.2
“Tehát ez két különböző influenza volt, két különböző mechanizmus, de bizonyos értelemben ugyanaz a hatás” – mondja Smeyne, aki 2016-ban költözött a philadelphiai Thomas Jefferson Egyetemre. “Gyulladást és elhalást idéztek elő az agy azon részeiben, amelyeket a Parkinson-kórban degenerálódni látunk.”
Smeyne kísérletei nem az egyetlenek, amelyek arra utalnak, hogy a vírusfertőzések hozzájárulhatnak a neurodegeneratív rendellenességekhez, és a kapcsolat nem korlátozódik az influenzára. Több különböző vírus, köztük a kanyaró és a herpesz, például rágcsálókban a szklerózis multiplex (MS) tüneteit okozhatja.3 A herpeszvírus szintje pedig magasabb az Alzheimer-kórban elhunyt emberek agyában, mint a betegségben nem szenvedőkében,4 míg egyes HIV-betegeknél demencia alakul ki, amely a jelek szerint összefügg a fertőzéssel.
“A vírusokat gyakran figyelmen kívül hagyják a neurodegeneratív betegségekkel kapcsolatban” – mondja Anthony van den Pol, a Yale Egyetem neurobiológusa a The Scientistnek. “Ez részben azért van így, mert nincs egyértelmű jele annak, hogy egy vírus neurodegeneratív betegséget okoz. Pedig lehet.”
Betolakodás az agyba
Az európai orvosok már 1385-ben feljegyeztek összefüggéseket az influenzafertőzés és a pszichózis között. Az influenza és az agy közötti kapcsolat az 1918-as spanyolnátha járvány idején és után vált sokkal nyilvánvalóbbá. A vírus és az agy kapcsolatának közvetlenebb bizonyítékai az 1970-es években születtek, amikor Eugenia Gamboa, a Columbia Egyetem akkori neurológusa és munkatársai által vezetett kutatók vírusantigéneket találtak olyan elhunytak agyában, akiket az encephalitis lethargica nevű állapot sújtott.5 A lázzal, fejfájással és kettős látással járó encephalitis lethargica tünetei az 1918-as spanyolnáthához kapcsolódtak – és egyesek szerint az okozta -, és a kutatók feltételezték, hogy az állapot a Parkinson-kór előjele lehet. Aztán 1997-ben egy tudóscsoport arról számolt be, hogy a japán encephalitis vírusnak kitett patkányoknál az emberi Parkinson-kórhoz hasonló tünetekkel járó betegség alakult ki.6
A vírusfertőzés és az agyi betegségek közötti kapcsolatot azonban hevesen vitatják. És amikor a washingtoni Fegyveres Erők Patológiai Intézetének kutatói a 2000-es évek elején PCR segítségével a H1N1 genom töredékeit keresték az encephalitis lethargica áldozatainak konzervált agyszövetében, nem találták a vírus jeleit.7
Ez volt a kutatások állása, amikor Smeyne felfedezte a H5N1-fertőzött kacsák súlyos, Parkinson-kórhoz hasonló agykárosodását. Senki sem vizsgálta közvetlenül, hogy a vírus képes-e Parkinson-kórt okozni, amíg ő meg nem fertőzte az egereket H5N1 vírussal, és nem dokumentálta a substantia nigra súlyos károsodását. Eredményei egy lehetséges útvonalat is feltártak, amelyen a vírus a testből az agyba terjedhet. Smeyne szerint nem a substantia nigra volt a vírus eredeti célpontja; először a bélben lévő neuronokat fertőzte meg. “Ezután a vírus a nervus vagusba jutott, és alapvetően a nervus vagust használta hátsó ajtóként az agyba.”
Az átjutási útvonalak
Egyes vírusok az orron és a szájon keresztül juthatnak be a szervezetbe, és a szaglógumókon; a nyelvidegen, amely az állkapocsvonalban és a nyelvben fut végig; vagy a vagusidegen, amely a nyakon és a mellkason keresztül a gyomorba jut, szaporodva és terjedve jutnak el az agyba.

Az egyes kutatások azonban nem találtak kapcsolatot a vírusfertőzés és az agykárosodás között. Amikor például az amerikai Betegségellenőrzési és Megelőzési Központok kutatói Atlantában (Georgia) az 1918-as spanyolnátha-járványt okozó influenzatörzs hatásait vizsgálták, a fertőzött egerek agyában nem tapasztaltak gyulladásra utaló jeleket8. “További munkára van szükség a vírusfertőzés és a neurodegeneratív betegségek közötti kapcsolat kereséséhez” – mondja Terrence Tumpey mikrobiológus, az említett tanulmány társszerzője.
Smeyne gyanítja, hogy a vírusok és az agyközpontú betegségek közötti kapcsolat sokkal finomabb lehet. A H1N1 és a Parkinson-kór közötti kapcsolat további feltárása érdekében ő és kollégái egy MPTP nevű toxint adtak a vírusfertőzésből felépült egereknek. A vegyi anyag az 1970-es években főzött, rossz minőségű szintetikus heroin mellékterméke volt, amely a használóknál Parkinson-kór kialakulásához vezetett. Az MPTP-vel kezelt, H1N1 vírussal fertőzött egereknél a betegség jelei jelentkeztek, és 25 százalékkal több idegsejtet vesztettek el a substantia nigrában, mint a toxinnal kezelt, nem fertőzött egereknél vagy a vírussal fertőzött, de MPTP-nek nem kitett egereknél9.
“Ez azt sugallta számunkra”, mondja Smeyne, “hogy bár a H1N1-fertőzés önmagában nem okoz Parkinson-kórt, az idegrendszert arra készítette fel, hogy érzékennyé váljon más olyan dolgokra, amelyek ezt tennék.”
Tágabb kapcsolat a vírusok és a neurodegeneráció között
Az influenza-Parkinson-kór kapcsolat nem az egyetlen kapcsolat, amelyet a kutatók a vírusok és a neurológiai problémák között találtak. Az 1980-as évek végén és az 1990-es évek elején a kutatók megállapították, hogy az olyan vírusokkal, mint a kanyaró és a herpesz megfertőzött egerek ugyanolyan károsodást szenvedtek oligodendrocitáikban – a központi idegrendszerben lévő sejtekben, amelyek a mielint, az idegsejtek axonjai köré tekeredő szigetelő zsírhüvelyt termelik -, mint az SM-betegek. Nem világos, hogy a vírusok közvetlenül az oligodendrocitákba hatoltak-e be, vagy csak az egerek immunrendszerét provokálták a sejtek megtámadására, de a végeredmény az idegsejtek demyelinizációja lett, mondja van den Pol, éppúgy, mint ami az MS-betegeknél megfigyelhető.

Az egyik vírustörzs, amely az egerekben MS-tüneteket idézett elő, a 6-os herpeszvírus volt, amelyet az Alzheimer-kór kialakulásával is kapcsolatba hoztak. A vírusfertőzések és az Alzheimer-kór között az elmúlt évtizedekben már dokumentálták a feltételezett kapcsolatot, de a lehetőség tavaly újra felmerült, amikor Joel Dudley, a Mount Sinai Icahn School of Medicine munkatársa és kollégái agybankokból származó adatokat és publikált tanulmányokat áttekintve megállapították, hogy az Alzheimer-kórban szenvedő betegeknél négy kulcsfontosságú agyi régióban emelkedett a vírusok, például a humán herpeszvírus 6 és a humán herpeszvírus 7 szintje. A genetikai és proteomikai adatok alapján a kutatók azt is megállapították, hogy a humán herpeszvírus 6 olyan génexpressziót indukálhat, amely serkenti az amiloid β fehérje kialakulását, amely az Alzheimer-kór jellegzetességeinek számító plakkokat képez.4
Szem “Mikrobák váltják ki az Alzheimer-kórt?”.
Ez az összefüggés nem bizonyítja, hogy a vírusok okozzák a betegséget, de arra utal, hogy a kórokozók mégiscsak szerepet játszhatnak a neurodegeneratív betegségekben, mondja Dudley. “Az egyik dolog, ami ma más, mint a kórokozó-hipotézissel kapcsolatos korábbi elmélkedések, az az, hogy sokkal hatékonyabb szekvenálási módszerekkel rendelkezünk, amelyekkel elfogulatlanabb pillantást vethetünk az agyszövet mikrobiális DNS/RNS-tájképére” – mondja. “Valószínűleg még jobban meg fogjuk tudni vizsgálni ezt a kérdést, amint a hosszú leolvasású szekvenálási technológiát és az egysejtes szekvenálási technológiát alkalmazzuk az agyszövetmintákra”.”
A HIV egy másik vírus, amelyről a kutatók azt gyanítják, hogy Alzheimer- vagy Parkinson-kórhoz hasonló agykárosodást okozhat. Az 1990-es években a tudósok kimutatták, hogy a HIV képes áthatolni a vér-agy gáton, és a későbbi vizsgálatok kimutatták, hogy amikor a vírus beszivárog az agyba, az idegsejtek elhalását és a szinaptikus kapcsolatok elvesztését serkenti.10 Újabban az orvosok olyan HIV-fertőzött betegekről számolnak be, akiknél demencia és az Alzheimer-kóros betegeknél megfigyelhető agyi anyagvesztés alakul ki, magyarázza Sara Salinas, a franciaországi Montpellier Egyetem patológusa és virológusa és munkatársai a Frontiers in Cellular Neuroscience című szakfolyóirat 2018-as áttekintő cikkében.11 Újabb vizsgálatok azt mutatják, hogy a HIV-betegeknél amiloid β plakkok alakulnak ki. Smeyne szerint pedig a HIV-betegeknél a mozgás lassúsága és remegés is kialakulhat.
A vér-agy gáton való átjutás
Az idegrendszerrel való kölcsönhatás során a vírusrészecskék közvetlenül vagy az endotélsejtek fertőzésével átjuthatnak a vér-agy gáton (lent balra), vagy trójai faló megközelítést alkalmazhatnak (középen), megfertőzve a gáton átjutó monocitákat, mielőtt a fehérvérsejtekből szaporodnak és kirobbannak, amint az agyban vannak. Alternatív megoldásként egyes vírusok nem lépik át a vér-agy gátat, de olyan immunválaszt idéznek elő, amely citokineket vagy kemokineket sarkallhat a válaszfal áttörésére (jobbra).

A neuronális kommunikáció módozatainak közelebbi vizsgálata nyomokat adhat a neurodegeneratív betegségek kialakulásához. Az év elején két tudóscsoport arról számolt be, hogy a neuronok amellett, hogy elektromos és kémiai jeleket használnak egymás közötti kommunikációjukhoz, extracelluláris vezikulákat is alkalmaznak, amelyek hírvivő RNS-t hordoznak.12,13 E vezikulák szerkezete emlékeztet arra, ahogyan a HIV és más retrovírusok védőburkot, úgynevezett kapszidokat építenek, amelyek a vírus genetikai anyagát sejtről sejtre szállítják – mondja Jason Shepherd, a Utahi Egyetem idegkutatója és az egyik tanulmány társszerzője. Szerinte a hólyagocskákat kódoló gének esetleg korábbi fertőzésekből származó maradványok lehetnek, és ezek a vírusokat utánzó kapszidok toxikus fehérjéket, például amiloid β-t rejthetnek magukban és terjeszthetik azokat az egész agyban.
“Nyilvánvaló, hogy a vírusok befolyásolják az agyat” – mondja Shepherd, de ennek a kapcsolatnak a természete továbbra is tisztázatlan.”
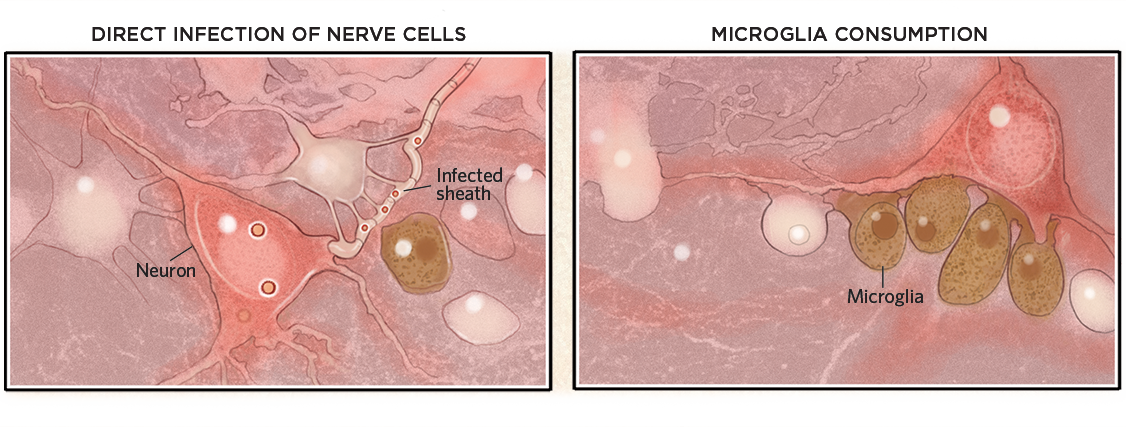
Agykárosodás
Az agyban a vírusok megfertőzhetik a sejteket vagy azok mielinhüvelyét, és elpusztíthatják azokat (lent, balra). A vírusoknak azonban nem feltétlenül kell az agyba jutniuk ahhoz, hogy kárt okozzanak. Olyan immunválaszt is kiválthatnak, amely aktiválja a mikrogliát, amely aztán felemészti az egyébként egészséges neuronokat (jobbra).
A felejtés megmarad
A vírusfertőzésre adott agyi reakciók megértésének egyik kihívása az, hogy a hatások még sokáig fennmaradhatnak, miután immunrendszerünk kiürítette a fertőzést a szervezetünkből. Az év elején például Martin Korte, a németországi Technische Universität Braunschweig munkatársa és kollégái arról számoltak be, hogy az influenzavírus bizonyos törzseivel megfertőzött egerek agyában memóriazavarok jelentkeztek még azután is, hogy látszólag meggyógyultak. Kiderült, hogy az agyuk még 30-60 nappal az első fertőzés után is tele volt mikrogliával.14 A mikroglia szintje a fertőzést követő 60 nap körül kezdhet visszaállni a normális tartományba, a fiatal egerek neuronjai pedig teljesen helyreálltak, az állatok memóriateljesítményével együtt. Mégis, a mikroglia száma akár 120 napig is emelkedett maradhat, mondja Korte a The Scientistnek; ez emberi időszámítás szerint több mint 10 évnek felel meg.
Van den Pol szerint éppen az ilyen késés az, amiért a tudósok nehezen fogadják el, hogy a vírusok neurodegeneratív betegségeket okozhatnak. “A tudományban gyakran úgy gondoljuk, hogy valamilyen ok és okozat gyakran ezredmásodpercek” – mondja. “Itt évtizedekről beszélünk. A vírus bemegy, majd talán évtizedekkel később potenciálisan súlyos neurodegenerációt okozhat” – egy ilyen hosszú távú kapcsolatot nehéz bizonyítani.”
A tudományban gyakran gondolunk arra, hogy valamilyen ok és hatás gyakran ezredmásodpercek. Itt évtizedekről van szó.”
-Anthony van den Pol,
Yale Egyetem
Ha a vírusfertőzések és a neurológiai problémák közötti kapcsolatot konkrétabban meg lehet állapítani, a kutatók talán képesek lesznek olyan módszereket kidolgozni, amelyekkel enyhíthetők a neurológiai hatások, mondja van den Pol. Annak megértése, hogy a fertőzések hogyan váltják ki az immunrendszert, például olyan módszerekhez vezethet, amelyekkel a glia által vezérelt gyulladást le lehet szabályozni a hosszú távú károsodás megelőzésének reményében – javasolja.
Addig is Smeyne megjegyzi, hogy az influenza elleni védőoltás – vagy legalábbis a Tamiflu szedése, ha valaki megfertőződik – segíthet megelőzni az influenzafertőzés neurológiai szövődményeit. Ő és kollégái egereken tesztelték ezt a megközelítést, miután eredményeik kimutatták az influenza, az MPTP toxin és a Parkinson-kór közötti kapcsolatot. A kutatócsoport egerek egy csoportjának 30 nappal azelőtt adott H1N1 vakcinát, hogy az állatokat megfertőzték volna a vírussal. Az egerek egy másik csoportját a fertőzést követő héten Tamifluval kezelték. Mindkét egércsoportnak hagyták, hogy felépüljön, mielőtt alacsony dózisú MPTP-t kaptak volna. Míg a kontroll egereknél, amelyek sem a vakcinát, sem az influenzakezelést nem kapták meg, Parkinson-kórhoz hasonló tünetek alakultak ki, a kezelt egereknél nem alakultak ki neurodegeneratív hatások. “Csak a vakcinával való korai kezeléssel vagy profilaktikus kezeléssel védekeztünk” – mondja Smeyne.”
Ez újabb bizonyíték arra, hogy a vírusfertőzések károsíthatják az agyat, mondja Smeyne, de még mindig nincs olyan slam-dunk tanulmány, amely bizonyítja, hogy egy vírus okozhatja a Parkinson-kórt, vagy az Alzheimer-kórt, vagy bármely más neurológiai rendellenességet. “Nekem tetszik az az elképzelés, hogy a vírusok számos különböző agyi betegséget okozhatnak, mint hipotézis” – mondja van den Pol. “De azt is tiszteletben tartom, hogy ez tényleg csak egy hipotézis.”
- H. Jang et al., “Highly pathogenic H5N1 influenza virus can enter the central nervous system and induce neuroinflammation and neurodegeneration,” PNAS, 106:14063-68, 2009.
- S. Sadasivan et al., “Induction of microglia activation after infection with the non-neurotropic A/CA/04/2009 H1N1 influenza virus,” PLOS ONE, 10:e0124047, 2015.
- U.G. Liebert, V. ter Meulen. “Virological aspects of measles virus-induced encephalomyelitis in Lewis and BN rats,” J Gen Virol, 68:1715-22, 1987.
- B. Readhead et al., “Multiscale analysis of independent Alzheimer’s cohorts finds disruption of molecular, genetic, and clinical networks by human herpesvirus,” Neuron, 99:64-82.e7, 2018.
- E.T. Gamboa et al., “Influenza virus antigen in postencephalitic parkinsonism brain. Detection by immunofluorescence,” Arch Neurol, 31:228-32, 1974.
- A. Ogata et al., “A rat model of Parkinson’s disease induced by Japanese encephalitis virus,” J Neurovirol, 3:141-47, 1997.
- S. McCall et al., “Influenza RNS not detected in archival brain tissues from acute encephalitis lethargica cases or in postencephalitic Parkinson cases,” J Neuropathol Exp Neurol, 60:696-704, 2001.
- J.C. Kash et al., “Genomic analysis of increased host immune and cell death responses induced by 1918 influenza virus,” Nature, 443:578-81, 2006.
- S. Sadasivan et al., “Az influenza és az 1-metil-4-fenil-1,2,3,6-tetrahidropiridin (MPTP) szinergista hatásai kiküszöbölhetők influenza terápiás szerek alkalmazásával: Experimental evidence for the multi-hit hypothesis,” NPJ Parkinsons Dis, 3:18, 2017.
- S. Peudenier et al., “HIV receptorok az agyban: a CD4 és az MHC-II vizsgálata emberi neuronokon, asztrocitákon és mikroglia sejteken,” Res Virol, 142:145-49, 1991.
- G. Canet et al., “HIV neuroinfekció és Alzheimer-kór: Similarities and potential links?” Front Cell Neurosci, 12:307, 2018.
- E.D. Pastuzyn et al., “The neuronal gene Arc encodes a repurposed retrotransposon gag protein that mediates intercellular RNA transfer,” Cell, 172:P275-88.E18, 2018.
- J. Ashley et al., “Retrovirus-like gag protein Arc1 binds RNS and traffics across synaptic boutons,” Cell, 172:P262-74.E11, 2018.
- S. Hosseini et al., “Long-term neuroinflammation induced by influenza A virus infection and the impact on hippocampal neuron morphology and function,” J Neurosci, 38:3060-80, 2018.
Leave a Reply