Menu
ABOVE : © ISTOCK.COM, bodym
Il y a un peu plus de 10 ans, alors que le neurobiologiste Richard Smeyne travaillait à l’hôpital de recherche pour enfants St. Jude à Memphis, il a vu une vidéo d’un canard agissant de façon étrange. L’oiseau au bec orange et aux plumes blanches se tenait légèrement à l’écart de son troupeau dans une ferme du Laos. Il tournait en rond et levait une aile, puis il a perdu l’équilibre et est tombé. Il s’est relevé, a essayé de battre des deux ailes et est retombé.
Smeyne a vu la vidéo alors qu’il assistait à un séminaire donné par David Boltz, alors post-doc, et le conseiller de Boltz, un « chasseur de grippe » nommé Robert Webster, qui dirigeait le programme de recherche sur la grippe à l’hôpital. Le canard, ont expliqué Boltz et Webster, était infecté par le virus H5N1 de la grippe aviaire qui avait rendu malades des milliers d’oiseaux et tué des centaines de personnes en 2006 et 2007. M. Smeyne, qui avait étudié la neurobiologie de la maladie de Parkinson chez la souris, a reconnu les problèmes moteurs de l’animal. Ce canard a la maladie de Parkinson, pensa-t-il.
Il a raconté cela à Webster après le séminaire, et Webster a ri, se souvient Smeyne. « Il a dit : « Eh bien, c’est un oiseau malade ». Mais Smeyne était curieux de connaître les mécanismes neuronaux qui sous-tendent le comportement anormal du canard. Il s’est demandé si des canards sains infectés par le virus H5N1 en laboratoire présenteraient une neurodégénérescence de type Parkinson. Dans le laboratoire de niveau de biosécurité 3 de St. Jude, lui et ses collègues ont infecté des canards avec le virus, puis ont sacrifié les oiseaux et retiré leurs cerveaux, les stockant dans du formaldéhyde pendant trois semaines pour tuer le virus actif.
Lorsque Smeyne a commencé à disséquer les cerveaux de canards une fois infectés, il s’est concentré sur une région appelée la substantia nigra, qui est souvent endommagée chez les patients atteints de Parkinson. « Quand je l’ai ouvert, quand j’ai coupé le cerveau, la substantia nigra était dévastée. Tous les neurones avaient complètement disparu », raconte Smeyne. Il est retourné voir Webster, se souvient-il, et lui a dit : « Je n’avais pas tort. Votre canard a bien la maladie de Parkinson. »
Ils induisaient une inflammation et une mort dans les parties du cerveau que nous voyons dégénérer dans la maladie de Parkinson.
-Richard Smeyne,
Université Thomas Jefferson
Parce que l’oiseau avait eu la grippe, Smeyne s’est demandé s’il y avait un lien entre l’infection virale et la neurodégénérescence étendue qu’il a observée. Il a demandé à Webster quels étaient les symptômes ressentis par les personnes infectées par le H5N1. La réponse de Webster – une inflammation du cerveau qui entraîne des tremblements et d’autres dysfonctionnements moteurs – ne ressemblait pas à « une maladie de Parkinson à part entière », dit Smeyne, « mais c’était du parkinsonisme », un sous-ensemble de symptômes de la maladie.
En se penchant sur la littérature, Smeyne a trouvé d’autres indices de la capacité de la grippe à endommager le cerveau. L’un des premiers liens entre la grippe et le dysfonctionnement neuronal a été une corrélation entre la grippe espagnole de 1918, causée par un sous-type appelé H1N1, et une épidémie de Parkinson quelques décennies plus tard. Dans les années 1940 et au début des années 1950, les diagnostics de cette maladie neurodégénérative ont semblé augmenter brusquement, passant de 1 à 2 % de la population américaine à 2,5 à 3 %, avant de retomber à 1 ou 2 %, explique M. Smeyne. « En gros, 50 % de personnes en plus ont eu la maladie de Parkinson au cours de ces années-là. »
Les preuves suggérant que l’infection par la grippe causait la maladie neurodégénérative étaient pour le moins ténues, mais la corrélation était suffisante pour que Smeyne approfondisse ses recherches. Avec ses collègues, il a injecté des doses non létales de H5N1 ou de H1N1 dans le nez de souris âgées de six à huit semaines, puis a suivi la propagation des virus dans le système nerveux des animaux. Les résultats ont été surprenants, dit-il : certains virus n’ont pas été empêchés de pénétrer dans le cerveau par la barrière hémato-encéphalique – une couche semi-perméable de cellules qui sépare le système nerveux central de la circulation du corps. Le virus H5N1, par exemple, pouvait facilement infiltrer les cellules nerveuses du cerveau et les tuer, et il semblait cibler particulièrement les neurones producteurs de dopamine dans la substantia nigra.1 Et si la souche de grippe H1N1 ne pouvait pas traverser la barrière hémato-encéphalique, elle a tout de même provoqué l’afflux de cellules immunitaires du système nerveux central, appelées microglies, dans la substantia nigra et l’hippocampe, provoquant une inflammation et la mort des cellules dans cette zone2.
« Il s’agissait donc de deux flus différents, de deux mécanismes différents, mais du même effet en un sens », explique Smeyne, qui a rejoint l’université Thomas Jefferson de Philadelphie en 2016. « Ils induisaient l’inflammation et la mort dans les parties du cerveau que nous voyons dégénérer dans la maladie de Parkinson. »
Les expériences de Smeyne ne sont pas les seules à suggérer que les infections virales peuvent contribuer aux troubles neurodégénératifs, et le lien ne se limite pas à la grippe. Plusieurs virus différents, dont celui de la rougeole et de l’herpès, peuvent donner lieu à des symptômes de sclérose en plaques (SEP) chez les rongeurs, par exemple.3 Et les niveaux d’herpèsvirus sont plus élevés dans le cerveau des personnes décédées de la maladie d’Alzheimer que chez celles qui n’en sont pas atteintes,4 tandis que certains patients séropositifs développent une démence qui semble être associée à l’infection.
« Les virus sont souvent ignorés en ce qui concerne les maladies neurodégénératives », explique le neurobiologiste Anthony van den Pol de l’université de Yale à The Scientist. « C’est en partie parce qu’il n’y a pas de signe clair qu’un virus cause une maladie neurodégénérative. Mais c’est possible. »
Invasion du cerveau
Dès 1385, des médecins européens ont enregistré des connexions entre l’infection par la grippe et la psychose. Ce lien entre la grippe et le cerveau est devenu beaucoup plus évident pendant et après l’épidémie de grippe espagnole de 1918. Des preuves plus directes du lien entre virus et cerveau ont été apportées dans les années 1970, lorsque des chercheurs dirigés par Eugenia Gamboa, alors neurologue à l’université Columbia, et ses collègues ont découvert des antigènes viraux dans le cerveau de personnes décédées qui avaient été atteintes d’une maladie connue sous le nom d’encéphalite léthargique.5 Présentant des symptômes tels que fièvre, maux de tête et vision double, l’encéphalite léthargique était associée à la grippe espagnole de 1918 – et, selon certains, causée par elle – et les chercheurs ont émis l’hypothèse que cette maladie pouvait être un précurseur des symptômes de la maladie de Parkinson. Puis, en 1997, une équipe de scientifiques a signalé que des rats exposés au virus de l’encéphalite japonaise avaient développé une maladie dont les symptômes étaient similaires à ceux de la maladie de Parkinson chez l’homme.6
Mais le lien entre l’infection virale et la maladie cérébrale a été vivement contesté. Et lorsque des chercheurs de l’Institut de pathologie des forces armées à Washington, DC, ont utilisé la PCR pour rechercher des fragments du génome H1N1 dans le tissu cérébral préservé des victimes de l’encéphalite léthargique au début des années 2000, ils n’ont trouvé aucun signe du virus.7
C’était l’état de la recherche lorsque Smeyne a découvert les graves lésions cérébrales de type Parkinson chez les canards infectés par le H5N1. Personne n’avait testé directement la capacité du virus à provoquer la maladie de Parkinson jusqu’à ce que Smeyne infecte des souris avec le virus H5N1 et documente de graves dommages à la substantia nigra. Ses résultats ont également révélé une voie possible de propagation du virus de l’organisme au cerveau. Selon M. Smeyne, la substantia nigra n’était pas la cible initiale du virus, qui a d’abord infecté les neurones de l’intestin. « Ensuite, le virus est allé dans le nerf vague et a essentiellement utilisé le nerf vague comme une porte dérobée vers le cerveau. »
Routes de passage
Certains virus peuvent pénétrer dans l’organisme par le nez et la bouche et se diriger vers le cerveau en se répliquant et en se propageant par les bulbes olfactifs ; le nerf lingual, qui descend le long de la mâchoire et pénètre dans la langue ; ou le nerf vague, qui traverse le cou et le thorax jusqu’à l’estomac.

Le schéma est étonnamment similaire à la façon dont la maladie de Parkinson semble se frayer un chemin dans le corps humain, dit Smeyne. Selon une hypothèse largement acceptée, proposée pour la première fois par le neuropathologiste allemand Heiko Braak en 2003, la maladie de Parkinson commence dans l’intestin, se manifestant par des problèmes digestifs, puis se déplace vers le cerveau. « La progression de la maladie de l’intestin au cerveau antérieur s’étale sur 25 ou 30 ans chez l’homme », explique M. Smeyne. Mais les souris vivent beaucoup moins longtemps. Chez les rongeurs, le virus de la grippe peut suivre le même parcours et créer les signes de la maladie de Parkinson en quelques semaines, note-t-il. Et comme Smeyne et ses collègues l’ont constaté avec les souris infectées par le H1N1, les virus incapables de pénétrer dans le cerveau peuvent tout de même jouer un rôle dans la neurodégénérescence, en déclenchant une inflammation sévère.
Certaines recherches n’ont cependant pas réussi à trouver un lien entre l’infection virale et les dommages au cerveau. Par exemple, lorsque des chercheurs des Centres américains de contrôle et de prévention des maladies d’Atlanta, en Géorgie, ont étudié les effets de la souche grippale à l’origine de l’épidémie de grippe espagnole de 1918, ils n’ont constaté aucun signe d’inflammation dans le cerveau des souris infectées8. « D’autres travaux sont nécessaires pour rechercher un lien entre l’infection virale et les maladies neurodégénératives », déclare le microbiologiste Terrence Tumpey, coauteur de cette étude.
Smeyne soupçonne que le lien entre les virus et les maladies centrées sur le cerveau pourrait être plus subtil. Pour explorer plus avant la relation entre le H1N1 et la maladie de Parkinson, lui et ses collègues ont administré une toxine appelée MPTP à des souris qui s’étaient remises d’une infection par le virus. Cette substance chimique est un sous-produit d’un mauvais lot d’héroïne synthétique fabriqué dans les années 1970, qui a conduit les consommateurs à développer la maladie de Parkinson. Les souris traitées au MPTP qui avaient été infectées par le H1N1 ont développé des signes de la maladie et ont perdu 25 % de neurones en plus dans la substantia nigra que les souris non infectées traitées avec la toxine ou les souris infectées par le virus mais non exposées au MPTP9.
« Cela nous a suggéré », dit Smeyne, « que si l’infection par le H1N1 n’a pas causé à elle seule la maladie de Parkinson, elle a amorcé le système nerveux pour qu’il soit sensible à d’autres choses qui le feraient. »
Un lien plus large entre les virus et la neurodégénérescence
Le lien entre la grippe et la maladie de Parkinson n’est pas le seul lien que les chercheurs ont établi entre les virus et les problèmes neurologiques. À la fin des années 1980 et au début des années 1990, les chercheurs ont constaté que les souris infectées par des virus tels que la rougeole et l’herpès subissaient le même type de dommages à leurs oligodendrocytes – cellules du système nerveux central qui produisent la myéline, la gaine grasse isolante enveloppant les axones des neurones – que les patients atteints de SEP. On ne sait pas si les virus ont envahi les oligodendrocytes directement ou s’ils ont simplement provoqué le système immunitaire des souris pour qu’il attaque les cellules, mais le résultat final a été une démyélinisation des neurones, selon van den Pol, tout comme ce que l’on observe chez les patients atteints de SEP.

L’une des souches virales qui a induit les symptômes de la SEP chez les souris était l’herpèsvirus 6, qui a également été associé au développement de la maladie d’Alzheimer. Des liens ténus entre les infections virales et la maladie d’Alzheimer ont été documentés au cours des dernières décennies, mais cette possibilité est réapparue l’année dernière lorsque Joel Dudley, de la Icahn School of Medicine de Mount Sinai, et ses collègues, en examinant les données des banques de cerveaux et des études publiées, ont découvert que les patients atteints de la maladie d’Alzheimer présentaient des niveaux élevés de virus, tels que l’herpèsvirus humain 6 et l’herpèsvirus humain 7, dans quatre régions clés du cerveau. En se basant sur des données génétiques et protéomiques, les chercheurs ont également découvert que l’herpèsvirus humain 6 pouvait induire une expression génétique qui stimule le développement de la protéine amyloïde β, qui forme des plaques caractéristiques de la maladie d’Alzheimer.4
Voir « Les microbes déclenchent-ils la maladie d’Alzheimer ? ».
Une telle corrélation ne prouve pas que les virus causent la maladie, mais elle suggère que les agents pathogènes peuvent jouer un rôle dans les maladies neurodégénératives après tout, dit Dudley. « Une chose qui est différente aujourd’hui par rapport aux précédentes réflexions sur l’hypothèse de l’agent pathogène, c’est que nous disposons de méthodes de séquençage beaucoup plus puissantes qui permettent de jeter un regard plus objectif sur le paysage microbien ADN/ARN du tissu cérébral », dit-il. « Il est probable que nous obtiendrons un regard encore meilleur sur cette question lorsque nous appliquerons la technologie de séquençage à long terme et la technologie de séquençage unicellulaire aux échantillons de tissu cérébral. »
Le VIH est un autre virus que les chercheurs soupçonnent de pouvoir provoquer des lésions cérébrales de type Alzheimer ou Parkinson. Dans les années 1990, les scientifiques ont montré que le VIH pouvait traverser la barrière hémato-encéphalique, et des études ultérieures ont révélé que lorsque le virus s’infiltre dans le cerveau, il stimule la mort neuronale et la perte de connexions synaptiques.10 Plus récemment, les médecins ont commencé à faire état de patients séropositifs qui développent une démence et une perte de matière cérébrale reflétant ce qui est observé chez les patients atteints de la maladie d’Alzheimer, expliquent Sara Salinas, pathologiste et virologue à l’Université de Montpellier en France, et ses collègues dans un article de synthèse publié en 2018 dans Frontiers in Cellular Neuroscience.11 Des études plus récentes montrent que les patients séropositifs développent des plaques d’amyloïde β. Et, selon Smeyne, les patients séropositifs peuvent également développer une lenteur dans les mouvements et des tremblements.
Traverser la barrière hémato-encéphalique
Lorsqu’elles interagissent avec le système nerveux, les particules virales peuvent traverser la barrière hémato-encéphalique directement ou par l’infection des cellules endothéliales (ci-dessous, à gauche), ou elles peuvent utiliser une approche de cheval de Troie (au centre), en infectant les monocytes qui traversent la barrière avant de se répliquer et d’éclater des globules blancs une fois dans le cerveau. Sinon, certains virus ne traversent pas la barrière hémato-encéphalique mais invoquent une réponse immunitaire qui peut inciter les cytokines ou les chimiokines à franchir la cloison (à droite).

Un examen plus approfondi des modes de communication neuronale pourrait donner quelques indices sur le développement des maladies neurodégénératives. En début d’année, deux groupes de scientifiques ont rapporté qu’en plus d’utiliser des signaux électriques et chimiques pour communiquer entre eux, les neurones utilisent des vésicules extracellulaires transportant des ARN messagers.12,13 La structure de ces vésicules rappelle la façon dont le VIH et d’autres rétrovirus construisent des enveloppes protectrices appelées capsides qui transportent le matériel génétique du virus de cellule en cellule, explique Jason Shepherd, neuroscientifique à l’Université de l’Utah et coauteur de l’une des études. Les gènes codant pour les vésicules pourraient éventuellement être des reliquats d’infections passées, suggère-t-il, et ces capsides imitant les virus pourraient héberger des protéines toxiques, comme l’amyloïde β, et les répandre dans le cerveau.
« Il est clair que les virus influencent le cerveau », dit Shepherd, mais la nature de cette relation reste floue.
Les lésions cérébrales
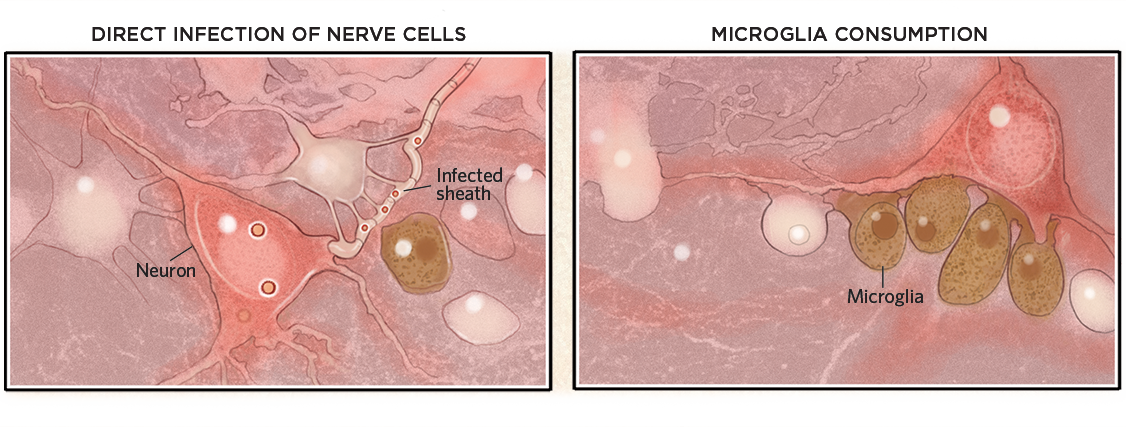
Une fois à l’intérieur du cerveau, les virus peuvent infecter les cellules ou leurs gaines de myéline et les tuer (ci-dessous, à gauche). Mais les virus ne doivent pas nécessairement pénétrer dans le cerveau pour causer des dommages. Ils peuvent également déclencher une réponse immunitaire qui active la microglie, qui consomme alors des neurones autrement sains (à droite).
L’oubli persiste
Un défi pour comprendre comment le cerveau répond à une infection virale est que les effets peuvent persister longtemps après que notre système immunitaire ait éliminé l’infection de notre corps. Au début de l’année, par exemple, Martin Korte, de la Technische Universität Braunschweig, en Allemagne, et ses collègues ont signalé que le cerveau de souris infectées par certaines souches du virus de la grippe présentait des déficits de mémoire, même après une guérison apparente. Il s’est avéré que leur cerveau était plein de microglie même 30 à 60 jours après le début de l’infection.14 Les niveaux de microglie peuvent commencer à revenir à la normale environ 60 jours après l’infection, et les neurones des jeunes souris se rétablissent complètement, ainsi que les performances de mémoire des animaux. Pourtant, le nombre de microglies peut rester élevé jusqu’à 120 jours, explique Korte à The Scientist ; cela équivaut à plus de 10 ans chez l’homme.
Van den Pol affirme qu’un tel décalage est exactement la raison pour laquelle les scientifiques ont du mal à accepter que des virus puissent causer des maladies neurodégénératives. « En science, nous pensons souvent que certaines causes et certains effets sont souvent des millisecondes », dit-il. « Ici, on parle de décennies. Le virus entre et puis peut-être des décennies plus tard, il peut causer une neurodégénérescence potentiellement grave »- un tel lien à long terme est difficile à démontrer.
En science, nous pensons souvent que certaines causes et certains effets sont souvent des millisecondes. Ici, vous parlez de décennies.
-Anthony van den Pol,
Yale University
Si le lien entre les infections virales et les problèmes neurologiques peut être plus concrètement établi, les chercheurs pourraient être en mesure de développer des moyens d’atténuer les effets neurologiques, dit van den Pol. Comprendre comment les infections déclenchent le système immunitaire, par exemple, pourrait conduire à des moyens de réguler à la baisse l’inflammation induite par la glie dans l’espoir de prévenir les dommages à long terme, suggère-t-il.
En attendant, Smeyne note que la vaccination contre la grippe – ou à tout le moins, la prise de Tamiflu si une personne est infectée – pourrait aider à prévenir les complications neurologiques de l’infection grippale. Lui et ses collègues ont testé cette approche chez la souris après que leurs résultats aient révélé le lien entre la grippe, la toxine MPTP et la maladie de Parkinson. L’équipe a administré à un groupe de souris un vaccin H1N1 30 jours avant d’infecter les animaux avec le virus. Un autre groupe de souris a été traité au Tamiflu pendant la semaine suivant l’infection. On a laissé les deux groupes de souris se rétablir avant de leur administrer une faible dose de MPTP. Alors que les souris témoins qui n’ont reçu ni le vaccin ni le traitement contre la grippe ont développé des symptômes semblables à ceux de la maladie de Parkinson, les souris traitées n’ont développé aucun effet neurodégénératif. « Nous avions protégé contre juste par un traitement précoce ou un traitement prophylactique avec le vaccin », dit Smeyne.
C’est une preuve supplémentaire pour soutenir l’idée que les infections virales peuvent endommager le cerveau, dit Smeyne, mais il n’y a toujours pas d’étude slam-dunk qui démontre qu’un virus peut causer Parkinson, ou Alzheimer, ou un certain nombre d’autres troubles neurologiques. « J’aime l’idée que les virus puissent causer un grand nombre de maladies cérébrales différentes en tant qu’hypothèse », déclare M. van den Pol. « Mais je respecte aussi le fait qu’il s’agit vraiment d’une hypothèse. »
- H. Jang et al, « Highly pathogenic H5N1 influenza virus can enter the central nervous system and induce neuroinflammation and neurodegeneration, » PNAS, 106:14063-68, 2009.
- S. Sadasivan et al, « Induction of microglia activation after infection with the non-neurotropic A/CA/04/2009 H1N1 influenza virus, » PLOS ONE, 10:e0124047, 2015.
- U.G. Liebert, V. ter Meulen. « Aspects virologiques de l’encéphalomyélite induite par le virus de la rougeole chez les rats Lewis et BN », J Gen Virol, 68:1715-22, 1987.
- B. Readhead et al, « Multiscale analysis of independent Alzheimer’s cohorts finds disruption of molecular, genetic, and clinical networks by human herpesvirus, » Neuron, 99:64-82.e7, 2018.
- E.T. Gamboa et al, « Influenza virus antigen in postencephalitic parkinsonism brain. Détection par immunofluorescence », Arch Neurol, 31:228-32, 1974.
- A. Ogata et al, « Un modèle de rat de la maladie de Parkinson induite par le virus de l’encéphalite japonaise », J Neurovirol, 3:141-47, 1997.
- S. McCall et al. « Influenza RNA not detected in archival brain tissues from acute encephalitis lethargica cases or in postencephalitic Parkinson cases », J Neuropathol Exp Neurol, 60:696-704, 2001.
- J.C. Kash et al. « Genomic analysis of increased host immune and cell death responses induced by 1918 influenza virus », Nature, 443:578-81, 2006.
- S. Sadasivan et al, « Les effets synergiques de la grippe et de la 1-méthyl-4-phényl-1,2,3,6-tétrahydropyridine (MPTP) peuvent être éliminés par l’utilisation de la thérapeutique de la grippe : Preuve expérimentale de l’hypothèse du multi-hit « , NPJ Parkinsons Dis, 3:18, 2017.
- S. Peudenier et al, « HIV receptors within the brain : a study of CD4 and MHC-II on human neurons, astrocytes and microglial cells, » Res Virol, 142:145-49, 1991.
- G. Canet et al, « HIV neuroinfection and Alzheimer’s disease : Similitudes et liens potentiels ? » Front Cell Neurosci, 12:307, 2018.
- E.D. Pastuzyn et al., « The neuronal gene Arc encodes a repurposed retrotransposon gag protein that mediates intercellular RNA transfer », Cell, 172:P275-88.E18, 2018.
- J. Ashley et al, « Retrovirus-like gag protein Arc1 binds RNA and traffics across synaptic buttons, » Cell, 172:P262-74.E11, 2018.
- S. Hosseini et al, « La neuroinflammation à long terme induite par l’infection par le virus de la grippe A et l’impact sur la morphologie et la fonction des neurones hippocampiques, » J Neurosci, 38:3060-80, 2018.
.
Leave a Reply