Menu
ABOVE: © ISTOCK.COM, bodym
For lidt over 10 år siden, da neurobiolog Richard Smeyne arbejdede på St. Jude Children’s Research Hospital i Memphis, så han en video af en and, der opførte sig mærkeligt. Den hvidfjerede fugl med orange næb stod lidt adskilt fra sin flok på en gård i Laos. Den gik i cirkler og vendte en vinge opad, hvorefter den mistede balancen og faldt om. Den rejste sig op, forsøgte at slå med begge vinger og faldt om igen.
Smeyne så videoen, mens han deltog i et seminar, der blev afholdt af den daværende postdoc David Boltz og Boltz’ rådgiver, en “influenzajæger” ved navn Robert Webster, der ledede influenzaforskningsprogrammet på hospitalet. Boltz og Webster forklarede, at anden var smittet med H5N1-fugleinfluenzaviruset, som havde gjort tusindvis af fugle syge og dræbt hundredvis af mennesker i 2006 og 2007. Smeyne, som havde studeret neurobiologien bag Parkinsons sygdom hos mus, genkendte dyrets motoriske problemer. Den and har Parkinsons sygdom, tænkte han.
Han fortalte Webster dette efter seminaret, og Webster grinede, husker Smeyne. “Han sagde: ‘Jamen, det er en syg fugl’.” Men Smeyne var nysgerrig på de neurale mekanismer, der lå til grund for andens unormale adfærd. Han spekulerede på, om raske ænder, der var inficeret med H5N1 i laboratoriet, ville udvise Parkinsons-lignende neurodegeneration. I St. Judes laboratorium på biosikkerhedsniveau 3 inficerede han og hans kolleger ænder med viruset, hvorefter de ofrede fuglene, fjernede deres hjerner og opbevarede dem i formaldehyd i tre uger for at dræbe det aktive virus.
Da Smeyne begyndte at dissekere de engang inficerede andehjerner, fokuserede han på et område kaldet substantia nigra, som ofte er beskadiget hos Parkinson-patienter. “Da jeg åbnede den, da jeg skar hjernen op, var substantia nigra ødelagt. Alle neuronerne var helt væk,” siger Smeyne. Han gik tilbage til Webster, husker han, og sagde: “Jeg tog ikke fejl. Din and har faktisk Parkinsons sygdom.”
De fremkaldte betændelse og død i de dele af hjernen, som vi ser degenerere ved Parkinsons sygdom.
-Richard Smeyne,
Thomas Jefferson University
Da fuglen havde haft influenza, spekulerede Smeyne på, om der var en sammenhæng mellem virusinfektionen og den omfattende neurodegeneration, han observerede. Han spurgte Webster om de symptomer, som mennesker, der var smittet med H5N1, havde. Websters svar – en betændelse i hjernen, der fører til rystelser og andre motoriske fejlfunktioner – lød ikke som “fuldblods Parkinsons sygdom”, siger Smeyne, “men det var parkinsonisme”, en delmængde af symptomerne på sygdommen.
Igennem litteraturen fandt Smeyne flere antydninger af influenzas evne til at skade hjernen. En af de tidligste forbindelser mellem influenza og neurale dysfunktioner var en sammenhæng mellem den spanske influenza i 1918, der blev forårsaget af en undertype kaldet H1N1, og en epidemi af Parkinsons sygdom nogle få årtier senere. I 1940’erne og begyndelsen af 1950’erne syntes diagnoserne af den neurodegenerative sygdom at stige pludseligt, fra 1-2 procent af den amerikanske befolkning til 2,5-3 procent, hvorefter de faldt tilbage til 1-2 procent, siger Smeyne. “Dybest set fik 50 procent flere mennesker i de år Parkinsons.”
Beviserne for, at influenzainfektion forårsagede den neurodegenerative lidelse, var mildest talt spinkle, men sammenhængen var nok til, at Smeyne undersøgte sagen nærmere. Sammen med sine kolleger skød han ikke-dødelige doser af H5N1 eller H1N1 op i næsen på seks til otte uger gamle mus og fulgte derefter, hvordan virusserne spredte sig gennem dyrenes nervesystem. Resultaterne var overraskende, siger han: Nogle vira blev ikke forhindret i at trænge ind i hjernen af blod-hjernebarrieren – et halvgennemtrængeligt lag af celler, der adskiller centralnervesystemet fra kroppens kredsløb. H5N1 kunne f.eks. let infiltrere nerveceller i hjernen og dræbe dem, og det viste sig, at det især var rettet mod de dopaminproducerende neuroner i substantia nigra.1 Og selv om H1N1-influenzastammen ikke kunne krydse blod-hjernebarrieren, fik den alligevel immunceller fra centralnervesystemet, kaldet mikroglia, til at strømme ind i substantia nigra og hippocampus, hvilket forårsagede betændelse og celledød i området.2
“Så det var to forskellige influenzaer, to forskellige mekanismer, men på en måde den samme effekt”, siger Smeyne, som flyttede til Thomas Jefferson University i Philadelphia i 2016. “De fremkaldte inflammation og død i de dele af hjernen, som vi ser degenerere i Parkinsons sygdom.”
Smeynes eksperimenter er ikke de eneste, der tyder på, at virusinfektioner kan bidrage til neurodegenerative lidelser, og forbindelsen er ikke begrænset til influenza. Flere forskellige vira, herunder mæslinger og herpes, kan f.eks. give anledning til symptomer på multipel sklerose (MS) hos gnavere.3 Og niveauerne af herpesvirus er højere i hjernen hos personer, der er døde af Alzheimers, end hos personer uden sygdommen,4 mens nogle HIV-patienter udvikler demens, der synes at være forbundet med infektionen.
“Virus bliver ofte ignoreret i forbindelse med neurodegenerative sygdomme,” siger neurobiolog Anthony van den Pol fra Yale University til The Scientist. “Det er til dels fordi der ikke er noget klart tegn på, at en virus forårsager en neurodegenerativ sygdom. Men det kan det måske.”
Invasion af hjernen
Så langt tilbage som i 1385 registrerede læger i Europa forbindelser mellem influenzainfektion og psykose. Denne forbindelse mellem influenza og hjernen blev langt mere tydelig under og efter den spanske influenzaepidemi i 1918. Mere direkte beviser for forbindelsen mellem virus og hjerne kom i 1970’erne, da forskere under ledelse af Eugenia Gamboa, dengang neurolog ved Columbia University, og kolleger fandt virale antigener i hjernen hos afdøde personer, der havde været ramt af en tilstand kendt som encephalitis lethargica.5 Med symptomer som feber, hovedpine og dobbeltsyn var encephalitis lethargica forbundet med – og nogle mente, at det var forårsaget af – den spanske influenza fra 1918, og forskerne spekulerede i, at tilstanden kunne være en forløber for Parkinsons symptomer. I 1997 rapporterede et hold forskere så, at rotter, der blev udsat for japansk encephalitisvirus, udviklede en sygdom med symptomer, der lignede Parkinsons sygdom hos mennesker.6
Men forbindelsen mellem virusinfektion og hjernesygdom har været stærkt omstridt. Og da forskere fra Armed Forces Institute of Pathology i Washington, DC, brugte PCR til at lede efter fragmenter af H1N1-genomet i det konserverede hjernevæv fra ofre for encephalitis lethargica i begyndelsen af 2000’erne, fandt de ingen tegn på virus.7
Sådan var forskningstilstanden, da Smeyne afslørede de alvorlige Parkinsons-lignende hjerneskader hos de H5N1-inficerede ænder. Ingen havde direkte testet virusets evne til at forårsage Parkinsons sygdom, før han inficerede mus med H5N1 og dokumenterede alvorlige skader på substantia nigra. Hans resultater afslørede også en mulig vej for virussen til at sprede sig fra kroppen til hjernen. Smeyne siger, at substantia nigra ikke var virusets første mål, men at det først inficerede neuroner i tarmen. “Derefter gik virussen ind i vagusnerven og brugte i bund og grund vagusnerven som en bagdør ind i hjernen.”
Passageveje
Nogle virus kan trænge ind i kroppen gennem næse og mund og bevæge sig til hjernen ved at replikere og sprede sig gennem lugtbulberne; den linguale nerve, som løber ned langs kæbelinjen og ind i tungen; eller vagusnerven, som løber gennem halsen og brystkassen til maven.

Mønstret ligner påfaldende meget den måde, hvorpå Parkinsons sygdom ser ud til at arbejde sig gennem menneskekroppen, siger Smeyne. Ifølge en bredt accepteret hypotese, der først blev fremsat af den tyske neuropatolog Heiko Braak i 2003, starter Parkinsons sygdom i tarmen og manifesterer sig som fordøjelsesproblemer, hvorefter den bevæger sig ind i hjernen. “Sygdommens udvikling fra tarmen til forhjernen finder sted over måske 25-30 år hos et menneske”, siger Smeyne. Men mus lever meget kortere. Hos gnaverne kan influenzaviruset tilbagelægge det samme forløb og skabe tegn på Parkinsons sygdom i løbet af få uger, bemærker han. Og som Smeyne og hans kolleger fandt med H1N1-inficerede mus, kan virus, der ikke kan nå ind i hjernen, stadig spille en rolle i neurodegeneration ved at udløse alvorlig inflammation.
En del forskning har dog ikke kunnet finde en forbindelse mellem virusinfektion og skader på hjernen. Da forskere fra US Centers for Disease Control and Prevention i Atlanta, Georgia, for eksempel undersøgte virkningerne af den influenzastamme, der forårsagede den spanske influenzaepidemi i 1918, kunne de ikke se tegn på betændelse i hjernen hos inficerede mus.8 “Der er behov for mere arbejde for at finde en forbindelse mellem virusinfektion og neurodegenerative sygdomme”, siger mikrobiolog Terrence Tumpey, som var medforfatter til denne undersøgelse.
Smeyne har mistanke om, at forbindelsen mellem virus og hjernecentrerede sygdomme kan være mere subtil. For yderligere at undersøge forholdet mellem H1N1 og Parkinsons sygdom gav han og hans kolleger et toksin kaldet MPTP til mus, der var kommet sig efter infektion med virus. Kemikaliet var et biprodukt fra et dårligt parti syntetisk heroin, der blev fremstillet i 1970’erne, og som fik brugerne til at udvikle Parkinsons sygdom. De MPTP-behandlede mus, der var blevet smittet med H1N1, udviklede tegn på sygdommen og mistede 25 procent flere neuroner i substantia nigra end uinficerede mus, der blev behandlet med toksinet, eller mus, der var blevet smittet med viruset, men ikke udsat for MPTP.9
“Det tyder på,” siger Smeyne, “at selv om H1N1-infektionen ikke i sig selv forårsagede Parkinsons sygdom, gjorde den nervesystemet følsomt over for andre ting, der kunne forårsage det.”
En bredere forbindelse mellem virus og neurodegeneration
Influenza-Parkinson-sammenhængen er ikke den eneste forbindelse, som forskere har lavet mellem virus og neurologiske problemer. I slutningen af 1980’erne og begyndelsen af 1990’erne fandt forskere ud af, at mus, der var inficeret med virus som f.eks. mæslinger og herpes, led den samme form for skade på deres oligodendrocytter – celler i centralnervesystemet, der producerer myelin, den isolerende fedtskede, der er viklet om neuronernes axoner – som patienter med MS gør. Det er ikke klart, om virusene invaderede oligodendrocytterne direkte, eller om de blot provokerede musenes immunsystem til at angribe cellerne, men slutresultatet var demyelinisering af neuroner, siger van den Pol, ligesom det, der ses hos MS-patienter.

En af de virusstammer, der fremkaldte MS-symptomer hos mus, var herpesvirus 6, som også har været forbundet med udviklingen af Alzheimers sygdom. Tentative forbindelser mellem virusinfektioner og Alzheimers er blevet dokumenteret i løbet af de sidste par årtier, men muligheden dukkede op igen sidste år, da Joel Dudley fra Icahn School of Medicine at Mount Sinai og kolleger, der gennemgik data fra hjernebanker og offentliggjorte undersøgelser, fandt, at patienter med Alzheimers sygdom havde forhøjede niveauer af virus, såsom humant herpesvirus 6 og humant herpesvirus 7, i fire centrale hjerneområder. På baggrund af genetiske og proteomiske data fandt forskerne også, at humant herpesvirus 6 kan inducere genekspression, der fremmer udviklingen af proteinet amyloid β, som danner plaques, der er kendetegnende for Alzheimers sygdom.4
Se “Do Microbes Trigger Alzheimer’s Disease?”
En sådan korrelation beviser ikke, at virus forårsager sygdommen, men det tyder på, at patogener måske alligevel spiller en rolle i neurodegenerative sygdomme, siger Dudley. “En ting, der er anderledes i dag sammenlignet med tidligere overvejelser om patogenhypotesen, er, at vi har langt mere kraftfulde sekventeringsmetoder, der kan tage et mere uvildigt kig på det mikrobielle DNA/RNA-landskab i hjernevæv”, siger han. “Vi vil sandsynligvis få et endnu bedre indblik i dette spørgsmål, når vi anvender long-read sekventeringsteknologi og enkeltcelle-sekventeringsteknologi på prøver af hjernevæv.”
HIV er en anden virus, som forskerne mistænker for at kunne forårsage Alzheimer-lignende eller Parkinson-lignende hjerneskader. I 1990’erne viste forskere, at HIV kunne krydse blod-hjernebarrieren, og efterfølgende undersøgelser viste, at når virussen infiltrerer hjernen, fremmer den neuronaldød og tab af synaptiske forbindelser.10 For nylig er læger begyndt at rapportere om patienter med HIV, der udvikler demens og et tab af hjernemateriale, der afspejler det, der ses hos Alzheimer-patienter, forklarer Sara Salinas, patolog og virolog ved universitetet i Montpellier i Frankrig, og kolleger i en oversigtsartikel i 2018 i Frontiers in Cellular Neuroscience.11 Nyere undersøgelser viser, at HIV-patienter udvikler plaques af amyloid β. Og, siger Smeyne, HIV-patienter kan også udvikle langsommelighed i bevægelse og rysten.
Krydsning af blod-hjernebarrieren
Når de interagerer med nervesystemet, kan virale partikler krydse blod-hjernebarrieren direkte eller gennem infektion af endothelceller (nedenfor til venstre), eller de kan bruge en trojansk hest-tilgang (i midten) og inficere monocytter, der krydser barrieren, før de replikerer og sprænger ud af de hvide blodlegemer, når de først er inde i hjernen. Alternativt krydser nogle vira ikke blod-hjernebarrieren, men fremkalder et immunrespons, der kan anspore cytokiner eller kemokiner til at bryde skellet (til højre).

Et nærmere kig på de neuronale kommunikationsformer kan give et fingerpeg om udviklingen af de neurodegenerative sygdomme. Tidligere i år rapporterede to grupper af forskere, at neuroner ud over at bruge elektriske og kemiske signaler til at tale sammen anvender ekstracellulære vesikler, der bærer budbringer-RNA’er.12,13 Strukturen af disse vesikler minder om den måde, hvorpå hiv og andre retrovirusser bygger beskyttende skaller kaldet capsider, der transporterer virusets genetiske materiale fra celle til celle, siger Jason Shepherd, der er neurovidenskabsmand ved University of Utah og medforfatter til en af undersøgelserne. Generne, der koder for vesiklerne, kunne muligvis være rester fra tidligere infektioner, foreslår han, og disse viruslignende kapsider kunne indeholde giftige proteiner, såsom amyloid β, og sprede dem i hele hjernen.
“Det er klart, at virus påvirker hjernen,” siger Shepherd, men arten af dette forhold er stadig uklart.
Hjerneskader
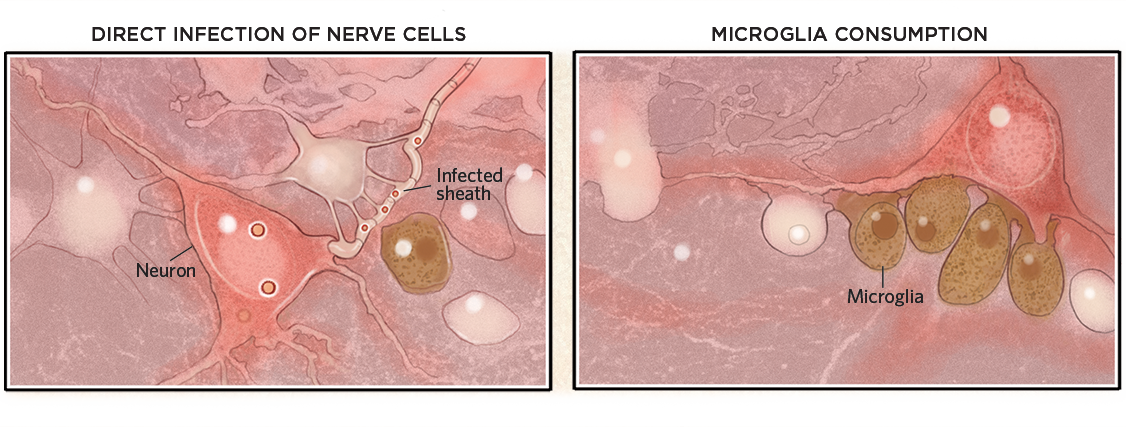
Når de først er inde i hjernen, kan virus inficere celler eller deres myelinskeder og dræbe dem (nedenfor, til venstre). Virusser behøver dog ikke nødvendigvis at trænge ind i hjernen for at forårsage skade. De kan også udløse et immunforsvar, der aktiverer mikroglia, som derefter æder ellers sunde neuroner (til højre).
Glemthed varer ved
En af udfordringerne ved at forstå, hvordan hjernen reagerer på virusinfektioner, er, at virkningerne kan vare ved længe efter, at vores immunsystem har fjernet infektionen fra vores krop. Tidligere i år rapporterede Martin Korte fra Technische Universität Braunschweig i Tyskland og kolleger for eksempel, at hjernen hos mus, der var inficeret med visse stammer af influenzavirus, havde hukommelsesunderskud, selv efter at de tilsyneladende var blevet raske. Det viste sig, at deres hjerner var fulde af mikroglia selv 30 til 60 dage efter, at infektionen først havde bidt sig fast.14 Niveauerne af mikroglia kan begynde at vende tilbage til det normale niveau omkring 60 dage efter infektionen, og neuronerne i de unge mus genoprettes fuldstændigt, sammen med dyrenes hukommelsespræstationer. Alligevel kan antallet af mikrogliaer forblive forhøjet i op til 120 dage, siger Korte til The Scientist; det svarer til mere end 10 år i mennesketid.
Van den Pol siger, at en sådan forsinkelse netop er grunden til, at forskerne har svært ved at acceptere, at vira kan forårsage neurodegenerative sygdomme. “I videnskaben tænker vi ofte på, at en eller anden årsag og virkning ofte er millisekunder,” siger han. “Her taler man om årtier. Virussen går ind, og så kan den måske årtier senere forårsage en potentielt alvorlig neurodegeneration” – en sådan langtidsforbindelse er svær at påvise.
I videnskaben tænker vi ofte på, at en årsag og virkning ofte er millisekunder. Her taler man om årtier.
-Anthony van den Pol,
Yale University
Hvis forbindelsen mellem virusinfektioner og neurologiske problemer kan fastslås mere konkret, vil forskerne måske kunne udvikle metoder til at afbøde de neurologiske virkninger, siger van den Pol. En forståelse af, hvordan infektioner udløser immunsystemet, kunne f.eks. føre til måder at nedregulere gliadrevet inflammation i håb om at forhindre langsigtede skader, foreslår han.
I mellemtiden bemærker Smeyne, at vaccination mod influenza – eller i det mindste at tage Tamiflu, hvis en person bliver smittet – kan hjælpe med at forhindre neurologiske komplikationer ved influenzainfektion. Han og hans kolleger testede denne tilgang på mus, efter at deres resultater afslørede forbindelsen mellem influenza, MPTP-toksinet og Parkinsons sygdom. Holdet gav en gruppe mus en H1N1-vaccine 30 dage før de inficerede dyrene med viruset. En anden gruppe af mus blev behandlet med Tamiflu i ugen efter, at de var blevet smittet. Begge grupper af mus fik lov til at komme sig, inden de fik en lav dosis MPTP. Mens kontrolmusene, der hverken fik vaccinen eller influenzabehandlingen, udviklede Parkinsons-lignende symptomer, udviklede de behandlede mus ingen neurodegenerative virkninger. “Vi havde beskyttet mod bare ved tidlig behandling eller profylaktisk behandling med vaccinen,” siger Smeyne.
Det er yderligere beviser til støtte for idéen om, at virusinfektioner kan skade hjernen, siger Smeyne, men der er stadig ikke nogen slam-dunk-undersøgelse, der viser, at en virus kan forårsage Parkinsons eller Alzheimers eller en række andre neurologiske lidelser. “Jeg kan godt lide idéen om, at vira kan forårsage en masse forskellige hjernesygdomme som en hypotese,” siger van den Pol. “Men jeg respekterer også det faktum, at det virkelig er en hypotese.”
- H. Jang et al., “Highly pathogenic H5N1 influenza virus can enter the central nervous system and induce neuroinflammation and neurodegeneration,” PNAS, 106:14063-68, 2009.
- S. Sadasivan et al., “Induction of microglia activation after infection with the non-neurotropic A/CA/04/2009 H1N1 influenza virus,” PLOS ONE, 10:e0124047, 2015.
- U.G. Liebert, V. ter Meulen. “Virological aspects of measles virus-induced encephalomyelitis in Lewis and BN rats,” J Gen Virol, 68:1715-22, 1987.
- B. Readhead et al., “Multiscale analysis of independent Alzheimer’s cohorts finds disruption of molecular, genetic, and clinical networks by human herpesvirus,” Neuron, 99:64-82.e7, 2018.
- E.T. Gamboa et al., “Influenza virus antigen in postencephalitic parkinsonism brain. Detection by immunofluorescence,” Arch Neurol, 31:228-32, 1974.
- A. Ogata et al., “A rat model of Parkinson’s disease induced by Japanese encephalitis virus,” J Neurovirol, 3:141-47, 1997.
- S. McCall et al., “Influenza RNA not detected in archival brain tissues from acute encephalitis lethargica cases or in postencephalitic Parkinson cases,” J Neuropathol Exp Neurol, 60:696-704, 2001.
- J.C. Kash et al., “Genomic analysis of increased host immune and cell death responses induced by 1918 influenza virus,” Nature, 443:578-81, 2006.
- S. Sadasivan et al., “Synergistiske virkninger af influenza og 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridin (MPTP) kan elimineres ved brug af influenzaterapeutika”: Experimental evidence for the multi-hit hypothesis,” NPJ Parkinsons Dis, 3:18, 2017.
- S. Peudenier et al., “HIV receptors within the brain: a study of CD4 and MHC-II on human neurons, astrocytes and microglial cells,” Res Virol, 142:145-49, 1991.
- G. Canet et al., “HIV neuroinfection and Alzheimer’s disease: Ligheder og potentielle forbindelser?” Front Cell Neurosci, 12:307, 2018.”
- E.D. Pastuzyn et al., “The neuronal gene Arc encodes a repurposed retrotransposon gag protein that mediates intercellular RNA transfer,” Cell, 172:P275-88.E18, 2018.”
- J. Ashley et al., “Retrovirus-lignende gag-protein Arc1 binder RNA og traffics på tværs af synaptiske boutoner,” Cell, 172:P262-74.E11, 2018.
- S. Hosseini et al., “Langtids neuroinflammation induceret af influenza A-virusinfektion og virkningen på hippocampal neuron morfologi og funktion,” J Neurosci, 38:3060-80, 2018.
Leave a Reply