Menu
ABOVE: © ISTOCK.COM, bodym
Před o něco více než 10 lety, když neurobiolog Richard Smeyne pracoval v dětské výzkumné nemocnici St. Jude v Memphisu, uviděl video, na kterém se podivně chovala kachna. Bíle opeřený pták s oranžovým zobákem stál mírně stranou od svého hejna na farmě v Laosu. Chodila v kruzích a mávala křídlem, pak ztratila rovnováhu a přepadla. Vstal, pokusil se zamávat oběma křídly a znovu se převrátil.
Smeyne video viděl, když se účastnil semináře, který vedl tehdejší postdoktorand David Boltz a Boltzův poradce, „lovec chřipky“ jménem Robert Webster, který vedl program výzkumu chřipky v nemocnici. Kachna, jak vysvětlovali Boltz a Webster, byla nakažena virem ptačí chřipky H5N1, který v letech 2006 a 2007 nakazil tisíce ptáků a zabil stovky lidí. Smeyne, který studoval neurobiologii Parkinsonovy choroby u myší, rozpoznal pohybové problémy zvířete. Ta kachna má Parkinsonovu chorobu, pomyslel si.
Po semináři to řekl Websterovi a ten se zasmál, vzpomíná Smeyne. „Řekl: ‚No, je to nemocný pták‘.“ Smeyne se však zajímal o nervové mechanismy, které stojí za abnormálním chováním kachny. Zajímalo ho, zda by zdravé kachny nakažené H5N1 v laboratoři vykazovaly neurodegeneraci podobnou Parkinsonově chorobě. V laboratoři St. Jude’s s úrovní biologické bezpečnosti 3 on a jeho kolegové infikovali kachny virem, pak ptáky obětovali, vyňali jim mozky a uložili je na tři týdny do formaldehydu, aby se aktivní virus zničil.
Když Smeyne začal pitvat kdysi infikované kachní mozky, zaměřil se na oblast zvanou substantia nigra, která je u pacientů s Parkinsonovou chorobou často poškozená. „Když jsem mozek otevřel a rozřízl, substantia nigra byla zdevastovaná. Všechny neurony byly úplně pryč,“ říká Smeyne. Vzpomíná, že se vrátil k Websterovi a řekl: „Nemýlil jsem se. Vaše kachna skutečně trpí Parkinsonovou chorobou.“
Vyvolávali zánět a odumírání v částech mozku, které pozorujeme degenerovat při Parkinsonově chorobě.
-Richard Smeyne,
Thomas Jefferson University
Protože měl pták chřipku, zajímalo Smeyneho, zda existuje souvislost mezi virovou infekcí a rozsáhlou neurodegenerací, kterou pozoroval. Zeptal se Webstera na příznaky, které se vyskytovaly u lidí nakažených virem H5N1. Websterova odpověď – zánět mozku, který vede k třesu a dalším motorickým poruchám – nezněla jako „plnohodnotná Parkinsonova choroba“, říká Smeyne, „ale byl to parkinsonismus“, podskupina příznaků této nemoci.
Podíváním se do literatury našel Smeyne další náznaky schopnosti chřipky poškozovat mozek. Jednou z prvních souvislostí mezi chřipkou a nervovou dysfunkcí byla korelace mezi španělskou chřipkou z roku 1918, způsobenou subtypem zvaným H1N1, a epidemií Parkinsonovy choroby o několik desetiletí později. Ve čtyřicátých a na počátku padesátých let minulého století se zdálo, že počet diagnóz tohoto neurodegenerativního onemocnění prudce vzrostl z 1-2 % americké populace na 2,5-3 % a poté opět klesl na 1-2 %, uvádí Smeyne. „V podstatě v těch letech onemocnělo Parkinsonovou chorobou o 50 procent více lidí.“
Důkazy naznačující, že chřipková infekce způsobuje neurodegenerativní poruchu, byly přinejmenším chabé, ale souvislost stačila Smeynemu k dalšímu zkoumání. Se svými kolegy vstříkl nesmrtící dávky viru H5N1 nebo H1N1 do nosu šesti- až osmitýdenních myší a pak sledoval, jak se viry šíří nervovým systémem zvířat. Výsledky byly podle něj překvapivé: některým virům nebránila v průniku do mozku hematoencefalická bariéra – polopropustná vrstva buněk, která odděluje centrální nervový systém od tělesného oběhu. Například virus H5N1 mohl snadno proniknout do nervových buněk v mozku a usmrtit je a zdálo se, že se zaměřuje zejména na neurony produkující dopamin v substantia nigra.1 A i když chřipkový kmen H1N1 nemohl proniknout přes hematoencefalickou bariéru, přesto způsobil, že imunitní buňky centrálního nervového systému zvané mikroglie proudily do substantia nigra a hipokampu a způsobily v této oblasti zánět a buněčnou smrt.2
„Takže šlo o dva různé flusy, dva různé mechanismy, ale v jistém smyslu stejný účinek,“ říká Smeyne, který v roce 2016 přešel na Univerzitu Thomase Jeffersona ve Filadelfii. „Vyvolávaly zánět a smrt v částech mozku, které pozorujeme degenerovat u Parkinsonovy choroby.“
Smeyneovy experimenty nejsou jediné, které naznačují, že virové infekce mohou přispívat k neurodegenerativním poruchám, a souvislost se neomezuje pouze na chřipku. Několik různých virů, včetně spalniček a herpesu, může například u hlodavců vyvolat příznaky roztroušené sklerózy (RS).3 A hladiny herpesvirů jsou vyšší v mozcích lidí, kteří zemřeli na Alzheimerovu chorobu, než u těch, kteří touto chorobou netrpěli,4 zatímco u některých pacientů s HIV se objevuje demence, která zřejmě souvisí s infekcí.
„Viry jsou v souvislosti s neurodegenerativními chorobami často přehlíženy,“ říká neurobiolog z Yaleovy univerzity Anthony van den Pol v rozhovoru pro časopis The Scientist. „Částečně je to proto, že neexistuje žádná jasná známka toho, že virus způsobuje neurodegenerativní onemocnění. Ale může.“
Invaze do mozku
Již v roce 1385 zaznamenali lékaři v Evropě souvislosti mezi chřipkovou infekcí a psychózou. Tato souvislost mezi chřipkou a mozkem se stala mnohem zřejmější během a po epidemii španělské chřipky v roce 1918. Přímější důkazy o spojení viru s mozkem přišly v 70. letech 20. století, kdy vědci pod vedením Eugenia Gamboa, tehdy neurologa na Kolumbijské univerzitě, a jeho kolegů našli virové antigeny v mozcích zemřelých lidí, kteří byli postiženi onemocněním známým jako encephalitis lethargica.5 Encephalitis lethargica s příznaky, jako je horečka, bolest hlavy a dvojité vidění, byla spojována se španělskou chřipkou z roku 1918 – a někteří se domnívali, že ji způsobila – a vědci spekulovali, že by toto onemocnění mohlo být předchůdcem příznaků Parkinsonovy choroby. V roce 1997 pak tým vědců oznámil, že u potkanů vystavených viru japonské encefalitidy se vyvinulo onemocnění s příznaky podobnými lidské Parkinsonově chorobě.6
O souvislosti mezi virovou infekcí a onemocněním mozku se však vedou vášnivé spory. A když vědci z Ústavu patologie ozbrojených sil ve Washingtonu počátkem roku 2000 pomocí PCR hledali fragmenty genomu viru H1N1 v konzervované mozkové tkáni obětí letargické encefalitidy, nenašli žádné známky viru.7
Takový byl stav výzkumu, když Smeyne odhalil závažné poškození mozku podobné Parkinsonově chorobě u kachen nakažených virem H5N1. Nikdo přímo netestoval schopnost viru vyvolat Parkinsonovu chorobu, dokud nenakazil myši virem H5N1 a nezdokumentoval těžké poškození substantia nigra. Jeho výsledky také odhalily možnou cestu šíření viru z těla do mozku. Podle Smeyneho nebyla substantia nigra původním cílem viru; virus nejprve infikoval neurony ve střevech. „Pak se virus dostal do bloudivého nervu a v podstatě ho využil jako zadní vrátka do mozku.“
Cesta průniku
Některé viry mohou do těla proniknout nosem a ústy a přesunout se do mozku tak, že se replikují a šíří čichovými bulbami; jazykovým nervem, který vede po čelisti a do jazyka; nebo bloudivým nervem, který prochází krkem a hrudním košem do žaludku.

Některé výzkumy však souvislost mezi virovou infekcí a poškozením mozku nenašly. Například když vědci z amerického Centra pro kontrolu a prevenci nemocí v Atlantě ve státě Georgia zkoumali účinky chřipkového kmene, který způsobil epidemii španělské chřipky v roce 1918, nezaznamenali v mozku nakažených myší žádné známky zánětu.8 „Je zapotřebí další práce, abychom hledali souvislost mezi virovou infekcí a neurodegenerativními onemocněními,“ říká mikrobiolog Terrence Tumpey, který je spoluautorem této studie.
Smeyne má podezření, že souvislost mezi viry a onemocněními zaměřenými na mozek by mohla být jemnější. Aby dále prozkoumal vztah mezi virem H1N1 a Parkinsonovou chorobou, podával se svými kolegy myším, které se zotavily z infekce virem, toxin zvaný MPTP. Tato chemická látka byla vedlejším produktem špatné šarže syntetického heroinu uvařeného v 70. letech 20. století, který u uživatelů vedl k rozvoji Parkinsonovy choroby. U myší, které byly infikovány virem H1N1, se po aplikaci MPTP objevily příznaky nemoci a ztratily o 25 % více neuronů v substantia nigra než neinfikované myši, kterým byl toxin podán, nebo myši infikované virem, ale nevystavené působení MPTP.9
„To nám naznačuje,“ říká Smeyne, „že infekce virem H1N1 sice sama o sobě Parkinsonovu chorobu nezpůsobila, ale připravila nervový systém na to, aby byl citlivý na jiné věci, které by ji mohly způsobit.“
Širší souvislost mezi viry a neurodegenerací
Spojitost mezi chřipkou a Parkinsonovou chorobou není jedinou souvislostí, kterou vědci mezi viry a neurologickými problémy zjistili. Na přelomu 80. a 90. let minulého století vědci zjistili, že u myší infikovaných viry, jako jsou spalničky a herpes, dochází ke stejnému poškození oligodendrocytů – buněk centrálního nervového systému, které produkují myelin, izolační tukovou pochvu obalující axony neuronů – jako u pacientů s RS. Není jasné, zda viry napadly oligodendrocyty přímo, nebo jen vyprovokovaly imunitní systém myší k útoku na tyto buňky, ale konečným výsledkem byla demyelinizace neuronů, jak říká van den Pol, stejně jako je tomu u pacientů s RS.

Jedním z kmenů viru, který u myší vyvolal příznaky RS, byl herpesvirus 6, který je rovněž spojován s rozvojem Alzheimerovy choroby. Předběžné souvislosti mezi virovými infekcemi a Alzheimerovou chorobou byly zdokumentovány již v minulých desetiletích, ale tato možnost se znovu objevila v loňském roce, kdy Joel Dudley z Icahn School of Medicine at Mount Sinai a jeho kolegové na základě přezkoumání údajů z mozkových bank a publikovaných studií zjistili, že pacienti s Alzheimerovou chorobou měli ve čtyřech klíčových oblastech mozku zvýšené hladiny virů, jako je lidský herpesvirus 6 a lidský herpesvirus 7. Tyto viry se vyskytovaly i v jiných oblastech mozku. Na základě genetických a proteomických dat vědci také zjistili, že lidský herpesvirus 6 může indukovat genovou expresi, která podporuje vývoj proteinu amyloidu β, jenž tvoří plaky, které jsou charakteristickými znaky Alzheimerovy choroby.4
Viz „Do Microbes Trigger Alzheimer’s Disease?“.
Taková korelace nedokazuje, že viry způsobují onemocnění, ale naznačuje, že patogeny přece jen mohou hrát roli v neurodegenerativních onemocněních, říká Dudley. „Jedna věc, která je dnes jiná ve srovnání s dřívějšími úvahami o hypotéze patogenů, je, že máme k dispozici mnohem výkonnější sekvenační metody, které umožňují nezaujatější pohled na mikrobiální DNA/RNA krajinu mozkové tkáně,“ říká. „Je pravděpodobné, že se na tuto otázku podíváme ještě lépe, až budeme na vzorky mozkové tkáně aplikovat technologii sekvenování s dlouhým čtením a technologii sekvenování jednotlivých buněk.“
HIV je dalším virem, u kterého vědci předpokládají, že by mohl způsobovat poškození mozku podobné Alzheimerově nebo Parkinsonově chorobě. V 90. letech minulého století vědci prokázali, že virus HIV dokáže překonat hematoencefalickou bariéru, a následné studie odhalily, že když virus pronikne do mozku, podnítí odumírání neuronů a ztrátu synaptických spojení.10 V poslední době začali lékaři informovat o pacientech s HIV, u nichž se objevuje demence a úbytek mozkové hmoty, který odráží to, co je pozorováno u pacientů s Alzheimerovou chorobou, vysvětluje Sara Salinasová, patoložka a viroložka z univerzity ve francouzském Montpellier, a její kolegové v přehledovém článku v časopise Frontiers in Cellular Neuroscience z roku 2018.11 Novější studie ukazují, že u pacientů s HIV se objevují plaky amyloidu β. A jak říká Smeyne, u pacientů s HIV se také může objevit zpomalení pohybu a třes.
Překonání hematoencefalické bariéry
Při interakci s nervovým systémem mohou virové částice překonat hematoencefalickou bariéru přímo nebo prostřednictvím infekce endoteliálních buněk (níže vlevo), nebo mohou použít přístup trojského koně (uprostřed), kdy infikují monocyty, které bariéru překonají, a poté se replikují a vyrazí z bílých krvinek, jakmile se dostanou do mozku. Případně některé viry nepřekračují hematoencefalickou bariéru, ale vyvolávají imunitní reakci, která může podnítit cytokiny nebo chemokiny k prolomení přepážky (vpravo).

Podrobnější pohled na způsoby neuronální komunikace může poskytnout určité vodítko k vývoji neurodegenerativních onemocnění. Začátkem letošního roku dvě skupiny vědců oznámily, že neurony kromě toho, že k vzájemné komunikaci používají elektrické a chemické signály, využívají extracelulární vezikuly nesoucí messengerové RNA.12,13 Struktura těchto vezikul připomíná způsob, jakým HIV a další retroviry vytvářejí ochranné obaly zvané kapsidy, které převážejí genetický materiál viru z buňky do buňky, říká Jason Shepherd, neurobiolog z University of Utah a spoluautor jedné ze studií. Geny kódující vezikuly by mohly být pozůstatkem dřívějších infekcí a tyto kapsidy napodobující virus by mohly obsahovat toxické proteiny, jako je amyloid β, a šířit je po celém mozku.
„Je zřejmé, že viry ovlivňují mozek,“ říká Shepherd, ale povaha tohoto vztahu zůstává nejasná.
Poškození mozku
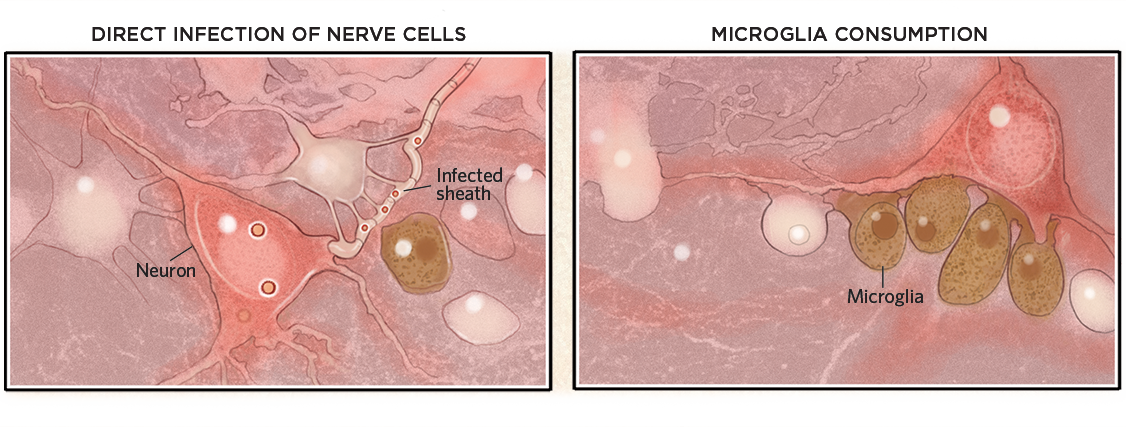
Po vstupu do mozku mohou viry infikovat buňky nebo jejich myelinové pochvy a usmrtit je (dole vlevo). Viry však nemusí nutně proniknout do mozku, aby způsobily poškození. Mohou také vyvolat imunitní reakci, která aktivuje mikroglie, které pak pohltí jinak zdravé neurony (vpravo).
Zapomnětlivost přetrvává
Jedním z problémů při pochopení toho, jak mozek reaguje na virovou infekci, je skutečnost, že následky mohou přetrvávat dlouho poté, co náš imunitní systém infekci z těla odstraní. Začátkem tohoto roku například Martin Korte z Technische Universität Braunschweig v Německu a jeho kolegové oznámili, že mozky myší infikovaných některými kmeny chřipkového viru trpěly poruchami paměti i poté, co se zdánlivě uzdravily. Ukázalo se, že jejich mozky byly plné mikroglií ještě 30 až 60 dní poté, co se infekce poprvé projevila.14 Hladina mikroglií se může začít vracet do normálního rozmezí zhruba 60 dní po infekci, přičemž neurony mladých myší se zcela obnoví a s nimi i paměťová výkonnost zvířat. Přesto může počet mikroglií zůstat zvýšený až 120 dní, říká Korte v časopise The Scientist; to odpovídá více než 10 letům v lidském měřítku.
Van den Pol říká, že právě takové zpoždění je důvodem, proč mají vědci problém přijmout, že by viry mohly způsobovat neurodegenerativní onemocnění. „Ve vědě si často myslíme, že nějaká příčina a následek jsou často milisekundy,“ říká. „Tady mluvíme o desetiletích. Virus se dostane dovnitř a pak možná o desítky let později může způsobit nějakou potenciálně závažnou neurodegeneraci“ – takovou dlouhodobou souvislost je těžké prokázat.
Ve vědě často uvažujeme o tom, že nějaká příčina a následek jsou často milisekundy. Tady mluvíme o desetiletích.
-Anthony van den Pol,
Yale University
Pokud se podaří konkrétněji prokázat souvislost mezi virovými infekcemi a neurologickými problémy, budou vědci možná schopni vyvinout způsoby, jak neurologické účinky zmírnit, říká van den Pol. Pochopení toho, jak infekce spouští imunitní systém, by například mohlo vést ke způsobům, jak snížit regulaci zánětu vyvolaného glií v naději, že se zabrání dlouhodobému poškození, navrhuje.
Smeyne mezitím poznamenává, že očkování proti chřipce – nebo přinejmenším užívání Tamiflu, pokud se člověk nakazí – by mohlo pomoci zabránit neurologickým komplikacím chřipkové infekce. On a jeho kolegové tento přístup testovali na myších poté, co jejich výsledky odhalily souvislost mezi chřipkou, toxinem MPTP a Parkinsonovou chorobou. Tým podal skupině myší vakcínu proti viru H1N1 30 dní před infikováním zvířat virem. Další skupině myší byl týden po nakažení podáván Tamiflu. Obě skupiny myší se zotavily a poté jim byla podána nízká dávka MPTP. Zatímco u kontrolních myší, které nedostaly ani vakcínu, ani léčbu proti chřipce, se rozvinuly příznaky podobné Parkinsonově chorobě, u léčených myší se žádné neurodegenerativní účinky neprojevily. „Ochránili jsme se před nimi právě včasnou léčbou nebo profylaktickou léčbou vakcínou,“ říká Smeyne.
Je to další důkaz podporující myšlenku, že virové infekce mohou poškozovat mozek, říká Smeyne, ale stále neexistuje žádná slam-dunk studie, která by prokázala, že virus může způsobit Parkinsona nebo Alzheimera nebo jakoukoli jinou řadu neurologických poruch. „Myšlenka, že viry mohou způsobit mnoho různých mozkových onemocnění, se mi líbí jako hypotéza,“ říká van den Pol. „Ale také respektuji skutečnost, že se skutečně jedná o hypotézu.“
- H. Jang et al., „Highly pathogenic H5N1 influenza virus can enter the central nervous system and induce neuroinflammation and neurodegeneration,“ PNAS, 106:14063-68, 2009.
- S. Sadasivan et al., „Induction of microglia activation after infection with the non-neurotropic A/CA/04/2009 H1N1 influenza virus,“ PLOS ONE, 10:e0124047, 2015.
- U.G. Liebert, V. ter Meulen. „Virological aspects of measles virus-induced encephalomyelitis in Lewis and BN rats“, J Gen Virol, 68:1715-22, 1987.
- B. Readhead et al., „Multiscale analysis of independent Alzheimer’s cohorts finds disruption of molecular, genetic, and clinical networks by human herpesvirus“, Neuron, 99:64-82.e7, 2018.
- E.T. Gamboa et al., „Influenza virus antigen in postencephalitic parkinsonism brain. Detection by immunofluorescence,“ Arch Neurol, 31:228-32, 1974.
- A. Ogata et al., „A rat model of Parkinson’s disease induced by Japanese encephalitis virus,“ J Neurovirol, 3:141-47, 1997.
- S. McCall et al., „Influenza RNA not detected in archival brain tissues from acute encephalitis lethargica cases or in postencephalitic Parkinson cases,“ J Neuropathol Exp Neurol, 60:696-704, 2001.
- J.C. Kash et al., „Genomic analysis of increased host immune and cell death responses induced by 1918 influenza virus,“ Nature, 443:578-81, 2006.
- S. Sadasivan et al, „Synergické účinky chřipky a 1-methyl-4-fenyl-1,2,3,6-tetrahydropyridinu (MPTP) lze eliminovat použitím chřipkových terapeutik: NPJ Parkinsons Dis, 3:18, 2017.
- S. Peudenier et al., „HIV receptors within the brain: a study of CD4 and MHC-II on human neurons, astrocytes and microglial cells“, Res Virol, 142:145-49, 1991.
- G. Canet et al., „HIV neuroinfection and Alzheimer’s disease: Podobnosti a potenciální souvislosti?“ Front Cell Neurosci, 12:307, 2018.
- E.D. Pastuzyn et al., „The neuronal gene Arc encodes a repurposed retrotransposon gag protein that mediates intercellular RNA transfer,“ Cell, 172:P275-88.E18, 2018.
- J. Ashley et al., „Retrovirus-like gag protein Arc1 binds RNA and traffics across synaptic boutons,“ Cell, 172:P262-74.E11, 2018.
- S. Hosseini et al., „Long-term neuroinflammation induced by influenza A virus infection and the impact on hippocampal neuron morphology and function“, J Neurosci, 38:3060-80, 2018.
.
Leave a Reply