Frontiers in Immunology
Introducere
În absența prevenției primare prin imunizare și a unui tratament specific pentru COVID-19 pot fi totuși disponibile strategii raționale de tratament. Pe lângă terapiile pentru a afecta direct replicarea virusului , au fost propuse imunoterapii pentru a reduce efectele inflamației induse de virus (2). Acestea includ tratamentul cu corticosteroizi, care nu sunt recomandate din cauza efectelor imunosupresoare ale acestora, care pot duce la un rezultat mai rău în comparație cu subiecții netratați. Abordările mai specifice vizează IL-6, TNFα, inhibitorii Janus kinazei (JAK1/JAK2) și inteferonii de tip 1 . În cele din urmă, sistemul complementului a fost considerat o țintă (3-5). Acești parametri pot avea o importanță prognostică, deoarece raportul IL6/interferon IFɤ pare să prezică severitatea bolii (6).
În plus, înțelegerea faptului că virusul utilizează enzima de conversie a angiotensinei 2 (ACE2) legată de membrană ca punct de intrare deschide potențiale strategii de modificare a activității acestui sistem. S-a propus că utilizarea de blocante ale receptorilor de angiotensină, care conduc la o expresie crescută a ACE2, poate fi dăunătoare (7). A fost exprimată, de asemenea, opinia alternativă a unui potențial efect benefic al acestor compuși (8), bazat pe efectele fiziologice antiinflamatorii și protectoare ale acestei enzime. Această controversă a fost recent subliniată în mod clar (9, 10). Provocarea este de a reduce ACE2 ca punct de intrare fără a înrăutăți reacția inflamatorie, odată ce a avut loc o infecție.
Reducerea ACE2 pentru a reduce intrarea Covid-19?
În urma constatărilor mecaniciste, reducerea expresiei ACE2 ar reduce numărul de puncte de acces ale virusului în organism în timpul infecției primare și, potențial, răspândirea în interiorul organismului. Ambele ar trebui să conducă la o evoluție clinică potențial mai blândă. Celulele care sunt susceptibile la infecția cu SARS par a fi în principal pneumocitele de tip II, enterocitele absorbante ileale și celulele secretoare ale caliciilor nazale (11). Prin urmare, ar putea fi utilă identificarea unui mecanism de reducere a expresiei membranare a ACE2 la aceste celule (având în vedere potențialele consecințe negative). Pentru a crește plauzibilitatea unei astfel de abordări, ar fi util să urmărim rapoartele privind utilizarea cu succes a abordărilor din medicina tradițională chineză (MTC). Unul dintre cei mai frecvent utilizați compuși din MTC conține un extract din glycyrrhiza glabra, adică planta de lemn dulce (12) și interacționează cu sistemul angiotensină-aldosteron: Unul dintre constituenții săi activi este glicirrizina (GL), care este metabolizată în intestinul uman în metabolitul activ din punct de vedere sistemic acidul gliciretinic (GA). Administrarea de GL și GA are o serie de efecte relevante: GA inhibă în primul rând o enzimă numită 11-beta-hidroxisteroid dehidrogenază (11bHSD), atât de tip 1, cât și de tip 2 (13). Relevant în acest caz apare tipul 2 (11bHSD2). Inhibarea sa permite cortizolului să acceseze receptorii mineralocorticoizi (MR) din țesuturile periferice specifice aldosteronului, inclusiv rinichiul, plămânii, celulele nazale și endoteliale, în care altfel ar fi împiedicat să facă acest lucru. Acest lucru se datorează activității sale de a degrada rapid cortizolul la nivel intracelular pentru a permite accesul aldosteronului la receptor. Cu alte cuvinte, o inhibiție a acestei enzime duce la o activare asemănătoare cu cea a aldosteronului a MR prin intermediul cortizolului și poate semăna cu efectele unor niveluri ridicate de aldosteron în aceste organe. Interesant în acest context este faptul că nivelurile ridicate de aldosteron conduc la o reducere a ACE2 în rinichi (14), un țesut care exprimă 11bHSD2 ca și celulele epiteliale pulmonare și nazale, adică principalele puncte de intrare pentru COVID-19, în timp ce antagonismul MR are efecte opuse în mai multe țesuturi (15). Acest lucru este în concordanță cu observația că, în anumite circumstanțe, compușii reducători de aldosteron, cum ar fi enalaprilul, pot duce la o creștere a expresiei ACE2 (16, 17).
Efect antiviral direct al GA sau GL
În mod interesant, GL sau metabolitul său activ GA exprimă efecte antivirale pentru virusul înrudit SARS-corona (18, 19) în culturi celulare: Celulele Verum infectate cu eșantioane de plasmă de pacienți au prezentat o reducere semnificativă a absorbției virusului și a ratei de replicare, atunci când GL a fost coadministrat (18); Un efect similar a fost descris de Chen et al. într-o linie celulară Vero-E6, însă nu s-a observat niciun efect într-o linie celulară fRhK4 (19). Este important de menționat că nu a fost studiat GA, compus activ la nivel sistemic după administrarea orală, ceea ce face ca aceste constatări să fie potențial relevante pentru administrarea locală (inhalată) sau intravenoasă. Într-un studiu efectuat pe celule ale tractului respirator uman, GA, dar nu și GL, a arătat un efect asupra ratei de infecție cu virusul sincițial respirator uman (20). Aceste efecte antivirale directe în afara RM indică un mecanism suplimentar, dar necunoscut. În acest context, ar putea fi important de reținut faptul că, pe lângă ACE2, serin proteinaza TMPRSS2 este necesară pentru infectarea unei celule (21). Inhibarea acestei enzime cu un inhibitor de protează ca intervenție terapeutică a fost propusă de autori. TMPRSS2 a fost implicată atât în infecțiile cu corona, cât și cu virusul gripal (22). Este interesant faptul că expresia acestei enzime este reglată de AG (23), ceea ce poate explica efectele antivirale mai largi ale AG (24). Este reglată de androgeni (23), ceea ce poate explica în parte diferențele de gen în ceea ce privește expresia clinică a infecțiilor COVID-19.
ACE2 Antiinflammation and Glycyrrhizin’s Anti-Inflammatory Effects
Consecințele în aval ale reducerii expresiei ACE2 sunt, așa cum s-a subliniat mai sus, oarecum controversate (25). Activitatea ACE2 este, în general, protectoare, inclusiv pentru țesutul pulmonar (26). Aceasta face acest lucru prin suprimarea consecințelor activării receptorului pentru endotoxină (LPS), adică a receptorului Toll-like 4 (TLR4) și, ca o consecință, a inflamației aferente în plămân (furtuna de endotoxină) (27): Supraexprimarea ACE2 a inhibat inflamația indusă de LPS în acest studiu. Prin urmare, expresia redusă a ACE2 ar putea fi considerată ca fiind îngrijorătoare. În acest context, o a doua proprietate a glicirrizinei devine importantă, și anume, efectul său imunomodulator. Cel mai bine cunoscut dintre acestea este efectul său antagonist al mecanismului dependent de TLR4. Un efect antagonist TLR4 al GA reduce inflamația în mai multe țesuturi, inclusiv în plămâni (28). În plus, GL conduce la o reducere a expresiei TLR4 în inimă și în plămâni într-un model de inflamație LPS. Acest lucru a fost însoțit de o reducere semnificativă a eliberării de citokine, și anume eliberarea de TNFα, IL6 și IL1ß (29). În concordanță, GL are efecte protectoare în sindromul de detresă respiratorie acută indus de activatorul TLR4 LPS la șoareci (28). Potențialul antiinflamator la nivelul plămânilor a fost demonstrat, de asemenea, într-un model de infecție cu Streptococcus aureus la șoareci, unde administrarea intraperitoneală de GL a suprimat markerii inflamatori în mare măsură (30). Aceste constatări sunt în concordanță cu activitatea GL sau GA de inhibare a căilor inflamatorii, prin intermediul TLR4 (31-34). Mecanismul GL împotriva inflamației pulmonare și cardiace poate fi, în parte, indirect, prin modificarea raportului dintre celulele supresoare derivate din mieloizi (MDSC) și celulele mieloide CD11b+Gr1 (29). În general, acțiunea GL de inhibare a activității TLR4 poate induce o activitate antiinflamatorie în aval de ACE2 mai puțin activă (35). În plus, GA duce la o suprimare a căii clasice, dar nu și a celei alternative a complementului (36). În cele din urmă, a fost descrisă o influență asupra secreției de interferoni: extractul de glycyrrhiza conduce la o secreție crescută de interferon 1ß în celulele tractului respirator superior și inferior (20), similară efectului GL și GA la șoareci, așa cum se determină în probele de ser (37); în plus, GL reduce mortalitatea la șoarecii infectați cu o doză letală de virus gripal printr-o modalitate dependentă de interferon ɤ și de celulele T (38). Aceste mecanisme antiinflamatorii pot fi, de asemenea, importante în SNC (39, 40) și, prin urmare, pot proteja împotriva consecințelor neurologice și psihiatrice ale unei infecții cu COVID-19.
Dintr-o perspectivă mai practică, poate fi, de asemenea, relevant faptul că coronavirusul SARS Co-V, care are asemănări cu COVID-19, a condus frecvent la hipotensiune arterială (25), ceea ce nu este neobișnuit în procesele inflamatorii. Acest simptom potențial critic poate fi depășit, de asemenea, cu glicirizină, care duce la o creștere a tensiunii arteriale (13). Vă rugăm să consultați figura 1 pentru o prezentare schematică.
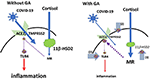
Figura 1. Model schematic al efectului glicirrizinei: Accesul COVID-19 în celule este mediat prin intermediul ACE2 cu TMPRSS2 ca și cofactor. Expresia ACE2 este reglată de receptorii mineralocorticoizi (MR): Activarea MR duce la o reducere a expresiei ACE2; GA inhibă 11βHSD2, ceea ce permite cortizolului să activeze MR, urmată de reducerea ACE2 (săgeata 1). TMPRSS2 sensibilizează ACE2 pentru actualizarea virusului în celulă. GA duce la o expresie redusă a TMPRSS2 și, prin urmare, poate oferi un mecanism suplimentar pentru a restricționa accesul virusului în celulă (săgeata 2). ACE2 are un mecanism antiinflamator prin generarea de angiotensină 1-7 și angiotensină 1-9. Prin activarea receptorilor MAS sau ai angiotensinei 2, căile inflamatorii sunt suprimate. Aceasta include, de asemenea, o expresie și/sau o activare redusă a receptorului membranar TLR4 (stânga), adică expresia redusă a ACE2 ar putea fi considerată ca fiind problematică (35). Cu toate acestea, GA inhibă direct TLR4 independent de activarea ACE2 (Săgeata 3). (liniile ϕ și întrerupte simbolizează inhibiția; liniile continue roșii simbolizează activarea).
Discuție
Multe întrebări rămân deschise. Care este rolul ACE2 solubilă față de cea legată de membrană? Poate exista un rol al ACE2 solubile pentru a proteja ocuparea membranei? Acest lucru a fost propus recent pe baza constatărilor din experimentele de cultură celulară (41). Cu toate acestea, acest lucru poate contrazice oarecum observația că subiecții cu insuficiență cardiacă, care ar trebui să fie considerați cu risc ridicat, prezintă niveluri ridicate de ACE2 solubilă (42). Care este diferența în diferite organe cu sau fără expresia 11bHSD2? Care este rolul reducerii contrareglatorii concomitente a aldosteronului plasmatic cu administrarea unui inhibitor de 11betaHSD2? La aceste întrebări se poate răspunde în cadrul unor studii clinice adecvate. Determinarea produsului final al enzimei ACE2, adică angiotensina 1-7, precum și potențialele consecințe clinice asupra tensiunii arteriale pot fi utile pentru a clarifica unele dintre aceste aspecte.
Important este faptul că glicirrizina are o toleranță generală bună. Are o declarație a FDA de GRAS (generally regarded as safe) (13). În special, o doză de până la 100 mg/zi utilizată în mod cronic este sigură și nu duce la modificări, care au fost observate la utilizarea cronică în doze mai mari. Efectele nedorite așteptate ale dozelor mari, inclusiv hipertensiunea arterială și hipokaliemia, trebuie totuși monitorizate. În contextul SARS a fost recomandată o doză de până la 300 mg pentru administrarea orală și de aproximativ 240 mg pentru o administrare intravenoasă (19). Cu toate acestea, Chen et al. afirmă că această doză pentru administrarea i.v. poate fi prea mică, ținând cont de EC50 a efectului asupra replicării virusului. Trebuie precizat faptul că acest efect direct este doar unul dintre cele trei mecanisme relevante pentru a viza procesul de boală legat de COVID-19. Două studii clinice cu etichetă deschisă sunt înregistrate pe site-ul de înregistrare a studiilor clinice al OMS, un studiu randomizat cu etichetă deschisă (ChiCTR2000029768) și o serie de cazuri (ChiCTR2000030490). Pentru acest studiu se utilizează o doză de 300 mg de glicirrizină pe cale orală/zi, doza pentru cealaltă investigație nu a fost raportată. Pentru alegerea căii de administrare este important să se ia în considerare faptul că, pentru o acțiune indusă de GA, administrarea orală de GL este crucială, deoarece GL nu este metabolizat în GA pe cale sistemică. Cu toate acestea, pentru un efect localizat al GL poate fi necesară o administrare intravenoasă sau inhalată, care trebuie combinată cu o administrare orală. Pentru utilizarea unei potențiale prevenții primare, se poate lua în considerare o selecție pragmatică a dozei de 150 mg/zi pe cale orală pentru studii ulterioare, deoarece această doză afectează activitatea MR.
Concluzie
Glicirrizina este un compus disponibil pe scară largă și în general sigur. Ea poate fi capabilă să reducă expresia ACE2 în plămâni și în ciuda faptului că reduce inflamația pulmonară. Ar trebui să merite a fi luată în considerare studierea acestui compus pentru un tip de prevenție primară, care nu reduce neapărat riscul de a fi infectat, dar potențial gravitatea bolii și în reducerea simptomatologiei deja existente. Acest lucru ar putea ajuta la reducerea numărului de pacienți în stare critică, care în prezent copleșesc sistemul de sănătate.
Contribuții ale autorilor
HM a redactat manuscrisul și versiunea finală.
Conflict de interese
HM deține un brevet pentru utilizarea glicirrizinei în depresia refractară la terapie.
Autorul declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Recunoștințe
HM dorește să îi mulțumească Laurei Zumpano pentru revizuirea și comentariile utile pentru manuscris.
1. Sanders JM, Monogue ML, Jodlowski TZ, Cutrell JB. Tratamente farmacologice pentru boala coronavirus 2019 (COVID-19): o revizuire. JAMA. (2020). doi: 10.1001/jama.2020.6019. .
PubMed Abstract | Textul integral | Google Scholar
2. Reddy Bonam S, Kaveri SV, Sakuntabhai A, Gilardin L, Bayry J. Imunoterapii adjuvante pentru gestionarea pacienților COVID-19 grav bolnavi. Cell Rep Med. (2020) 7:22. doi: 10.1016/j.xcrm.2020.100016
CrossRef Full Text | Google Scholar
3. Maglakelidze N, Manto KM, Manto KM, Craig TJ. O revizuire: are complementul sau sistemul de contact un rol în protecția sau patogeneza COVID-19? Pulm Therm. (2020) 1-8. doi: 10.1007/s41030-020-00118-5
CrossRef Full Text | Google Scholar
4. Mastaglio S, Ruggeri A, Risitano AM, Angelillo P, Yancopoulou D, Mastellos DC, et al. The first case of COVID-19 treated with the complement C3 inhibitor AMY-101. Clin Immunol. (2020) 215:108450. doi: 10.1016/j.clim.2020.108450
PubMed Abstract | Reflect Full Text | Google Scholar
5. Risitano AM, Mastellos DC, Huber-Lang M, Yancopoulou D, Garlanda C, Ciceri F, et al. Complementul ca țintă în COVID-19? (2020) Nat. Rev. Immunol. 1-2. doi: 10.1038/s41577-020-0320-7
CrossRef Full Text | Google Scholar
6. Lagunas-Rangel FA, Chavez-Valencia V. Raportul IL-6/IFN-gamma ridicat ar putea fi asociat cu boala severă la pacienții COVID-19. J. Med. Virol. (2020). doi: 10.1002/jmv.25900. .
PubMed Abstract | CopyRef Full Text | Google Scholar
7. Esler M, Esler D. Pot medicamentele care blochează receptorii de angiotensină să fie poate dăunătoare în pandemia COVID-19? J. Hypertens. (2020) 38:781-2. doi: 10.1097/HJH.0000000000002450
PubMed Abstract | Refef Full Text | Google Scholar
8. Fedson DS, Opal SM, Rordam OM. Ascunderea în văzul tuturor: o abordare a tratamentului pacienților cu infecție severă cu COVID-19. MBio. (2020) 11:e00398-20. doi: 10.1128/mBio.00398-20
PubMed Abstract | Refef Full Text | Google Scholar
9. Sommerstein R, Kochen MM, Messerli FH, Grani C. Boala Coronavirus 2019 (COVID-19): inhibitorii enzimei de conversie a angiotensinei / blocantele receptorilor de angiotensină au un efect bifazic? J Am Heart Assoc. (2020) 9:e016509. doi: 10.1161/JAHA.120.016509
PubMed Abstract | CrossRefect Full Text | Google Scholar
10. Vaduganathan M, Vardeny O, Michel T, Mcmurray JJ, Pfeffer MA, Solomon SD. Inhibitori ai sistemului renină-angiotensină-aldosteron la pacienții cu Covid-19. N Engl J Med. (2020) 382:1653-9. doi: 10.1056/NEJMsr2005760
PubMed Abstract | Ref Full Text | Google Scholar
11. Ziegler CG. Receptorul SARS-CoV-2 ACE2 este o genă stimulată de interferon în celulele epiteliale ale căilor respiratorii umane și este detectată în subseturi specifice de celule în toate țesuturile. Cell. (2020) S0092-8674:30500-6. doi: 10.1016/j.cell.2020.04.035
PubMed Abstract | Reflect Full Text | Google Scholar
12. Luo H, Tang QL, Shang YX, Liang SB, Yang M, Robinson N, et al. Poate fi utilizată medicina chineză pentru prevenirea bolii corona virus 2019 (COVID-19)? O revizuire a clasicilor istorici, a dovezilor de cercetare și a programelor actuale de prevenire. Chin J Integr Med. (2020) 26:243-50. doi: 10.1007/s11655-020-3192-6
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Comitetul de experți pentru revizuirea ingredientelor cosmetice. Raport final privind evaluarea siguranței acidului gliciretinic, a gliciretinatului de potasiu, a gliciretinatului de disodiu de succinoil, a gliciretinatului de gliceril, a gliciretinatului de gliceril, a stearatului de gliciretinil, gliciretinat de stearil, acid glicirizic, glicirizat de amoniu, glicirizat dipotasic, glicirizat disodic, glicirizat trisodic, glicirizat trisodic, glicirizat de metil și glicirizinat de potasiu. Int J Toxicol. (2007) 26 (Suppl. 2):79-112. doi: 10.1080/1091581070101351228
CrossRef Full Text | Google Scholar
14. Fukuda S, Horimai C, Harada K, Wakamatsu T, Fukasawa H, Muto S, et al. Leziunea renală indusă de aldosteron este mediată de activarea NFkappaB. Clin Exp Nephrol. (2011) 15:41-9. doi: 10.1007/s10157-010-0373-1
PubMed Abstract | Refef Full Text | Google Scholar
15. Keidar S, Gamliel-Lazarovich A, Kaplan M, Pavlotzky E, Hamoud S, Hayek T, et al. Blocanții receptorilor mineralocorticoizi cresc activitatea enzimei de conversie a angiotensinei 2 la pacienții cu insuficiență cardiacă congestivă. Circ Res. (2005) 97:946-53. doi: 10.1161/01.RES.0000187500.24964.7A
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Hu XS, Xie XD, Wang XX, Zeng CL, Ni YM, Yu GW, et al. Efectele inhibitorului enzimei de conversie a angiotensinei asupra expresiei enzimei de conversie a angiotensinei 2 în atriul pacienților cu fibrilație atrială. Zhonghua Xin Xue Guan Bing Za Zhi. (2007) 35:625-8.
PubMed Abstract | Google Scholar
17. Malfitano C, De Angelis K, Fernandes T, Fernandes T, Wichi RB, Rosa K, Pazzine M, et al. Enalaprilul în doze mici reduce angiotensina II și atenuează disfuncțiile cardiace și autonome induse de diabet. J Cardiovasc Pharmacol. (2012) 59:58-65. doi: 10.1097/FJC.0b013e3182354776
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Cinatl J, Morgenstern B, Bauer G, Chandra P, Rabenau H, Doerr HW. Glycyrrhizin, o componentă activă a rădăcinilor de lemn dulce, și replicarea coronavirusului asociat SARS. Lancet. (2003) 361:2045-6. doi: 10.1016/S0140-6736(03)13615-X
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Chen F, Chan KH, Chan KH, Jiang Y, Kao RY, Lu HT, Fan KW, et al. Sensibilitatea in vitro a 10 izolate clinice de coronavirus SARS la compuși antivirali selectați. J Clin Virol. (2004) 31:69-75. doi: 10.1016/j.jcv.2004.03.003
PubMed Abstract | Reflect Full Text | Google Scholar
20. Feng Yeh C, Wang KC, Chiang LC, Shieh DE, Yen MH, San Chang J. Extractul de apă de lemn dulce a avut activitate antivirală împotriva virusului sincițial respirator uman în liniile celulare ale tractului respirator uman. J Ethnopharmacol. (2013) 148:466-73. doi: 10.1016/j.jep.2013.04.040
PubMed Abstract | Refef Full Text | Google Scholar
21. Hoffmann M, Kleine-Weber H, Schroeder S, Kruger N, Herrler T, Erichsen S, et al. Intrarea celulelor SARS-CoV-2 depinde de ACE2 și TMPRSS2 și este blocată de un inhibitor de protează dovedit clinic. Cell. (2020) 181:271-80 e278. doi: 10.1016/j.cell.2020.02.052
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Shen LW LW, Mao HJ, Wu YL, Tanaka Y, Zhang W. TMPRSS2: o țintă potențială pentru tratamentul infecțiilor cu virus gripal și coronavirus. Biochimie. (2017) 142:1-10. doi: 10.1016/j.biochi.2017.07.016
PubMed Abstract | Refef Full Text | Google Scholar
23. Sun Y, Jiang M, Jiang M, Park PH, Song K. Suprimarea transcripțională a receptorului androgenic de către acidul 18beta-glicirretinic în celulele de cancer de prostată umană LNCaP. Arch Pharm Res. (2020) 43:433-48. doi: 10.1007/s12272-020-01228-z
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Hoever G, Baltina L, Michaelis M, Kondratenko R, Baltina L, Tolstikov GA, et al. Activitatea antivirală a derivaților acidului glicirricic împotriva SARS-coronavirus. J Med Chem. (2005) 48:1256-9. doi: 10.1021/jm0493008
PubMed Abstract | Refef Full Text | Google Scholar
25. Gurwitz D. Angiotensin receptor blockers as tentative SARS-CoV-2 therapeutics. Drug Dev. Res. (2020). doi: 10.1002/ddr.21656. .
PubMed Abstract | Reflectarea textului complet | Google Scholar
26. Kaparianos A, Argyropoulou E. Sisteme locale de renină-angiotensină II, enzima de conversie a angiotensinei și omologul său ACE2: rolul lor potențial în patogeneza bolilor pulmonare obstructive cronice, a hipertensiunii pulmonare și a sindromului de detresă respiratorie acută. Curr Med Chem. (2011) 18:3506-15. doi: 10.2174/092986711796642562
PubMed Abstract | Refef Full Text | Google Scholar
27. Ye R, Liu Z. ACE2 prezintă efecte protectoare împotriva leziunilor pulmonare acute induse de LPS la șoareci prin inhibarea căii LPS-TLR4. Exp Mol Pathol. (2020) 113:104350. doi: 10.1016/j.yexmp.2019.104350
PubMed Abstract |Ref Full Text | Google Scholar
28. Yu Z, Ohtaki Y, Kai K, Sasano T, Shimauchi H, Yokochi T, et al. Roluri critice ale trombocitelor în letalitatea indusă de lipopolizaharide: efectele glicirrizinei și o posibilă strategie pentru sindromul de detresă respiratorie acută. Int Immunopharmacol. (2005) 5:571-80. doi: 10.1016/j.intimp.2004.11.004
PubMed Abstract | Refef Full Text | Google Scholar
29. Seo EH, Song GY, Song GY, Kwak BO, Oh CS, Lee SH, Kim SH. Efectele glicirrizinei asupra diferențierii celulelor mieloide ale inimii și plămânilor la șoarecii septici induse de lipopolizaharide. Șoc. (2017) 48: 371-6. doi: 10.1097/SHK.0000000000000850
PubMed Abstract | Refef Full Text | Google Scholar
30. Yao L, Sun T. Administrarea de Glycyrrhizin ameliorează leziunile pulmonare acute induse de Streptococcus aureus. Int Immunopharmacol. (2019) 70:504-11. doi: 10.1016/j.intimp.2019.02.046
PubMed Abstract | Refef Full Text | Google Scholar
31. Vitali R, Palone F, Pierdomenico M, Negroni A, Cucchiara S, Aloi M, et al. Glicirrizatul dipotasic prin intermediul semnalizării HMGB1 sau AMPK suprimă stresul oxidativ în timpul inflamației intestinale. Biochem Pharmacol. (2015) 97:292-9. doi: 10.1016/j.bcp.2015.07.039
CrossRef Full Text | Google Scholar
32. Wu CX, He LX, Guo H, Tian XX, Liu Q, Sun H. Efectul de inhibare a glicirrizinei în eliberarea și exprimarea de către celulele RAW264.7 a boxei 1 a grupului de mare mobilitate indusă de lipopolizaharide. Șoc. (2015) 43:412-21. doi: 10.1097/SHK.0000000000000309
PubMed Abstract | Refef Full Text | Google Scholar
33. Thakur V, Nargis S, Gonzalez M, Pradhan S, Terreros D, Chattopadhyay M. Role of glycyrrhizin in the reduction of inflammation in diabetic kidney disease. Nephron. (2017) 137:137-47. doi: 10.1159/000477820
PubMed Abstract | Refef Full Text | Google Scholar
34. Wang XR, Hao HG, Chu L. Glicirrizina inhibă producția de mediatori inflamatori indusă de LPS în celulele epiteliale endometriale. Microb Pathog. (2017) 109:110-3. doi: 10.1016/j.micpath.2017.05.032
PubMed Abstract |Ref Full Text | Google Scholar
35. Ingraham NE, Lotfi-Emran S, Thielen BK, Techar K, Morris RS, Holtan SG, et al. Imunomodularea în COVID-19. Lancet Respir Med. (2020) S2213-2600:30226-5. doi: 10.1016/S2213-2600(20)30226-5
PubMed Abstract | Refef Full Text | Google Scholar
36. Kroes BH, Beukelman CJ, Van Den Berg AJ, Wolbink GJ, Van Dijk H, Labadie RP. Inhibarea complementului uman de către acidul beta-glicirretinic. Imunologie. (1997) 90:115-20. doi: 10.1046/j.1365-2567.1997.00131.x
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Abe N, Ebina T, Ishida N. Inducerea interferonului de către glicirrizină și acid glicirretinic la șoareci. Microbiol Immunol. (1982) 26:535-9. doi: 10.1111/j.1348-0421.1982.tb00207.x
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Utsunomiya T, Kobayashi M, Pollard RB, Suzuki F. Glicirrizina, o componentă activă a rădăcinilor de lemn dulce, reduce morbiditatea și mortalitatea șoarecilor infectați cu doze letale de virus gripal. Antimicrob Agents Chemother. (1997) 41:551-6. doi: 10.1128/AAC.41.3.551
PubMed Abstract | Refef Full Text | Google Scholar
39. Kong ZH, Chen X, Chen X, Hua HP, Liang L, Liu LJ. Pretratamentul oral al glicirrizinei previne deteriorarea cognitivă indusă de intervenția chirurgicală la șoarecii îmbătrâniți prin reducerea neuroinflamării și a patologiei legate de Alzheimer prin inhibarea HMGB1. J Mol Neurosci. (2017) 63:385-95. doi: 10.1007/s12031-017-0989-7
PubMed Abstract | Refef Full Text | Google Scholar
40. Lai S, Wu G, Jiang Z. Tratamentul cu glicirizină facilitează stingerea răspunsurilor de frică condiționate după o singură expunere prelungită la stres la șobolani. Cell Physiol Biochem. (2018) 45:2529-39. doi: 10.1159/000488271
PubMed Abstract | CrossRef Full Text | Google Scholar
41. Monteil V, Kwon H, Prado P, Hagelkruys A, Wimmer RA, Stahl M, et al. Inhibarea infecțiilor SARS-CoV-2 în țesuturile umane proiectate utilizând ACE2 umană solubilă de calitate clinică. Cell. (2020) 181:905-913.e7. doi: 10.1016/j.cell.2020.04.004
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Epelman S, Tang WH, Chen SY, Van Lente F, Francis GS, Sen S. Detectarea enzimei solubile de conversie a angiotensinei 2 în insuficiența cardiacă: perspective asupra căii endogene de contra-reglare a sistemului renină-angiotensină-aldosteron. J Am Coll Cardiol. (2008) 52:750-4. doi: 10.1016/j.jacc.2008.02.088
PubMed Abstract | Refef Full Text | Google Scholar
.
Leave a Reply