Frontiers in Immunologia
Introduzione
In assenza di una prevenzione primaria tramite immunizzazione e di un trattamento specifico per la COVID-19 possono comunque essere disponibili strategie di trattamento razionale. Oltre alle terapie per colpire direttamente la replicazione del virus, sono state proposte immunoterapie per ridurre gli effetti dell’infiammazione indotta dal virus (2). Queste includono il trattamento con corticosteroidi, che non sono raccomandati a causa dei loro effetti immunosoppressivi, che possono portare a un risultato peggiore rispetto ai soggetti non trattati. Approcci più specifici riguardano IL-6, TNFα, inibitori delle Janus kinasi (JAK1/JAK2) e inteferoni di tipo 1. Infine, il sistema del complemento è stato considerato come bersaglio (3-5). Questi parametri possono avere un’importanza prognostica, poiché il rapporto IL6/interferone IFɤ sembra predire la gravità della malattia (6).
Inoltre, l’intuizione che il virus utilizza l’enzima di conversione dell’angiotensina 2 (ACE2) legato alla membrana come punto d’ingresso apre potenziali strategie per modificare l’attività di questo sistema. È stato proposto che l’uso di bloccanti del recettore dell’angiotensina, che portano a un’espressione upregolata di ACE2, può essere dannoso (7). È stata anche espressa la visione alternativa di un potenziale effetto benefico di questi composti (8), basata sugli effetti fisiologicamente antinfiammatori e protettivi di questo enzima. Questa controversia è stata recentemente delineata chiaramente (9, 10). La sfida è quella di ridurre l’ACE2 come punto d’ingresso senza peggiorare la reazione infiammatoria, una volta che l’infezione si è verificata.
Riduzione dell’ACE2 per ridurre l’ingresso del Covid-19?
Seguendo i risultati meccanicistici, ridurre l’espressione dell’ACE2 ridurrebbe il numero di punti di accesso del virus al corpo durante l’infezione primaria e potenzialmente la diffusione nel corpo. Entrambi dovrebbero portare a un decorso clinico potenzialmente più mite. Le cellule suscettibili all’infezione con la SARS sembrano essere principalmente i pneumociti di tipo II, gli enterociti assorbenti ileali e le cellule secretorie del calice nasale (11). Pertanto, potrebbe valere la pena di identificare un meccanismo per ridurre l’espressione di ACE2 di membrana in queste cellule (tenendo a mente le potenziali conseguenze negative). Per aumentare la plausibilità di un tale approccio sarebbe utile seguire i rapporti sull’uso di successo degli approcci della medicina tradizionale cinese (MTC). Uno dei composti più utilizzati della MTC contiene un estratto di glycyrrhiza glabra, cioè la pianta della liquirizia (12) e interagisce con il sistema angiotensina-aldosterone: Uno dei suoi costituenti attivi è la glicirrizina (GL), che viene metabolizzata nell’intestino dell’uomo nel metabolita sistemicamente attivo acido glicirretinico (GA). La somministrazione di GL e GA ha una serie di effetti rilevanti: GA inibisce principalmente un enzima chiamato 11-beta-idrossisteroide deidrogenasi (11bHSD), sia tipo 1 che 2 (13). Di rilevanza qui appare il tipo 2 (11bHSD2). La sua inibizione permette al cortisolo di accedere ai recettori dei mineralocorticoidi (MR) nei tessuti periferici specifici per l’aldosterone, tra cui il rene, il polmone, il naso e le cellule endoteliali, in cui sarebbe altrimenti impedito di farlo. Questo grazie alla sua attività di degradare rapidamente il cortisolo intracellulare per permettere l’accesso dell’aldosterone al recettore. In altre parole, un’inibizione di questo enzima porta a un’attivazione di MR simile all’aldosterone attraverso il cortisolo e può assomigliare agli effetti di alti livelli di aldosterone in questi organi. Interessante in questo contesto è che alti livelli di aldosterone portano ad una downregulation di ACE2 nel rene (14), un tessuto che esprime 11bHSD2 come il polmone e le cellule epiteliali nasali, cioè i principali punti di ingresso per COVID-19, mentre l’antagonismo di MR ha effetti opposti in diversi tessuti (15). Questo è in linea con l’osservazione che in certe circostanze i composti che riducono l’aldosterone, come l’enalapril, possono portare ad un aumento dell’espressione di ACE2 (16, 17).
Effetto antivirale diretto di GA o GL
Interessantemente GL o il suo metabolita attivo GA esprime effetti antivirali per il virus correlato SARS-corona (18, 19) nella cultura cellulare: Le cellule Verum infettate con campioni di plasma di pazienti hanno mostrato un assorbimento e un tasso di replicazione del virus significativamente ridotti, quando GL è stato co-somministrato (18); un effetto simile è stato descritto da Chen et al. in una linea cellulare Vero-E6, tuttavia, nessun effetto è stato osservato in una linea cellulare fRhK4 (19). È importante notare che il GA, il composto sistemicamente attivo dopo la somministrazione orale, non è stato studiato, il che rende questi risultati potenzialmente rilevanti per la somministrazione locale (inalata) o endovenosa. In uno studio con cellule del tratto respiratorio umano GA, ma non GL ha mostrato un effetto sul tasso di infezione con il virus respiratorio sinciziale umano (20). Questi effetti antivirali diretti al di fuori di MR indicano un meccanismo aggiuntivo, ma sconosciuto. In questo contesto può essere importante notare che oltre ad ACE2 la serina proteasi TMPRSS2 è richiesta per l’infezione di una cellula (21). L’inibizione di questo enzima con un inibitore della proteasi come intervento terapeutico è stato proposto dagli autori. TMPRSS2 è stato coinvolto sia nelle infezioni da virus della corona che in quelle da virus dell’influenza (22). È interessante notare che l’espressione di questo enzima è regolata da GA (23), il che potrebbe spiegare i più ampi effetti antivirali di GL (24). È regolata dagli androgeni (23), il che può spiegare in parte le differenze di genere nell’espressione clinica delle infezioni COVID-19.
ACE2 Antiinflammation and Glycyrrhizin’s Anti-Inflammatory Effects
Le conseguenze a valle della ridotta espressione di ACE2 sono, come delineato sopra, piuttosto controverse (25). L’attività di ACE2 è generalmente protettiva, anche per il tessuto polmonare (26). Lo fa sopprimendo le conseguenze dell’attivazione del recettore per l’endotossina (LPS), cioè il recettore toll-like 4 (TLR4) e, di conseguenza, l’infiammazione nel polmone (endotoxin storm) (27): La sovraespressione di ACE2 ha inibito l’infiammazione indotta da LPS in questo studio. Pertanto, la ridotta espressione di ACE2 potrebbe essere considerata preoccupante. In questo contesto, una seconda proprietà della glicirrizina diventa importante, cioè il suo effetto immunmodulatorio. Il più noto di questi è il suo effetto antagonista dei meccanismi TLR4 dipendenti. Un effetto antagonista di TLR4 di GA riduce l’infiammazione in diversi tessuti, compreso il polmone (28). Inoltre, GL porta ad una riduzione dell’espressione di TLR4 nel cuore e nel polmone in un modello di infiammazione LPS. Questo è stato accompagnato da una significativa riduzione del rilascio di citochine, cioè il rilascio di TNFα, IL6 e IL1ß (29). In accordo con GL ha effetti protettivi nella sindrome da distress respiratorio acuto indotta dall’attivatore TLR4 LPS nei topi (28). Il potenziale antinfiammatorio all’interno del polmone è stato dimostrato anche in un modello murino di infezione da Streptococcus aureus, dove la somministrazione intraperitoneale di GL ha soppresso ampiamente i marcatori infiammatori (30). Questi risultati sono in linea con l’attività di GL o GA per inibire le vie infiammatorie, attraverso TLR4 (31-34). Il meccanismo di GL contro l’infiammazione polmonare e cardiaca può in parte essere indiretto alterando il rapporto delle cellule soppressorie di derivazione mieloide (MDSC) alle cellule mieloidi CD11b+Gr1 (29). Nel complesso, l’azione di GL per inibire l’attività di TLR4 può indurre un’attività antinfiammatoria a valle del meno attivo ACE2 (35). Inoltre, GA porta a una soppressione della via classica, ma non di quella alternativa del complemento (36). Infine, è stata descritta un’influenza sulla secrezione di interferone: l’estratto di glicirriza porta a un aumento della secrezione di interferone 1ß nelle cellule del tratto respiratorio superiore e inferiore (20) simile all’effetto di GL e GA nei topi, come determinato in campioni di siero (37); inoltre GL riduce la morte nei topi infettati con una dose letale di virus dell’influenza attraverso un modo dipendente da interferone ɤ e cellule T (38). Questi meccanismi antinfiammatori possono essere importanti anche nel SNC (39, 40) e possono quindi proteggere dalle conseguenze neurologiche e psichiatriche di un’infezione da COVID-19.
Da una prospettiva più pratica può anche essere rilevante che il coronavirus SARS Co-V, che ha somiglianze con COVID-19, ha portato spesso all’ipotensione arteriosa (25), che non è rara nei processi infiammatori. Questo sintomo potenzialmente critico può anche essere superato con la glicirrizina, che porta ad un aumento della pressione sanguigna (13). Vedere la Figura 1 per una panoramica schematica.
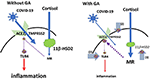
Figura 1. Modello schematico dell’effetto della glicirrizina: L’accesso di COVID-19 nelle cellule è mediato da ACE2 con TMPRSS2 come cofattore. L’espressione di ACE2 è regolata dai recettori dei mineralocorticoidi (MR): L’attivazione di MR porta ad una riduzione dell’espressione di ACE2; GA inibisce l’11βHSD2, che permette al cortisolo di attivare MR, seguito da ACE2-downregulation (freccia 1). TMPRSS2 sensibilizza ACE2 per l’aggiornamento del virus nella cellula. GA porta a una ridotta espressione di TMPRSS2 e può quindi fornire un ulteriore meccanismo per limitare l’accesso del virus nella cellula (freccia 2). ACE2 ha un meccanismo antinfiammatorio attraverso la generazione di angiotensina 1-7 e angiotensina 1-9. Attraverso l’attivazione dei recettori MAS o dell’angiotensina 2 le vie infiammatorie sono soppresse. Questo include anche una ridotta espressione e/o attivazione del recettore TLR4 di membrana (a sinistra), cioè la ridotta espressione di ACE2 potrebbe essere considerata problematica (35). Tuttavia, GA inibisce direttamente TLR4 indipendentemente dall’attivazione di ACE2 (freccia 3). (ϕ e linee interrotte simboleggiano l’inibizione; linee rosse continue simboleggiano l’attivazione).
Discussione
Molte domande rimangono aperte. Qual è il ruolo dell’ACE2 solubile rispetto a quello legato alla membrana? Può esserci un ruolo dell’ACE2 solubile per proteggere l’occupazione della membrana? Questo è stato recentemente proposto sulla base di risultati in esperimenti di coltura cellulare (41). Questo potrebbe, tuttavia, contraddire in qualche modo l’osservazione che i soggetti con insufficienza cardiaca, che dovrebbero essere considerati ad alto rischio, mostrano alti livelli di ACE2 solubile (42). Qual è la differenza nei diversi organi con o senza espressione di 11bHSD2? Qual è il ruolo della concomitante riduzione controregolatoria dell’aldosterone plasmatico con la somministrazione di un inibitore della 11betaHSD2? Queste domande possono trovare risposta in studi clinici appropriati. La determinazione del prodotto finale dell’enzima ACE2, cioè l’angiotensina 1-7 così come le potenziali conseguenze cliniche sulla pressione sanguigna possono essere utili per chiarire alcune di queste questioni.
Importante, la glicirrizina ha un generale ben tollerato. Ha una dichiarazione FDA di GRAS (generally regarded as safe) (13). In particolare, una dose fino a 100 mg/giorno usata cronicamente è sicura e non porta a cambiamenti, che sono stati osservati con l’uso cronico in dosi più elevate. Gli effetti indesiderati attesi di dosi elevate, tra cui l’ipertensione e l’ipopotassiemia, devono comunque essere monitorati. Nel contesto della SARS è stata raccomandata una dose fino a 300 mg per la somministrazione orale e di circa 240 mg per una somministrazione endovenosa (19). Tuttavia, Chen et al. affermano che questa dose per la somministrazione endovenosa potrebbe essere troppo bassa, tenendo conto dell’EC50 dell’effetto sulla replicazione del virus. Va detto che questo effetto diretto è solo uno dei tre meccanismi rilevanti per colpire il processo di malattia legato al COVID-19. Due studi clinici in aperto sono registrati sul sito di registrazione degli studi clinici dell’OMS, uno studio randomizzato in aperto (ChiCTR2000029768) e una serie di casi (ChiCTR2000030490). Per lo studio viene utilizzata una dose di 300 mg di glicirrizina per via orale/die, la dose per l’altra indagine non è stata riportata. Per la scelta della via di somministrazione è importante considerare che per un’azione indotta da GA la somministrazione orale di GL è cruciale, poiché GL non viene metabolizzato a GA per via sistemica. Tuttavia, per un effetto localizzato di GL può essere necessaria una somministrazione endovenosa o inalatoria, che dovrebbe essere combinata con una somministrazione orale. Per l’uso di una potenziale prevenzione primaria una selezione pragmatica della dose di 150 mg/giorno per via orale può essere considerata per ulteriori studi, poiché questa dose influenza l’attività della MR.
Conclusione
La glicirrizina è un composto ampiamente disponibile e complessivamente sicuro. Può essere in grado di ridurre l’espressione di ACE2 nel polmone e nonostante ciò ridurre l’infiammazione polmonare. Dovrebbe valere la pena di studiare questo composto per un tipo di prevenzione primaria, che non necessariamente abbassa il rischio di essere infettati, ma potenzialmente la gravità della malattia, e nel ridurre la sintomatologia già esistente. Questo potrebbe aiutare a ridurre il numero di pazienti gravemente malati, che attualmente sovraccaricano il sistema sanitario.
Contributi degli autori
HM ha redatto il manoscritto e la versione finale.
Conflitto di interessi
HM detiene un brevetto per l’uso della glicirrizina nella depressione refrattaria alla terapia.
L’autore dichiara che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
HM desidera ringraziare Laura Zumpano per la sua revisione e gli utili commenti sul manoscritto.
1. Sanders JM, Monogue ML, Jodlowski TZ, Cutrell JB. Trattamenti farmacologici per la malattia da coronavirus 2019 (COVID-19): una revisione. JAMA. (2020). doi: 10.1001/jama.2020.6019. .
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Reddy Bonam S, Kaveri SV, Sakuntabhai A, Gilardin L, Bayry J. immunoterapie aggiunto per la gestione dei pazienti gravemente malati COVID-19. Cell Rep Med. (2020) 7:22. doi: 10.1016/j.xcrm.2020.100016
CrossRef Full Text | Google Scholar
3. Maglakelidze N, Manto KM, Craig TJ. Una revisione: il complemento o il sistema di contatto hanno un ruolo nella protezione o nella patogenesi della COVID-19? Pulm Ther. (2020) 1-8. doi: 10.1007/s41030-020-00118-5
CrossRef Full Text | Google Scholar
4. Mastaglio S, Ruggeri A, Risitano AM, Angelillo P, Yancopoulou D, Mastellos DC, et al. Il primo caso di COVID-19 trattato con l’inibitore del complemento C3 AMY-101. Clin Immunol. (2020) 215:108450. doi: 10.1016/j.clim.2020.108450
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Risitano AM, Mastellos DC, Huber-Lang M, Yancopoulou D, Garlanda C, Ciceri F, et al. Complemento come bersaglio in COVID-19? (2020) Nat. Rev. Immunol. 1-2. doi: 10.1038/s41577-020-0320-7
CrossRef Full Text | Google Scholar
6. Lagunas-Rangel FA, Chavez-Valencia V. Un alto rapporto IL-6/IFN-gamma potrebbe essere associato alla malattia grave nei pazienti COVID-19. J. Med. Virol. (2020). doi: 10.1002/jmv.25900. .
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Esler M, Esler D. I farmaci bloccanti il recettore dell’angiotensina possono forse essere dannosi nella pandemia COVID-19? J. Hypertens. (2020) 38:781-2. doi: 10.1097/HJH.0000000000002450
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Fedson DS, Opal SM, Rordam OM. Nascondere in piena vista: un approccio al trattamento di pazienti con grave infezione COVID-19. MBio. (2020) 11:e00398-20. doi: 10.1128/mBio.00398-20
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Sommerstein R, Kochen MM, Messerli FH, Grani C. Coronavirus disease 2019 (COVID-19): gli inibitori dell’enzima di conversione dell’angiotensina/bloccanti del recettore dell’angiotensina hanno un effetto bifasico? J Am Heart Assoc. (2020) 9:e016509. doi: 10.1161/JAHA.120.016509
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Vaduganathan M, Vardeny O, Michel T, Mcmurray JJ, Pfeffer MA, Solomon SD. Inibitori del sistema renina-angiotensina-aldosterone in pazienti con Covid-19. N Engl J Med. (2020) 382:1653-9. doi: 10.1056/NEJMsr2005760
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Ziegler CG. Il recettore SARS-CoV-2 ACE2 è un gene stimolato dall’interferone nelle cellule epiteliali delle vie aeree umane ed è rilevato in sottoinsiemi cellulari specifici nei vari tessuti. Cell. (2020) S0092-8674:30500-6. doi: 10.1016/j.cell.2020.04.035
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Luo H, Tang QL, Shang YX, Liang SB, Yang M, Robinson N, et al. La medicina cinese può essere utilizzata per la prevenzione della malattia da virus corona 2019 (COVID-19)? Una revisione dei classici storici, delle prove di ricerca e degli attuali programmi di prevenzione. Chin J Integr Med. (2020) 26:243-50. doi: 10.1007/s11655-020-3192-6
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Gruppo di esperti per la revisione degli ingredienti cosmetici. Relazione finale sulla valutazione della sicurezza dell’acido glicirretinico, del glicirretinato di potassio, del succinoil glicirretinato disodico, del gliceril glicirretinato, del glicirretinil stearato, Stearyl Glycyrrhetinate, acido glicirrizico, glicirrizato di ammonio, glicirrizato dipotassico, glicirrizato disodico, glicirrizato trisodico, glicirrizato di metile e glicirrizinato di potassio. Int J Toxicol. (2007) 26 (Suppl. 2):79-112. doi: 10.1080/10915810701351228
CrossRef Full Text | Google Scholar
14. Fukuda S, Horimai C, Harada K, Wakamatsu T, Fukasawa H, Muto S, et al. danno renale indotto da aldosterone è mediato da attivazione NFkappaB. Clin Exp Nephrol. (2011) 15:41-9. doi: 10.1007/s10157-010-0373-1
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Keidar S, Gamliel-Lazarovich A, Kaplan M, Pavlotzky E, Hamoud S, Hayek T, et al. blocco del recettore dei mineralcorticoidi aumenta l’attività dell’enzima di conversione dell’angiotensina 2 in pazienti con insufficienza cardiaca congestizia. Circ Res. (2005) 97:946-53. doi: 10.1161/01.RES.0000187500.24964.7A
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Hu XS, Xie XD, Wang XX, Zeng CL, Ni YM, Yu GW, et al. Effetti dell’inibitore dell’enzima di conversione dell’angiotensina sull’espressione dell’enzima di conversione dell’angiotensina 2 nell’atrio di pazienti con fibrillazione atriale. Zhonghua Xin Xue Guan Bing Za Zhi. (2007) 35:625-8.
PubMed Abstract | Google Scholar
17. Malfitano C, De Angelis K, Fernandes T, Wichi RB, Rosa K, Pazzine M, et al. enalapril a basso dosaggio riduce l’angiotensina II e attenua le disfunzioni cardiache e autonomiche indotte dal diabete. J Cardiovasc Pharmacol. (2012) 59:58-65. doi: 10.1097/FJC.0b013e3182354776
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Cinatl J, Morgenstern B, Bauer G, Chandra P, Rabenau H, Doerr HW. Glicirrizina, un componente attivo delle radici di liquirizia, e replicazione del coronavirus associato alla SARS. Lancet. (2003) 361:2045-6. doi: 10.1016/S0140-6736(03)13615-X
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Chen F, Chan KH, Jiang Y, Kao RY, Lu HT, Fan KW, et al. Suscettibilità in vitro di 10 isolati clinici di SARS coronavirus a composti antivirali selezionati. J Clin Virol. (2004) 31:69-75. doi: 10.1016/j.jcv.2004.03.003
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Feng Yeh C, Wang KC, Chiang LC, Shieh DE, Yen MH, San Chang J. L’estratto d’acqua di liquirizia aveva attività antivirale contro il virus respiratorio sinciziale umano in linee cellulari del tratto respiratorio umano. J Ethnopharmacol. (2013) 148:466-73. doi: 10.1016/j.jep.2013.04.040
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Hoffmann M, Kleine-Weber H, Schroeder S, Kruger N, Herrler T, Erichsen S, et al. SARS-CoV-2 ingresso delle cellule dipende da ACE2 e TMPRSS2 ed è bloccato da un inibitore della proteasi clinicamente provato. Cell. (2020) 181:271-80 e278. doi: 10.1016/j.cell.2020.02.052
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Shen LW, Mao HJ, Wu YL, Tanaka Y, Zhang W. TMPRSS2: un potenziale bersaglio per il trattamento delle infezioni da virus dell’influenza e coronavirus. Biochimie. (2017) 142:1-10. doi: 10.1016/j.biochi.2017.07.016
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Sun Y, Jiang M, Park PH, Song K. Soppressione trascrizionale del recettore degli androgeni da parte dell’acido 18beta-glicirretinico in cellule di cancro alla prostata umana LNCaP. Arch Pharm Res. (2020) 43:433-48. doi: 10.1007/s12272-020-01228-z
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Hoever G, Baltina L, Michaelis M, Kondratenko R, Baltina L, Tolstikov GA, et al. Attività antivirale dei derivati dell’acido glicirrizico contro il SARS-coronavirus. J Med Chem. (2005) 48:1256-9. doi: 10.1021/jm0493008
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Gurwitz D. Bloccanti del recettore dell’angiotensina come tentativi di terapia della SARS-CoV-2. Drug Dev. Res. (2020). doi: 10.1002/ddr.21656. .
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Kaparianos A, Argyropoulou E. Sistemi locali di renina-angiotensina II, enzima di conversione dell’angiotensina e il suo omologo ACE2: il loro ruolo potenziale nella patogenesi delle malattie polmonari ostruttive croniche, ipertensione polmonare e sindrome da distress respiratorio acuto. Curr Med Chem. (2011) 18:3506-15. doi: 10.2174/092986711796642562
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Ye R, Liu Z. ACE2 mostra effetti protettivi contro il danno polmonare acuto indotto da LPS nei topi inibendo il percorso LPS-TLR4. Exp Mol Pathol. (2020) 113:104350. doi: 10.1016/j.yexmp.2019.104350
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Yu Z, Ohtaki Y, Kai K, Sasano T, Shimauchi H, Yokochi T, et al. Ruolo critico delle piastrine nella letalità indotta da lipopolisaccaridi: effetti della glicirrizina e possibile strategia per la sindrome da distress respiratorio acuto. Int Immunopharmacol. (2005) 5:571-80. doi: 10.1016/j.intimp.2004.11.004
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Seo EH, Song GY, Kwak BO, Oh CS, Lee SH, Kim SH. Effetti della glicirrizina sulla differenziazione delle cellule mieloidi del cuore e dei polmoni in topi settici indotti da lipopolisaccaridi. Shock. (2017) 48:371-6. doi: 10.1097/SHK.0000000000000850
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Yao L, Sun T. La somministrazione di glicirrizina migliora il danno polmonare acuto indotto dallo Streptococcus aureus. Int Immunopharmacol. (2019) 70:504-11. doi: 10.1016/j.intimp.2019.02.046
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Vitali R, Palone F, Pierdomenico M, Negroni A, Cucchiara S, Aloi M, et al. Dipotassium glycyrrhizate via HMGB1 o AMPK signaling sopprime lo stress ossidativo durante l’infiammazione intestinale. Biochem Pharmacol. (2015) 97:292-9. doi: 10.1016/j.bcp.2015.07.039
CrossRef Full Text | Google Scholar
32. Wu CX, He LX, Guo H, Tian XX, Liu Q, Sun H. Effetto di inibizione della glicirrizina in lipopolisaccaride indotto ad alta mobilità gruppo box 1 rilasciando e l’espressione da RAW264.7 cellule. Shock. (2015) 43:412-21. doi: 10.1097/SHK.0000000000000309
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Thakur V, Nargis S, Gonzalez M, Pradhan S, Terreros D, Chattopadhyay M. Ruolo della glicirrizina nella riduzione dell’infiammazione nella malattia renale diabetica. Nephron. (2017) 137:137-47. doi: 10.1159/000477820
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Wang XR, Hao HG, Chu L. Glycyrrhizin inibisce la produzione di mediatori infiammatori indotta da LPS nelle cellule epiteliali endometriali. Microb Pathog. (2017) 109:110-3. doi: 10.1016/j.micpath.2017.05.032
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Ingraham NE, Lotfi-Emran S, Thielen BK, Techar K, Morris RS, Holtan SG, et al. Immunomodulazione in COVID-19. Lancet Respir Med. (2020) S2213-2600:30226-5. doi: 10.1016/S2213-2600(20)30226-5
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Kroes BH, Beukelman CJ, Van Den Berg AJ, Wolbink GJ, Van Dijk H, Labadie RP. Inibizione del complemento umano da parte dell’acido beta-glicirretinico. Immunologia. (1997) 90:115-20. doi: 10.1046/j.1365-2567.1997.00131.x
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Abe N, Ebina T, Ishida N. Induzione dell’interferone da glicirrizina e acido glicirretinico nei topi. Microbiol Immunol. (1982) 26:535-9. doi: 10.1111/j.1348-0421.1982.tb00207.x
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Utsunomiya T, Kobayashi M, Pollard RB, Suzuki F. La glicirrizina, un componente attivo delle radici di liquirizia, riduce la morbilità e la mortalità dei topi infettati con dosi letali di virus dell’influenza. Antimicrob Agents Chemother. (1997) 41:551-6. doi: 10.1128/AAC.41.3.551
PubMed Abstract | CrossRef Full Text | Google Scholar
39. Kong ZH, Chen X, Hua HP, Liang L, Liu LJ. Il pretrattamento orale di glicirrizina previene il deterioramento cognitivo indotto dalla chirurgia nei topi anziani riducendo la neuroinfiammazione e la patologia legata all’Alzheimer attraverso l’inibizione di HMGB1. J Mol Neurosci. (2017) 63:385-95. doi: 10.1007/s12031-017-0989-7
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Lai S, Wu G, Jiang Z. Glycyrrhizin trattamento facilita l’estinzione di risposte di paura condizionata dopo una singola esposizione prolungata allo stress nei ratti. Cell Physiol Biochem. (2018) 45:2529-39. doi: 10.1159/000488271
PubMed Abstract | CrossRef Full Text | Google Scholar
41. Monteil V, Kwon H, Prado P, Hagelkruys A, Wimmer RA, Stahl M, et al. Inibizione delle infezioni SARS-CoV-2 in tessuti umani ingegnerizzati usando ACE2 umano solubile di grado clinico. Cell. (2020) 181:905-913.e7. doi: 10.1016/j.cell.2020.04.004
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Epelman S, Tang WH, Chen SY, Van Lente F, Francis GS, Sen S. Rilevamento di solubile angiotensina-convertitore enzima 2 in insufficienza cardiaca: intuizioni nel percorso endogeno contro-regolazione del sistema renina-angiotensina-aldosterone. J Am Coll Cardiol. (2008) 52:750-4. doi: 10.1016/j.jacc.2008.02.088
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply