Synteza Gabriela
Mechanizm
Zaczynamy od ftalimidu, traktujemy go zasadą jak KOH lub NaOH, dodajemy halogenek alkilowy, a następnie uwalniamy powstałą aminę. Rozbijmy każdy krok mechanizmu:
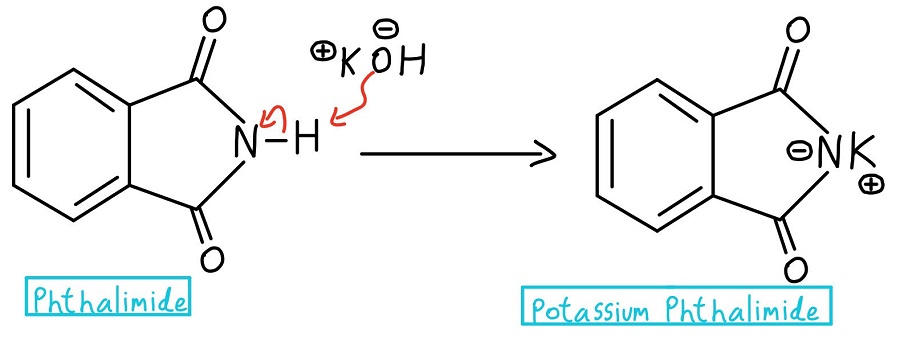
Deprotonacja azotu
W pierwszym kroku azot ftalimidu jest deprotonowany w celu utworzenia ftalimidu potasu. Uwaga: niektórzy profesorowie mogą po prostu zacząć od ftalimidu potasu i całkowicie pominąć etap deprotonacji.
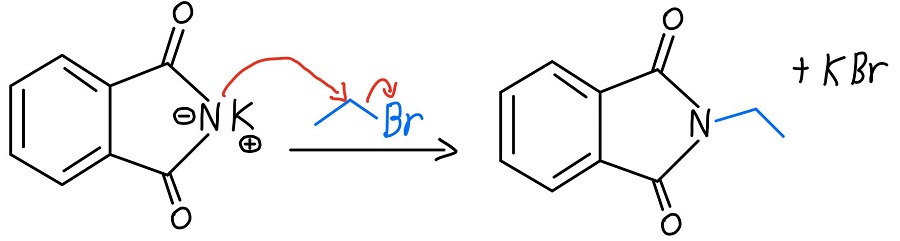
Alkilacja azotu
Teraz, gdy azot ma ładunek ujemny, może działać jako nukleofil i przeprowadzić reakcję SN2 na halogenku alkilowym. Gdy to się stanie, mamy pierwszorzędową aminę tylko czekającą na uwolnienie.
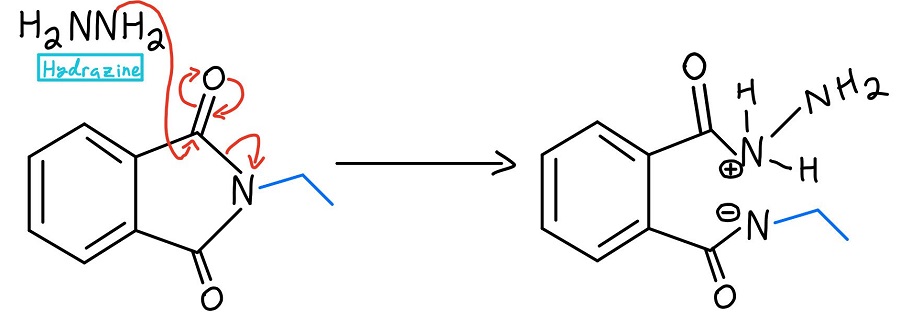
Hydrazyna nukleofilowa substytucja acylowa
W tym momencie istnieje kilka wariantów. Zazwyczaj używa się hydrazyny (NH2NH2), ale czasami stosuje się hydrolizę kwaśną lub zasadową. Przyjrzymy się tym mechanizmom później. W każdym przypadku, nukleofil odrzuca azot poprzez mechanizm nukleofilowej substytucji acylowej.
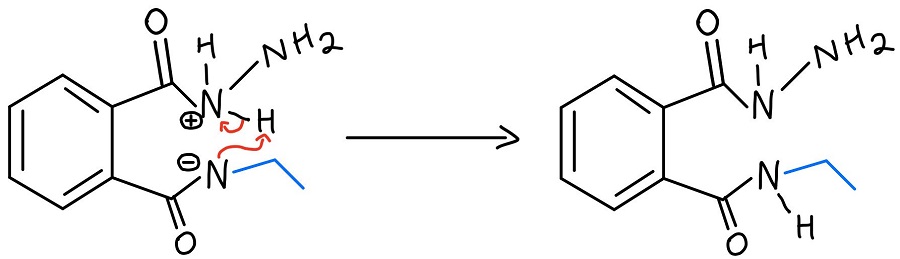
Wewnątrzcząsteczkowe przeniesienie protonu N-N
Protonowana hydrazyna jest następnie deprotonowana przez azot, który właśnie został odrzucony z jednego karbonylu. Nadal musimy pozbyć się aminy z drugiego karbonylu, a NH2 z hydrazyny powtarza proces, aby ją odrzucić.
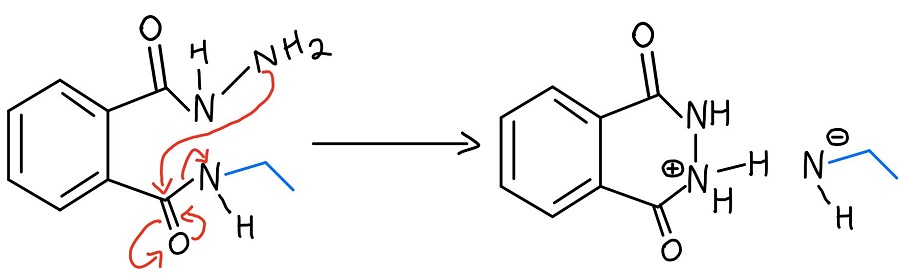
Drugi NAS
Nieprzereagowany NH2 hydrazyny atakuje drugi karbonyl poprzez inny mechanizm NAS, aby ostatecznie odrzucić aminę. Teraz mamy ładunek ujemny i ładunek dodatni, którymi trzeba się zająć.
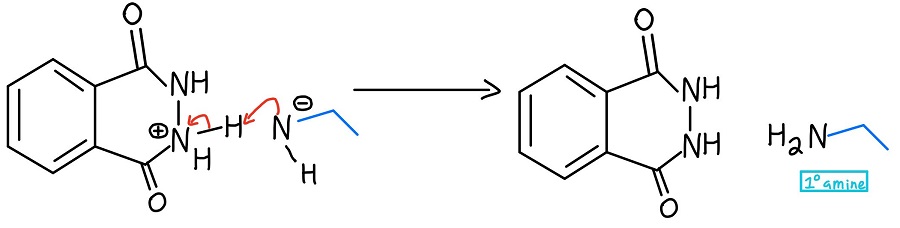
Pierwotna formacja aminy
Ujemny azot deprotonuje dodatni azot i proszę bardzo… mamy naszą pierwotną aminę (jak również cykliczny produkt – ftalhydrazyd)! Na wypadek, gdybyś chciał zobaczyć cały mechanizm na raz, oto on:
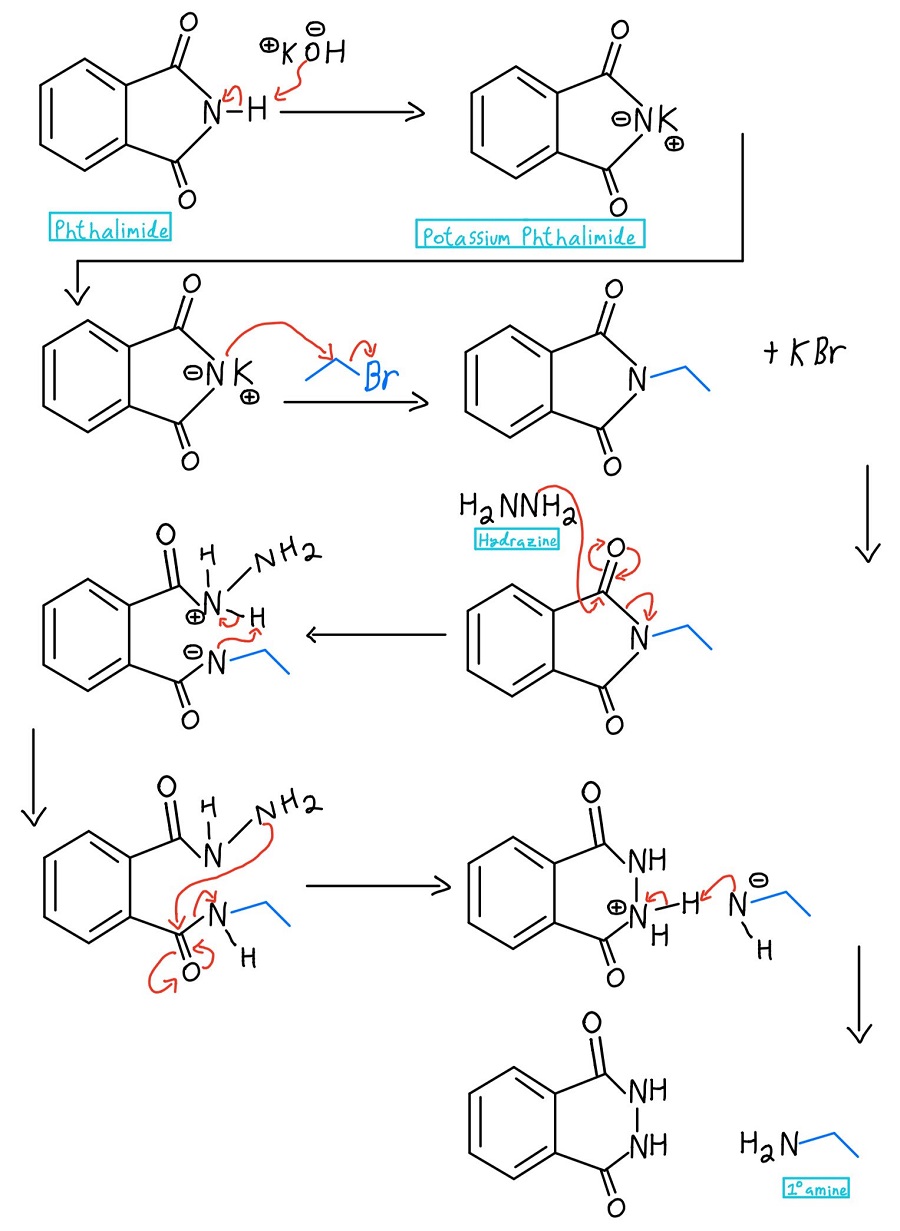
Pełny mechanizm hydrazyny
.
Leave a Reply