Infezione da Burkholderia cepacia complex in un’unità di fibrosi cistica per adulti a Madrid | Enfermedades Infecciosas y Microbiología Clínica
Introduzione
Burkholderia cepacia complex (BCC) è emerso come patogeno significativo nei pazienti con fibrosi cistica (CF) a causa del rischio di sindrome cepacia (una polmonite necrotizzante mortale con batteriemia), la multi-resistenza innata dell’organismo agli antibiotici e la trasmissibilità dei ceppi batterici tra i pazienti attraverso il contatto sociale.1 Il contatto stretto e prolungato tra i pazienti FC e la condivisione di nebulizzatori facilita l’acquisizione e la trasmissione di BCC.2,3 È dimostrato che l’acquisizione di batteri BCC è associata all’ospedalizzazione e all’infezione incrociata per contatto sociale FC.
La tassonomia del genere Burkholderia ha subito diverse revisioni importanti negli ultimi decenni. A metà degli anni ’90, è stato dimostrato che i ceppi di “B. cepacia” appartengono ad almeno cinque specie diverse, che sono state indicate collettivamente come il complesso B. cepacia.4 Ulteriori analisi tassonomiche hanno rivelato che all’interno del BCC erano presenti ancora più specie e attualmente sono state descritte 17 specie del complesso B. cepacia4-7: B. cepacia, B. multivorans, B. cenocepacia, B. stabilis, B. vietanmiensis, B. dolosa, B. ambifaria, B. anthina, B. pyrrocinia, B. ubonensis, B. latens, B. diffusa, B. arboris, B. seminalis, B. metallica, B. lata e B. contaminans.8
Ad eccezione di B. ubonensis, tutte queste specie sono state isolate dall’espettorato di pazienti FC,6,7 con B. cenocepacia e B. multivorans come predominanti.9
B. cenocepacia è suddiviso in 4 sottotipi (IIIa, IIIb, IIIc e IIId), che sono codificati da quattro alleli del gen recA e ci sono differenze nella frequenza e nella virulenza dei ceppi. Inoltre, B. cenocepacia è considerato uno degli agenti patogeni più gravi perché è frequentemente associato a una ridotta sopravvivenza e al più alto rischio di sviluppare la sindrome cepacia fatale.10 Le specie BCC sono intrinsecamente resistenti a molti antibiotici come gli aminoglicosidi e la polimixina B e spesso richiedono una terapia combinata per sopprimere l’infezione nella FC.11
Le infezioni da batteri BCC nei pazienti FC sono spesso correlate a un aumento della morbilità e della mortalità, e la resistenza innata di questi organismi a un’ampia gamma di antibiotici complica il trattamento dei pazienti infetti.12,13 Questa resistenza è causata da vari meccanismi, tra cui una permeabilità limitata, cambiamenti nella struttura del lipopolisaccaride e la presenza di diverse pompe di efflusso multidroga, beta-lattamasi cromosomiche inducibili e proteine di legame alla penicillina alterate. Inoltre, la formazione di biofilm in vitro è stata descritta per più ceppi di B. cepacia complex e questo può contribuire alla loro capacità di sopravvivere nell’ambiente polmonare della FC fornendo una protezione aggiuntiva contro gli antibiotici.14-16
Il trattamento dei pazienti infettati da BCC dovrebbe essere basato preferibilmente sui risultati dei test di suscettibilità e spesso include una terapia combinata con due o tre antibiotici che mostrano un’attività sinergica.12,17,18Gli studi di suscettibilità in vitro sui ceppi di BCC mostrano che le concentrazioni breakpoint di ceftazidime, ciprofloxacina, meropenem, tetracicline o alte dosi di tobramicina hanno un’attività batteriostatica contro una frazione considerevole di questi ceppi.19-21 Di conseguenza, questi antibiotici sono spesso usati per trattare i pazienti FC infetti da BCC. Inoltre, il cotrimoxazolo è ancora frequentemente usato nel trattamento delle infezioni croniche da BCC, sebbene i test di suscettibilità di questi antibiotici complementari abbiano rivelato una scarsa attività contro molti ceppi di BCC.18,22
L’obiettivo di questo studio è stato quello di valutare l’isolamento e la suscettibilità del BCC e di analizzare le ripercussioni cliniche.
Metodi
L’espettorato dei pazienti con FC è stato analizzato per gli isolati finali di BCC, presso l’unità FC adulti dell’ospedale La Princesa che è in funzione dal marzo 1997. Questi campioni sono stati trattati nel dipartimento di microbiologia secondo la procedura standard23; abbiamo usato un mezzo selettivo specifico e una striscia quantitativa, utilizzando la procedura convenzionale di diluizione seriale del campione. L’espettorato è stato sottoposto a un processo di omogeneizzazione con N-acetilcisteina prima della coltura. Nel nostro laboratorio, i terreni di coltura utilizzati sono stati: agar sangue, agar cioccolato bacitracina, agar manitolo-sale, agar MacConkey, agar Sabouraud cloranfenicol e terreno selettivo per B. cepacia chiamato BCSA (Biomèrieux). Il tempo di incubazione delle piastre era da 3 a 5 giorni a 35°C. Il Bacitracin chocolate agar è stato incubato in atmosfera CO2.
L’identificazione preliminare dei ceppi di BCC è stata effettuata con MicroScan (Siemens) e Api 20 NE (Biomerieux). Queste procedure sono state eseguite secondo le raccomandazioni del produttore.24
In seguito, i ceppi sono stati rimessi al Centro Nacional de Microbiología (Majadahonda, Madrid) per la conferma e la determinazione della specie e della genospecie. Per questo studio, sono stati eseguiti i seguenti metodi: Api 20 NE (biomerieux, Marcy l’Etoile) e GN2 Microplate (BIOLOG, Hayward, CA) e metodi molecolari. Tutte le procedure sono state eseguite secondo le raccomandazioni del produttore.
Estrazione del DNA cromosomico
L’estrazione del DNA è stata eseguita con il kit commerciale QIAamp DNA Mini Kit (QIAGEN, GmbH, Hilden, Germania) seguendo le istruzioni del produttore.
L’analisi PCR
L’amplificazione dei geni è stata eseguita in un volume finale di 25μl, utilizzando il kit PuReTaq Ready-To-Go PCR Beads (Amersham Biosciences, Buckinghamshire, UK), e contenente 5μl di DNA estratto e 10pmol di ogni primer: fD1 e rP225 per 16S rDNA, e BCR1 e BCR426 per recA. I cicli termici sono stati eseguiti in un TaKaRa PCR Thermal Cycler v. III mod TP600 (TAKARA BIO Inc., Otsu, Shiga) nelle seguenti condizioni per 16S rDNA: 94°C per 5min per il primo ciclo, 35 cicli di 15s a 94°C, annealing per 15s a 55°C, ed estensione a 72°C per 1min e 50s. Le condizioni per l’amplificazione di recA erano le seguenti: 94°C per 5min, 30 cicli di 30s a 94°C, annealing per 45s a 55°C, ed estensione a 72°C per 10min.
Abbiamo visualizzato 2μl di ogni prodotto di PCR mediante elettroforesi su gel di agarosio con concentrazione di agarosio regolata all’1,5% e usando 1× TAE buffer. I marcatori di dimensione molecolare sono stati inclusi in tutti i gel: Marker X 0.07-12.2kbp (Roche Applied Sciences, Mannheim, Germania) e GeneRuler 100bp DNA Ladder (Fermentas GmbH, St. Leon-Rot, Germania) per i prodotti 16s rDNA e recA, rispettivamente.
I ceppi identificati come B. cenocepacia sono stati sottoposti al metodo PCR con primer specifici per il gruppo RecA-IIIA (BCRG3A1 e BCRG3A2) e RecA-IIIB (BCRG3B1 e BCRG3B2) in condizioni precedentemente descritte.24
Dieci μl di prodotti di PCR sono stati visualizzati mediante elettroforesi su gel di agarosio alle stesse condizioni descritte sopra.
Analisi della sequenza nucleotidica
I prodotti di PCR di 16s rDNA e recA sono stati sequenziati usando rispettivamente fD1 e rP2 e BCR1 come primer. Le reazioni di sequenziamento sono state preparate con Big Dye Terminator v 3.1 (Applied Biosystem, USA) in un volume finale di 10μl secondo le istruzioni del produttore, e analizzate con il sistema di elettroforesi capillare ABI PRISM 3100 genetic analyzer (Applied Biosystem, USA). Le sequenze sono state assemblate utilizzando il software SeqMan 3.61 (DNA Star, Inc, Madison, WI, USA). L’analisi ha comportato anche l’uso di Basic Local Alignment Search Tool (BLAST: www.ncbi.nlm.nih.gov) per stabilire la corretta identità genica.
Analisi PFGE
Il rapporto tra le specie è stato analizzato mediante elettroforesi in gel a campo pulsato (PFGE). La preparazione delle spine, la lisi, il lavaggio delle cellule e la digestione di restrizione sono stati eseguiti come descritto in precedenza25,26 con leggere differenze. È stato utilizzato l’enzima di restrizione XbaI (40U, Fermentas GmbH, St. Leon-Rot, Germania). La PFGE è stata eseguita seguendo il protocollo descritto per Stenotrophomonas maltophilia da Valdezate et al.,27 e utilizzando DRIII Chef System (Bio-Rad Laboratories, Hercules, USA) e lambda phage concatemers (Biolabs, New England, UK) come marker di peso molecolare. Le immagini sono state ottenute con il software Quantity One v. 4.6.1 (BioRad). L’analisi delle immagini è stata eseguita visivamente e gli isolati sono stati considerati indistinguibili dal punto di vista genotipico se presentavano un identico modello di bandeggio.
La suscettibilità agli antibiotici è stata eseguita mediante microdiluizione con MicroScan e diffusione su disco contemporaneamente. Entrambi i metodi sono stati considerati come breakpoint CLSI.28 Per la ciprofloxacina e l’imipenem, sono stati utilizzati i breakpoint di levofloxacina e meropenem, rispettivamente. Sono stati studiati i seguenti antibiotici: ceftazidima, ciprofloxacina, levofloxacina, cotrimoxazolo, minociclina, imipenem e meropenem.
I pazienti con BCC sono stati studiati con le seguenti variabili: età (all’inizio e attualmente), sesso, peso (all’inizio e attualmente), gen mutazione Regolatore Transmembrana della Fibrosi Cistica, evoluzione della funzione respiratoria che è stata determinata dalla percentuale secondo il valore teorico del volume espirato nel primo secondo (FEV1) dal loro primo isolamento come pure le puntualizzazioni radiologiche di Brasfield e cliniche di Shawchman all’inizio dell’isolamento BCC e attuale.
È stata valutata la co-colonizzazione con altri microrganismi.
Il punteggio Brasfield è stato valutato con 0-5 (da basso ad alto) secondo i segni radiologici: intrappolamento dell’aria, ombre lineari, lesioni cistiche nodulari, consolidamento segmentale o lobare e l’impressione globale della gravità. La punteggiatura globale ottenuta è stata sottratta a 25. Il valore più basso ottenuto corrispondeva a una radiologia più grave. La radiologia toracica e il suo corrispondente punteggio Brasfield sono stati condotti ogni anno.
Punteggio clinico Shwachman ha valutato 4 elementi con punteggiatura massima di 25 ciascuno: attività generale, esame fisico, crescita e alimentazione e radiografia del torace. La punteggiatura ideale era 100 e lo stato dei pazienti è stato classificato secondo la punteggiatura: eccellente (86-100 punti), buono (71-85 punti), lieve (56-70 punti), moderato (40-55 punti) o grave (inferiore o uguale a 40).
Risultati
BCC è stato isolato in 12 dei 70 pazienti adulti FC (17,1%) durante 10 anni. Due dei pazienti hanno avuto un trapianto di polmone, uno di loro è morto dopo il trapianto e l’altro, BCC è stato eradicato nel 2005 prima del trapianto che era nel 2011. Il BCC è stato eliminato nell’altro paziente nel 2009. Questi pazienti sono stati studiati solo per pochi mesi, e quindi l’evoluzione clinica non è stata registrata. B. cenocepacia è stata isolata in 4 pazienti (33,3%), B. contaminans in 3 pazienti (25%), B. stabilis in 2 pazienti (16,7%), B. vietnamiensis in 2 pazienti (16,7%), B. cepacia in un paziente (8,3%), B. multivorans in un paziente (8,3%) e B. lata in un paziente (8,3%). Tra B. cenocepacia, il sottotipo IIIa è stato identificato in due pazienti su 4 (50%), e il sottotipo IIIb negli altri due pazienti (50%). Un paziente aveva dapprima B. cenocepacia e poi aveva una B. lata. Allo stesso modo, un altro paziente aveva B. stabilis e poi aveva B. contaminans. Nel nostro studio, il 50% dei pazienti con BCC aveva ceppi di Staphylococcus aureus (Tabella 1).
Isoluzioni delle varie specie del complesso Burkholderia cepacia e co-colonizzazione con altri patogeni FC in pazienti cronici.
| Paziente | Isolamento 1 | Isolamento 2 | Co-colonizzazione | Osservazioni |
| 1 | B. contaminans | H. influenzae | ||
| 2 | B. cepacia | P. aeruginosa | ||
| 3 | B. cenocepacia (sub. IIIa) | – | ||
| 4 | B. multivorans | S. aureusH. influenzae | ||
| 5 | B. vietnamiensis | S. aureus | ||
| 6 | B. stabilis | S. aureus | ||
| 7 | B. cenocepacia (sub. IIIb) | S. aureus | ||
| 8 | B. cenocepacia (sub. IIIb) | B. lata | P. aeruginosa | Eradicato |
| 9 | B. stabilis | B. contaminans | S. aureus | |
| 10 | B. cenocepacia (sub IIIa) | – | Trapiantato e morto | |
| 11 | B. vietnamiensis | S. aureus | Eradicato e trapiantato | |
| 12 | B. contaminans | – |
L’analisi PFGE mostra che lo stesso ceppo è stato isolato in ogni paziente FC ma era diverso tra i pazienti, quindi questo certifica che non c’è stata trasmissione incrociata.
Il 90% dei BCC erano sensibili al meropenem, l’80% al cotrimoxazolo, il 60% alla minociclina, il 50% alla ceftazidima e il 40% alla levofloxacina, il 20% alla ciprofloxacina e il 10% all’imipenem.
Il 50% dei pazienti FC erano maschi e l’età media in cui questi pazienti hanno avuto il loro primo isolamento di BCC era 24,4 (SD: 7,71). Il 41,7% dei pazienti aveva F508del/altra mutazione, il 33,3% aveva F508del/F508 mutazione e il 25% aveva altra/altra mutazione.
All’inizio il punteggio di Brasfield e Shwachman è stato calcolato per tutti i pazienti inclusi in questo studio, e la punteggiatura media era 18,6 e 82,3. Tuttavia, l’attuale punteggio di Brasfield e Shwachman è stato condotto con i pazienti colonizzati. La punteggiatura media era 21,1 e 81. Solo 1 paziente aveva il diabete e 6 pazienti avevano insufficienza pancreatica. La tabella 2 mostra le caratteristiche cliniche dei pazienti FC che avevano BCC.
Caratteristiche cliniche dei pazienti con fibrosi cistica.
| Frequenza del sesso (%) | |
| Maschio | 6 (50%) |
| Donna | 6 (50%) |
| Età media (SD) | |
| Infezione primaria (n=12) | 24.4 anni (7.71) |
| Attuale (n=9) | 29 anni (8.04) |
| Peso medio (SD) | |
| Infezione primaria (n=12) | 57.9kg (8.5) |
| Attuale (n=9) | 58.7kg (8.6) |
| Frequenza di mutazione (%) | |
| F508del/F508del (n=12) | 4 (33. 3%) |
| F508del/altro (n=12) | 5 (41.7%) |
| Altro/altro (n=12) | 3 (25%) |
| Brasfield punteggiatura media | |
| Infezione primaria (n=12) | 18.6 |
| Corrente (n=9) | 21.1 |
| Puntualizzazione Shwachman media | |
| Infezione primaria (n=12) | 82.3 |
| Attuale (n=9) | 81 |
| Frequenza diabete (%) | |
| Attuale (n=9) | 0 (0%) |
| Insuf. pancreatica frequenza (%) | |
| Attuale (n=9) | 6 (66.6%) |
La figura 1 mostra l’evoluzione della funzione polmonare (%FEV1) dei pazienti che avevano più di un isolamento di BCC.
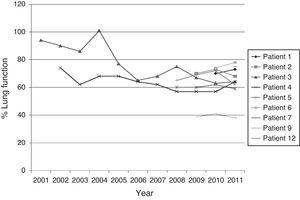
Evoluzione della funzione polmonare dei pazienti cronici FC dal primo isolamento di BCC nell’espettorato.
Discussione
Ci sono pochi studi relativi all’evoluzione clinica dei pazienti con una specie isolata di BCC, e c’è un’idea generale che la specie B. cenocepacia sia associata ad una maggiore morbilità e mortalità nei pazienti FC.19 Pertanto, non ci sono molti dati recenti sui pazienti con BCC in Spagna. Uno studio nell’Hospital Universitario de Cruces mostra un aumento dell’incidenza della colonizzazione con BCC.29
È importante che l’identificazione delle specie di BCC sia effettuata in un centro specializzato, perché i facultativi aiutano a supervisionare uno stretto monitoraggio di questi pazienti che sono colonizzati da queste specie, poiché possono evolvere negativamente.
Uno studio eseguito da Van Pelt et al.30 mostra che API 20 NE era più preciso di MicroScan. Il 90% degli isolati è stato identificato correttamente usando API 20NE contro il 68% di MicroScan. Essi suggeriscono l’uso di piastre BCSA per l’isolamento iniziale di B. cepacia direttamente da materiale clinico. La sensibilità di questi mezzi di crescita è apparsa eccellente (96%); la specificità non era del 100%. È stato abbastanza sorprendente scoprire che per i test automatizzati, come MicroScan, la precisione era insufficiente. Il risultato principale della presente analisi è il fatto che l’identificazione molecolare mediante analisi PCR-RFLP è superiore alle procedure biochimiche e microbiologiche di identificazione delle specie, anche se va sottolineato che i risultati ottenuti con API20 NE erano soddisfacenti.30
Nel nostro studio, B. cenocepacia, B. contaminans, B. vietnamiensis, B. stabilis, B. multivorans, B. cepacia e B. lata sono stati isolati dalle secrezioni respiratorie di 12 pazienti FC esaminati e B. cenocepacia era la specie più prevalente come la maggior parte dei dati descritti nella letteratura europea dei pazienti FC.19 Tuttavia, questa scoperta non concorda con uno studio portoghese (Susana Correia et cols), in cui le specie più frequenti erano B. cepacia 57% e B. stabilis 13%. È forse dovuto all’uso di soluzioni saline non sterili intrinsecamente contaminate da B. cepacia.19 Queste soluzioni contaminate sono state rilevate da Infarmed durante un’ispezione microbiologica di routine.19 Nel nostro studio B. cepacia e B. stabilis sono stati isolati in proporzione inferiore come altri studi in Europa e America.19
Tra gli isolamenti di B. cenocepacia, c’era la stessa proporzione tra B. cenocepacia sottotipi IIIa e IIIb.
Uno dei pazienti aveva B. cenocepacia come primo isolamento, B. lata come secondo isolamento e poi è stato eradicato. Un altro paziente aveva B. vietnamiensis nel 2004 che è stato eradicato, e il trapianto di polmone è stato fatto in lui nel 2011, e un altro paziente è stato isolato con B. cenocepacia sottotipo IIIa nel 2004, ma è morto nello stesso anno dopo un trapianto di polmone. I risultati di sopravvivenza del trapianto di polmone sono peggiori nei pazienti che sono colonizzati con B. cenocepacia, quindi alcune unità di trapianto controindicano il trapianto in quel caso. È stato riconosciuto che B. cenocepacia ha una prognosi peggiore rispetto a B. multivorans, con una sopravvivenza più breve se abbinata a controlli di Pseudomonas aeruginosa.31 La sindrome di Cepacia è stata riportata con entrambe queste specie.26 L’esatta fisiopatologia di questa sindrome è poco conosciuta, e il tasso di mortalità preciso non è noto, anche se si pensa che si avvicini al 100%.32
I nostri pazienti hanno bassi valori di FEV1. Un gran numero di pazienti era già deteriorato prima dell’isolamento della BCC a causa della colonizzazione da parte di altri agenti patogeni e della progressione della malattia. Nei pazienti clinicamente stabili non sono state osservate alterazioni significative nei valori di FEV1 e nello stato nutrizionale. Ci sono prove che la colonizzazione polmonare potrebbe non essere rilevata da colture standard per un certo tempo (fino a 2 anni) dopo l’acquisizione della BCC.33 Inoltre, non è chiaro se, nei casi di isolamento intermittente, ci sia una reinfezione da un nuovo ceppo o se ci sia una recrudescenza del ceppo iniziale.20 Nella maggior parte dei casi del nostro diverso isolamento, non è stata osservata alcuna sostituzione dei ceppi iniziali di BCC.
Sono stati registrati casi in cui lo stesso ceppo (con lo stesso genotipo), che ha infettato persistentemente un paziente per diversi anni, è stato eradicato dalla terapia antibiotica o non ha avuto alcun impatto apparente sul quadro clinico di altri pazienti. Non è chiaro perché i ceppi delle diverse specie di BCC differiscano per persistenza, epidemiologia e potenziale patogeno nella FC e perché gli stessi ceppi possano essere associati a evoluzioni cliniche molto diverse.19 Ciò dipende da fattori inerenti a ogni singolo paziente, dalla co-colonizzazione da parte di altri patogeni e da altri fattori ancora da identificare, sottolineando l’importanza di intraprendere studi di questo tipo.19
La resistenza agli antibiotici è considerata un importante fattore di virulenza degli organismi BCC.14 Sebbene la terapia sia solitamente guidata dai test di suscettibilità antimicrobica, raramente si ottiene l’eradicazione degli organismi BCC.21 Molteplici ipotesi sono state formulate per spiegare questo fallimento, tra cui concentrazioni inadeguate di antibiotici o inattivazione dell’antibiotico nell’espettorato, difese dell’ospite alterate nei pazienti FC, formazione di biofilm, effetto “inoculo” e tasso di crescita in vivo di questi organismi.34
Elke et al. hanno riportato in uno studio belga che meropenem, minociclina e ceftazidime erano gli antibiotici più attivi contro l’isolamento di BCC e ciprofloxazin e trimetoprim/sulfametossazolo avevano l’attività più bassa.35 Tuttavia, il nostro studio ha trovato che meropenem era il più attivo con il 90% di suscettibilità, seguito da trimetoprim/sulfametossazolo, minociclina e ceftazidime con 80%, 60% e 50%, rispettivamente. Anche se gli organismi BCC sono tipicamente resistenti agli aminoglicosidi, alte dosi di tobramicina hanno inibito la maggior parte dei ceppi testati. La tobramicina nebulizzata che produce alte concentrazioni di picco nell’espettorato è sempre più utilizzata per il trattamento dei pazienti FC.36-38
Di conseguenza, queste concentrazioni più elevate dovrebbero essere prese in considerazione quando si valuta l’utilità di questo antibiotico.35 Diversi rapporti confermano che la tobramicina nebulizzata mostra una grande promessa nel trattamento dei pazienti affetti da FC con BCC: per esempio, Weidmann et al.39 hanno recentemente descritto la completa eradicazione degli organismi BCC dai polmoni dei pazienti FC utilizzando una combinazione di tobramicina nebulizzata e amiloride. Inoltre, una terapia combinata con meropenem e tobramicina nebulizzata ed endovenosa ha anche portato al successo del trattamento di una paziente FC donna affetta da sindrome cepacia, anche se i campioni di espettorato di quest’ultima paziente sono rimasti positivi per B. cenocepacia.39
Le specie BCC sono intrinsecamente resistenti a molti antibiotici come gli aminoglicosidi e la polimixina B e spesso richiedono una terapia combinata per sopprimere l’infezione nella FC.11 Gli antibiotici polimixina, gentamicina e vancomicina sono utilizzati ad alte concentrazioni in B. cepacia Selective Agar, un mezzo altamente efficace per il loro isolamento dall’espettorato della FC.11 Nzula et al.13 hanno confrontato la suscettibilità agli antibiotici di sei specie di BCC e hanno concluso che era altamente variabile, ad eccezione della resistenza innata alla polimixina e non legata allo stato tassonomico degli isolati esaminati. L’efflusso, la secrezione di beta-lattamasi cromosomiche e l’impermeabilità dell’involucro esterno dei batteri BCC sono stati implicati nella resistenza agli antibiotici.14
Al contrario, la base molecolare della resistenza ai biocidi nei batteri BCC è stata poco studiata nonostante questi organismi siano legati a molti casi di contaminazione in disinfettanti e altre soluzioni antinfettive.40
La missione e quindi la sfida posta dall’identificazione delle specie BCC per i laboratori di microbiologia clinica di routine sono diverse. I ceppi isolati su terreni selettivi e identificati provvisoriamente come appartenenti alla BCC utilizzando sistemi commerciali devono essere confermati con i classici test biochimici descritti.41
La diagnosi precoce della BCC è estremamente importante sia per il paziente FC che per la comunità FC. Tuttavia, uno studio recente5 ha indicato che meno della metà dei centri statunitensi intervistati utilizzano terreni selettivi specifici per B. cepacia o incubano le colture per periodi prolungati, il che migliora la resa di questo organismo. L’uso di queste tecniche di coltura aggiornate non è tecnicamente impegnativo e dovrebbe essere lo standard di cura previsto in ogni centro FC in tutto il mondo.
In questo studio, abbiamo eradicato B. cenocepacia solo in un paziente; un altro paziente è morto immediatamente dopo il trapianto, e nessuno dei due pazienti ha avuto la sindrome da cepacia e ha subito un importante deterioramento clinico, anche se il periodo di osservazione era breve perché hanno acquisito BCC recentemente.
Il miglioramento della diagnosi delle infezioni causate dai membri del BCC e da altri organismi simili a B. cepacia aiuterà l’interpretazione dei risultati degli studi di esito clinico, e così facendo fornirà informazioni cruciali riguardo alla patogenicità e/o trasmissibilità dei ceppi specifici coinvolti.5
Conflitto di interessi
Nessuno degli autori ha alcun conflitto di interessi da dichiarare.
Leave a Reply